1.3.2+氧化剂和还原剂课件(共24页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2+氧化剂和还原剂课件(共24页)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 16:08:12 | ||
图片预览







文档简介
(共24张PPT)
第一课时 氧化还原反应
人教版 必修1
第三节 氧化还原反应
第一章 物质及其变化
生活中的氧化反应
食物的腐败
钢铁生锈
燃料的燃烧
烟花的绽放
第一课时 氧化还原反应
化学史诗——拉瓦锡 燃烧的氧化学说
法国化学家拉瓦锡通过测试金刚石等物质的燃烧实验,提出了燃烧的氧化学说。这时人们:
把物质得到氧的反应叫做氧化反应,
把物质失去氧的反应叫做还原反应。
任务一:
从得失氧角度分析氧化还原反应
(1)请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成下表。
【概 念】氧化反应、还原反应是在一个反应中同时发生的,
同时发生
把这样的反应称为 。
从化合价升降角度分析氧化还原反应
(2)下列各物质中哪些元素的化合价发生了改变?请标明。
【结论】有化合价升高的反应是氧化反应;
有化合价降低的反应是还原反应。
+2
+4
0
0
+3
+4
+2
0
任务二:
化合价升高
化合价降低
+4
0
+4
+2
+2
0
+3
0
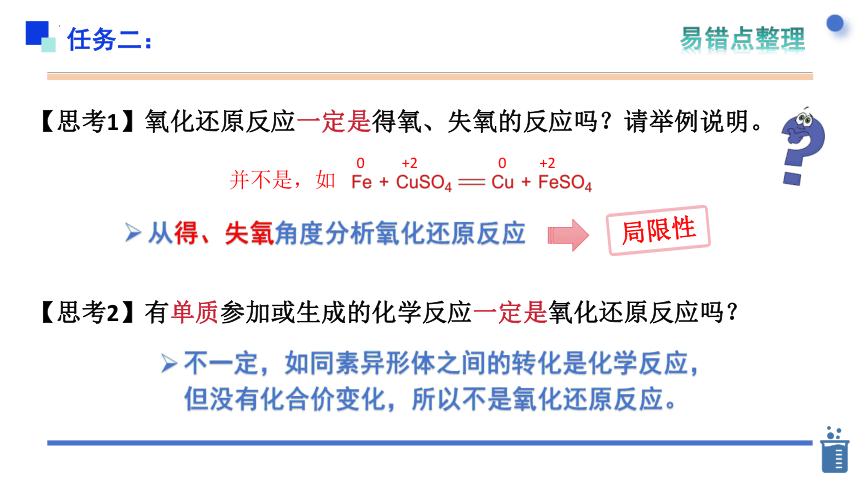
【思考1】氧化还原反应一定是得氧、失氧的反应吗?请举例说明。
并不是,如
0
+2
+2
0
从得、失氧角度分析氧化还原反应
局限性
【思考2】有单质参加或生成的化学反应一定是氧化还原反应吗?
任务二:
易错点整理
不一定,如同素异形体之间的转化是化学反应,
但没有化合价变化,所以不是氧化还原反应。
有化合价的升降
(重要特征)
【课堂练习】判断下列反应是否属于氧化还原反应。
氧化还原反应的判断依据是什么呢?
先标化合价!
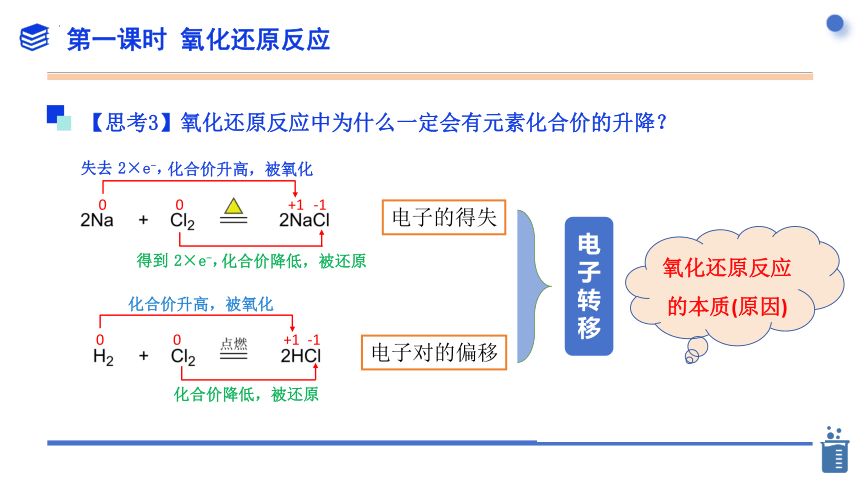
【思考3】氧化还原反应中为什么一定会有元素化合价的升降?
0
-1
0
+1
0
-1
0
+1
化合价升高,被氧化
化合价升高,被氧化
化合价降低,被还原
化合价降低,被还原
失去 2×e-,
电子的得失
电子对的偏移
从微观角度分析
得到 2×e-,
第一课时 氧化还原反应
H
H Cl
Cl
形成共用电子对
电
子
转
移
氧化还原反应的本质(原因)
【思考3】氧化还原反应中为什么会发生化合价的升降?
电子转移导致化合价改变
任务二:
易错点整理
第一课时 氧化还原反应
失去电子 (或电子对偏离)的反应叫氧化反应;
得到电子 (或电子对偏向)的反应叫还原反应;
凡是有电子转移(得失或偏移)的反应就叫氧化还原反应。
从电子得失的角度分析氧化还原反应
电子转移导致了化合价的改变!
失去电子或
电子对偏离
得到电子或
电子对偏向
氧化反应
还原反应
氧化还原反应一定有电子的转移(得失或偏移)
化合价升高
化合价降低
升 失 氧
降 得 还
电子的转移
化合价的升降
本质
特征
氧化还原反应得判断方法
小结
(1) 从得失氧角度认识氧化还原反应(有局限性):
有得失氧的化学反应是氧化还原反应。
(2) 从化合价升降角度认识氧化还原反应(重要特征):
有元素化合价升降的化学反应是氧化还原反应。
(3) 从电子转移角度认识氧化还原反应(本质)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
第一课时 氧化还原反应
C + O2 == CO2
CaO + H2O == Ca(OH)2
2KClO3 == 2KCl + 3O2↑
Cu(OH)2 == CuO + H2O
H2+CuO == Cu + H2O
Zn + CuCl2 ═ ZnCl2 + Cu
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
2HCl + CaCO3 == CaCl2 + H2O + CO2↑
△
点燃
△
△
化合
分解
置换
复分解
归纳:氧化还原反应与四种基本反应类型的关系:
不一定是
不一定是
一定是
一定不是
有单质参加的化合反应一定是氧化还原反应.
有单质生成的分解反应一定是氧化还原反应.
置换反应一定是氧化还原反应.
复分解反应一定不是氧化还原反应.
化合反应
氧化还原反应
复分解反应
第一课时 氧化还原反应
【课堂练习】
1、氧化还原反应与四种基本反应类型的关系如下图,请补充填写完整。
1. 下列有关氧化还原反应的叙述中,正确的是( )
A. 一定有氧元素参加
B. 得到电子的物质发生氧化反应
C. 一种物质被氧化则另一种物质被还原
D.一定有电子转移(得失或偏移)
D
【课堂练习】
2. 下列反应中,属于氧化还原反应的是( )
A. 3NO2+H2O=2HNO3 +NO
B. 3O2 = 2O3
C. 2H2O2===2H2O+O2
D.CaCO3===CaO+CO2
【课堂练习】
AC
3、某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是
C
【课堂练习】
升 失 氧
降 得 还
知识回顾
化合价升高 (重要特征)
失电子 (本质、原因)
(元素) 被氧化
(物质) 发生氧化反应
化合价降低 (重要特征)
得电子 (本质、原因)
(元素) 被还原
(物质) 发生还原反应
化学与生活:焊接铁轨
在焊接铁轨时,人们常将铝粉与氧化铁的混合物点燃,由于反应放出大量的热,置换出的铁以熔融态流出.让熔融的铁流入铁轨的裂缝,冷却后就将铁轨牢牢的黏结在一起.
2Al + Fe2O3 2Fe + Al2O3
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
0
+3
0
+3
思考:反应中电子得失情况如何表示?
生活中的氧化反应
失去2×3e- ,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
2Al + Fe2O3 2Fe + Al2O3
0
+3
0
+3
a.标变价
b.连双线
c. 注得失
1、双线桥法
电子转移如何表示?
注意:失电子总数=得电子总数
价态变化原子个数 ×每个原子得失电子数
1.标变价:标出变价元素的化合价
2.连双线:箭头从反应物指向生成物的同一种元素
3.注得失:写出“失去”、“得到”及相应的电子数
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
2Na+ Cl2 = 2NaCl
0
0
+1
-1
"双线桥"法小结
1.用双线桥法表示下列反应的电子转移
2KClO3 2KCl+3O2↑
-2
-1
0
+5
得到2×6e- ,化合价降低,被还原
失去6×2e- ,化合价升高,被氧化
"双线桥"法巩固练习
① 单线桥画在反应物一侧,不跨越等号。
② 箭头由失电子元素指向得电子元素。
③ 单线桥不需要写“失去”“得到”。
④ 数字表示该反应中得失电子的总数。
2CuO + C 2 Cu + CO2
高温
4e-
+2 0 0 +4
↑
"单线桥"法
a.标变价
b.连单线
c. 注总数
Cu + 4HNO3(浓) === Cu(NO3)2+ 2 NO2↑+ 2H2O
2e-
"单线桥"法巩固练习
第一课时 氧化还原反应
人教版 必修1
第三节 氧化还原反应
第一章 物质及其变化
生活中的氧化反应
食物的腐败
钢铁生锈
燃料的燃烧
烟花的绽放
第一课时 氧化还原反应
化学史诗——拉瓦锡 燃烧的氧化学说
法国化学家拉瓦锡通过测试金刚石等物质的燃烧实验,提出了燃烧的氧化学说。这时人们:
把物质得到氧的反应叫做氧化反应,
把物质失去氧的反应叫做还原反应。
任务一:
从得失氧角度分析氧化还原反应
(1)请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成下表。
【概 念】氧化反应、还原反应是在一个反应中同时发生的,
同时发生
把这样的反应称为 。
从化合价升降角度分析氧化还原反应
(2)下列各物质中哪些元素的化合价发生了改变?请标明。
【结论】有化合价升高的反应是氧化反应;
有化合价降低的反应是还原反应。
+2
+4
0
0
+3
+4
+2
0
任务二:
化合价升高
化合价降低
+4
0
+4
+2
+2
0
+3
0
【思考1】氧化还原反应一定是得氧、失氧的反应吗?请举例说明。
并不是,如
0
+2
+2
0
从得、失氧角度分析氧化还原反应
局限性
【思考2】有单质参加或生成的化学反应一定是氧化还原反应吗?
任务二:
易错点整理
不一定,如同素异形体之间的转化是化学反应,
但没有化合价变化,所以不是氧化还原反应。
有化合价的升降
(重要特征)
【课堂练习】判断下列反应是否属于氧化还原反应。
氧化还原反应的判断依据是什么呢?
先标化合价!
【思考3】氧化还原反应中为什么一定会有元素化合价的升降?
0
-1
0
+1
0
-1
0
+1
化合价升高,被氧化
化合价升高,被氧化
化合价降低,被还原
化合价降低,被还原
失去 2×e-,
电子的得失
电子对的偏移
从微观角度分析
得到 2×e-,
第一课时 氧化还原反应
H
H Cl
Cl
形成共用电子对
电
子
转
移
氧化还原反应的本质(原因)
【思考3】氧化还原反应中为什么会发生化合价的升降?
电子转移导致化合价改变
任务二:
易错点整理
第一课时 氧化还原反应
失去电子 (或电子对偏离)的反应叫氧化反应;
得到电子 (或电子对偏向)的反应叫还原反应;
凡是有电子转移(得失或偏移)的反应就叫氧化还原反应。
从电子得失的角度分析氧化还原反应
电子转移导致了化合价的改变!
失去电子或
电子对偏离
得到电子或
电子对偏向
氧化反应
还原反应
氧化还原反应一定有电子的转移(得失或偏移)
化合价升高
化合价降低
升 失 氧
降 得 还
电子的转移
化合价的升降
本质
特征
氧化还原反应得判断方法
小结
(1) 从得失氧角度认识氧化还原反应(有局限性):
有得失氧的化学反应是氧化还原反应。
(2) 从化合价升降角度认识氧化还原反应(重要特征):
有元素化合价升降的化学反应是氧化还原反应。
(3) 从电子转移角度认识氧化还原反应(本质)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
第一课时 氧化还原反应
C + O2 == CO2
CaO + H2O == Ca(OH)2
2KClO3 == 2KCl + 3O2↑
Cu(OH)2 == CuO + H2O
H2+CuO == Cu + H2O
Zn + CuCl2 ═ ZnCl2 + Cu
2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO4
2HCl + CaCO3 == CaCl2 + H2O + CO2↑
△
点燃
△
△
化合
分解
置换
复分解
归纳:氧化还原反应与四种基本反应类型的关系:
不一定是
不一定是
一定是
一定不是
有单质参加的化合反应一定是氧化还原反应.
有单质生成的分解反应一定是氧化还原反应.
置换反应一定是氧化还原反应.
复分解反应一定不是氧化还原反应.
化合反应
氧化还原反应
复分解反应
第一课时 氧化还原反应
【课堂练习】
1、氧化还原反应与四种基本反应类型的关系如下图,请补充填写完整。
1. 下列有关氧化还原反应的叙述中,正确的是( )
A. 一定有氧元素参加
B. 得到电子的物质发生氧化反应
C. 一种物质被氧化则另一种物质被还原
D.一定有电子转移(得失或偏移)
D
【课堂练习】
2. 下列反应中,属于氧化还原反应的是( )
A. 3NO2+H2O=2HNO3 +NO
B. 3O2 = 2O3
C. 2H2O2===2H2O+O2
D.CaCO3===CaO+CO2
【课堂练习】
AC
3、某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是
C
【课堂练习】
升 失 氧
降 得 还
知识回顾
化合价升高 (重要特征)
失电子 (本质、原因)
(元素) 被氧化
(物质) 发生氧化反应
化合价降低 (重要特征)
得电子 (本质、原因)
(元素) 被还原
(物质) 发生还原反应
化学与生活:焊接铁轨
在焊接铁轨时,人们常将铝粉与氧化铁的混合物点燃,由于反应放出大量的热,置换出的铁以熔融态流出.让熔融的铁流入铁轨的裂缝,冷却后就将铁轨牢牢的黏结在一起.
2Al + Fe2O3 2Fe + Al2O3
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
0
+3
0
+3
思考:反应中电子得失情况如何表示?
生活中的氧化反应
失去2×3e- ,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
2Al + Fe2O3 2Fe + Al2O3
0
+3
0
+3
a.标变价
b.连双线
c. 注得失
1、双线桥法
电子转移如何表示?
注意:失电子总数=得电子总数
价态变化原子个数 ×每个原子得失电子数
1.标变价:标出变价元素的化合价
2.连双线:箭头从反应物指向生成物的同一种元素
3.注得失:写出“失去”、“得到”及相应的电子数
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
2Na+ Cl2 = 2NaCl
0
0
+1
-1
"双线桥"法小结
1.用双线桥法表示下列反应的电子转移
2KClO3 2KCl+3O2↑
-2
-1
0
+5
得到2×6e- ,化合价降低,被还原
失去6×2e- ,化合价升高,被氧化
"双线桥"法巩固练习
① 单线桥画在反应物一侧,不跨越等号。
② 箭头由失电子元素指向得电子元素。
③ 单线桥不需要写“失去”“得到”。
④ 数字表示该反应中得失电子的总数。
2CuO + C 2 Cu + CO2
高温
4e-
+2 0 0 +4
↑
"单线桥"法
a.标变价
b.连单线
c. 注总数
Cu + 4HNO3(浓) === Cu(NO3)2+ 2 NO2↑+ 2H2O
2e-
"单线桥"法巩固练习
