1.2.1 电解质的电离课件(共24页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1 电解质的电离课件(共24页)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 16:04:19 | ||
图片预览






文档简介
(共24张PPT)
第一课时 电解质的电离
人教版 必修1
第二节 离子反应
第一章 物质及其变化
生活常识
小心触电
化学与生活密切相关!
【导入】为什么带有汗液的手触碰通电电源容易触电?
因为水会导电~
因为NaCl会导电~
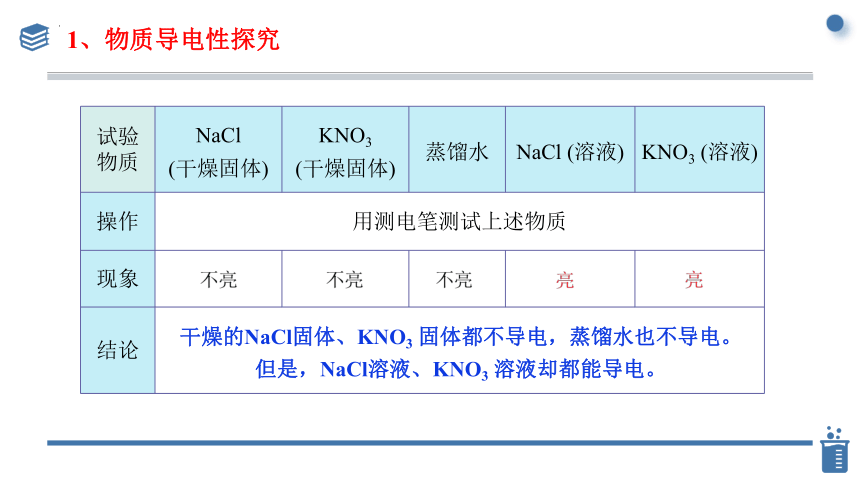
1、物质导电性探究
试验物质 NaCl (干燥固体) KNO3 (干燥固体) 蒸馏水 NaCl (溶液) KNO3 (溶液)
操作 用测电笔测试上述物质 现象
结论 干燥的NaCl固体、KNO3 固体都不导电,蒸馏水也不导电。
但是,NaCl溶液、KNO3 溶液却都能导电。
2、电解质与非电解质
电解质的定义:我们把像NaCl、KNO3、HCl、NaOH等这种,
在水溶液中或熔融状态下能导电的化合物称为“电解质”。
“或”,是指满足其中一种状态就可以。
电解质必须是化合物,必须是自身能够电离。
酸只有在水溶液中才具有导电性,如液态 HCl不具导电性。
化合物
电解质
非电解质
酸 (如 HCl、HNO3、H2SO4、CH3COOH …)
碱 (如 NaOH、Ca(OH)2、Al(OH)3、NH3 H2O …)
非金属氧化物 (如 SO2、CO2…)
大多数有机物 (如 蔗糖、酒精…)
盐 (如 NaCl、KNO3、MgSO4 …)
活泼金属氧化物 (如 CaO、Na2O、MgO…)
能导电
均不导电
非酸性气态氢化物 ( 如 NH3 等)
H2O
2、电解质与非电解质
1、NaCl 溶液能导电,因此NaCl 溶液属于电解质。
2、水不是电解质。
3、金属铁可以导电,属于电解质。
4、BaSO4 固体不导电,但它是电解质。
× 混合物不属于电解质。
× 水导电能力较差,但属于电解质。
× 铁是单质,不属于电解质。
【随堂练习1】判断下列说法是否正确。
√
难溶于水的无机化合物也可以是电解质。
如BaSO4、AgCl在熔融状态下或溶于水的部分能电离。
【随堂练习1】判断下列说法是否正确。
5、 CO2的水溶液能导电,所以CO2是电解质( )
×
6、电解质不一定溶于水( )
提示:CO2溶于水导电本质上是因为CO2与H2O反应生成了新物质H2CO3,H2CO3是电解质.
√
7、一个化合物不是电解质就是非电解质 ( )
√
提示:比如BaSO4、AgCl、Cu(OH)2等
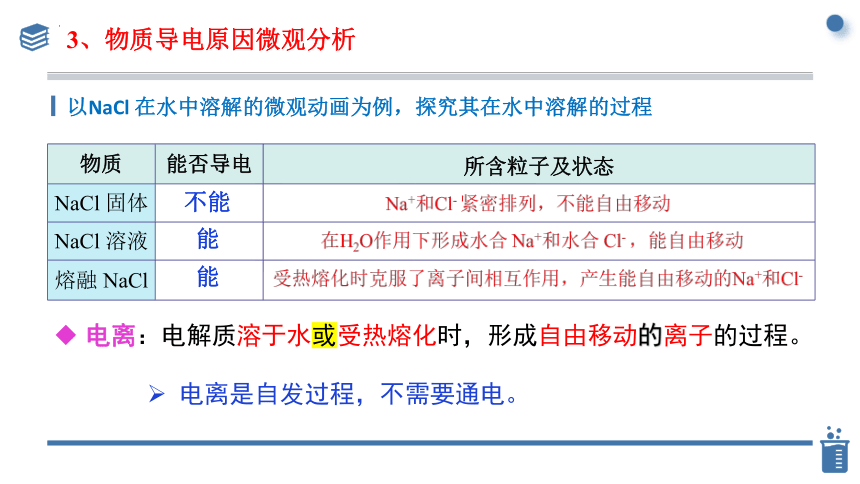
以NaCl 在水中溶解的微观动画为例,探究其在水中溶解的过程
物质 能否导电 所含粒子及状态
NaCl 固体
NaCl 溶液
熔融 NaCl
3、物质导电原因微观分析
不能
能
能
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
电离是自发过程,不需要通电。
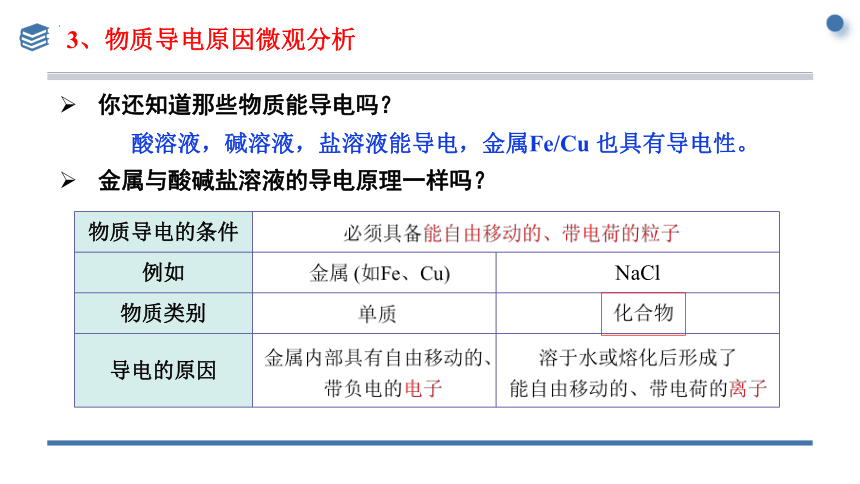
你还知道那些物质能导电吗?
酸溶液,碱溶液,盐溶液能导电,金属Fe/Cu 也具有导电性。
物质导电的条件 例如 NaCl
物质类别
导电的原因
金属与酸碱盐溶液的导电原理一样吗?
3、物质导电原因微观分析
同性电荷相斥,异性电荷相吸
3、物质导电原因微观分析
如 NaCl 的电离方程式:
Na+ + Cl- (为了简便,仍以离子符号表示水合离子)
NaCl
4、电离方程式书写
化学式
等号
阳离子+阴离子
检查:
①等号两边各元素的原子个数相等
②等号右边离子所带的电荷总数为零
注意:
原子团不能拆开;
离子个数写在离子符号前。
① 写出下列酸的电离方程式:HCl、HNO3、H2SO4
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
▲酸的本质:电离时生成的阳离子全部是 H+ 。
5、酸、碱、盐的电离及定义
② 写出下列碱的电离方程式:NaOH、KOH、Ba(OH)2
5、酸、碱、盐的电离及定义
NaOH ==== Na+ + OH-
▲碱的本质:电离时生成的阴离子全部是 OH- 。
Ba(OH)2 ==== Ba2+ + 2OH-
KOH ==== K+ + OH-
③ 写出下列盐的电离方程式:NH4Cl、Fe2(SO4)3、NaHCO3
5、酸、碱、盐的电离及定义
NH4Cl === NH4+ + Cl-
▲盐的本质:电离时能生成金属离子或NH4+和酸根离子。
Fe2(SO4)3 === 2Fe3+ +3SO42-
NaHCO3 === Na+ + HCO3-
生活常识
小心触电
化学与生活密切相关!
【导入】为什么用湿手触碰电器电源容易触电?
因为手上的汗液中含有 NaCl 等物质,当遇到水时,
会形成能导电的电解质溶液。因此湿手直接接触电源时容易发生触电事故。
==》NaCl 是一种电解质。
6、影响溶液导电性的因素 (控制变量法-比较)
离子浓度:离子浓度越大,导电能力越强。
离子所带电荷数:离子所带电荷数越高,导电能力越强。
溶液温度:溶液温度越高,导电能力越强。
电解质类型:电解质类型不同,导电能力不同。
& ①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤硫酸
⑥稀硫酸 ⑦液氨 ⑧氨水 ⑨SO2 ⑩胆矾晶体 ⑾熔融NaCl ⑿蔗糖晶体 ⒀酒精 ⒁酒精溶液 ⒂石墨 ⒃BaSO4
(1)上述状态下可导电的是_____ __________
(2)属于电解质的是____________________
(3)属于非电解质的是____________________
(4)上述状态下的电解质不能导电的是_ ________
① ② ④ ⑥ ⑧ ⑾ ⒂
③ ⑤ ⑩ ⑾ ⒃
⑦ ⑨ ⑿ ⒀
③ ⑤ ⑩ ⒃
【随堂练习2】完成下列填写。
第一课时 电解质的电离
电解质
强电解质:在水溶液中全部电离的电解质,包括强酸、强碱、绝大部分盐…
弱电解质:在水溶液中部分电离的电解质,包括弱酸、弱碱、水…
并不是,不同电解质在水中电离程度不同,有些可以全部电离,有些只能部分电离。
【思考】所有的电解质在水中都能完全电离吗?
课堂练习1
下列哪些物质属于强电解质?哪些属于弱电解质?
HCl、Ba(OH)2、Ca(OH)2、CuSO4、 CH3COOH、H2CO3、 NH3·H2O、水
强电解质:HCl、Ba(OH)2、Ca(OH)2、CuSO4;
弱电解质:CH3COOH、H2CO3、 NH3·H2O、水。
第一课时 电解质的电离
交流讨论
2、 有人认为 BaSO4 难溶于水,所以它不是强电解质。你认同这种观点吗?
不认同这种观点,BaSO4 是强电解质。
原因:
BaSO4 是电解质,它在熔融状态下能够电离出 Ba2+ 和 SO42-。
BaSO4 难溶于水,导电性差,但是它在水溶液中溶解的部分是能够完全电离的,所以是强电解质。
电离方程式:表示电解质电离过程的式子
第一课时 物质的分类
KNO3
H2O
H2SO4
HNO3
HCl
注意事项:
常见的原子团不能拆,如NO3-、OH-、SO42-等
弱电解质的电离要用“ ”表示
方程式必须配平 (阴阳离子电荷数相等)
【酸的本质】电离时生成的阳离子全部是氢离子(H+)
第一课时 物质的分类
思考与讨论
Ca(OH)2
Ba(OH)2
NaOH
写出下列碱的电离方程式,并参考酸的本质,尝试从电离角度概括碱的本质。
【碱的本质】电离时生成的阴离子全部是氢氧根离子(OH-)
第一课时 物质的分类
课堂练习
1、 下列叙述中,正确的是( )。
KNO3 固体不导电,所以 KNO3 不是电解质。
铜丝、石墨均能导电,所以它们都是电解质。
熔融的 MgCl2 能导电,所以 MgCl2 是电解质。
NaCl 溶于水,在通电条件下才能发生电离。
电解质的电离与是否通电无关。
第一课时 物质的分类
课堂练习
2、 写出下列物质的电离方程式。
(1) HNO3 (2) KOH (3) Fe2(SO4)3 (4) NH4NO3
答案:
(1)
(2)
(3)
(4)
第一课时 物质的分类
课后作业
1、 写出部分盐的电离方程式,并类比酸、碱的本质,从电离角度归纳出盐的本质。
2、思考弱电解质溶液中,可能存在哪些粒子?以H2CO3为例.
第一课时 电解质的电离
人教版 必修1
第二节 离子反应
第一章 物质及其变化
生活常识
小心触电
化学与生活密切相关!
【导入】为什么带有汗液的手触碰通电电源容易触电?
因为水会导电~
因为NaCl会导电~
1、物质导电性探究
试验物质 NaCl (干燥固体) KNO3 (干燥固体) 蒸馏水 NaCl (溶液) KNO3 (溶液)
操作 用测电笔测试上述物质 现象
结论 干燥的NaCl固体、KNO3 固体都不导电,蒸馏水也不导电。
但是,NaCl溶液、KNO3 溶液却都能导电。
2、电解质与非电解质
电解质的定义:我们把像NaCl、KNO3、HCl、NaOH等这种,
在水溶液中或熔融状态下能导电的化合物称为“电解质”。
“或”,是指满足其中一种状态就可以。
电解质必须是化合物,必须是自身能够电离。
酸只有在水溶液中才具有导电性,如液态 HCl不具导电性。
化合物
电解质
非电解质
酸 (如 HCl、HNO3、H2SO4、CH3COOH …)
碱 (如 NaOH、Ca(OH)2、Al(OH)3、NH3 H2O …)
非金属氧化物 (如 SO2、CO2…)
大多数有机物 (如 蔗糖、酒精…)
盐 (如 NaCl、KNO3、MgSO4 …)
活泼金属氧化物 (如 CaO、Na2O、MgO…)
能导电
均不导电
非酸性气态氢化物 ( 如 NH3 等)
H2O
2、电解质与非电解质
1、NaCl 溶液能导电,因此NaCl 溶液属于电解质。
2、水不是电解质。
3、金属铁可以导电,属于电解质。
4、BaSO4 固体不导电,但它是电解质。
× 混合物不属于电解质。
× 水导电能力较差,但属于电解质。
× 铁是单质,不属于电解质。
【随堂练习1】判断下列说法是否正确。
√
难溶于水的无机化合物也可以是电解质。
如BaSO4、AgCl在熔融状态下或溶于水的部分能电离。
【随堂练习1】判断下列说法是否正确。
5、 CO2的水溶液能导电,所以CO2是电解质( )
×
6、电解质不一定溶于水( )
提示:CO2溶于水导电本质上是因为CO2与H2O反应生成了新物质H2CO3,H2CO3是电解质.
√
7、一个化合物不是电解质就是非电解质 ( )
√
提示:比如BaSO4、AgCl、Cu(OH)2等
以NaCl 在水中溶解的微观动画为例,探究其在水中溶解的过程
物质 能否导电 所含粒子及状态
NaCl 固体
NaCl 溶液
熔融 NaCl
3、物质导电原因微观分析
不能
能
能
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
电离是自发过程,不需要通电。
你还知道那些物质能导电吗?
酸溶液,碱溶液,盐溶液能导电,金属Fe/Cu 也具有导电性。
物质导电的条件 例如 NaCl
物质类别
导电的原因
金属与酸碱盐溶液的导电原理一样吗?
3、物质导电原因微观分析
同性电荷相斥,异性电荷相吸
3、物质导电原因微观分析
如 NaCl 的电离方程式:
Na+ + Cl- (为了简便,仍以离子符号表示水合离子)
NaCl
4、电离方程式书写
化学式
等号
阳离子+阴离子
检查:
①等号两边各元素的原子个数相等
②等号右边离子所带的电荷总数为零
注意:
原子团不能拆开;
离子个数写在离子符号前。
① 写出下列酸的电离方程式:HCl、HNO3、H2SO4
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
HNO3 === H+ + NO3-
▲酸的本质:电离时生成的阳离子全部是 H+ 。
5、酸、碱、盐的电离及定义
② 写出下列碱的电离方程式:NaOH、KOH、Ba(OH)2
5、酸、碱、盐的电离及定义
NaOH ==== Na+ + OH-
▲碱的本质:电离时生成的阴离子全部是 OH- 。
Ba(OH)2 ==== Ba2+ + 2OH-
KOH ==== K+ + OH-
③ 写出下列盐的电离方程式:NH4Cl、Fe2(SO4)3、NaHCO3
5、酸、碱、盐的电离及定义
NH4Cl === NH4+ + Cl-
▲盐的本质:电离时能生成金属离子或NH4+和酸根离子。
Fe2(SO4)3 === 2Fe3+ +3SO42-
NaHCO3 === Na+ + HCO3-
生活常识
小心触电
化学与生活密切相关!
【导入】为什么用湿手触碰电器电源容易触电?
因为手上的汗液中含有 NaCl 等物质,当遇到水时,
会形成能导电的电解质溶液。因此湿手直接接触电源时容易发生触电事故。
==》NaCl 是一种电解质。
6、影响溶液导电性的因素 (控制变量法-比较)
离子浓度:离子浓度越大,导电能力越强。
离子所带电荷数:离子所带电荷数越高,导电能力越强。
溶液温度:溶液温度越高,导电能力越强。
电解质类型:电解质类型不同,导电能力不同。
& ①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤硫酸
⑥稀硫酸 ⑦液氨 ⑧氨水 ⑨SO2 ⑩胆矾晶体 ⑾熔融NaCl ⑿蔗糖晶体 ⒀酒精 ⒁酒精溶液 ⒂石墨 ⒃BaSO4
(1)上述状态下可导电的是_____ __________
(2)属于电解质的是____________________
(3)属于非电解质的是____________________
(4)上述状态下的电解质不能导电的是_ ________
① ② ④ ⑥ ⑧ ⑾ ⒂
③ ⑤ ⑩ ⑾ ⒃
⑦ ⑨ ⑿ ⒀
③ ⑤ ⑩ ⒃
【随堂练习2】完成下列填写。
第一课时 电解质的电离
电解质
强电解质:在水溶液中全部电离的电解质,包括强酸、强碱、绝大部分盐…
弱电解质:在水溶液中部分电离的电解质,包括弱酸、弱碱、水…
并不是,不同电解质在水中电离程度不同,有些可以全部电离,有些只能部分电离。
【思考】所有的电解质在水中都能完全电离吗?
课堂练习1
下列哪些物质属于强电解质?哪些属于弱电解质?
HCl、Ba(OH)2、Ca(OH)2、CuSO4、 CH3COOH、H2CO3、 NH3·H2O、水
强电解质:HCl、Ba(OH)2、Ca(OH)2、CuSO4;
弱电解质:CH3COOH、H2CO3、 NH3·H2O、水。
第一课时 电解质的电离
交流讨论
2、 有人认为 BaSO4 难溶于水,所以它不是强电解质。你认同这种观点吗?
不认同这种观点,BaSO4 是强电解质。
原因:
BaSO4 是电解质,它在熔融状态下能够电离出 Ba2+ 和 SO42-。
BaSO4 难溶于水,导电性差,但是它在水溶液中溶解的部分是能够完全电离的,所以是强电解质。
电离方程式:表示电解质电离过程的式子
第一课时 物质的分类
KNO3
H2O
H2SO4
HNO3
HCl
注意事项:
常见的原子团不能拆,如NO3-、OH-、SO42-等
弱电解质的电离要用“ ”表示
方程式必须配平 (阴阳离子电荷数相等)
【酸的本质】电离时生成的阳离子全部是氢离子(H+)
第一课时 物质的分类
思考与讨论
Ca(OH)2
Ba(OH)2
NaOH
写出下列碱的电离方程式,并参考酸的本质,尝试从电离角度概括碱的本质。
【碱的本质】电离时生成的阴离子全部是氢氧根离子(OH-)
第一课时 物质的分类
课堂练习
1、 下列叙述中,正确的是( )。
KNO3 固体不导电,所以 KNO3 不是电解质。
铜丝、石墨均能导电,所以它们都是电解质。
熔融的 MgCl2 能导电,所以 MgCl2 是电解质。
NaCl 溶于水,在通电条件下才能发生电离。
电解质的电离与是否通电无关。
第一课时 物质的分类
课堂练习
2、 写出下列物质的电离方程式。
(1) HNO3 (2) KOH (3) Fe2(SO4)3 (4) NH4NO3
答案:
(1)
(2)
(3)
(4)
第一课时 物质的分类
课后作业
1、 写出部分盐的电离方程式,并类比酸、碱的本质,从电离角度归纳出盐的本质。
2、思考弱电解质溶液中,可能存在哪些粒子?以H2CO3为例.
