1.1.2物质的转化课件(共21页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2物质的转化课件(共21页)2023-2024学年高一上学期化学人教版(2019)必修第一册 | 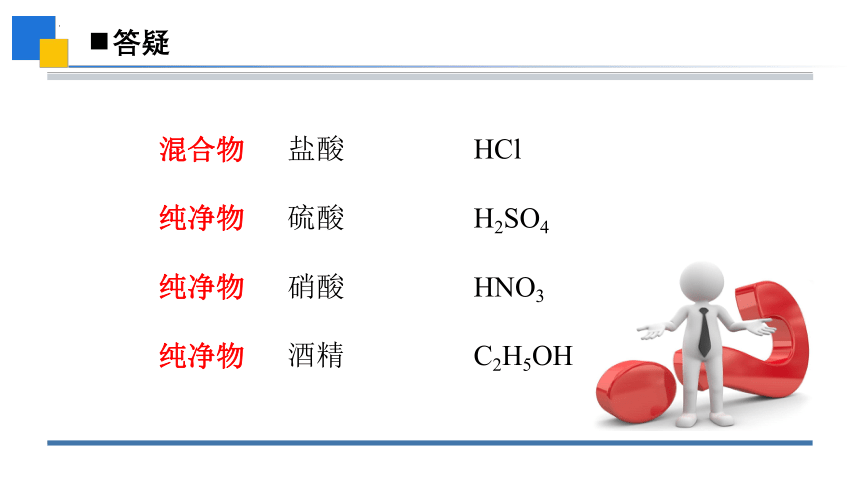 | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 17:20:28 | ||
图片预览








文档简介
(共21张PPT)
盐酸 HCl
硫酸 H2SO4
硝酸 HNO3
酒精 C2H5OH
答疑
混合物
纯净物
纯净物
纯净物
答疑
1、盐酸、硫酸、硝酸、酒精是混合物还是纯净物?
盐酸是氯化氢气体溶于水形成的溶液,所以盐酸是混合物。
在高中阶段,单纯提到“硫酸”是指纯净物,即 H2SO4;若提到稀硫酸或浓硫酸时则为混合物。“硝酸”化学式是 HNO3,同理为纯净物。
乙醇俗称酒精,化学式是:C2H5OH,当提到15%酒精这时是混合物。
这里的OH不是氢氧根,是羟基,因此不是碱。
盐酸是混合物,硫酸、硝酸、酒精是纯净物。
2、空气是胶体吗?
空气不是胶体。
空气是由氮气、氧气、稀有气体(氦、氖、氩、氪、氙、氡)、二氧化碳以及其他物质组成(粒子直径均<1nm)。
但实际上,空气中会存在一些粉尘、水滴等小颗粒,他们分散在空气中形成气溶胶。如云、烟、雾。此时空气作为分散剂。
3、H2SO4、CH3COOH 分别是几元酸?
H2SO4 是二元酸;CH3COOH 是一元酸。
无机酸,一般情况下 有几个氢就是几元酸。
有机酸,一般情况下 有几个 COOH 就是几元酸。
COOH (羧基——有机酸的官能团)
答疑
第二课时 物质的转化
人教版 必修1
第一节 物质的分类及转化
第一章 物质及其变化
生活中的物质转化
铁链生锈
铜鼎生锈
木炭燃烧
铁被氧化成红色的铁锈
铜被氧化成绿色的铜绿
木炭燃烧发光发热,产生CO2
结论:通过化学变化可以实现物质之间的转化。
【化学反应特点】物质种类改变,但元素种类不变。
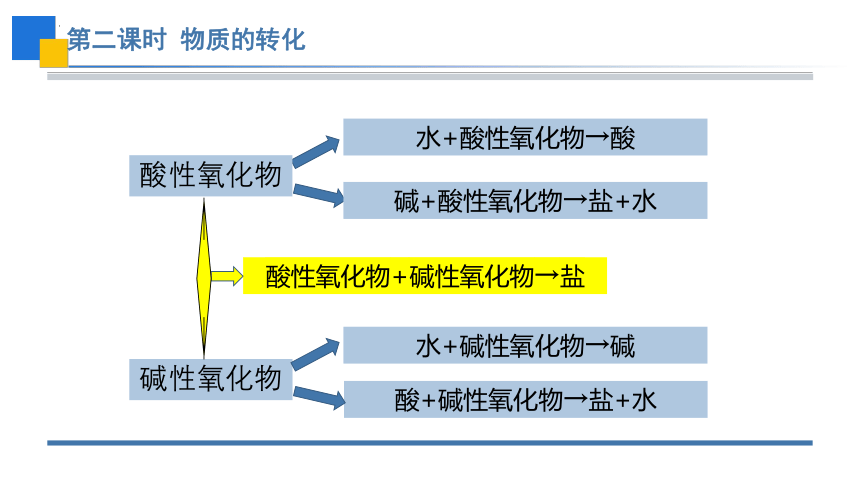
水+酸性氧化物→酸
碱+酸性氧化物→盐+水
碱性氧化物
水+碱性氧化物→碱
酸+碱性氧化物→盐+水
酸性氧化物+碱性氧化物→盐
酸性氧化物
第二课时 物质的转化
酸的性质:
1.能使指示剂显色:遇紫色石蕊试液显( )色 ,
2.能与活泼金属反应生成盐和氢气
Zn + H2SO4 == ZnSO4 + H2↑
3.能与碱性氧化物反应生成盐和水
CuO+ 2HCl == CuCl2 + H2O
CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O
4.能与碱发生中和反应生成盐和水
5.能与某些盐反应生成新盐和新酸
NaOH + HCl == NaCl + H2O
红
溶液中都含H+
碱的性质:
溶液中都含OH-
1.能使指示剂显色 :遇紫色石蕊试液显( )色 , 遇无色酚酞显( )色;
CO2 + 2NaOH == Na2CO3 + H2O
CuSO4 + 2NaOH == Cu(OH)2↓ + Na2SO4
3.能与酸发生中和反应,生成盐和水
HCl +NaOH == NaCl + H2O
2.与酸性氧化物反应生成盐和水
4.能与某些盐反应生成新盐和新碱
蓝
红
CuSO4 + Fe == Cu + FeSO4
1.盐跟某些金属的反应
Na2CO3 + H2SO4 ==Na2SO4 + CO2↑ +H2O
2.盐跟酸的反应
3.盐跟碱的反应
Na2CO3 + Ca(OH)2 == CaCO3↓ + 2NaOH
4.盐跟另一种盐的反应
AgNO3 + NaCl == AgCl↓ + NaNO3
盐的性质:
酸性氧化物
金属
非金属
碱
盐
酸
盐
酸
金属
碱性氧化物
碱
盐
碱
碱性氧化物
总结:单质、氧化物、酸、碱、盐之间的转化关系
盐
第二课时 物质的转化
化合反应
分解反应
置换反应(依据金属活动顺序表)
复分解反应(溶液中进行的交换反应)
四
大
基
本
反
应
类
型
A + B == AB
AB == A + B
AB + CD == BC + AD
或 AB+ CD == BD + CA
AB + CD == AD + CB
金属+酸:
氢前面的金属能置换出酸中的氢
(一般而言这里的酸指盐酸和稀硫酸)
金属+盐溶液:
排在前面的金属能把后面的
金属从它的盐溶液中置换出来。(盐可溶,金属除K、Ca、Na)
置换反应发生条件
金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
从左到右金属活性逐渐减弱
第二课时 物质的转化
【思考】酸、碱、盐一定会发生复分解反应吗?
复分解反应发生条件:
生成物:沉淀、气体或水
反应物 :一般而言,无酸必全溶
不是复分解反应
第二课时 物质的转化
【思考与讨论】写出下列物质之间转化的化学方程式,体会由金属单质到盐的转化关系。
。
Ca
CaO
Ca(OH)2
CaSO4
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
第二课时 物质的转化
【思考与讨论】写出下列物质之间转化的化学方程式,体会由非金属单质到盐的转化关系。
C
CO2
H2CO3
CaCO3
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
【结论】根据物质的组成和性质,以及物质之间的转化关系,可以确定制取某类物质的可能方法。
第二课时 物质的转化
走进工业
如制备 NaOH 可以选用什么方法?写出相应化学方程式
碱性氧化物与水反应
盐与另一种碱反应
想制取某种碱,通常可以采取哪些方法?
物质转化——逻辑建构
思考:如何制备 MgCl2
元素组成 寻找原料
物质性质 设计反应路径
Mg + 2HCl = MgCl2 + H2↑
Mg + CuCl2 = MgCl2 + Cu
MgO + 2HCl = MgCl2 + H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
MgCO3+ 2HCl = MgCl2 + H2O + CO2↑
MgSO4+ BaCl2 = MgCl2 + BaSO4 ↓
①金属+非金属
②金属+酸
③金属+盐
④氧化物+酸
⑤碱+酸
⑥盐+酸
⑦盐+盐
Mg + Cl2 = MgCl2
第二课时 物质的转化
巩固练习
1、写出下列物质之间转化的化学方程式。
答:(1)
(2)
2
第二课时 物质的转化
巩固练习
答案:
2、以 Fe、CuO、H2SO4 三种物质为原料,用两种方法制取Cu,请写出反应化学方程式。
物质的分类及转化
同类物质 往往具有相似的性质
酸的化学性质:
①与活泼金属反应;②与碱性氧化物反应;③与碱反应;④与某些盐反应; ④使石蕊变红
碱的化学性质:
①与非金属氧化物反应;②与酸反应;③与某些盐反应;④使酚酞试剂变红,使紫色石蕊试剂变蓝反应
盐的化学性质:
①与金属反应;②与酸反应;③与碱反应;④与某些盐反应
物质的转化:
根据物质的组成和性质,通过化学变化实现物质之间的转化。 物质转化过程中元素不会改变,这是考虑物质间如何转化的基本。
盐酸 HCl
硫酸 H2SO4
硝酸 HNO3
酒精 C2H5OH
答疑
混合物
纯净物
纯净物
纯净物
答疑
1、盐酸、硫酸、硝酸、酒精是混合物还是纯净物?
盐酸是氯化氢气体溶于水形成的溶液,所以盐酸是混合物。
在高中阶段,单纯提到“硫酸”是指纯净物,即 H2SO4;若提到稀硫酸或浓硫酸时则为混合物。“硝酸”化学式是 HNO3,同理为纯净物。
乙醇俗称酒精,化学式是:C2H5OH,当提到15%酒精这时是混合物。
这里的OH不是氢氧根,是羟基,因此不是碱。
盐酸是混合物,硫酸、硝酸、酒精是纯净物。
2、空气是胶体吗?
空气不是胶体。
空气是由氮气、氧气、稀有气体(氦、氖、氩、氪、氙、氡)、二氧化碳以及其他物质组成(粒子直径均<1nm)。
但实际上,空气中会存在一些粉尘、水滴等小颗粒,他们分散在空气中形成气溶胶。如云、烟、雾。此时空气作为分散剂。
3、H2SO4、CH3COOH 分别是几元酸?
H2SO4 是二元酸;CH3COOH 是一元酸。
无机酸,一般情况下 有几个氢就是几元酸。
有机酸,一般情况下 有几个 COOH 就是几元酸。
COOH (羧基——有机酸的官能团)
答疑
第二课时 物质的转化
人教版 必修1
第一节 物质的分类及转化
第一章 物质及其变化
生活中的物质转化
铁链生锈
铜鼎生锈
木炭燃烧
铁被氧化成红色的铁锈
铜被氧化成绿色的铜绿
木炭燃烧发光发热,产生CO2
结论:通过化学变化可以实现物质之间的转化。
【化学反应特点】物质种类改变,但元素种类不变。
水+酸性氧化物→酸
碱+酸性氧化物→盐+水
碱性氧化物
水+碱性氧化物→碱
酸+碱性氧化物→盐+水
酸性氧化物+碱性氧化物→盐
酸性氧化物
第二课时 物质的转化
酸的性质:
1.能使指示剂显色:遇紫色石蕊试液显( )色 ,
2.能与活泼金属反应生成盐和氢气
Zn + H2SO4 == ZnSO4 + H2↑
3.能与碱性氧化物反应生成盐和水
CuO+ 2HCl == CuCl2 + H2O
CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O
4.能与碱发生中和反应生成盐和水
5.能与某些盐反应生成新盐和新酸
NaOH + HCl == NaCl + H2O
红
溶液中都含H+
碱的性质:
溶液中都含OH-
1.能使指示剂显色 :遇紫色石蕊试液显( )色 , 遇无色酚酞显( )色;
CO2 + 2NaOH == Na2CO3 + H2O
CuSO4 + 2NaOH == Cu(OH)2↓ + Na2SO4
3.能与酸发生中和反应,生成盐和水
HCl +NaOH == NaCl + H2O
2.与酸性氧化物反应生成盐和水
4.能与某些盐反应生成新盐和新碱
蓝
红
CuSO4 + Fe == Cu + FeSO4
1.盐跟某些金属的反应
Na2CO3 + H2SO4 ==Na2SO4 + CO2↑ +H2O
2.盐跟酸的反应
3.盐跟碱的反应
Na2CO3 + Ca(OH)2 == CaCO3↓ + 2NaOH
4.盐跟另一种盐的反应
AgNO3 + NaCl == AgCl↓ + NaNO3
盐的性质:
酸性氧化物
金属
非金属
碱
盐
酸
盐
酸
金属
碱性氧化物
碱
盐
碱
碱性氧化物
总结:单质、氧化物、酸、碱、盐之间的转化关系
盐
第二课时 物质的转化
化合反应
分解反应
置换反应(依据金属活动顺序表)
复分解反应(溶液中进行的交换反应)
四
大
基
本
反
应
类
型
A + B == AB
AB == A + B
AB + CD == BC + AD
或 AB+ CD == BD + CA
AB + CD == AD + CB
金属+酸:
氢前面的金属能置换出酸中的氢
(一般而言这里的酸指盐酸和稀硫酸)
金属+盐溶液:
排在前面的金属能把后面的
金属从它的盐溶液中置换出来。(盐可溶,金属除K、Ca、Na)
置换反应发生条件
金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
从左到右金属活性逐渐减弱
第二课时 物质的转化
【思考】酸、碱、盐一定会发生复分解反应吗?
复分解反应发生条件:
生成物:沉淀、气体或水
反应物 :一般而言,无酸必全溶
不是复分解反应
第二课时 物质的转化
【思考与讨论】写出下列物质之间转化的化学方程式,体会由金属单质到盐的转化关系。
。
Ca
CaO
Ca(OH)2
CaSO4
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
第二课时 物质的转化
【思考与讨论】写出下列物质之间转化的化学方程式,体会由非金属单质到盐的转化关系。
C
CO2
H2CO3
CaCO3
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
【结论】根据物质的组成和性质,以及物质之间的转化关系,可以确定制取某类物质的可能方法。
第二课时 物质的转化
走进工业
如制备 NaOH 可以选用什么方法?写出相应化学方程式
碱性氧化物与水反应
盐与另一种碱反应
想制取某种碱,通常可以采取哪些方法?
物质转化——逻辑建构
思考:如何制备 MgCl2
元素组成 寻找原料
物质性质 设计反应路径
Mg + 2HCl = MgCl2 + H2↑
Mg + CuCl2 = MgCl2 + Cu
MgO + 2HCl = MgCl2 + H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
MgCO3+ 2HCl = MgCl2 + H2O + CO2↑
MgSO4+ BaCl2 = MgCl2 + BaSO4 ↓
①金属+非金属
②金属+酸
③金属+盐
④氧化物+酸
⑤碱+酸
⑥盐+酸
⑦盐+盐
Mg + Cl2 = MgCl2
第二课时 物质的转化
巩固练习
1、写出下列物质之间转化的化学方程式。
答:(1)
(2)
2
第二课时 物质的转化
巩固练习
答案:
2、以 Fe、CuO、H2SO4 三种物质为原料,用两种方法制取Cu,请写出反应化学方程式。
物质的分类及转化
同类物质 往往具有相似的性质
酸的化学性质:
①与活泼金属反应;②与碱性氧化物反应;③与碱反应;④与某些盐反应; ④使石蕊变红
碱的化学性质:
①与非金属氧化物反应;②与酸反应;③与某些盐反应;④使酚酞试剂变红,使紫色石蕊试剂变蓝反应
盐的化学性质:
①与金属反应;②与酸反应;③与碱反应;④与某些盐反应
物质的转化:
根据物质的组成和性质,通过化学变化实现物质之间的转化。 物质转化过程中元素不会改变,这是考虑物质间如何转化的基本。
