化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共13张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共13张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 17:48:36 | ||
图片预览




文档简介
(共13张PPT)
第三节 氧化还原反应
第2课时 氧化剂与还原剂
第一章 物质及其变化
2
1
本节重点
本节难点
认识氧化剂与还原剂
氧化还原反应中相关概念间的联系
生活中的氧化剂、还原剂
脱氧剂
抗氧化护肤品
任务1:认识氧化剂、还原剂
(1)用双线桥法表示反应中物质元素化合价变化及电子转移过程。
0
-1
0
+1
0
-1
0
+1
失去 2×e-,化合价升高,被氧化
得到 2×e-,化合价降低,被还原
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
Cl2氧化剂,具有氧化性
Na还原剂,具有还原性
Cl2氧化剂,具有氧化性
H2还原剂,具有还原性
① 电子转移
② 化合价升降
升—失—氧化——还原剂
降—得—还原——氧化剂
口诀:
一、氧化剂、还原剂(P25)
1. 氧化剂:得到电子(或电子对偏向)、化合价降低的物质。
2. 还原剂:失去电子(或电子对偏离)、化合价升高的物质。
二、氧化性、还原性
氧化剂——具有氧化性(得到电子的能力)
还原剂——具有还原性(失去电子的能力)
得电子能力越强,氧化性越强。
失电子能力越强,还原性越强。
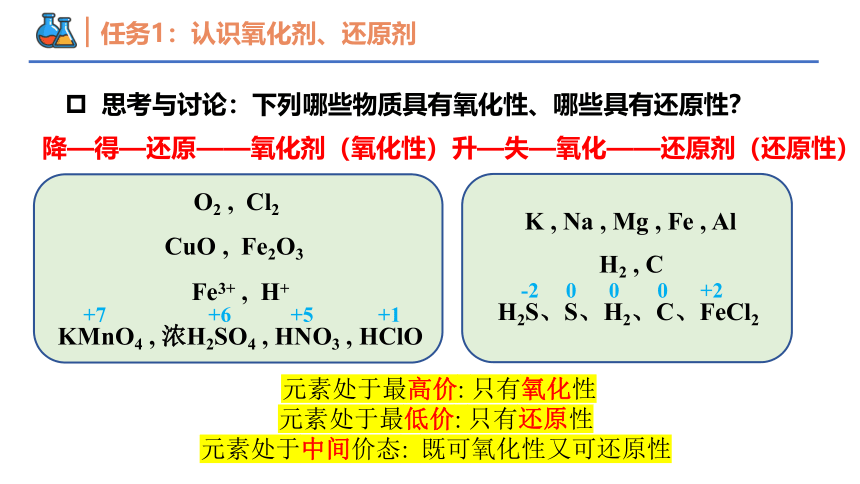
元素处于最高价: 只有氧化性
元素处于最低价: 只有还原性
元素处于中间价态: 既可氧化性又可还原性
任务1:认识氧化剂、还原剂
思考与讨论:下列哪些物质具有氧化性、哪些具有还原性?
O2 , Cl2
CuO , Fe2O3
Fe3+ , H+
KMnO4 , 浓H2SO4 , HNO3 , HClO
K , Na , Mg , Fe , Al
H2 , C
H2S、S、H2、C、FeCl2
-2 0 0 0 +2
升—失—氧化——还原剂(还原性)
降—得—还原——氧化剂(氧化性)
+7 +6 +5 +1
任务2:认识氧化产物、还原产物
得到2e- ,化合价降低,被还原
失去2×e-,化合价升高,被氧化
CuO + H2 Cu + H2O
+2
+1
0
0
氧化剂
还原剂
(2)请分析该反应中的氧化剂、还原剂、氧化产物、还原产物。
还原产物
氧化产物
氧化产物:还原剂被氧化后的生成物
还原产物:氧化剂被还原后的生成物
任务2:认识氧化产物、还原产物
2CuO + C 2Cu + CO2
高温
2KMnO4 = K2MnO4 + MnO2 + O2
氧化剂 还原剂 还原产物 氧化产物
还原剂 还原产物 还原产物 氧化产物
氧化剂
随堂练习:请指出 氧化剂、还原剂、氧化产物、还原产物。
氧化性:
还原性:
氧化剂 > 氧化产物
还原剂 > 还原产物
任务3:氧化性、还原性比较
CuO + H2 Cu + H2O
+2
+1
0
0
氧化剂
还原剂
还原产物
氧化产物
Cl2 + H2O = HCl + HClO
氧化剂 还原产物 氧化产物
还原剂
氧化性:
还原性:
Cl2 > HClO
Cl2 > HCl
归纳:氧化还原反应概念模型的构建
Fe + CuSO4 FeSO4 + Cu
还原性
氧化性
还原剂
氧化剂
氧化产物
还原产物
化合价升高
还原反应
氧化反应
被还原
被氧化
失电子
得电子
化合价降低
0 +2 +2 0
变成还原产物
变成氧化产物
升—失—氧化——还原剂
降—得—还原——氧化剂
归纳:氧化还原反应概念模型的构建
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
升—失—氧化——还原剂(还原性)
降—得—还原——氧化剂(氧化性)
探究课堂
【变式1】下列物质可以作为食品包装中的脱氧剂成分的是 ( )
A、FeCl3 B、Fe
C、Fe2O3 D、Na2FeO4
【变式2】已知维生素E可作为抗氧化剂,则维生素E ( )
A.作还原剂 B. 作氧化剂
C.被还原 D. 化合价降低
B
A
认识氧化剂、还原剂
氧化性、还原性的比较
氧化还原反应中基本概念之间的关系
第三节
氧化还原反应
第2课时
升—失—氧化——还原剂(还原性)
降—得—还原——氧化剂(氧化性)
第三节 氧化还原反应
第2课时 氧化剂与还原剂
第一章 物质及其变化
2
1
本节重点
本节难点
认识氧化剂与还原剂
氧化还原反应中相关概念间的联系
生活中的氧化剂、还原剂
脱氧剂
抗氧化护肤品
任务1:认识氧化剂、还原剂
(1)用双线桥法表示反应中物质元素化合价变化及电子转移过程。
0
-1
0
+1
0
-1
0
+1
失去 2×e-,化合价升高,被氧化
得到 2×e-,化合价降低,被还原
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
Cl2氧化剂,具有氧化性
Na还原剂,具有还原性
Cl2氧化剂,具有氧化性
H2还原剂,具有还原性
① 电子转移
② 化合价升降
升—失—氧化——还原剂
降—得—还原——氧化剂
口诀:
一、氧化剂、还原剂(P25)
1. 氧化剂:得到电子(或电子对偏向)、化合价降低的物质。
2. 还原剂:失去电子(或电子对偏离)、化合价升高的物质。
二、氧化性、还原性
氧化剂——具有氧化性(得到电子的能力)
还原剂——具有还原性(失去电子的能力)
得电子能力越强,氧化性越强。
失电子能力越强,还原性越强。
元素处于最高价: 只有氧化性
元素处于最低价: 只有还原性
元素处于中间价态: 既可氧化性又可还原性
任务1:认识氧化剂、还原剂
思考与讨论:下列哪些物质具有氧化性、哪些具有还原性?
O2 , Cl2
CuO , Fe2O3
Fe3+ , H+
KMnO4 , 浓H2SO4 , HNO3 , HClO
K , Na , Mg , Fe , Al
H2 , C
H2S、S、H2、C、FeCl2
-2 0 0 0 +2
升—失—氧化——还原剂(还原性)
降—得—还原——氧化剂(氧化性)
+7 +6 +5 +1
任务2:认识氧化产物、还原产物
得到2e- ,化合价降低,被还原
失去2×e-,化合价升高,被氧化
CuO + H2 Cu + H2O
+2
+1
0
0
氧化剂
还原剂
(2)请分析该反应中的氧化剂、还原剂、氧化产物、还原产物。
还原产物
氧化产物
氧化产物:还原剂被氧化后的生成物
还原产物:氧化剂被还原后的生成物
任务2:认识氧化产物、还原产物
2CuO + C 2Cu + CO2
高温
2KMnO4 = K2MnO4 + MnO2 + O2
氧化剂 还原剂 还原产物 氧化产物
还原剂 还原产物 还原产物 氧化产物
氧化剂
随堂练习:请指出 氧化剂、还原剂、氧化产物、还原产物。
氧化性:
还原性:
氧化剂 > 氧化产物
还原剂 > 还原产物
任务3:氧化性、还原性比较
CuO + H2 Cu + H2O
+2
+1
0
0
氧化剂
还原剂
还原产物
氧化产物
Cl2 + H2O = HCl + HClO
氧化剂 还原产物 氧化产物
还原剂
氧化性:
还原性:
Cl2 > HClO
Cl2 > HCl
归纳:氧化还原反应概念模型的构建
Fe + CuSO4 FeSO4 + Cu
还原性
氧化性
还原剂
氧化剂
氧化产物
还原产物
化合价升高
还原反应
氧化反应
被还原
被氧化
失电子
得电子
化合价降低
0 +2 +2 0
变成还原产物
变成氧化产物
升—失—氧化——还原剂
降—得—还原——氧化剂
归纳:氧化还原反应概念模型的构建
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
升—失—氧化——还原剂(还原性)
降—得—还原——氧化剂(氧化性)
探究课堂
【变式1】下列物质可以作为食品包装中的脱氧剂成分的是 ( )
A、FeCl3 B、Fe
C、Fe2O3 D、Na2FeO4
【变式2】已知维生素E可作为抗氧化剂,则维生素E ( )
A.作还原剂 B. 作氧化剂
C.被还原 D. 化合价降低
B
A
认识氧化剂、还原剂
氧化性、还原性的比较
氧化还原反应中基本概念之间的关系
第三节
氧化还原反应
第2课时
升—失—氧化——还原剂(还原性)
降—得—还原——氧化剂(氧化性)
