四川省凉山州宁南中学2023-2024学年高一上学期第二次月考化学模拟试题(二)(含答案)
文档属性
| 名称 | 四川省凉山州宁南中学2023-2024学年高一上学期第二次月考化学模拟试题(二)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 22:36:13 | ||
图片预览



文档简介
宁南中学2026届高一上期第二次月考化学模拟试题(二)
测试范围:必修一第一、二、三章
(时间:75分钟 分值:100分)
可能用到的原子量: N 14 O 16 Na 23 Cl 35.5 Fe 56 Cu 64
一、选择题(每小题只有一个选项符合题意,每题3分,共42分)
1、下列物质中,属于纯净物的是( )
①陶瓷 ②水泥 ③玻璃 ④漂白粉 ⑤NH3 ⑥氯水 ⑦液氧
A.①③⑤ B.②④⑥ C.⑤⑦ D.⑥⑦
2、 贵州省博物馆中陈列着如图这件名为“战国兽面纹铜戈”的青铜器,通长23厘米,内长8.5厘米,阑宽9.3厘米,做工精美。以下关于合金的说法不正确的是
A. 青铜是我国最早使用的合金 B. 合金中可以含有碳等非金属
C. 合金的熔点比各组成成分低 D. 铝合金可以耐强酸强碱腐蚀
3、化学与社会、生活密切相关,下列说法不正确的是( )
A.漂白粉和漂粉精既可作漂白棉、麻的漂白剂,也可用作游泳池等场所消毒剂
B.在清洗卫生间时,混合使用“洁厕灵”和“84消毒液”可增强消毒效果
C.氧化还原反应广泛存在于生产和生活中,如金属的冶炼、食物的腐败、绿色植物的光合作用等
D.小苏打受热分解或与面团发酵产生的酸反应产生气体,因此可用作面点膨松剂
4、下列离子方程式正确的是( )
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++3Cu=2Fe+3Cu2+
C.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
D.Na与CuSO4水溶液反应:2Na+Cu2+=Cu+2Na+
5、下列各组中的离子,能在溶液中大量共存的是
A. B.
C. D.
6、下列叙述正确的是( )
A.常温常压下,所含的原子数是
B.在中充分燃烧,生成
C.在标准状况下,和CO2的混合气体中含氧原子数共0.2NA
D.与一定量完全反应,生成和混合物,钠失去电子总数大于
7、某些离子的检验及结论一定正确的是( )
A.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有
B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中变浑浊,则一定有
C.用铂丝蘸某无色溶液,在无色灯焰灼烧观察到黄色火焰,则一定含Na+,可能含K+
D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-
8、已知酸性:。在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A.新制氯水呈黄绿色是因为溶液中含有HCl
B.新制氯水久置后,溶液中、数目均增多
C.将KHCO3固体加入新制的氯水中,有气泡产生,说明氯水中有HClO
D.向紫色石蕊试液中加入氯水溶液先变蓝后褪色
9、下列关于Na2CO3、NaHCO3的叙述正确的是( )
①在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
②向相同浓度的Na2CO3、NaHCO3溶液中加少量盐酸,产生CO2气体较快的为NaHCO3
③除去NaHCO3固体中的Na2CO3:将固体加热至恒重
④能用澄清石灰水鉴别Na2CO3、NaHCO3溶液
⑤相同温度下,溶解度:Na2CO3⑥物质的量相同时,消耗盐酸的量:Na2CO3>NaHCO3
A.②⑥ B.①③ C.④⑤ D.③⑥
10、周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应为:。下列有关该反应的说法不正确的是( )
A.该反应是氧化还原反应,发生化合价变化的有二种元素
B.得电子,发生的是还原反应
C.由此反应可知,化合反应一定是氧化还原反应
D.参与反应消耗
11、下列物质的鉴别或除杂方法错误的是
A.用丁达尔现象鉴别淀粉溶液和NaCl溶液
B.用溶液除去中含有的HCl气体
C.用烧碱溶液鉴别溶液、溶液、溶液
D.除去溶液中杂质:通入
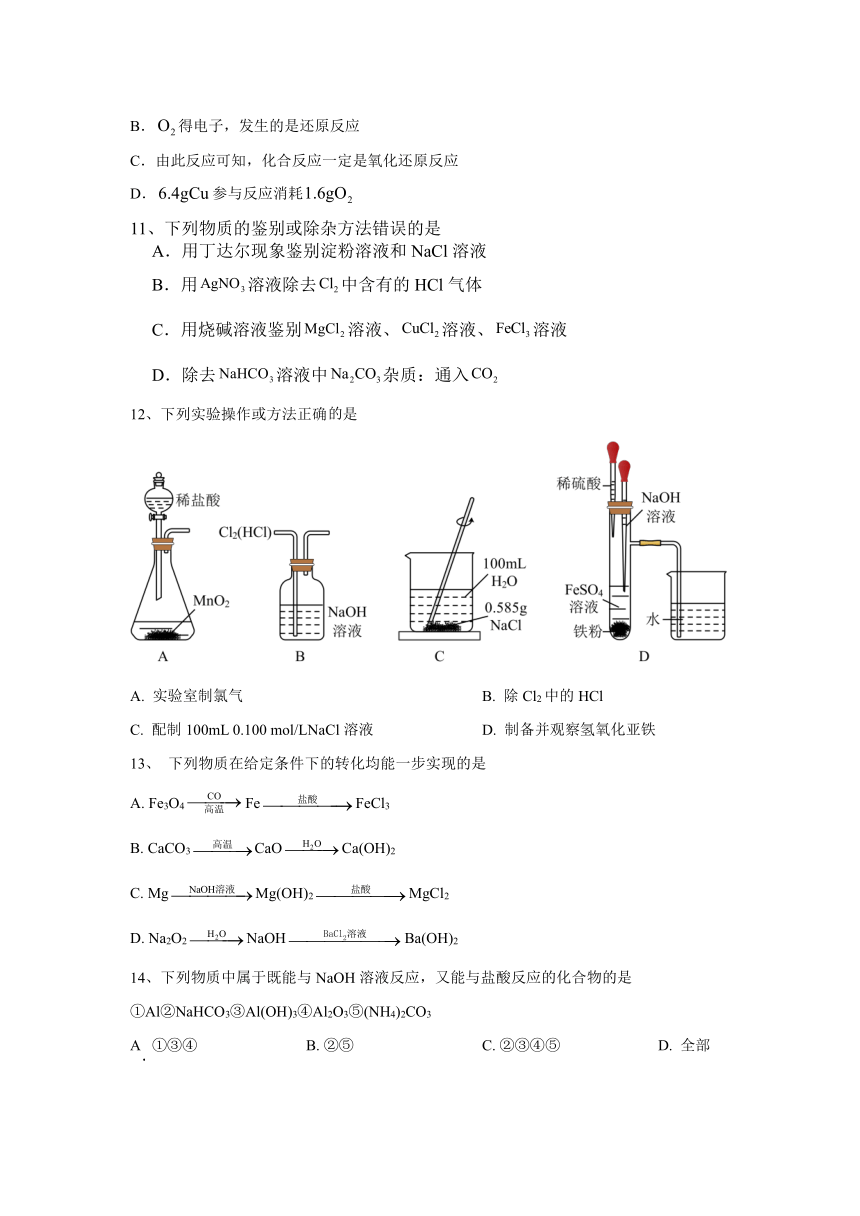
12、下列实验操作或方法正确是
A. 实验室制氯气 B. 除Cl2中的HCl
C. 配制100mL 0.100 mol/LNaCl溶液 D. 制备并观察氢氧化亚铁
13、 下列物质在给定条件下的转化均能一步实现的是
A. Fe3O4FeFeCl3
B. CaCO3CaOCa(OH)2
C. MgMg(OH)2MgCl2
D. Na2O2NaOHBa(OH)2
14、下列物质中属于既能与NaOH溶液反应,又能与盐酸反应的化合物的是①Al②NaHCO3③Al(OH)3④Al2O3⑤(NH4)2CO3
A ①③④ B. ②⑤ C. ②③④⑤ D. 全部
二、填空题(除标记外每空2分,共58分)。
15、(12分)现有下列物质:
①熔融NaCl ②溶液 ③氯气 ④ ⑤NaOH溶液 ⑥氢氧化铁胶体 ⑦
⑧铜 ⑨ 过氧化钠 ⑩
上述物质中属于电解质的是___________________(填标号)。
(2)将②逐滴加入⑥中的现象是_____________________________________。
(3)④加入过量的氢氧化钡溶液中,发生反应的离子方程式为__________________________。
(4)③通入石灰乳中,发生反应的化学方程式为_______________________________。
(5)⑦与⑨反应的化学方程式为:___________________________________,该反应生成标准状况下22.4L氧气,转移的电子数目为_______。
16、(14分)实验室现需要240mL 1 mol/L葡萄糖溶液。请根据所学知识回答下列问题:
(1)葡萄糖的摩尔质量为 。
(2)配制该溶液所需仪器有天平、量筒、烧杯、胶头滴管、 。
(3)需称量葡萄糖固体的质量为 g。
a.向容量瓶中直接加蒸馏水至离刻度线处
b.将溶液冷却至室温后转移到容量瓶中
c.将配制好的溶液转入准备好的试剂瓶中贮存备用
d.将称量好的葡萄糖用适量水在小烧杯内溶解
e.称量配制溶液所需的葡萄糖
f.盖上容量瓶塞子,上下颠倒容量瓶使溶液混合均匀
g.用胶头滴管小心加蒸馏水至刻度线
h.用少量蒸馏水洗涤小烧杯和玻璃棒次,并将洗涤液转移到容量瓶中
①容量瓶使用前应 。
②正确的操作顺序是 (填标号)。
③判断下列操作对所配制溶液的浓度有何影响(填“偏高”、“偏低”或“无影响”):
i.在烧杯中溶解葡萄糖时,有少量溶液溅出 。
ii.未冷却至室温就转移定容 。
iii.定容时仰视刻度线 。
iv.转移溶液前,容量瓶中有少量的蒸馏水 。
17、(16分)铁及其化合物在生产生活中有重要用途。某化学兴趣小组同学设计以下实验探究铁及其化合物性质。
I.“铁与水反应”的实验,并检验产物的性质:
(1)A装置的作用是______________________。
(2)B中反应的化学方程式为_________________________________。
(3)点燃E处酒精灯之前应进行的操作是______________________。
Ⅱ.制备氢氧化亚铁:设计如下实验能较长时间观察到白色Fe(OH)2沉淀,选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。
(4)植物油的作用是_________________________________。
(5)实验时,先___________(填“打开”或“关闭”)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,___________(填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能持续一段时间不变色。
Ⅲ.制备FeCl3:已知无水FeCl3在空气中遇水易潮解,加热易升华,实验装置如图。
(6)饱和食盐水的作用是_________________________________。
(7)装置D发生反应的化学方程式为_________________________________。
(8)硬质玻璃管直接接入收集器的优点是_________________________________。
(9)F装置的两个作用是______________________、______________________。
18、(16分)、已知A是一种红棕色金属氧化物,B、D是金属单质,C是两性金属氧化物,J是一种难溶于水的白色化合物,受热后容易发生分解。
已知:
(1)写出下列物质的化学式:C________________、E________________、G________________。
(2)按要求写方程式:
①的化学方程式:_________________________________;
②EF的离子方程式:________________________________;
③的离子方程式:________________________________;
④B与溶液反应的离子方程式:_________。
⑤检验E中阳离子的具体操作为__________________________________________。
⑥检验H中阴离子的具体操作为__________________________________________。
宁南中学2026届高一上期第二次月考化学模拟试题(二)
答案
一、选择题(本大题共15小题,每空3分,共计42分。)
题目 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 C D B B A C C B A C B D B C
二、填空题(本大题共4小题,共计58分。)
15、(12分)除标注,其余每空2分
(1)①④⑨
(2)先出现红褐色沉淀后沉淀消失,溶液变为黄色
(3)
(4)2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 +2H2O
(5)2Na2O2+2CO2===2Na2CO3+O2 2NA
16、(14分)(1)180g/mol
(2)玻璃棒、250mL容量瓶
(3)45.0g
(4) 检查是否漏水 edbhagfc 偏低 偏高 偏低 无影响
17、(16分)(1)产生水蒸气
(2)
(3)收集H2,并检验其纯度
(4)隔绝空气,防止二价铁被氧化
(5) ①. 打开 ②. 关闭
(6)除去Cl2中混有的HCl
(7)
(8)防止FeCl3在导气管中凝华成固体堵塞装置
(9) ①. 除去过量的Cl2尾气,防止污染空气 ②. 防止空气中的水蒸气进入收集器导致FeCl3潮解变质
18、(16分)除标注,其余每空2分
(1) FeCl2 Fe(OH)3
(2) Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
Al2O3 + 2OH- +3H2O=2[Al(OH)4]-
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
取少量待测液于试管中滴加KSCN溶液,若溶液呈红色,则说明原溶液有Fe3+。
取少量待测液于试管中先加入稀硝酸酸化,再滴加AgNO3溶液,若出现白色沉淀,则证明原溶液有Cl-。
测试范围:必修一第一、二、三章
(时间:75分钟 分值:100分)
可能用到的原子量: N 14 O 16 Na 23 Cl 35.5 Fe 56 Cu 64
一、选择题(每小题只有一个选项符合题意,每题3分,共42分)
1、下列物质中,属于纯净物的是( )
①陶瓷 ②水泥 ③玻璃 ④漂白粉 ⑤NH3 ⑥氯水 ⑦液氧
A.①③⑤ B.②④⑥ C.⑤⑦ D.⑥⑦
2、 贵州省博物馆中陈列着如图这件名为“战国兽面纹铜戈”的青铜器,通长23厘米,内长8.5厘米,阑宽9.3厘米,做工精美。以下关于合金的说法不正确的是
A. 青铜是我国最早使用的合金 B. 合金中可以含有碳等非金属
C. 合金的熔点比各组成成分低 D. 铝合金可以耐强酸强碱腐蚀
3、化学与社会、生活密切相关,下列说法不正确的是( )
A.漂白粉和漂粉精既可作漂白棉、麻的漂白剂,也可用作游泳池等场所消毒剂
B.在清洗卫生间时,混合使用“洁厕灵”和“84消毒液”可增强消毒效果
C.氧化还原反应广泛存在于生产和生活中,如金属的冶炼、食物的腐败、绿色植物的光合作用等
D.小苏打受热分解或与面团发酵产生的酸反应产生气体,因此可用作面点膨松剂
4、下列离子方程式正确的是( )
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++3Cu=2Fe+3Cu2+
C.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:SO+Ba2+=BaSO4↓
D.Na与CuSO4水溶液反应:2Na+Cu2+=Cu+2Na+
5、下列各组中的离子,能在溶液中大量共存的是
A. B.
C. D.
6、下列叙述正确的是( )
A.常温常压下,所含的原子数是
B.在中充分燃烧,生成
C.在标准状况下,和CO2的混合气体中含氧原子数共0.2NA
D.与一定量完全反应,生成和混合物,钠失去电子总数大于
7、某些离子的检验及结论一定正确的是( )
A.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有
B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中变浑浊,则一定有
C.用铂丝蘸某无色溶液,在无色灯焰灼烧观察到黄色火焰,则一定含Na+,可能含K+
D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-
8、已知酸性:。在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A.新制氯水呈黄绿色是因为溶液中含有HCl
B.新制氯水久置后,溶液中、数目均增多
C.将KHCO3固体加入新制的氯水中,有气泡产生,说明氯水中有HClO
D.向紫色石蕊试液中加入氯水溶液先变蓝后褪色
9、下列关于Na2CO3、NaHCO3的叙述正确的是( )
①在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
②向相同浓度的Na2CO3、NaHCO3溶液中加少量盐酸,产生CO2气体较快的为NaHCO3
③除去NaHCO3固体中的Na2CO3:将固体加热至恒重
④能用澄清石灰水鉴别Na2CO3、NaHCO3溶液
⑤相同温度下,溶解度:Na2CO3
A.②⑥ B.①③ C.④⑤ D.③⑥
10、周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应为:。下列有关该反应的说法不正确的是( )
A.该反应是氧化还原反应,发生化合价变化的有二种元素
B.得电子,发生的是还原反应
C.由此反应可知,化合反应一定是氧化还原反应
D.参与反应消耗
11、下列物质的鉴别或除杂方法错误的是
A.用丁达尔现象鉴别淀粉溶液和NaCl溶液
B.用溶液除去中含有的HCl气体
C.用烧碱溶液鉴别溶液、溶液、溶液
D.除去溶液中杂质:通入
12、下列实验操作或方法正确是
A. 实验室制氯气 B. 除Cl2中的HCl
C. 配制100mL 0.100 mol/LNaCl溶液 D. 制备并观察氢氧化亚铁
13、 下列物质在给定条件下的转化均能一步实现的是
A. Fe3O4FeFeCl3
B. CaCO3CaOCa(OH)2
C. MgMg(OH)2MgCl2
D. Na2O2NaOHBa(OH)2
14、下列物质中属于既能与NaOH溶液反应,又能与盐酸反应的化合物的是①Al②NaHCO3③Al(OH)3④Al2O3⑤(NH4)2CO3
A ①③④ B. ②⑤ C. ②③④⑤ D. 全部
二、填空题(除标记外每空2分,共58分)。
15、(12分)现有下列物质:
①熔融NaCl ②溶液 ③氯气 ④ ⑤NaOH溶液 ⑥氢氧化铁胶体 ⑦
⑧铜 ⑨ 过氧化钠 ⑩
上述物质中属于电解质的是___________________(填标号)。
(2)将②逐滴加入⑥中的现象是_____________________________________。
(3)④加入过量的氢氧化钡溶液中,发生反应的离子方程式为__________________________。
(4)③通入石灰乳中,发生反应的化学方程式为_______________________________。
(5)⑦与⑨反应的化学方程式为:___________________________________,该反应生成标准状况下22.4L氧气,转移的电子数目为_______。
16、(14分)实验室现需要240mL 1 mol/L葡萄糖溶液。请根据所学知识回答下列问题:
(1)葡萄糖的摩尔质量为 。
(2)配制该溶液所需仪器有天平、量筒、烧杯、胶头滴管、 。
(3)需称量葡萄糖固体的质量为 g。
a.向容量瓶中直接加蒸馏水至离刻度线处
b.将溶液冷却至室温后转移到容量瓶中
c.将配制好的溶液转入准备好的试剂瓶中贮存备用
d.将称量好的葡萄糖用适量水在小烧杯内溶解
e.称量配制溶液所需的葡萄糖
f.盖上容量瓶塞子,上下颠倒容量瓶使溶液混合均匀
g.用胶头滴管小心加蒸馏水至刻度线
h.用少量蒸馏水洗涤小烧杯和玻璃棒次,并将洗涤液转移到容量瓶中
①容量瓶使用前应 。
②正确的操作顺序是 (填标号)。
③判断下列操作对所配制溶液的浓度有何影响(填“偏高”、“偏低”或“无影响”):
i.在烧杯中溶解葡萄糖时,有少量溶液溅出 。
ii.未冷却至室温就转移定容 。
iii.定容时仰视刻度线 。
iv.转移溶液前,容量瓶中有少量的蒸馏水 。
17、(16分)铁及其化合物在生产生活中有重要用途。某化学兴趣小组同学设计以下实验探究铁及其化合物性质。
I.“铁与水反应”的实验,并检验产物的性质:
(1)A装置的作用是______________________。
(2)B中反应的化学方程式为_________________________________。
(3)点燃E处酒精灯之前应进行的操作是______________________。
Ⅱ.制备氢氧化亚铁:设计如下实验能较长时间观察到白色Fe(OH)2沉淀,选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。
(4)植物油的作用是_________________________________。
(5)实验时,先___________(填“打开”或“关闭”)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,___________(填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能持续一段时间不变色。
Ⅲ.制备FeCl3:已知无水FeCl3在空气中遇水易潮解,加热易升华,实验装置如图。
(6)饱和食盐水的作用是_________________________________。
(7)装置D发生反应的化学方程式为_________________________________。
(8)硬质玻璃管直接接入收集器的优点是_________________________________。
(9)F装置的两个作用是______________________、______________________。
18、(16分)、已知A是一种红棕色金属氧化物,B、D是金属单质,C是两性金属氧化物,J是一种难溶于水的白色化合物,受热后容易发生分解。
已知:
(1)写出下列物质的化学式:C________________、E________________、G________________。
(2)按要求写方程式:
①的化学方程式:_________________________________;
②EF的离子方程式:________________________________;
③的离子方程式:________________________________;
④B与溶液反应的离子方程式:_________。
⑤检验E中阳离子的具体操作为__________________________________________。
⑥检验H中阴离子的具体操作为__________________________________________。
宁南中学2026届高一上期第二次月考化学模拟试题(二)
答案
一、选择题(本大题共15小题,每空3分,共计42分。)
题目 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 C D B B A C C B A C B D B C
二、填空题(本大题共4小题,共计58分。)
15、(12分)除标注,其余每空2分
(1)①④⑨
(2)先出现红褐色沉淀后沉淀消失,溶液变为黄色
(3)
(4)2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 +2H2O
(5)2Na2O2+2CO2===2Na2CO3+O2 2NA
16、(14分)(1)180g/mol
(2)玻璃棒、250mL容量瓶
(3)45.0g
(4) 检查是否漏水 edbhagfc 偏低 偏高 偏低 无影响
17、(16分)(1)产生水蒸气
(2)
(3)收集H2,并检验其纯度
(4)隔绝空气,防止二价铁被氧化
(5) ①. 打开 ②. 关闭
(6)除去Cl2中混有的HCl
(7)
(8)防止FeCl3在导气管中凝华成固体堵塞装置
(9) ①. 除去过量的Cl2尾气,防止污染空气 ②. 防止空气中的水蒸气进入收集器导致FeCl3潮解变质
18、(16分)除标注,其余每空2分
(1) FeCl2 Fe(OH)3
(2) Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
Al2O3 + 2OH- +3H2O=2[Al(OH)4]-
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
取少量待测液于试管中滴加KSCN溶液,若溶液呈红色,则说明原溶液有Fe3+。
取少量待测液于试管中先加入稀硝酸酸化,再滴加AgNO3溶液,若出现白色沉淀,则证明原溶液有Cl-。
同课章节目录
