第三节 物质组成的表示第3课时 物质组成的定量表示课件(共26张PPT)
文档属性
| 名称 | 第三节 物质组成的表示第3课时 物质组成的定量表示课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 22:43:38 | ||
图片预览








文档简介
(共26张PPT)
第三节
物质组成的表示
第3课时
物质组成的定量表示
【重点】了解相对分子质量的含义。
【难点】计算相对分子质量和组成物质各元素的质量比,计算物
质中某元素的质量分数。
1.学会利用相对原子质量进行物质组成的简单计算。
2.能根据化学式进行各元素质量比的简单计算。
3.能根据化学式进行某元素的质量分数的简单计算。
学习目标
教学目标
新知导入
说出下列化学符号的意义。
2O
O2
2个氧原子
1个氧分子由2个氧原子构成
2个氧原子的相对原子质量=
2×16=32
氧气的相对分子质量=
概念
化学式中各原子的相对原子质量的总和。
一、相对分子质量
2×16=32
1.H2O 的相对分子质量
2.NH4NO3的相对分子质量
1× 2+16 = 18
14× 2+ 1 ×4 + 16 × 3= 80
关键:
数清原子的个数。
例题
判断正误:
(1)相对分子质量是分子的实际质量。 ( )
(2)水(H2O)的化学式量为1×2+16=18 g。 ( )
×
×
小题快练
1.H2SO4的相对分子质量
2.CO(NH2)2的相对分子质量
1× 2 + 32 + 16 × 4= 98
12+16 +(14+1×2)×2 = 60
或 12+16 +14×2+1×4 = 60
CxHyOz的相对分子质量
12x +y +16z
跟踪练习
1×2 :16
水中氢元素和氧元素的质量比=
水中氢元素的质量
水中氧元素的质量
概念
元素的质量比等于化合物中各元素原子的相对原子
质量与原子个数乘积的比。
二、计算组成元素的质量比
CxHyOz中C、H、O的质量比
12 ∶ (16 × 2) = 3 ∶ 8
(14 × 2)∶(1× 4)∶(16 × 3 )= 7∶1∶12
12 ∶16∶(14×2)∶(1×4 )= 3∶4∶7∶1
12x ∶y ∶16z
1.CO2中C、O的质量比
2.NH4NO3中N、H、O的质量比
3.CO(NH2)2 中C、O、N、H的质量比
例题
判断正误:
(3)化合物中各元素的质量比为化学式中该元素的相对原子质量×原子个数之比,应约简为最简整数比。 ( )
(4)锰酸钾(K2MnO4)中钾、锰、氧三种元素的质量比是2∶1∶4。 ( )
√
×
小题快练
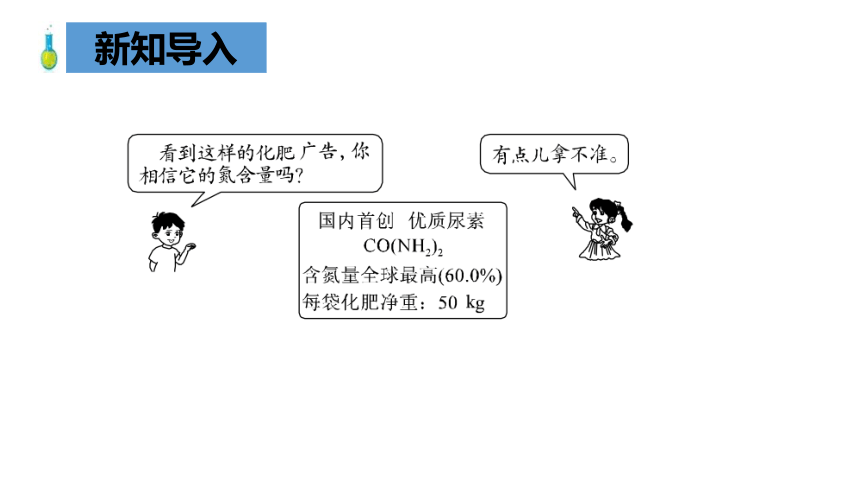
氮元素的质量分数真实吗?
尿素的化学式:
CO(NH2)2
(假设该尿素不含杂质)
三、计算物质中元素的质量分数
CO(NH2)2 中N元素的质量分数为
=
尿素的相对分子质量
N的相对原子质量×N的原子数
×100%
=
12+16 +14×2+1×4
14×2
×100%
≈
46.7%
化肥的含量真实。
三、计算物质中元素的质量分数
1. 计算氮肥NH4NO3中氮元素的质量分数。
解:
NH4NO3的相对分子质量=14+1 ×4+14+16 ×3=80
氮元素的质量分数
N的相对原子质量×N的原子数
NH4NO3的相对分子质量
×100%
=
14 ×2
80
×100%
=
= 35%
例题
2.若测得某种NH4HCO3的含氮量为18%,判断该物质是否纯净?
NH4HCO3的相对分子质量=14+1×5+12+16×3=79
解:
因为17.7%<18%, 所以该物质不纯净。
79
14 ×1
×100%≈17.7%
氮元素的质量分数=
例题
1.剧烈运动时肌肉里产生乳酸(C3H6O3),会导致肌肉酸痛.下列说法错误的是( )
A.乳酸的相对分子质量为90
B.乳酸由碳、氢、氧三种元素组成
C.乳酸中氧元素的质量分数最大
D.乳酸中碳、氢、氧元素质量之比为1:2:1
D
跟踪练习
2. 第五届中国(湖南)国际矿物宝石博览会在郴州成功举行.这场亚洲最大的矿物宝石博览会以“神奇的框晶,多彩的萤石”
为主题,向世界充分展示了“矿晶之都,多彩郴州”的独特魅
力.萤石的主要成分是CaF2,试计算:
(1)CaF2的相对分子质量是____;
(2)CaF2中钙元素和氟元素的质量比为_______;
(3)CaF2中氟元素的质量分数为_______(结果精确到0.1%).
78
20:19
48.7%
3.某化合物由碳、氢两种元素组成,这两种元素的质量比为3:1,该化合物的化学式量为16,写出它的化学式。
解:设化学式为CxHy
12x:y=3:1
12x+y=16
X=1 y=4
化学式为 CH4
4、已知FeSO4、Fe2(SO4)3 的混合物中铁元素的质量分数为a%,则氧元素的质量分数为( )
6.血红蛋白的相对分子质量为68000,其中铁元素质量分数为0.33%,则平均每个血红蛋白分子中铁原子个数( )
A.400个 B.20个 C.224个 D.4个
5.下列铜的化合物中,铜元素的质量分数最大的是( )
A.CuO B.CuSO4 C. Cu(OH)2 D. Cu2O
D
D
1. 计算氮肥NH4NO3中氮元素的质量分数。
解:
NH4NO3的相对分子质量=14+1 ×4+14+16 ×3=80
氮元素的质量分数
N的相对原子质量×N的原子数
NH4NO3的相对分子质量
×100%
=
14 ×2
80
×100%
=
= 35%
例题
四、继续探究:35%是什么意思
35%的含义:100克硝酸铵中含氮元素的质量为35克。
若硝酸铵的质量是100g,硝酸铵中氮元素的质量是多少?
100g×35%=35g
若硝酸铵中氮元素的质量是70g,则硝酸铵的质量是多少?
70g÷35%=200g
练习:(1)计算二氧化硫中硫元素的质量分数。
(2)计算64t 二氧化硫中硫元素的质量。
解:(1)SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
(2)64t二氧化硫中硫元素的质量=64t×50%=32 t
元素质量=物质质量×元素质量分数
物质质量=元素质量÷元素质量分数
总结
1、化学式量:化学式中各原子的相对原子质量的总和
2、化合物中各元素的质量比
元素的质量比=各原子的相对原子质量(总和)之比
3、化合物中某元素的质量分数
元素的质量分数=
化学式量
X100%
元素的相对原子质量×原子个数
4、化合物中元素的质量
元素的质量=化合物的质量×元素的质量分数
课堂总结
有关相对分子质量的计算
根据:化学式
依据:化学式的意义
工具:相对原子质量
计算相对分子质量
计算物质组成元素的质量比
计算物质中某元素的质量分数
课堂总结
生活中的化学
第三节
物质组成的表示
第3课时
物质组成的定量表示
【重点】了解相对分子质量的含义。
【难点】计算相对分子质量和组成物质各元素的质量比,计算物
质中某元素的质量分数。
1.学会利用相对原子质量进行物质组成的简单计算。
2.能根据化学式进行各元素质量比的简单计算。
3.能根据化学式进行某元素的质量分数的简单计算。
学习目标
教学目标
新知导入
说出下列化学符号的意义。
2O
O2
2个氧原子
1个氧分子由2个氧原子构成
2个氧原子的相对原子质量=
2×16=32
氧气的相对分子质量=
概念
化学式中各原子的相对原子质量的总和。
一、相对分子质量
2×16=32
1.H2O 的相对分子质量
2.NH4NO3的相对分子质量
1× 2+16 = 18
14× 2+ 1 ×4 + 16 × 3= 80
关键:
数清原子的个数。
例题
判断正误:
(1)相对分子质量是分子的实际质量。 ( )
(2)水(H2O)的化学式量为1×2+16=18 g。 ( )
×
×
小题快练
1.H2SO4的相对分子质量
2.CO(NH2)2的相对分子质量
1× 2 + 32 + 16 × 4= 98
12+16 +(14+1×2)×2 = 60
或 12+16 +14×2+1×4 = 60
CxHyOz的相对分子质量
12x +y +16z
跟踪练习
1×2 :16
水中氢元素和氧元素的质量比=
水中氢元素的质量
水中氧元素的质量
概念
元素的质量比等于化合物中各元素原子的相对原子
质量与原子个数乘积的比。
二、计算组成元素的质量比
CxHyOz中C、H、O的质量比
12 ∶ (16 × 2) = 3 ∶ 8
(14 × 2)∶(1× 4)∶(16 × 3 )= 7∶1∶12
12 ∶16∶(14×2)∶(1×4 )= 3∶4∶7∶1
12x ∶y ∶16z
1.CO2中C、O的质量比
2.NH4NO3中N、H、O的质量比
3.CO(NH2)2 中C、O、N、H的质量比
例题
判断正误:
(3)化合物中各元素的质量比为化学式中该元素的相对原子质量×原子个数之比,应约简为最简整数比。 ( )
(4)锰酸钾(K2MnO4)中钾、锰、氧三种元素的质量比是2∶1∶4。 ( )
√
×
小题快练
氮元素的质量分数真实吗?
尿素的化学式:
CO(NH2)2
(假设该尿素不含杂质)
三、计算物质中元素的质量分数
CO(NH2)2 中N元素的质量分数为
=
尿素的相对分子质量
N的相对原子质量×N的原子数
×100%
=
12+16 +14×2+1×4
14×2
×100%
≈
46.7%
化肥的含量真实。
三、计算物质中元素的质量分数
1. 计算氮肥NH4NO3中氮元素的质量分数。
解:
NH4NO3的相对分子质量=14+1 ×4+14+16 ×3=80
氮元素的质量分数
N的相对原子质量×N的原子数
NH4NO3的相对分子质量
×100%
=
14 ×2
80
×100%
=
= 35%
例题
2.若测得某种NH4HCO3的含氮量为18%,判断该物质是否纯净?
NH4HCO3的相对分子质量=14+1×5+12+16×3=79
解:
因为17.7%<18%, 所以该物质不纯净。
79
14 ×1
×100%≈17.7%
氮元素的质量分数=
例题
1.剧烈运动时肌肉里产生乳酸(C3H6O3),会导致肌肉酸痛.下列说法错误的是( )
A.乳酸的相对分子质量为90
B.乳酸由碳、氢、氧三种元素组成
C.乳酸中氧元素的质量分数最大
D.乳酸中碳、氢、氧元素质量之比为1:2:1
D
跟踪练习
2. 第五届中国(湖南)国际矿物宝石博览会在郴州成功举行.这场亚洲最大的矿物宝石博览会以“神奇的框晶,多彩的萤石”
为主题,向世界充分展示了“矿晶之都,多彩郴州”的独特魅
力.萤石的主要成分是CaF2,试计算:
(1)CaF2的相对分子质量是____;
(2)CaF2中钙元素和氟元素的质量比为_______;
(3)CaF2中氟元素的质量分数为_______(结果精确到0.1%).
78
20:19
48.7%
3.某化合物由碳、氢两种元素组成,这两种元素的质量比为3:1,该化合物的化学式量为16,写出它的化学式。
解:设化学式为CxHy
12x:y=3:1
12x+y=16
X=1 y=4
化学式为 CH4
4、已知FeSO4、Fe2(SO4)3 的混合物中铁元素的质量分数为a%,则氧元素的质量分数为( )
6.血红蛋白的相对分子质量为68000,其中铁元素质量分数为0.33%,则平均每个血红蛋白分子中铁原子个数( )
A.400个 B.20个 C.224个 D.4个
5.下列铜的化合物中,铜元素的质量分数最大的是( )
A.CuO B.CuSO4 C. Cu(OH)2 D. Cu2O
D
D
1. 计算氮肥NH4NO3中氮元素的质量分数。
解:
NH4NO3的相对分子质量=14+1 ×4+14+16 ×3=80
氮元素的质量分数
N的相对原子质量×N的原子数
NH4NO3的相对分子质量
×100%
=
14 ×2
80
×100%
=
= 35%
例题
四、继续探究:35%是什么意思
35%的含义:100克硝酸铵中含氮元素的质量为35克。
若硝酸铵的质量是100g,硝酸铵中氮元素的质量是多少?
100g×35%=35g
若硝酸铵中氮元素的质量是70g,则硝酸铵的质量是多少?
70g÷35%=200g
练习:(1)计算二氧化硫中硫元素的质量分数。
(2)计算64t 二氧化硫中硫元素的质量。
解:(1)SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
(2)64t二氧化硫中硫元素的质量=64t×50%=32 t
元素质量=物质质量×元素质量分数
物质质量=元素质量÷元素质量分数
总结
1、化学式量:化学式中各原子的相对原子质量的总和
2、化合物中各元素的质量比
元素的质量比=各原子的相对原子质量(总和)之比
3、化合物中某元素的质量分数
元素的质量分数=
化学式量
X100%
元素的相对原子质量×原子个数
4、化合物中元素的质量
元素的质量=化合物的质量×元素的质量分数
课堂总结
有关相对分子质量的计算
根据:化学式
依据:化学式的意义
工具:相对原子质量
计算相对分子质量
计算物质组成元素的质量比
计算物质中某元素的质量分数
课堂总结
生活中的化学
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
