2023—2024学年人教化学九年级下册第十单元 酸和碱 分层练习(含答案)
文档属性
| 名称 | 2023—2024学年人教化学九年级下册第十单元 酸和碱 分层练习(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 316.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 09:16:48 | ||
图片预览




文档简介
2023—2024学年人教化学九年级下册第10单元 酸和碱 分层练习附答案
人教第10单元 酸和碱
一、选择题。(16题)
1、类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素;所以含同种元素的物质都是单质
B.浓盐酸有挥发性,所以浓硫酸也有挥发性
C.碱的溶液显碱性,所以显碱性的溶液一定是碱溶液
D.酸溶液中都是氢离子,所以酸的化学性质相似
2、下列不属于稀盐酸和稀硫酸相似化学性质的是( )
A.都能与氯化钡反应生成白色沉淀
B.都能使紫色石蕊溶液变红
C.都能与黑色氧化铜粉末反应生成蓝色溶液
D.都能与镁条反应生成氢气
3、下列有关熟石灰的说法错误的是 ( )
A.熟石灰又称消石灰
B.熟石灰是白色粉末状固体,微溶于水
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰对皮肤、衣服等有腐蚀作用
4、下列有关物质的组成、构成与性质关系的说法正确的是( )
A.水和过氧化氢的组成元素相同,故它们的化学性质相同
B.稀硫酸和稀盐酸中都含有大量氢离子,故它们具有一些共同的化学性质
C.构成金刚石和石墨的原子相同,故它们的物理性质相同
D.氢氧化铜和氢氧化钠中都含有氢氧根离子,故它们都能使无色酚酞溶液变为红色
5、能够将氢氧化钠溶液和澄清石灰水区别开的方法是( )
A. 观察颜色 B. 滴加酚酞溶液
C. 滴加石蕊溶液 D. 通入二氧化碳
6、下列反应中属于中和反应的是( )
A. Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4═Na2SO4+2H2O
C. CO2+2NaOH═Na2CO3+H2O
D. Fe+CuSO4═Cu+FeSO4
7、下列常见的三种溶液:①澄清石灰水,②食盐水,③食醋。pH大小关系是( )
A.②>①>③ B.③>②>①
C.①>②>③ D.③>①>②
8、60g镁、铁、锌混合物与足量的稀硫酸反应得到混合溶液,蒸发得到252g硫酸盐固体.则反应产生的氢气质量为( )
A. 4.0g B. 3.9g C. 3.0g D. 2.5g
9、将紫色石蕊试液滴入稀盐酸中,溶液的颜色变成( )
A. 无色 B. 蓝色 C. 红色 D. 紫色
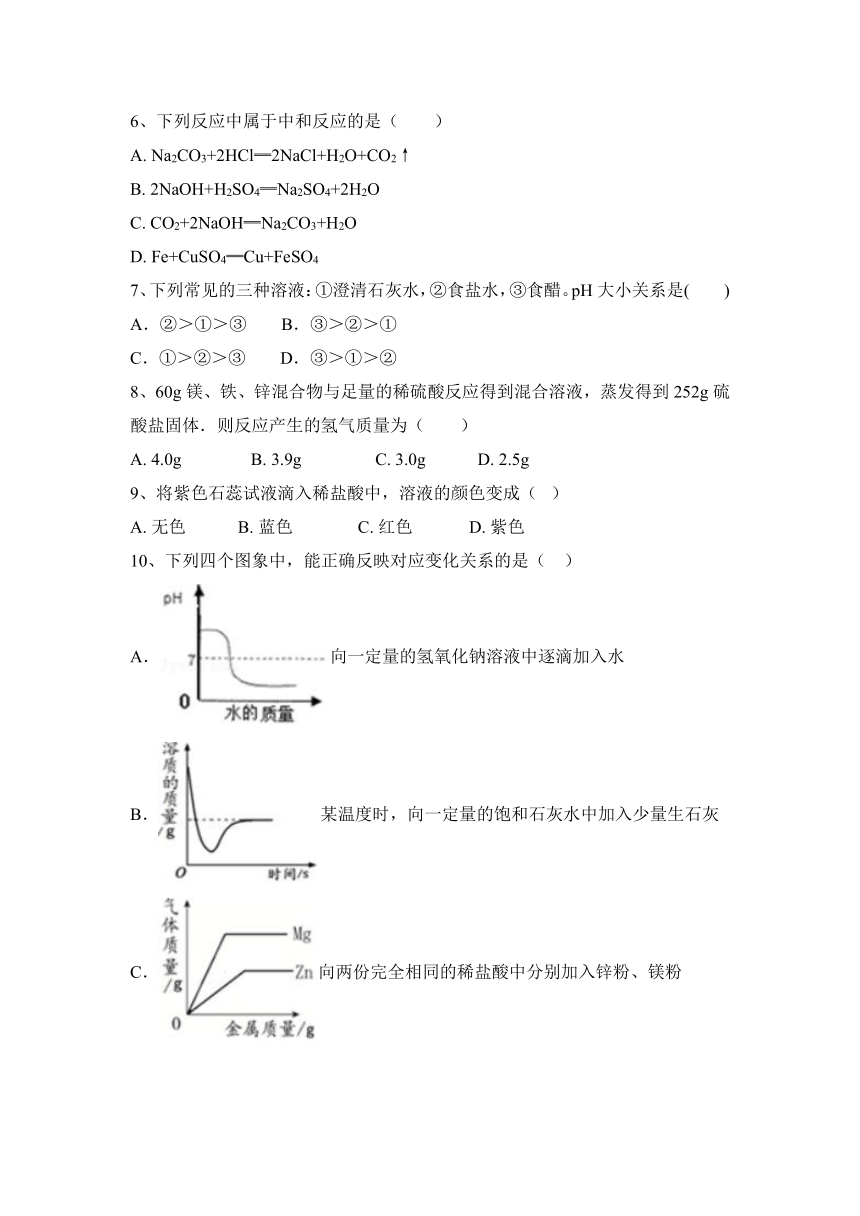
10、下列四个图象中,能正确反映对应变化关系的是( )
A.向一定量的氢氧化钠溶液中逐滴加入水
B.某温度时,向一定量的饱和石灰水中加入少量生石灰
C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D.将水通电一段时间
11、《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是( )
A.白酒 B.纯碱溶液 C.食盐溶液 D.柠檬酸
12、要鉴别下列各组物质,使用无色酚酞溶液能够达到目的是( )
A. 澄清石灰石、氢氧化钠溶液 B. 稀盐酸、稀硫酸
C. 蒸馏水、稀硫酸 D. 稀盐酸、澄清石灰水
13、元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是( )
A. O B. Si C. Al D. Fe
14、柠檬酸(C6H8O7)在水溶液中可以解离出H+ , 从而呈现酸性,主要用于香料或作为饮料的酸化剂,下列物质不能与柠檬酸反应的是( )
A. CO2 B. Fe2O3 C. Mg D. NaOH
15、下列图象与选项中描述的实验能够正确对应的是( )
A.①表示稀释pH=3的盐酸
B.②表示锌粒投入足量盐酸中
C.③表示石灰水中加入生石灰
D.④表示实验室用氯酸钾来制取氧气
16、类推和推理是重要的学习方法.下列推理中正确的是( )
A.明矾和二氧化氯均可用作净水剂,所以净水原理相同
B.组成CO和CO2的元素相同,但它们的分子构成不同,所以它们的化学性质不同
C.NaOH和CaO溶于水时均能放出热量,是因为它们都能和水发生反应
D.浓盐酸、浓硫酸敞口放置后质量分数都会变小,是因为它们都有挥发性
二、填空题。
17、氢氧化钠曝露在空气中,容易 ,
使表面潮湿并逐渐溶解,这种现象叫作 ,这是氢氧化钠固体需要 保存的原因之一。
18、“宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法,请结合如图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题。
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式__________________。
(2)写出图中C方框内甲、乙两种粒子的符号:甲_________,乙_________。
(3)从微观的角度分析,上述反应的实质是_________(填粒子符号,下同)和_________结合成H2O。
19、归纳是学习的重要方法,小明在学习酸、碱、盐后,绘制出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应),请填写下列空白:
(1)在图中空白方框中可填写指示剂或________(填物质类别)。
(2)反应⑦要能发生要求金属必须排在金属活动性表中________的前面。
(3)图中所归纳出酸的化学性质有________条。
(4)写出一个符合反应⑤的方程式________。
(5)验证反应②,可以选择下列_______________(填两种物质序号)进行反应。
A. SO2 B. HNO3 C. CuO D. Ba(OH)2
(6)碱具有相似化学性质的原因是碱溶液中都含有________(填微粒符号)。
20、(1)用pH试纸测定溶液的pH时,正确的操作是:_______________________________ 。
(2)小华同学用pH试纸,按正确操作测定洗发剂和护发剂的pH。测得洗发剂的pH略大于7,则洗发剂显________性;测得护发剂的pH略小于7,则护发剂显________性。
(3)弱酸性有益于头发的健康。想一想,洗发时应先用______剂,后用______剂。
21、通过研究铁制品的实践活动,同学们认识到铁生锈的条件是:
。废旧钢铁表面的铁锈可用盐酸除去,用化学方程式表示其原理: 。
三、简答题。
22、某校环保小组监测到某造纸厂向学校附近的一条河中排放碱性污水,请你根据碱的两条不同性质,设计两个实验证明。
四、实验探究题。
23、酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
【实验探究Ⅱ】
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在:
范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色:
(填“一定”或“不一定”)变红。
24、已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳:在空气中加热,则生成氧化铁和二氧化碳.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
回答下列问题:
(1)仪器①的名称是____________;
(2)写出装置A中发生的反应的化学方程式_____________;
(3)实验前先通CO后加热的原因是_______;实验结束时待装置冷却后再关闭K的原因是_____________
(4)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且_______;
(5)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a____b(填“>”“=”或“<”);
(6)D处为收集尾气的装置,应选择______装置(填“甲”“乙”或“丙”)
五、计算题。
25、为了测定某稀硫酸的溶质质量分数,在10g稀硫酸中滴加过量的氯化钡溶液,得到沉淀2.33g,求该稀硫酸的溶质质量分数。
2023—2024学年人教化学九年级下册第10单元 酸和碱 分层练习附答案
人教第10单元 酸和碱
一、选择题。(16题)
1、类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素;所以含同种元素的物质都是单质
B.浓盐酸有挥发性,所以浓硫酸也有挥发性
C.碱的溶液显碱性,所以显碱性的溶液一定是碱溶液
D.酸溶液中都是氢离子,所以酸的化学性质相似
【答案】D
2、下列不属于稀盐酸和稀硫酸相似化学性质的是( )
A.都能与氯化钡反应生成白色沉淀
B.都能使紫色石蕊溶液变红
C.都能与黑色氧化铜粉末反应生成蓝色溶液
D.都能与镁条反应生成氢气
【答案】A
3、下列有关熟石灰的说法错误的是 ( )
A.熟石灰又称消石灰
B.熟石灰是白色粉末状固体,微溶于水
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰对皮肤、衣服等有腐蚀作用
【答案】C
4、下列有关物质的组成、构成与性质关系的说法正确的是( )
A.水和过氧化氢的组成元素相同,故它们的化学性质相同
B.稀硫酸和稀盐酸中都含有大量氢离子,故它们具有一些共同的化学性质
C.构成金刚石和石墨的原子相同,故它们的物理性质相同
D.氢氧化铜和氢氧化钠中都含有氢氧根离子,故它们都能使无色酚酞溶液变为红色
【答案】B
5、能够将氢氧化钠溶液和澄清石灰水区别开的方法是( )
A. 观察颜色 B. 滴加酚酞溶液
C. 滴加石蕊溶液 D. 通入二氧化碳
【答案】D
6、下列反应中属于中和反应的是( )
A. Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4═Na2SO4+2H2O
C. CO2+2NaOH═Na2CO3+H2O
D. Fe+CuSO4═Cu+FeSO4
【答案】B
7、下列常见的三种溶液:①澄清石灰水,②食盐水,③食醋。pH大小关系是( )
A.②>①>③ B.③>②>①
C.①>②>③ D.③>①>②
【答案】C
8、60g镁、铁、锌混合物与足量的稀硫酸反应得到混合溶液,蒸发得到252g硫酸盐固体.则反应产生的氢气质量为( )
A. 4.0g B. 3.9g C. 3.0g D. 2.5g
【答案】A
9、将紫色石蕊试液滴入稀盐酸中,溶液的颜色变成( )
A. 无色 B. 蓝色 C. 红色 D. 紫色
【答案】 C
10、下列四个图象中,能正确反映对应变化关系的是( )
A.向一定量的氢氧化钠溶液中逐滴加入水
B.某温度时,向一定量的饱和石灰水中加入少量生石灰
C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D.将水通电一段时间
【答案】C
11、《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是( )
A.白酒 B.纯碱溶液 C.食盐溶液 D.柠檬酸
【答案】B
12、要鉴别下列各组物质,使用无色酚酞溶液能够达到目的是( )
A. 澄清石灰石、氢氧化钠溶液 B. 稀盐酸、稀硫酸
C. 蒸馏水、稀硫酸 D. 稀盐酸、澄清石灰水
【答案】D
13、元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是( )
A. O B. Si C. Al D. Fe
【答案】C
14、柠檬酸(C6H8O7)在水溶液中可以解离出H+ , 从而呈现酸性,主要用于香料或作为饮料的酸化剂,下列物质不能与柠檬酸反应的是( )
A. CO2 B. Fe2O3 C. Mg D. NaOH
【答案】 A
15、下列图象与选项中描述的实验能够正确对应的是( )
A.①表示稀释pH=3的盐酸
B.②表示锌粒投入足量盐酸中
C.③表示石灰水中加入生石灰
D.④表示实验室用氯酸钾来制取氧气
【答案】B
16、类推和推理是重要的学习方法.下列推理中正确的是( )
A.明矾和二氧化氯均可用作净水剂,所以净水原理相同
B.组成CO和CO2的元素相同,但它们的分子构成不同,所以它们的化学性质不同
C.NaOH和CaO溶于水时均能放出热量,是因为它们都能和水发生反应
D.浓盐酸、浓硫酸敞口放置后质量分数都会变小,是因为它们都有挥发性
【答案】B
二、填空题。
17、氢氧化钠曝露在空气中,容易 ,
使表面潮湿并逐渐溶解,这种现象叫作 ,这是氢氧化钠固体需要 保存的原因之一。
【答案】吸收水分 潮解 密封
18、“宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法,请结合如图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题。
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式__________________。
(2)写出图中C方框内甲、乙两种粒子的符号:甲_________,乙_________。
(3)从微观的角度分析,上述反应的实质是_________(填粒子符号,下同)和_________结合成H2O。
【答案】(1)H2SO4+2NaOH=Na2SO4+2H2O (2)Na+ SO42- (3)H+ OH-
19、归纳是学习的重要方法,小明在学习酸、碱、盐后,绘制出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应),请填写下列空白:
(1)在图中空白方框中可填写指示剂或________(填物质类别)。
(2)反应⑦要能发生要求金属必须排在金属活动性表中________的前面。
(3)图中所归纳出酸的化学性质有________条。
(4)写出一个符合反应⑤的方程式________。
(5)验证反应②,可以选择下列_______________(填两种物质序号)进行反应。
A. SO2 B. HNO3 C. CuO D. Ba(OH)2
(6)碱具有相似化学性质的原因是碱溶液中都含有________(填微粒符号)。
【答案】(1)氧化物 (2)H (3)4 (4)Fe+CuSO4=Cu+FeSO4
(5)A,D (6)OH-
20、(1)用pH试纸测定溶液的pH时,正确的操作是:_______________________________ 。
(2)小华同学用pH试纸,按正确操作测定洗发剂和护发剂的pH。测得洗发剂的pH略大于7,则洗发剂显________性;测得护发剂的pH略小于7,则护发剂显________性。
(3)弱酸性有益于头发的健康。想一想,洗发时应先用______剂,后用______剂。
【答案】(1)将pH试纸放在白瓷板(或玻璃片或表面皿)上,用干净的玻璃棒蘸取(或胶头滴管吸取)待测液滴于pH试纸上,然后将试纸颜色与标准比色卡对照读数。 (2)碱 酸 (3)洗发 护发
21、通过研究铁制品的实践活动,同学们认识到铁生锈的条件是:
。废旧钢铁表面的铁锈可用盐酸除去,用化学方程式表示其原理: 。
【答案】与氧气和水同时接触;Fe2O3+6HCl=2FeCl3+3H2O
三、简答题。
22、某校环保小组监测到某造纸厂向学校附近的一条河中排放碱性污水,请你根据碱的两条不同性质,设计两个实验证明。
【答案】(1)用PH试纸测定其PH (2)加入酚酞溶液
四、实验探究题。
23、酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
【实验探究Ⅱ】
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在:
范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色:
(填“一定”或“不一定”)变红。
【答案】【实验探究Ⅰ】升高。 (1)放热 小于。 (2)H+、OH-。
【实验探究Ⅱ】
(1)NaOH+HCl=NaCl+H2O。
(2)三;反应物中不含碳元素。 足量的稀盐酸。8.2~14。
总结反思:不一定。
24、已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳:在空气中加热,则生成氧化铁和二氧化碳.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
回答下列问题:
(1)仪器①的名称是____________;
(2)写出装置A中发生的反应的化学方程式_____________;
(3)实验前先通CO后加热的原因是_______;实验结束时待装置冷却后再关闭K的原因是_____________
(4)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且_______;
(5)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a____b(填“>”“=”或“<”);
(6)D处为收集尾气的装置,应选择______装置(填“甲”“乙”或“丙”)
【答案】酒精灯 FeCO3FeO+CO2↑,FeO+COFe+CO2
将装置内的空气排净,以防加热时爆炸
以防空气进入,在高温下将生成的铁氧化
C中澄清的石灰水不变浑浊 < 乙
五、计算题。
25、为了测定某稀硫酸的溶质质量分数,在10g稀硫酸中滴加过量的氯化钡溶液,得到沉淀2.33g,求该稀硫酸的溶质质量分数。
【答案】该稀硫酸的溶质质量分数为9.8%。
【详解】设该稀硫酸的溶质质量为x
BaCl2+H2SO4=BaSO4↓+2HCl
98 233
x 2.33g
=解得x=0.98g
该稀硫酸的溶质质量分数= 100%=9.8%
答:该稀硫酸的溶质质量分数为9.8%。
人教第10单元 酸和碱
一、选择题。(16题)
1、类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素;所以含同种元素的物质都是单质
B.浓盐酸有挥发性,所以浓硫酸也有挥发性
C.碱的溶液显碱性,所以显碱性的溶液一定是碱溶液
D.酸溶液中都是氢离子,所以酸的化学性质相似
2、下列不属于稀盐酸和稀硫酸相似化学性质的是( )
A.都能与氯化钡反应生成白色沉淀
B.都能使紫色石蕊溶液变红
C.都能与黑色氧化铜粉末反应生成蓝色溶液
D.都能与镁条反应生成氢气
3、下列有关熟石灰的说法错误的是 ( )
A.熟石灰又称消石灰
B.熟石灰是白色粉末状固体,微溶于水
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰对皮肤、衣服等有腐蚀作用
4、下列有关物质的组成、构成与性质关系的说法正确的是( )
A.水和过氧化氢的组成元素相同,故它们的化学性质相同
B.稀硫酸和稀盐酸中都含有大量氢离子,故它们具有一些共同的化学性质
C.构成金刚石和石墨的原子相同,故它们的物理性质相同
D.氢氧化铜和氢氧化钠中都含有氢氧根离子,故它们都能使无色酚酞溶液变为红色
5、能够将氢氧化钠溶液和澄清石灰水区别开的方法是( )
A. 观察颜色 B. 滴加酚酞溶液
C. 滴加石蕊溶液 D. 通入二氧化碳
6、下列反应中属于中和反应的是( )
A. Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4═Na2SO4+2H2O
C. CO2+2NaOH═Na2CO3+H2O
D. Fe+CuSO4═Cu+FeSO4
7、下列常见的三种溶液:①澄清石灰水,②食盐水,③食醋。pH大小关系是( )
A.②>①>③ B.③>②>①
C.①>②>③ D.③>①>②
8、60g镁、铁、锌混合物与足量的稀硫酸反应得到混合溶液,蒸发得到252g硫酸盐固体.则反应产生的氢气质量为( )
A. 4.0g B. 3.9g C. 3.0g D. 2.5g
9、将紫色石蕊试液滴入稀盐酸中,溶液的颜色变成( )
A. 无色 B. 蓝色 C. 红色 D. 紫色
10、下列四个图象中,能正确反映对应变化关系的是( )
A.向一定量的氢氧化钠溶液中逐滴加入水
B.某温度时,向一定量的饱和石灰水中加入少量生石灰
C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D.将水通电一段时间
11、《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是( )
A.白酒 B.纯碱溶液 C.食盐溶液 D.柠檬酸
12、要鉴别下列各组物质,使用无色酚酞溶液能够达到目的是( )
A. 澄清石灰石、氢氧化钠溶液 B. 稀盐酸、稀硫酸
C. 蒸馏水、稀硫酸 D. 稀盐酸、澄清石灰水
13、元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是( )
A. O B. Si C. Al D. Fe
14、柠檬酸(C6H8O7)在水溶液中可以解离出H+ , 从而呈现酸性,主要用于香料或作为饮料的酸化剂,下列物质不能与柠檬酸反应的是( )
A. CO2 B. Fe2O3 C. Mg D. NaOH
15、下列图象与选项中描述的实验能够正确对应的是( )
A.①表示稀释pH=3的盐酸
B.②表示锌粒投入足量盐酸中
C.③表示石灰水中加入生石灰
D.④表示实验室用氯酸钾来制取氧气
16、类推和推理是重要的学习方法.下列推理中正确的是( )
A.明矾和二氧化氯均可用作净水剂,所以净水原理相同
B.组成CO和CO2的元素相同,但它们的分子构成不同,所以它们的化学性质不同
C.NaOH和CaO溶于水时均能放出热量,是因为它们都能和水发生反应
D.浓盐酸、浓硫酸敞口放置后质量分数都会变小,是因为它们都有挥发性
二、填空题。
17、氢氧化钠曝露在空气中,容易 ,
使表面潮湿并逐渐溶解,这种现象叫作 ,这是氢氧化钠固体需要 保存的原因之一。
18、“宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法,请结合如图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题。
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式__________________。
(2)写出图中C方框内甲、乙两种粒子的符号:甲_________,乙_________。
(3)从微观的角度分析,上述反应的实质是_________(填粒子符号,下同)和_________结合成H2O。
19、归纳是学习的重要方法,小明在学习酸、碱、盐后,绘制出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应),请填写下列空白:
(1)在图中空白方框中可填写指示剂或________(填物质类别)。
(2)反应⑦要能发生要求金属必须排在金属活动性表中________的前面。
(3)图中所归纳出酸的化学性质有________条。
(4)写出一个符合反应⑤的方程式________。
(5)验证反应②,可以选择下列_______________(填两种物质序号)进行反应。
A. SO2 B. HNO3 C. CuO D. Ba(OH)2
(6)碱具有相似化学性质的原因是碱溶液中都含有________(填微粒符号)。
20、(1)用pH试纸测定溶液的pH时,正确的操作是:_______________________________ 。
(2)小华同学用pH试纸,按正确操作测定洗发剂和护发剂的pH。测得洗发剂的pH略大于7,则洗发剂显________性;测得护发剂的pH略小于7,则护发剂显________性。
(3)弱酸性有益于头发的健康。想一想,洗发时应先用______剂,后用______剂。
21、通过研究铁制品的实践活动,同学们认识到铁生锈的条件是:
。废旧钢铁表面的铁锈可用盐酸除去,用化学方程式表示其原理: 。
三、简答题。
22、某校环保小组监测到某造纸厂向学校附近的一条河中排放碱性污水,请你根据碱的两条不同性质,设计两个实验证明。
四、实验探究题。
23、酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
【实验探究Ⅱ】
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在:
范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色:
(填“一定”或“不一定”)变红。
24、已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳:在空气中加热,则生成氧化铁和二氧化碳.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
回答下列问题:
(1)仪器①的名称是____________;
(2)写出装置A中发生的反应的化学方程式_____________;
(3)实验前先通CO后加热的原因是_______;实验结束时待装置冷却后再关闭K的原因是_____________
(4)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且_______;
(5)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a____b(填“>”“=”或“<”);
(6)D处为收集尾气的装置,应选择______装置(填“甲”“乙”或“丙”)
五、计算题。
25、为了测定某稀硫酸的溶质质量分数,在10g稀硫酸中滴加过量的氯化钡溶液,得到沉淀2.33g,求该稀硫酸的溶质质量分数。
2023—2024学年人教化学九年级下册第10单元 酸和碱 分层练习附答案
人教第10单元 酸和碱
一、选择题。(16题)
1、类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素;所以含同种元素的物质都是单质
B.浓盐酸有挥发性,所以浓硫酸也有挥发性
C.碱的溶液显碱性,所以显碱性的溶液一定是碱溶液
D.酸溶液中都是氢离子,所以酸的化学性质相似
【答案】D
2、下列不属于稀盐酸和稀硫酸相似化学性质的是( )
A.都能与氯化钡反应生成白色沉淀
B.都能使紫色石蕊溶液变红
C.都能与黑色氧化铜粉末反应生成蓝色溶液
D.都能与镁条反应生成氢气
【答案】A
3、下列有关熟石灰的说法错误的是 ( )
A.熟石灰又称消石灰
B.熟石灰是白色粉末状固体,微溶于水
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰对皮肤、衣服等有腐蚀作用
【答案】C
4、下列有关物质的组成、构成与性质关系的说法正确的是( )
A.水和过氧化氢的组成元素相同,故它们的化学性质相同
B.稀硫酸和稀盐酸中都含有大量氢离子,故它们具有一些共同的化学性质
C.构成金刚石和石墨的原子相同,故它们的物理性质相同
D.氢氧化铜和氢氧化钠中都含有氢氧根离子,故它们都能使无色酚酞溶液变为红色
【答案】B
5、能够将氢氧化钠溶液和澄清石灰水区别开的方法是( )
A. 观察颜色 B. 滴加酚酞溶液
C. 滴加石蕊溶液 D. 通入二氧化碳
【答案】D
6、下列反应中属于中和反应的是( )
A. Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4═Na2SO4+2H2O
C. CO2+2NaOH═Na2CO3+H2O
D. Fe+CuSO4═Cu+FeSO4
【答案】B
7、下列常见的三种溶液:①澄清石灰水,②食盐水,③食醋。pH大小关系是( )
A.②>①>③ B.③>②>①
C.①>②>③ D.③>①>②
【答案】C
8、60g镁、铁、锌混合物与足量的稀硫酸反应得到混合溶液,蒸发得到252g硫酸盐固体.则反应产生的氢气质量为( )
A. 4.0g B. 3.9g C. 3.0g D. 2.5g
【答案】A
9、将紫色石蕊试液滴入稀盐酸中,溶液的颜色变成( )
A. 无色 B. 蓝色 C. 红色 D. 紫色
【答案】 C
10、下列四个图象中,能正确反映对应变化关系的是( )
A.向一定量的氢氧化钠溶液中逐滴加入水
B.某温度时,向一定量的饱和石灰水中加入少量生石灰
C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉
D.将水通电一段时间
【答案】C
11、《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是( )
A.白酒 B.纯碱溶液 C.食盐溶液 D.柠檬酸
【答案】B
12、要鉴别下列各组物质,使用无色酚酞溶液能够达到目的是( )
A. 澄清石灰石、氢氧化钠溶液 B. 稀盐酸、稀硫酸
C. 蒸馏水、稀硫酸 D. 稀盐酸、澄清石灰水
【答案】D
13、元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是( )
A. O B. Si C. Al D. Fe
【答案】C
14、柠檬酸(C6H8O7)在水溶液中可以解离出H+ , 从而呈现酸性,主要用于香料或作为饮料的酸化剂,下列物质不能与柠檬酸反应的是( )
A. CO2 B. Fe2O3 C. Mg D. NaOH
【答案】 A
15、下列图象与选项中描述的实验能够正确对应的是( )
A.①表示稀释pH=3的盐酸
B.②表示锌粒投入足量盐酸中
C.③表示石灰水中加入生石灰
D.④表示实验室用氯酸钾来制取氧气
【答案】B
16、类推和推理是重要的学习方法.下列推理中正确的是( )
A.明矾和二氧化氯均可用作净水剂,所以净水原理相同
B.组成CO和CO2的元素相同,但它们的分子构成不同,所以它们的化学性质不同
C.NaOH和CaO溶于水时均能放出热量,是因为它们都能和水发生反应
D.浓盐酸、浓硫酸敞口放置后质量分数都会变小,是因为它们都有挥发性
【答案】B
二、填空题。
17、氢氧化钠曝露在空气中,容易 ,
使表面潮湿并逐渐溶解,这种现象叫作 ,这是氢氧化钠固体需要 保存的原因之一。
【答案】吸收水分 潮解 密封
18、“宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法,请结合如图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题。
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式__________________。
(2)写出图中C方框内甲、乙两种粒子的符号:甲_________,乙_________。
(3)从微观的角度分析,上述反应的实质是_________(填粒子符号,下同)和_________结合成H2O。
【答案】(1)H2SO4+2NaOH=Na2SO4+2H2O (2)Na+ SO42- (3)H+ OH-
19、归纳是学习的重要方法,小明在学习酸、碱、盐后,绘制出如图所示的物质之间的反应关系(图中短线连接的物质表示能相互反应),请填写下列空白:
(1)在图中空白方框中可填写指示剂或________(填物质类别)。
(2)反应⑦要能发生要求金属必须排在金属活动性表中________的前面。
(3)图中所归纳出酸的化学性质有________条。
(4)写出一个符合反应⑤的方程式________。
(5)验证反应②,可以选择下列_______________(填两种物质序号)进行反应。
A. SO2 B. HNO3 C. CuO D. Ba(OH)2
(6)碱具有相似化学性质的原因是碱溶液中都含有________(填微粒符号)。
【答案】(1)氧化物 (2)H (3)4 (4)Fe+CuSO4=Cu+FeSO4
(5)A,D (6)OH-
20、(1)用pH试纸测定溶液的pH时,正确的操作是:_______________________________ 。
(2)小华同学用pH试纸,按正确操作测定洗发剂和护发剂的pH。测得洗发剂的pH略大于7,则洗发剂显________性;测得护发剂的pH略小于7,则护发剂显________性。
(3)弱酸性有益于头发的健康。想一想,洗发时应先用______剂,后用______剂。
【答案】(1)将pH试纸放在白瓷板(或玻璃片或表面皿)上,用干净的玻璃棒蘸取(或胶头滴管吸取)待测液滴于pH试纸上,然后将试纸颜色与标准比色卡对照读数。 (2)碱 酸 (3)洗发 护发
21、通过研究铁制品的实践活动,同学们认识到铁生锈的条件是:
。废旧钢铁表面的铁锈可用盐酸除去,用化学方程式表示其原理: 。
【答案】与氧气和水同时接触;Fe2O3+6HCl=2FeCl3+3H2O
三、简答题。
22、某校环保小组监测到某造纸厂向学校附近的一条河中排放碱性污水,请你根据碱的两条不同性质,设计两个实验证明。
【答案】(1)用PH试纸测定其PH (2)加入酚酞溶液
四、实验探究题。
23、酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究Ⅰ】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 ,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(1)由图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”),但它们稀释时温度的变化量远 两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子发生反应放出热量的缘故。
【实验探究Ⅱ】
(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为 。
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想 是错误的,理由是 。
实验验证:取样,滴加 ,无气泡产生,猜想三错误。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在:
范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色:
(填“一定”或“不一定”)变红。
【答案】【实验探究Ⅰ】升高。 (1)放热 小于。 (2)H+、OH-。
【实验探究Ⅱ】
(1)NaOH+HCl=NaCl+H2O。
(2)三;反应物中不含碳元素。 足量的稀盐酸。8.2~14。
总结反思:不一定。
24、已知碳酸亚铁在隔绝空气的条件下,受热易分解生成氧化亚铁和二氧化碳:在空气中加热,则生成氧化铁和二氧化碳.某化学兴趣小组用如图所示的装置模拟炼铁过程,并测定某样品中碳酸亚铁的含量(该装置气密性良好,B中氢氧化钠溶液足量).实验过程中,先打开K通入一氧化碳再加热;装置A中固体质量不再减少后,停止加热,待装置A冷却到室温后关闭K,实验测得装置A中固体质量减少了ag,装置B中液体质量增加了bg.
回答下列问题:
(1)仪器①的名称是____________;
(2)写出装置A中发生的反应的化学方程式_____________;
(3)实验前先通CO后加热的原因是_______;实验结束时待装置冷却后再关闭K的原因是_____________
(4)能判断生成的二氧化碳全部被装置B吸收的依据是:装置B的质量增加且_______;
(5)若生成的二氧化碳全部被装置B吸收,不考虑水的蒸发且该样品中所含杂质不参加反应,则a____b(填“>”“=”或“<”);
(6)D处为收集尾气的装置,应选择______装置(填“甲”“乙”或“丙”)
【答案】酒精灯 FeCO3FeO+CO2↑,FeO+COFe+CO2
将装置内的空气排净,以防加热时爆炸
以防空气进入,在高温下将生成的铁氧化
C中澄清的石灰水不变浑浊 < 乙
五、计算题。
25、为了测定某稀硫酸的溶质质量分数,在10g稀硫酸中滴加过量的氯化钡溶液,得到沉淀2.33g,求该稀硫酸的溶质质量分数。
【答案】该稀硫酸的溶质质量分数为9.8%。
【详解】设该稀硫酸的溶质质量为x
BaCl2+H2SO4=BaSO4↓+2HCl
98 233
x 2.33g
=解得x=0.98g
该稀硫酸的溶质质量分数= 100%=9.8%
答:该稀硫酸的溶质质量分数为9.8%。
同课章节目录
