第1章 化学反应与能量转化 测试题 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 化学反应与能量转化 测试题 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-18 23:09:42 | ||
图片预览



文档简介
第1章 化学反应与能量转化 测试题
一、选择题
1.下列叙述的方法不正确的是
A.金属的电化学腐蚀比化学腐蚀更普遍 B.用铝质铆钉焊接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀 D.在粗铜的电解精炼中纯铜做阴极
2.炒过菜的铁锅未及时洗净(残液中含),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
A.红褐色锈斑中含有氢氧化铁 B.铁锅腐蚀发生的是化学腐蚀
C.失去电子经电解质溶液转移给C D.C是负极,在C表面上发生氧化反应
3.利用电化学原理消除污染,还可获得电能,下面是一种处理垃圾渗透液的装置工作原理图。下列说法错误的是
A.X极的电极反应式为
B.Y是正极,发生还原反应
C.当电路中通过5 mol电子,正极区有14 g气体放出
D.盐桥内移向X电极
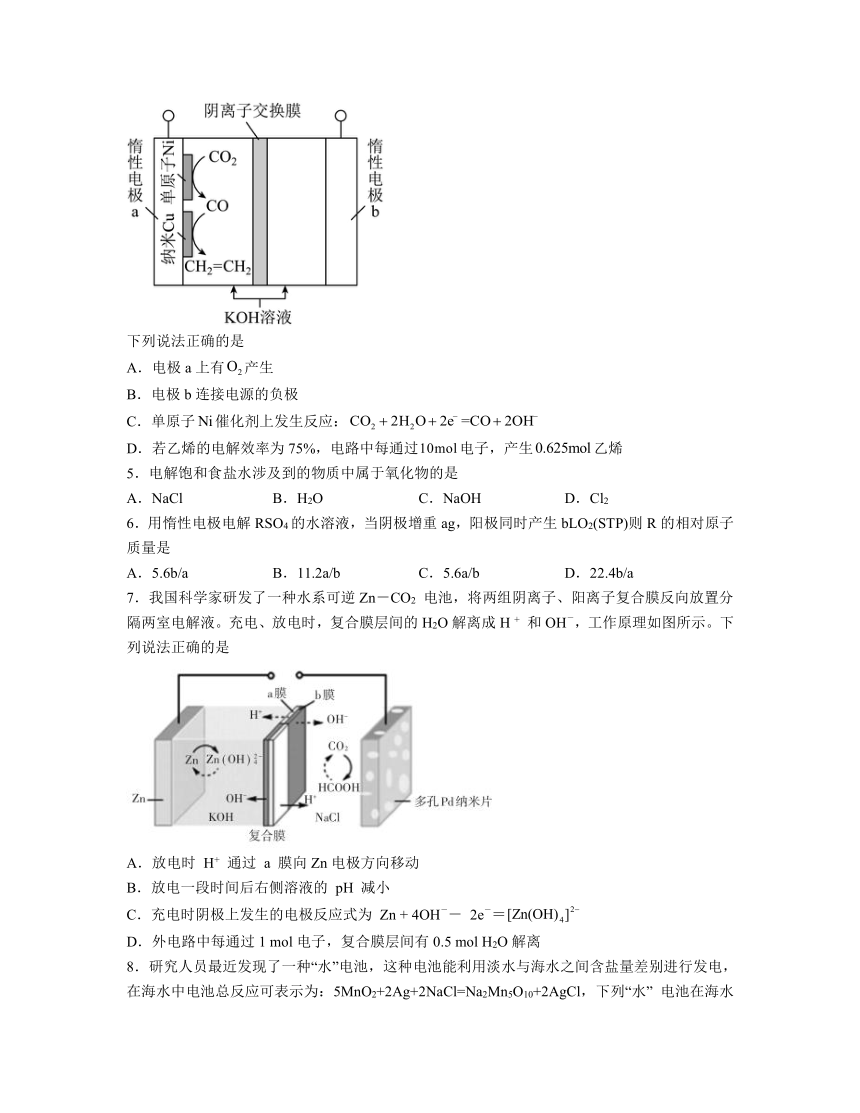
4.我国科学家采用单原子和纳米作串联催化剂,通过电解法将转化为乙烯,装置示意图如下。已知:电解效率。
下列说法正确的是
A.电极a上有产生
B.电极b连接电源的负极
C.单原子催化剂上发生反应:
D.若乙烯的电解效率为75%,电路中每通过电子,产生乙烯
5.电解饱和食盐水涉及到的物质中属于氧化物的是
A.NaCl B.H2O C.NaOH D.Cl2
6.用惰性电极电解RSO4的水溶液,当阴极增重ag,阳极同时产生bLO2(STP)则R的相对原子质量是
A.5.6b/a B.11.2a/b C.5.6a/b D.22.4b/a
7.我国科学家研发了一种水系可逆Zn-CO2 电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液。充电、放电时,复合膜层间的H2O解离成H + 和OH-,工作原理如图所示。下列说法正确的是
A.放电时 H+ 通过 a 膜向Zn电极方向移动
B.放电一段时间后右侧溶液的 pH 减小
C.充电时阴极上发生的电极反应式为 Zn + 4OH-- 2e-=
D.外电路中每通过1 mol电子,复合膜层间有0.5 mol H2O解离
8.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.Na2Mn5O10是氧化产物
9.高纯硅(Si)是当今科技的核心材料,是现代电子信息工业的关键材料。利用高纯硅可制成计算机内的芯片和CPU,还可以制成太阳能光伏电池。目前,中国已经成为世界太阳能电池生产第一大国。制备高纯硅的反应为:。制取高纯硅的反应为吸热反应,下列说法正确的是
A.断开H—H键放出能量 B.形成Si—Si键放出热量
C.需要高温的反应都是放热反应 D.反应物的总能量大于生成物的总能量
10.“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得△H4/(kJ mol-1)为
A.+533 B.+686 C.+838 D.+1143
11.传统文化是中华文明的瑰宝。下列有关传统文化分析错误的是
选项 传统文华摘要 分析与判断
A 《己亥杂诗》记载“落红不是无情物,化作春泥更护花” 蕴含自然界中的氮循环
B 《周礼》记载“煤饼烧蛎房成灰”(蛎房主要成分为) 蛎房发生了吸热反应
C 《吕氏春秋·精通》记载“慈石召铁,或引之也” 慈石指,能吸附铁
D 《金石类》记载“有硇水者,剪银塊投之,则旋而为水” 硇水是、溶液
A.A B.B C.C D.D
12.据统计,2022年我国光伏发电并装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是
A.光伏并网发电装置中N型半导体为正极
B.c、d为阳离子交换膜,e为阴离子交换膜
C.a为阴极,电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑
D.制备182g四甲基氢氧化铵,两极共产生33.6L气体
13.中国科学院成功研发出一种新型铝—石墨双离子电池,大幅度提升了电池的能量密度。该电池结构如图所示,反应为。下列说法错误的是
A.放电时,石墨电极电势比铝锂电极电势高
B.放电时,正极的电极反应式为
C.充电时,向石墨电极移动
D.充电时,铝锂电极质量增加
14.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
C.马口铁(镀锡铁)破损时与电解质溶液接触,铁先被腐蚀
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
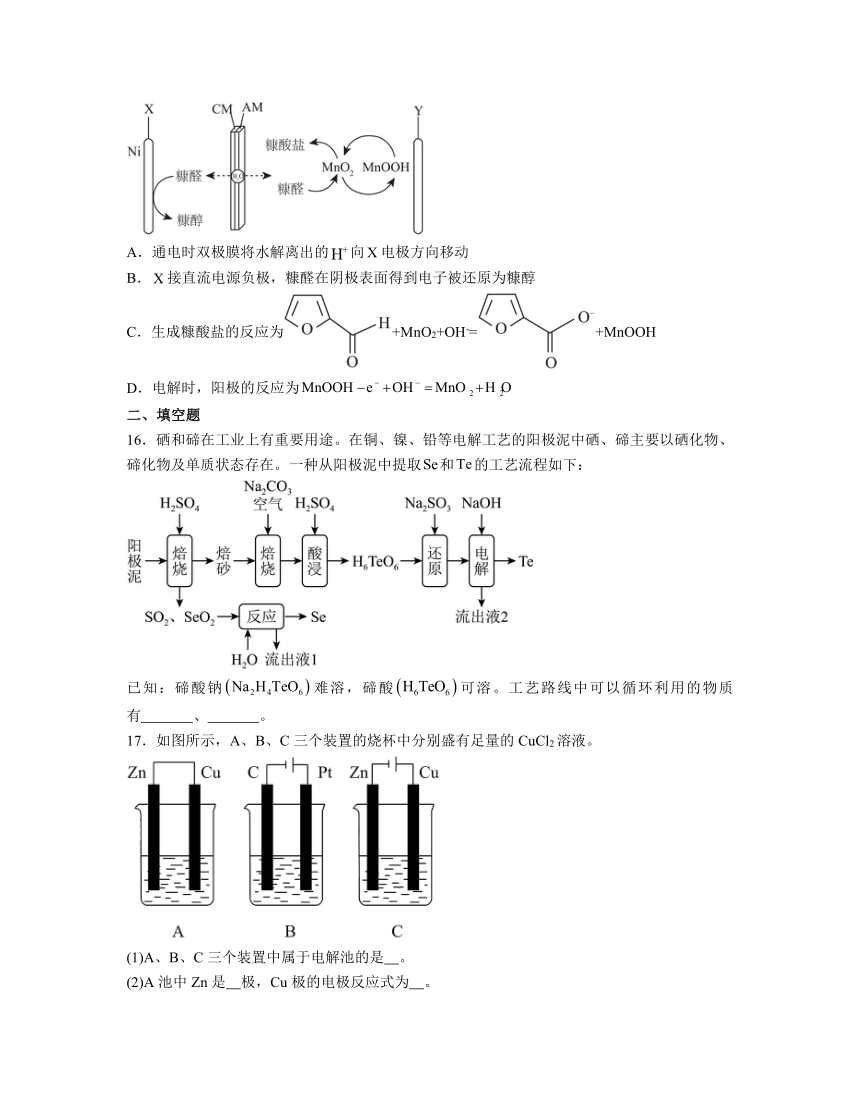
15.双极膜(CM/AM)在电场作用下能将水解离为H+和OH-,用双极膜电解槽电解糠醛()溶液制备糠醇()和糠酸盐()时,MnO2/MnOOH在电极与糠醛之间传递电子,电解过程如图所示。下列说法错误的是
A.通电时双极膜将水解离出的向电极方向移动
B.接直流电源负极,糠醛在阴极表面得到电子被还原为糠醇
C.生成糠酸盐的反应为+MnO2+OH-=+MnOOH
D.电解时,阳极的反应为
二、填空题
16.硒和碲在工业上有重要用途。在铜、镍、铅等电解工艺的阳极泥中硒、碲主要以硒化物、碲化物及单质状态存在。一种从阳极泥中提取和的工艺流程如下:
已知:碲酸钠难溶,碲酸可溶。工艺路线中可以循环利用的物质有 、 。
17.如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于电解池的是 。
(2)A池中Zn是 极,Cu极的电极反应式为 。
(3)B池中Pt棒上的电极反应为 。B池中的总反应化学方程式为 。
(4)C池中Cu极电极反应式为 。
18.如图所示为水溶液锂离子电池体系。放电时,电池的负极是 (填“a”或“b”),溶液中的从 (填“a向b”或“b向a”)迁移。
19.钢铁的电化学腐蚀
类别 项目 析氢腐蚀 吸氧腐蚀
图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
负极 Fe-2e-=Fe2+
正极 2H++2e-=H2↑ O2+4e-+2H2O=4OH-
总反应
后续反应 最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下:4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·xH2O+(3-x)H2O
联系 通常两种腐蚀同时存在,但后者更普遍
20.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、和)在催化剂作用下合成甲醇,发生的主要反应如下:
①
②
③
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 H—H C—O C≡O H—O C—H
E/ 436 343 1076 465 413
由此计算 ;已知,则 。
(2)已知在常温常压下:
①
②
写出表示甲醇燃烧热的热化学方程式 。
(3)已知常温时红磷比白磷稳定,已知:
①(白磷,s)
②4P(红磷,s)
比较反应中的大小: (填“>”、“<”或“=”)。
(4)人体内葡萄糖的消耗可用下列热化学方程式表示: ;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为 。
21.已知:,。
试回答下列问题。
(1)的摩尔燃烧焓为 ,的摩尔燃烧焓为 。
(2)和组成的混合气体完全氧化生成和时放出的热量 。
(3)和的混合气体完全燃烧生成和时放出热量,则在混合气体中和的物质的量之比是 。
22.有原子序数依次增大的五种主族元素X、Y、Z、W、R,已知:①X与Z,Y、R与W分别同族;②X、Z、W分别与Y都可组成两种中学常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同。根据以上叙述回答问题:
(1)R单质可用作半导体材料,写出该元素名称 它与Y元素原子序数差为
(2)用电子式表示化合物X2W的形成过程 。
(3)写出2种均由X、Y、Z、W 4种元素所组成的化合物在水溶液中发生反应的化学方程式 。Z、X、W三种元素组成的盐溶于水呈碱性,溶液中离子浓度大小顺序为: 。
(4)X、Y两元素的单质已被应用于宇宙飞船的燃料电池,其结构如图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。b电极上的电极反应式为 。
(5)请写出Z元素单质的一种用途 。
23.实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料制取FeCl3。已知FeCl3易升华,易潮解。
(1)装置B、C中应盛放的试剂名称分别为 、 ;从装置A导出的气体若不经过装置B、C而直接进入D管,将对实验产生的不良后果是 。
(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式: 。
(3)装置F所起的作用是 。
【参考答案】
一、选择题
1.B
解析:A.金属的腐蚀以电化学腐蚀为主,电化学腐蚀比化学腐蚀更普遍,A正确;
B.铝质铆钉、铁板、潮湿的空气构成了原电池,铝比铁活泼,铝质铆钉作负极,容易腐蚀,铁板得到保护,B错误;
C.因钢铁生锈需要氧气、水,在干燥空气中不易被腐蚀,C正确;
D.电解精炼铜时,铜离子在阴极被还原成铜单质,所以纯铜为阴极,D正确;
综上所述答案为B。
2.A
【分析】该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+,正极反应式为O2+2H2O+4e-=4OH-。
解析:A.铁与氧气发生电化学腐蚀生成Fe(OH)2,Fe(OH)2进一步被氧化为Fe(OH)3,红褐色锈斑中含有氢氧化铁,A正确;
B.铁锅腐蚀发生的是电化学腐蚀,B错误;
C.原电池中电子沿外导线从负极流向正极,不能通过电解质溶液,电解质溶液中是离子的定向移动形成闭合回路,C错误;
D.C是正极,正极电极反应是溶液中氧气得到电子发生还原反应,D错误;
故选A。
3.A
【分析】X电极为转变为N2发生了氧化反应为负极,而Y极转变为N2发生了还原反应为正极。
解析:A.溶液介质为中性,电极反应为,A项错误;
B.Y极转变为N2化合价降低发生了还原反应为正极,B项正确;
C.正极的关系式为N2~10e-即每产生1molN2会转移10mol电子,当电路中通过5mol电子时正极区产生0.5mol电子质量为m=M×n=14g,C项正确;
D.离子的移动方向:带正电的离子移向正极,带负电的离子移向负极,即Cl-移向X极,D项正确;
故选A。
4.D
【分析】电极a上二氧化碳得电子生成或得电子产生乙烯,a为阴极,b为阳极;
解析:A.电极a上二氧化碳得电子生成或得电子产生乙烯,没有氧气产生,A项错误;
B.电极b为阳极,与电源正极相连,B项错误;
C.由图可知,单原子催化剂上发生反应:,C项错误;
D.若乙烯的电解效率为75%,电路中通过电子时,根据公式得n(生成乙烯所用的电子),由转化为乙烯的电极反应为,所以当n(生成乙烯所用的电子)时,产生的乙烯为,D项正确;
故选:D。
5.B
解析:氧化物指的是只含有两种元素,其中一种为氧元素的化合物,在电解饱和食盐水中,发生反应:2NaCl+2H2O=2NaOH+Cl2+H2,所以只有H2O是氧化物,故选B。
6.B
解析:用惰性电极电解溶液,电极不参与反应,阴极增重,则是溶液中R2+得电子,阳极是OH-失电子,电极反应式为:阴极:2R2++4e-=2R,阳极: 4OH--4e-=2H2O+O2,根据生成O2的量,可求得失电子数即:
根据得失电子总数相等可得R的物质的量为:
则R的相对分子质量为M===,故B符合要求;
答案选B。
7.B
【分析】充电、放电时,复合膜层间的H2O解离成H + 和OH-,工作原理如图所示。由装置可知Zn电极在放电时作负极,失电子转化为,则双极膜中的OH-应流向负极,氢离子流向正极,多孔Pd纳米片作原电池正极,发生电极反应为,据此分析解答。
解析:A.根据图中信息可知,放电时复合膜中OH-通过a膜,H+通过b膜,故A错误;
B.放电时Zn为负极,多孔Pd纳米片为正极,放电时CO2在多孔Pd纳米片表面得到电子发生还原反应转化为甲酸,导致右侧溶液的 pH 减小,故B正确;
C.充电时Zn为阴极,多孔Pd纳米片为阳极,阴极得到电子发生还原反应生成Zn,故C错误;
D.复合膜中H2O解离成H+和OH-,由于电子所带电荷数与H+和OH-所带电荷数相等,所以外电路中每通过1 mol电子,复合膜层间有1 mol H2O解离,故D错误;
故选:B。
8.B
解析:A.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,而不是正极反应式,故A错误;
B.根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故B正确;
C.在原电池中阴离子向负极移动,阳离子向正极移动,故C错误;
D.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,Ag元素化合价上升,Mn元素化合价下降,则Na2Mn5O10是还原产物,故D错误;
故选:B。
9.B
解析:A.断开H—H键吸收能量,A错误;
B.形成Si—Si键放出热量,B正确;
C.反应条件与反应放热吸热没有绝对关系,如是吸热反应,C错误;
D.吸热反应反应物的总能量小于生成物的总能量,D错误;
故选B。
10.C
解析:①;
②;
③;
④;
⑤;
⑥;则⑤+①-⑥-②+③得④,得到+838 kJ mol-1,所以A B D错误, C正确,
故选C。
11.D
解析:A.“化作春泥更护花”暗示:氮肥有利于作物生长,涉及氮的固定与循环利用,A项正确;
B.碳酸钙分解反应是吸热反应,B项正确;
C.慈石就是磁石,主要成分是,磁石能吸附铁粉,C项正确;
D.“水”能溶解银等金属,这里“硇水”指硝酸,D项错误。
故答案选D。
12.C
【分析】从图中可以看出,光伏并网发电装置中,a电极连接N型半导体,则其为负极,b电极连接P型半导体,则其为正极;电解装置中,a极为阴极,b极为阳极。从电解池a极区溶液中四甲基氢氧化铵[(CH3)4NOH]浓度增大,也可推出(CH3)4N+透过c膜向a电极移动,则a电极为阴极,c膜为阳膜;Cl-透过d膜向右侧移动,则d膜为阴膜;Na+透过e膜向左侧移动,则e膜为阳膜。
解析:A.由分析可知,光伏并网发电装置中,N型半导体为负极,A不正确;
B.由分析可知,c、e为阳离子交换膜,d为阴离子交换膜,B不正确;
C.a为阴极,(CH3)4N+得电子产物与电解质作用,生成(CH3)4NOH和H2,电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑,C正确;
D.182g四甲基氢氧化铵的物质的量为=2mol,则a极生成1molH2,b极生成0.5molO2,两极共产生1.5mol气体,但由于温度、压强未知,所以无法求出生成气体的体积,D不正确;
故选C。
13.B
【分析】锂为活泼金属,由总反应可知,放电时石墨电极为正极、铝锂电极为负极;
解析:A.放电时石墨电极为正极、铝锂电极为负极,故石墨电极电势比铝锂电极电势高,故A正确;
B.放电时,属于原电池的工作原理,正极Cx(PF6)得到电子被还原,电极反应式为:Cx(PF6)+e-=xC+ PF,故B错误;
C.充电时,属于电解池的工作原理,阴离子向阳极移动,故PF向阳极移动,故C正确;
D.充电时,属于电解池的工作原理,电解池的阴极发生电子的还原反应,即Al+Li++e-=AlLi,所以铝锂电极质量增加,故D正确;
答案选B。
14.B
解析:A.把铜片和铁片紧靠在一起浸入稀硫酸中,构成原电池,铜片为正极,氢离子得电子变为氢气,表面出现气泡,A正确;
B.把铜片插入三氯化铁溶液中,发生反应2Fe3++Cu=2Fe2++Cu2+,没有铁单质析出,B错误;
C.锡不如铁活泼,马口铁(镀锡铁)破损时形成原电池,铁为负极,先被腐蚀,C正确;
D.锌粒置换置换出铜,锌铜盐酸构成原电池,反应速率加快,D正确;
综上所述答案为B。
15.C
【分析】由题干电解过程图示可知,X极上是将糠醛转化为糠醇,发生了还原反应,故X为阴极,与电源的负极相连,则Y为阳极,与电源的正极相连,故电流方向即正电荷移动方向为有Y流向X,故双极膜(CM/AM)在电场作用下能将水解离为H+和OH-,H+流向X极,OH-移向Y极,X极电极反应为:+2H++2e-=,Y极的电极反应为:MnOOH-e-+OH-=MnO2+H2O,然后生成的MnO2将糠醛氧化为糠醛酸盐,反应为:+2MnO2+OH-→+2MnOOH,据此分析解题。
解析:A.通电时双极膜将水解离为H+和OH-,阳离子向阴极移动;X极糠醛溶液生成糖醇发生了还原反应,则X极为阴极;所以H+向X电极方向移动,A正确;
B.由分析可知,X极的糠醛发生了还原反应被还原生成糖醇,为阴极,接电源的负极,B正确;
C.生成糠酸盐的反应:+2MnO2+OH-→+2MnOOH,C错误;
D.电解时MnOOH在阳极上失电子发生氧化反应生成MnO2,电极反应式为MnOOH-e-+OH-═MnO2+H2O,D正确;
故答案为:C。
二、填空题
16.
解析:由流程信息可知焙烧产物二氧化硫与二氧化硒在水溶液中发生氧化还原反应生成Se和硫酸;电解过程中碲酸被亚硫酸钠还原生成的二氧化碲在阴极得电子发生生成Te,同时生成氢氧根离子,即电解过程中生成了NaOH,和NaOH在流程中既做反应物也作生成物可循环利用,故答案为:;。
17. BC 负 Cu2++2e-=Cu 2Cl--2e-=Cl2↑ CuCl2Cu+Cl2↑ Cu-2e-=Cu2+
解析:(1)A中有自发的氧化还原反应:Zn+CuCl2=ZnCl2+Cu,所以为原电池,B、C均有外接电源,为电解池;
(2)A池中总反应为Zn+CuCl2=ZnCl2+Cu,所以Zn电极失电子发生氧化反应为负极;Cu电极上铜离子得电子生成Cu,电极反应式为Cu2++2e-=Cu;
(3)B中Pt电极与电源的正极相连为阳极,溶液中氯离子在阳极失电子被氧化,电极反应式为2Cl--2e-=Cl2↑;B中C电极为阴极,铜离子得电子被还原生成铜单质,所以总反应为CuCl2Cu+Cl2↑;
(4)C中铜电极与电源正极相连为阳极,铜失电子被氧化成铜离子,电极反应式为Cu-2e-=Cu2+。
18. b b向a
解析:为活泼金属,失电子发生氧化反应,所以电池的负极是b,正极是a;原电池中阳离子向正极移动,即从b向a迁移。
19.Fe+2H+=Fe2++H2↑ 2Fe+O2+2H2O=2Fe(OH)2
解析:酸性条件下铁发生析氢腐蚀,铁和氢离子生成氢气和亚铁离子,总反应为Fe+2H+=Fe2++H2↑;
在酸性很弱或中性条件下,铁发生吸氧腐蚀,铁和氧气、水生成氢氧化亚铁,总反应为2Fe+O2+2H2O=2Fe(OH)2。
20.(1) -99 +41
(2)
(3)<
(4)810g
解析:(1)反应热=反应物总键能-生成物总键能,故1076kJ/mol+2436kJ/mol-(3413+343+465)kJ/mol=-99 kJ/mol;根据盖斯定律可知,由②-①可得反应③,故-58 kJ/mol -(-99 kJ/mol)= +41kJ/mol。
(2)已知反应① ;
反应② ;根据盖斯定律可知,由①+②4可得, ,则表示甲醇燃烧热的热化学方程式为 。
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,<。
(4)已知 ,可知某人每天消耗12600kJ热量,需要葡萄糖的物质的量为,则他每天至少要摄入葡萄糖的质量为。
21. 3:1
解析:(1)摩尔燃烧焓表示1mol可燃物完全燃烧生成指定的氧化物所放出的热量,故、的摩尔燃烧焓分别为、-2220 kJ mol-1
(2)和的混合气体完全氧化生成和放出的热量
。
(3)设混合气体中和的物质的量分别为、,则有,,解得、,则。
22.硒 26 NaHSO4+NaHSO3=Na2SO4+SO2↑+H2O )c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-) O2+4e-+4H+=2H2O 冶炼钛钽铌锆等金属、高压钠灯、钠钾合金做原子反应堆的导热剂、制取钠的化合物等
【分析】据问题(1)中信息:R单质可用作半导体材料,R的原子序数最大,因此R为硒;Y、R与W分别同族,所以Y在第二周期,为氧元素,W为硫元素;Y的阴离子与Z的阳离子的核外电子排布相同,Y在第二周期,为氧元素,Z在第三周期,为钠元素;X与Z同族,X为氢元素;X、Z、W分别与Y都可组成两种中学常见的化合物分别为:H2O,Na2O,SO2;上述推断符合以上题给信息;结合以上分析回答题中问题。
解析:根据问题(1)中信息:R单质可用作半导体材料,R的原子序数最大,因此R为硒;Y、R与W分别同族,所以Y在第二周期,为氧元素,W为硫元素;Y的阴离子与Z的阳离子的核外电子排布相同,Y在第二周期,为氧元素,Z在第三周期,为钠元素;X与Z同族,X为氢元素;X、Z、W分别与Y都可组成两种中学常见的化合物分别为:H2O,Na2O,SO2;上述推断符合以上题给信息;
(1)结合以上分析可知,R单质可用作半导体材料,写出该元素名称硒;氧的核电荷数为8,硫的核电荷数为16,硒的核电荷数为34,所以硒与氧元素原子序数差为34-8=26;综上所述,故为:硒 ,26。
(2)X2W为H2S,属于共价化合物,电子式表示化合物X2W的形成过程:。
(3)2种均由H、O、Na、S 4种元素所组成的化合物分别为:NaHSO4和NaHSO3;二者反应生成硫酸钠和水,化学方程式为:NaHSO4+NaHSO3=Na2SO4+SO2↑+H2O;Na、H、S三种元素组成的盐为NaHS,该物质显碱性,电离过程小于水解过程,所以溶液中离子浓度大小顺序为: c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)。
(4) 根据图可知,氢氧燃料电池中,氢气在负极发生氧化反应,氧气在正极发生还原反应,X为氢气,所以a为负极,Y为氧气,所以b为正极;氧气在b极得电子发生还原反应,在酸性条件下生成水,极反应为:O2+4e-+4H+=2H2O。
(5)金属钠它具有强的还原性,能够冶炼钛钽铌锆等金属;除此以外,还可以做高压钠灯、钠钾合金做原子反应堆的导热剂、制取钠的化合物等;综上所述,故为:冶炼钛钽铌锆等金属、高压钠灯、钠钾合金做原子反应堆的导热剂、制取钠的化合物等(回答一条即可)。
23.(1)饱和食盐水 浓硫酸 氯化氢和水蒸气随Cl2进入D中能和铁反应生成H2,H2和Cl2混合受热会发生爆炸
(2)
(3)吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入E中
【分析】装置A是实验室制备氯气,装置B是除去氯气中的氯化氢,装置C是除去氯气中的水蒸气,装置D是Cl2与铁粉反应制取FeCl3,装置F是尾气处理同时防止空气中的水蒸气进入装置E中;据此分析作答。
解析:(1)浓盐酸具有挥发性, Cl2中含有HCl、H2O(g),由于HCl、H2O(g)都能与铁反应生成H2, H2和Cl2混合加热时会发生爆炸,所以气体依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去HCI、H2O(g)得到干燥的Cl2 ,故答案为:饱和食盐水;浓硫酸;未除去的HCl和H2O(g)随Cl2进入D中和铁反应生成H2, H2和Cl2混合加热时会发生爆炸;
(2)铁粉与Cl2在点燃条件下反应生成氯化铁,其化学方程式为: ,故答案为: ;
(3)氯气有毒,污染环境,所以不能直接排放到空气中,碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应,所以可用碱石灰处理尾气,空气中有水蒸气,碱石灰还能吸收水蒸气,防止空气中的水蒸气进入E中,所以可作干燥。故答案为:吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入E中。
【点睛】本题考查氯气的制备及其性质,侧重考查学生基础知识的掌握情况,试题比较简单
一、选择题
1.下列叙述的方法不正确的是
A.金属的电化学腐蚀比化学腐蚀更普遍 B.用铝质铆钉焊接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀 D.在粗铜的电解精炼中纯铜做阴极
2.炒过菜的铁锅未及时洗净(残液中含),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
A.红褐色锈斑中含有氢氧化铁 B.铁锅腐蚀发生的是化学腐蚀
C.失去电子经电解质溶液转移给C D.C是负极,在C表面上发生氧化反应
3.利用电化学原理消除污染,还可获得电能,下面是一种处理垃圾渗透液的装置工作原理图。下列说法错误的是
A.X极的电极反应式为
B.Y是正极,发生还原反应
C.当电路中通过5 mol电子,正极区有14 g气体放出
D.盐桥内移向X电极
4.我国科学家采用单原子和纳米作串联催化剂,通过电解法将转化为乙烯,装置示意图如下。已知:电解效率。
下列说法正确的是
A.电极a上有产生
B.电极b连接电源的负极
C.单原子催化剂上发生反应:
D.若乙烯的电解效率为75%,电路中每通过电子,产生乙烯
5.电解饱和食盐水涉及到的物质中属于氧化物的是
A.NaCl B.H2O C.NaOH D.Cl2
6.用惰性电极电解RSO4的水溶液,当阴极增重ag,阳极同时产生bLO2(STP)则R的相对原子质量是
A.5.6b/a B.11.2a/b C.5.6a/b D.22.4b/a
7.我国科学家研发了一种水系可逆Zn-CO2 电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液。充电、放电时,复合膜层间的H2O解离成H + 和OH-,工作原理如图所示。下列说法正确的是
A.放电时 H+ 通过 a 膜向Zn电极方向移动
B.放电一段时间后右侧溶液的 pH 减小
C.充电时阴极上发生的电极反应式为 Zn + 4OH-- 2e-=
D.外电路中每通过1 mol电子,复合膜层间有0.5 mol H2O解离
8.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.Na2Mn5O10是氧化产物
9.高纯硅(Si)是当今科技的核心材料,是现代电子信息工业的关键材料。利用高纯硅可制成计算机内的芯片和CPU,还可以制成太阳能光伏电池。目前,中国已经成为世界太阳能电池生产第一大国。制备高纯硅的反应为:。制取高纯硅的反应为吸热反应,下列说法正确的是
A.断开H—H键放出能量 B.形成Si—Si键放出热量
C.需要高温的反应都是放热反应 D.反应物的总能量大于生成物的总能量
10.“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得△H4/(kJ mol-1)为
A.+533 B.+686 C.+838 D.+1143
11.传统文化是中华文明的瑰宝。下列有关传统文化分析错误的是
选项 传统文华摘要 分析与判断
A 《己亥杂诗》记载“落红不是无情物,化作春泥更护花” 蕴含自然界中的氮循环
B 《周礼》记载“煤饼烧蛎房成灰”(蛎房主要成分为) 蛎房发生了吸热反应
C 《吕氏春秋·精通》记载“慈石召铁,或引之也” 慈石指,能吸附铁
D 《金石类》记载“有硇水者,剪银塊投之,则旋而为水” 硇水是、溶液
A.A B.B C.C D.D
12.据统计,2022年我国光伏发电并装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是
A.光伏并网发电装置中N型半导体为正极
B.c、d为阳离子交换膜,e为阴离子交换膜
C.a为阴极,电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑
D.制备182g四甲基氢氧化铵,两极共产生33.6L气体
13.中国科学院成功研发出一种新型铝—石墨双离子电池,大幅度提升了电池的能量密度。该电池结构如图所示,反应为。下列说法错误的是
A.放电时,石墨电极电势比铝锂电极电势高
B.放电时,正极的电极反应式为
C.充电时,向石墨电极移动
D.充电时,铝锂电极质量增加
14.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
C.马口铁(镀锡铁)破损时与电解质溶液接触,铁先被腐蚀
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
15.双极膜(CM/AM)在电场作用下能将水解离为H+和OH-,用双极膜电解槽电解糠醛()溶液制备糠醇()和糠酸盐()时,MnO2/MnOOH在电极与糠醛之间传递电子,电解过程如图所示。下列说法错误的是
A.通电时双极膜将水解离出的向电极方向移动
B.接直流电源负极,糠醛在阴极表面得到电子被还原为糠醇
C.生成糠酸盐的反应为+MnO2+OH-=+MnOOH
D.电解时,阳极的反应为
二、填空题
16.硒和碲在工业上有重要用途。在铜、镍、铅等电解工艺的阳极泥中硒、碲主要以硒化物、碲化物及单质状态存在。一种从阳极泥中提取和的工艺流程如下:
已知:碲酸钠难溶,碲酸可溶。工艺路线中可以循环利用的物质有 、 。
17.如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于电解池的是 。
(2)A池中Zn是 极,Cu极的电极反应式为 。
(3)B池中Pt棒上的电极反应为 。B池中的总反应化学方程式为 。
(4)C池中Cu极电极反应式为 。
18.如图所示为水溶液锂离子电池体系。放电时,电池的负极是 (填“a”或“b”),溶液中的从 (填“a向b”或“b向a”)迁移。
19.钢铁的电化学腐蚀
类别 项目 析氢腐蚀 吸氧腐蚀
图形描述
条件 水膜酸性较强 水膜酸性很弱或呈中性
负极 Fe-2e-=Fe2+
正极 2H++2e-=H2↑ O2+4e-+2H2O=4OH-
总反应
后续反应 最终生成铁锈(主要成分为Fe2O3·xH2O),反应如下:4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·xH2O+(3-x)H2O
联系 通常两种腐蚀同时存在,但后者更普遍
20.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、和)在催化剂作用下合成甲醇,发生的主要反应如下:
①
②
③
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 H—H C—O C≡O H—O C—H
E/ 436 343 1076 465 413
由此计算 ;已知,则 。
(2)已知在常温常压下:
①
②
写出表示甲醇燃烧热的热化学方程式 。
(3)已知常温时红磷比白磷稳定,已知:
①(白磷,s)
②4P(红磷,s)
比较反应中的大小: (填“>”、“<”或“=”)。
(4)人体内葡萄糖的消耗可用下列热化学方程式表示: ;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为 。
21.已知:,。
试回答下列问题。
(1)的摩尔燃烧焓为 ,的摩尔燃烧焓为 。
(2)和组成的混合气体完全氧化生成和时放出的热量 。
(3)和的混合气体完全燃烧生成和时放出热量,则在混合气体中和的物质的量之比是 。
22.有原子序数依次增大的五种主族元素X、Y、Z、W、R,已知:①X与Z,Y、R与W分别同族;②X、Z、W分别与Y都可组成两种中学常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同。根据以上叙述回答问题:
(1)R单质可用作半导体材料,写出该元素名称 它与Y元素原子序数差为
(2)用电子式表示化合物X2W的形成过程 。
(3)写出2种均由X、Y、Z、W 4种元素所组成的化合物在水溶液中发生反应的化学方程式 。Z、X、W三种元素组成的盐溶于水呈碱性,溶液中离子浓度大小顺序为: 。
(4)X、Y两元素的单质已被应用于宇宙飞船的燃料电池,其结构如图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。b电极上的电极反应式为 。
(5)请写出Z元素单质的一种用途 。
23.实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料制取FeCl3。已知FeCl3易升华,易潮解。
(1)装置B、C中应盛放的试剂名称分别为 、 ;从装置A导出的气体若不经过装置B、C而直接进入D管,将对实验产生的不良后果是 。
(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式: 。
(3)装置F所起的作用是 。
【参考答案】
一、选择题
1.B
解析:A.金属的腐蚀以电化学腐蚀为主,电化学腐蚀比化学腐蚀更普遍,A正确;
B.铝质铆钉、铁板、潮湿的空气构成了原电池,铝比铁活泼,铝质铆钉作负极,容易腐蚀,铁板得到保护,B错误;
C.因钢铁生锈需要氧气、水,在干燥空气中不易被腐蚀,C正确;
D.电解精炼铜时,铜离子在阴极被还原成铜单质,所以纯铜为阴极,D正确;
综上所述答案为B。
2.A
【分析】该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+,正极反应式为O2+2H2O+4e-=4OH-。
解析:A.铁与氧气发生电化学腐蚀生成Fe(OH)2,Fe(OH)2进一步被氧化为Fe(OH)3,红褐色锈斑中含有氢氧化铁,A正确;
B.铁锅腐蚀发生的是电化学腐蚀,B错误;
C.原电池中电子沿外导线从负极流向正极,不能通过电解质溶液,电解质溶液中是离子的定向移动形成闭合回路,C错误;
D.C是正极,正极电极反应是溶液中氧气得到电子发生还原反应,D错误;
故选A。
3.A
【分析】X电极为转变为N2发生了氧化反应为负极,而Y极转变为N2发生了还原反应为正极。
解析:A.溶液介质为中性,电极反应为,A项错误;
B.Y极转变为N2化合价降低发生了还原反应为正极,B项正确;
C.正极的关系式为N2~10e-即每产生1molN2会转移10mol电子,当电路中通过5mol电子时正极区产生0.5mol电子质量为m=M×n=14g,C项正确;
D.离子的移动方向:带正电的离子移向正极,带负电的离子移向负极,即Cl-移向X极,D项正确;
故选A。
4.D
【分析】电极a上二氧化碳得电子生成或得电子产生乙烯,a为阴极,b为阳极;
解析:A.电极a上二氧化碳得电子生成或得电子产生乙烯,没有氧气产生,A项错误;
B.电极b为阳极,与电源正极相连,B项错误;
C.由图可知,单原子催化剂上发生反应:,C项错误;
D.若乙烯的电解效率为75%,电路中通过电子时,根据公式得n(生成乙烯所用的电子),由转化为乙烯的电极反应为,所以当n(生成乙烯所用的电子)时,产生的乙烯为,D项正确;
故选:D。
5.B
解析:氧化物指的是只含有两种元素,其中一种为氧元素的化合物,在电解饱和食盐水中,发生反应:2NaCl+2H2O=2NaOH+Cl2+H2,所以只有H2O是氧化物,故选B。
6.B
解析:用惰性电极电解溶液,电极不参与反应,阴极增重,则是溶液中R2+得电子,阳极是OH-失电子,电极反应式为:阴极:2R2++4e-=2R,阳极: 4OH--4e-=2H2O+O2,根据生成O2的量,可求得失电子数即:
根据得失电子总数相等可得R的物质的量为:
则R的相对分子质量为M===,故B符合要求;
答案选B。
7.B
【分析】充电、放电时,复合膜层间的H2O解离成H + 和OH-,工作原理如图所示。由装置可知Zn电极在放电时作负极,失电子转化为,则双极膜中的OH-应流向负极,氢离子流向正极,多孔Pd纳米片作原电池正极,发生电极反应为,据此分析解答。
解析:A.根据图中信息可知,放电时复合膜中OH-通过a膜,H+通过b膜,故A错误;
B.放电时Zn为负极,多孔Pd纳米片为正极,放电时CO2在多孔Pd纳米片表面得到电子发生还原反应转化为甲酸,导致右侧溶液的 pH 减小,故B正确;
C.充电时Zn为阴极,多孔Pd纳米片为阳极,阴极得到电子发生还原反应生成Zn,故C错误;
D.复合膜中H2O解离成H+和OH-,由于电子所带电荷数与H+和OH-所带电荷数相等,所以外电路中每通过1 mol电子,复合膜层间有1 mol H2O解离,故D错误;
故选:B。
8.B
解析:A.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,而不是正极反应式,故A错误;
B.根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故B正确;
C.在原电池中阴离子向负极移动,阳离子向正极移动,故C错误;
D.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,Ag元素化合价上升,Mn元素化合价下降,则Na2Mn5O10是还原产物,故D错误;
故选:B。
9.B
解析:A.断开H—H键吸收能量,A错误;
B.形成Si—Si键放出热量,B正确;
C.反应条件与反应放热吸热没有绝对关系,如是吸热反应,C错误;
D.吸热反应反应物的总能量小于生成物的总能量,D错误;
故选B。
10.C
解析:①;
②;
③;
④;
⑤;
⑥;则⑤+①-⑥-②+③得④,得到+838 kJ mol-1,所以A B D错误, C正确,
故选C。
11.D
解析:A.“化作春泥更护花”暗示:氮肥有利于作物生长,涉及氮的固定与循环利用,A项正确;
B.碳酸钙分解反应是吸热反应,B项正确;
C.慈石就是磁石,主要成分是,磁石能吸附铁粉,C项正确;
D.“水”能溶解银等金属,这里“硇水”指硝酸,D项错误。
故答案选D。
12.C
【分析】从图中可以看出,光伏并网发电装置中,a电极连接N型半导体,则其为负极,b电极连接P型半导体,则其为正极;电解装置中,a极为阴极,b极为阳极。从电解池a极区溶液中四甲基氢氧化铵[(CH3)4NOH]浓度增大,也可推出(CH3)4N+透过c膜向a电极移动,则a电极为阴极,c膜为阳膜;Cl-透过d膜向右侧移动,则d膜为阴膜;Na+透过e膜向左侧移动,则e膜为阳膜。
解析:A.由分析可知,光伏并网发电装置中,N型半导体为负极,A不正确;
B.由分析可知,c、e为阳离子交换膜,d为阴离子交换膜,B不正确;
C.a为阴极,(CH3)4N+得电子产物与电解质作用,生成(CH3)4NOH和H2,电极反应式为2(CH3)4N++2H2O+2e-=2(CH3)4NOH+H2↑,C正确;
D.182g四甲基氢氧化铵的物质的量为=2mol,则a极生成1molH2,b极生成0.5molO2,两极共产生1.5mol气体,但由于温度、压强未知,所以无法求出生成气体的体积,D不正确;
故选C。
13.B
【分析】锂为活泼金属,由总反应可知,放电时石墨电极为正极、铝锂电极为负极;
解析:A.放电时石墨电极为正极、铝锂电极为负极,故石墨电极电势比铝锂电极电势高,故A正确;
B.放电时,属于原电池的工作原理,正极Cx(PF6)得到电子被还原,电极反应式为:Cx(PF6)+e-=xC+ PF,故B错误;
C.充电时,属于电解池的工作原理,阴离子向阳极移动,故PF向阳极移动,故C正确;
D.充电时,属于电解池的工作原理,电解池的阴极发生电子的还原反应,即Al+Li++e-=AlLi,所以铝锂电极质量增加,故D正确;
答案选B。
14.B
解析:A.把铜片和铁片紧靠在一起浸入稀硫酸中,构成原电池,铜片为正极,氢离子得电子变为氢气,表面出现气泡,A正确;
B.把铜片插入三氯化铁溶液中,发生反应2Fe3++Cu=2Fe2++Cu2+,没有铁单质析出,B错误;
C.锡不如铁活泼,马口铁(镀锡铁)破损时形成原电池,铁为负极,先被腐蚀,C正确;
D.锌粒置换置换出铜,锌铜盐酸构成原电池,反应速率加快,D正确;
综上所述答案为B。
15.C
【分析】由题干电解过程图示可知,X极上是将糠醛转化为糠醇,发生了还原反应,故X为阴极,与电源的负极相连,则Y为阳极,与电源的正极相连,故电流方向即正电荷移动方向为有Y流向X,故双极膜(CM/AM)在电场作用下能将水解离为H+和OH-,H+流向X极,OH-移向Y极,X极电极反应为:+2H++2e-=,Y极的电极反应为:MnOOH-e-+OH-=MnO2+H2O,然后生成的MnO2将糠醛氧化为糠醛酸盐,反应为:+2MnO2+OH-→+2MnOOH,据此分析解题。
解析:A.通电时双极膜将水解离为H+和OH-,阳离子向阴极移动;X极糠醛溶液生成糖醇发生了还原反应,则X极为阴极;所以H+向X电极方向移动,A正确;
B.由分析可知,X极的糠醛发生了还原反应被还原生成糖醇,为阴极,接电源的负极,B正确;
C.生成糠酸盐的反应:+2MnO2+OH-→+2MnOOH,C错误;
D.电解时MnOOH在阳极上失电子发生氧化反应生成MnO2,电极反应式为MnOOH-e-+OH-═MnO2+H2O,D正确;
故答案为:C。
二、填空题
16.
解析:由流程信息可知焙烧产物二氧化硫与二氧化硒在水溶液中发生氧化还原反应生成Se和硫酸;电解过程中碲酸被亚硫酸钠还原生成的二氧化碲在阴极得电子发生生成Te,同时生成氢氧根离子,即电解过程中生成了NaOH,和NaOH在流程中既做反应物也作生成物可循环利用,故答案为:;。
17. BC 负 Cu2++2e-=Cu 2Cl--2e-=Cl2↑ CuCl2Cu+Cl2↑ Cu-2e-=Cu2+
解析:(1)A中有自发的氧化还原反应:Zn+CuCl2=ZnCl2+Cu,所以为原电池,B、C均有外接电源,为电解池;
(2)A池中总反应为Zn+CuCl2=ZnCl2+Cu,所以Zn电极失电子发生氧化反应为负极;Cu电极上铜离子得电子生成Cu,电极反应式为Cu2++2e-=Cu;
(3)B中Pt电极与电源的正极相连为阳极,溶液中氯离子在阳极失电子被氧化,电极反应式为2Cl--2e-=Cl2↑;B中C电极为阴极,铜离子得电子被还原生成铜单质,所以总反应为CuCl2Cu+Cl2↑;
(4)C中铜电极与电源正极相连为阳极,铜失电子被氧化成铜离子,电极反应式为Cu-2e-=Cu2+。
18. b b向a
解析:为活泼金属,失电子发生氧化反应,所以电池的负极是b,正极是a;原电池中阳离子向正极移动,即从b向a迁移。
19.Fe+2H+=Fe2++H2↑ 2Fe+O2+2H2O=2Fe(OH)2
解析:酸性条件下铁发生析氢腐蚀,铁和氢离子生成氢气和亚铁离子,总反应为Fe+2H+=Fe2++H2↑;
在酸性很弱或中性条件下,铁发生吸氧腐蚀,铁和氧气、水生成氢氧化亚铁,总反应为2Fe+O2+2H2O=2Fe(OH)2。
20.(1) -99 +41
(2)
(3)<
(4)810g
解析:(1)反应热=反应物总键能-生成物总键能,故1076kJ/mol+2436kJ/mol-(3413+343+465)kJ/mol=-99 kJ/mol;根据盖斯定律可知,由②-①可得反应③,故-58 kJ/mol -(-99 kJ/mol)= +41kJ/mol。
(2)已知反应① ;
反应② ;根据盖斯定律可知,由①+②4可得, ,则表示甲醇燃烧热的热化学方程式为 。
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,<。
(4)已知 ,可知某人每天消耗12600kJ热量,需要葡萄糖的物质的量为,则他每天至少要摄入葡萄糖的质量为。
21. 3:1
解析:(1)摩尔燃烧焓表示1mol可燃物完全燃烧生成指定的氧化物所放出的热量,故、的摩尔燃烧焓分别为、-2220 kJ mol-1
(2)和的混合气体完全氧化生成和放出的热量
。
(3)设混合气体中和的物质的量分别为、,则有,,解得、,则。
22.硒 26 NaHSO4+NaHSO3=Na2SO4+SO2↑+H2O )c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-) O2+4e-+4H+=2H2O 冶炼钛钽铌锆等金属、高压钠灯、钠钾合金做原子反应堆的导热剂、制取钠的化合物等
【分析】据问题(1)中信息:R单质可用作半导体材料,R的原子序数最大,因此R为硒;Y、R与W分别同族,所以Y在第二周期,为氧元素,W为硫元素;Y的阴离子与Z的阳离子的核外电子排布相同,Y在第二周期,为氧元素,Z在第三周期,为钠元素;X与Z同族,X为氢元素;X、Z、W分别与Y都可组成两种中学常见的化合物分别为:H2O,Na2O,SO2;上述推断符合以上题给信息;结合以上分析回答题中问题。
解析:根据问题(1)中信息:R单质可用作半导体材料,R的原子序数最大,因此R为硒;Y、R与W分别同族,所以Y在第二周期,为氧元素,W为硫元素;Y的阴离子与Z的阳离子的核外电子排布相同,Y在第二周期,为氧元素,Z在第三周期,为钠元素;X与Z同族,X为氢元素;X、Z、W分别与Y都可组成两种中学常见的化合物分别为:H2O,Na2O,SO2;上述推断符合以上题给信息;
(1)结合以上分析可知,R单质可用作半导体材料,写出该元素名称硒;氧的核电荷数为8,硫的核电荷数为16,硒的核电荷数为34,所以硒与氧元素原子序数差为34-8=26;综上所述,故为:硒 ,26。
(2)X2W为H2S,属于共价化合物,电子式表示化合物X2W的形成过程:。
(3)2种均由H、O、Na、S 4种元素所组成的化合物分别为:NaHSO4和NaHSO3;二者反应生成硫酸钠和水,化学方程式为:NaHSO4+NaHSO3=Na2SO4+SO2↑+H2O;Na、H、S三种元素组成的盐为NaHS,该物质显碱性,电离过程小于水解过程,所以溶液中离子浓度大小顺序为: c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)。
(4) 根据图可知,氢氧燃料电池中,氢气在负极发生氧化反应,氧气在正极发生还原反应,X为氢气,所以a为负极,Y为氧气,所以b为正极;氧气在b极得电子发生还原反应,在酸性条件下生成水,极反应为:O2+4e-+4H+=2H2O。
(5)金属钠它具有强的还原性,能够冶炼钛钽铌锆等金属;除此以外,还可以做高压钠灯、钠钾合金做原子反应堆的导热剂、制取钠的化合物等;综上所述,故为:冶炼钛钽铌锆等金属、高压钠灯、钠钾合金做原子反应堆的导热剂、制取钠的化合物等(回答一条即可)。
23.(1)饱和食盐水 浓硫酸 氯化氢和水蒸气随Cl2进入D中能和铁反应生成H2,H2和Cl2混合受热会发生爆炸
(2)
(3)吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入E中
【分析】装置A是实验室制备氯气,装置B是除去氯气中的氯化氢,装置C是除去氯气中的水蒸气,装置D是Cl2与铁粉反应制取FeCl3,装置F是尾气处理同时防止空气中的水蒸气进入装置E中;据此分析作答。
解析:(1)浓盐酸具有挥发性, Cl2中含有HCl、H2O(g),由于HCl、H2O(g)都能与铁反应生成H2, H2和Cl2混合加热时会发生爆炸,所以气体依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去HCI、H2O(g)得到干燥的Cl2 ,故答案为:饱和食盐水;浓硫酸;未除去的HCl和H2O(g)随Cl2进入D中和铁反应生成H2, H2和Cl2混合加热时会发生爆炸;
(2)铁粉与Cl2在点燃条件下反应生成氯化铁,其化学方程式为: ,故答案为: ;
(3)氯气有毒,污染环境,所以不能直接排放到空气中,碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应,所以可用碱石灰处理尾气,空气中有水蒸气,碱石灰还能吸收水蒸气,防止空气中的水蒸气进入E中,所以可作干燥。故答案为:吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入E中。
【点睛】本题考查氯气的制备及其性质,侧重考查学生基础知识的掌握情况,试题比较简单
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
