第1章 化学反应与能量转化 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 化学反应与能量转化 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 01:21:33 | ||
图片预览


文档简介
第1章 化学反应与能量转化 测试题
一、选择题
1.下列叙述不正确的是
A.生铁比纯铁更容易生锈
B.铁管上镶嵌锌块,铁管不易被腐蚀
C.电解精炼铜时,以待精炼的铜作为阳极
D.外加电流法是把被保护的钢铁设备作为阳极,使钢铁表面腐蚀电流降至零或接近零
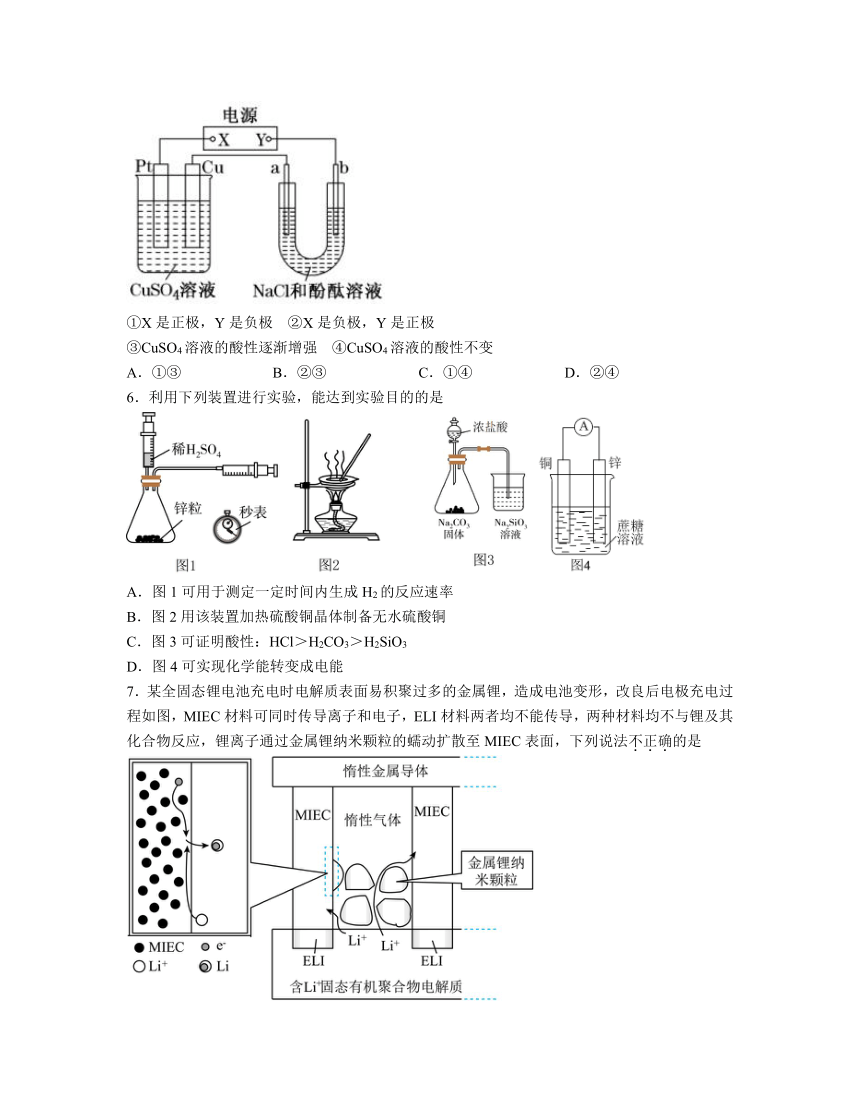
2.如图甲是一种利用微生物将废水中的尿素(,氮元素显价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
A.透过质子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极的反应式:
D.当N电极消耗0.5mol气体时,则铁电极增重32g
3.关于金属的腐蚀与防护,下列说法正确的是
A.图①:铁丝发生吸氧腐蚀 B.图②: 金属性M>Fe
C.图③:防护方法为牺牲阳极的阴极保护法 D.图③:N不可选石墨
4.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应为
B.酸性氢氧燃料电池的正极电极反应为
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为
D.钢铁发生吸氧腐蚀时,铁作负极被氧化:
5.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法中正确的是
①X是正极,Y是负极 ②X是负极,Y是正极
③CuSO4溶液的酸性逐渐增强 ④CuSO4溶液的酸性不变
A.①③ B.②③ C.①④ D.②④
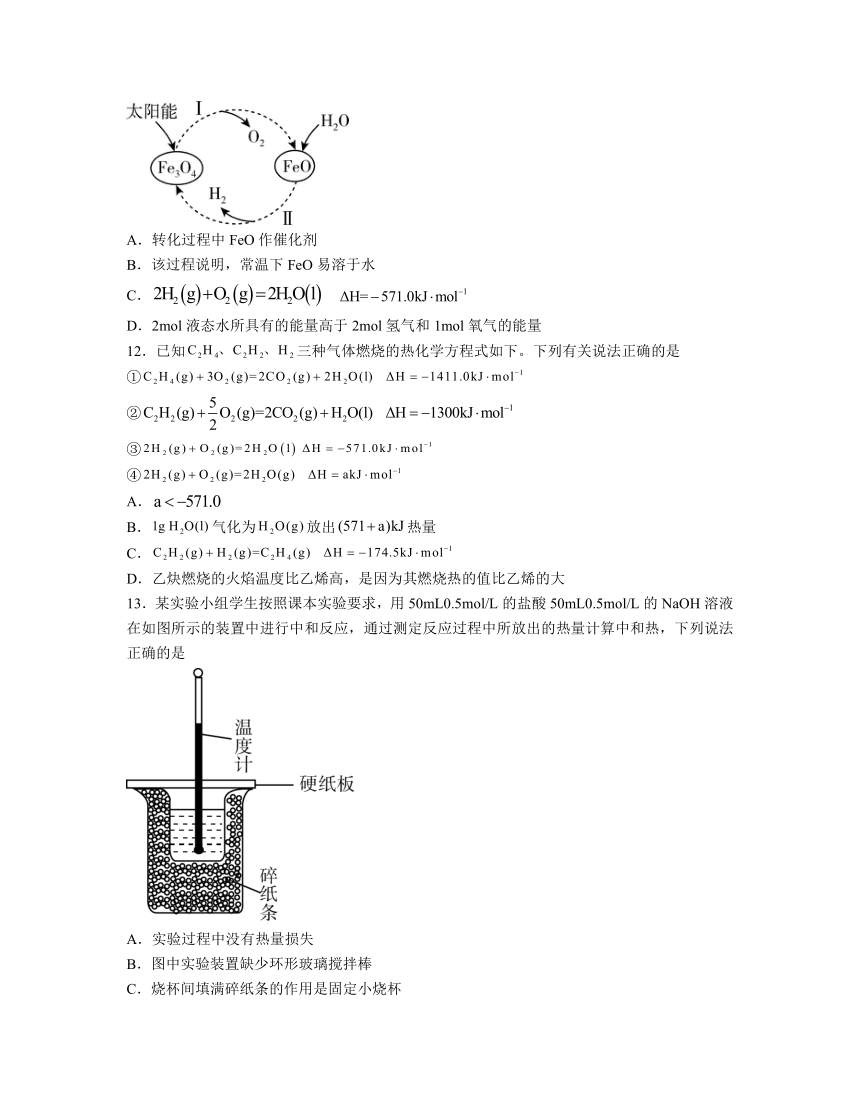
6.利用下列装置进行实验,能达到实验目的的是
A.图1可用于测定一定时间内生成H2的反应速率
B.图2用该装置加热硫酸铜晶体制备无水硫酸铜
C.图3可证明酸性:HCl>H2CO3>H2SiO3
D.图4可实现化学能转变成电能
7.某全固态锂电池充电时电解质表面易积聚过多的金属锂,造成电池变形,改良后电极充电过程如图,MIEC材料可同时传导离子和电子,ELI材料两者均不能传导,两种材料均不与锂及其化合物反应,锂离子通过金属锂纳米颗粒的蠕动扩散至MIEC表面,下列说法不正确的是
A.当电池处于放电状态时,图示电极发生氧化反应
B.充电时沿MIEC向惰性金属导体迁移,避免局部积聚
C.另一极的电极材料为,则放电时的电极反应为
D.当MIEC上有电荷发生迁移时,电极中的金属锂质量变化为
8.在如图所示的装置中,a的金属活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是
A.氢离子在碳棒表面被还原,碳棒上有气体放出,溶液中c(H+)变小
B.a是负极,b是正极
C.电子从a极经导线到b极,再经过稀硫酸回到a极,从而形成闭合回路
D.a极上发生了氧化反应
9.下列有关说法正确的是
A.虽然药物能治病,但大部分药物有毒副作用
B.抗生素能抵抗所有细菌感染,可以大量使用
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.用氯气处理水中的Cu2+、Hg2+等重金属离子
10.下列各组材料中,不能组成原电池的是
A B C D
两极材料 Zn片、石墨 Cu片、Ag片 Zn片、Ag片 Fe片、Cu片
插入溶液 稀硫酸 AgNO3溶液 蔗糖溶液 稀盐酸
A.A B.B C.C D.D
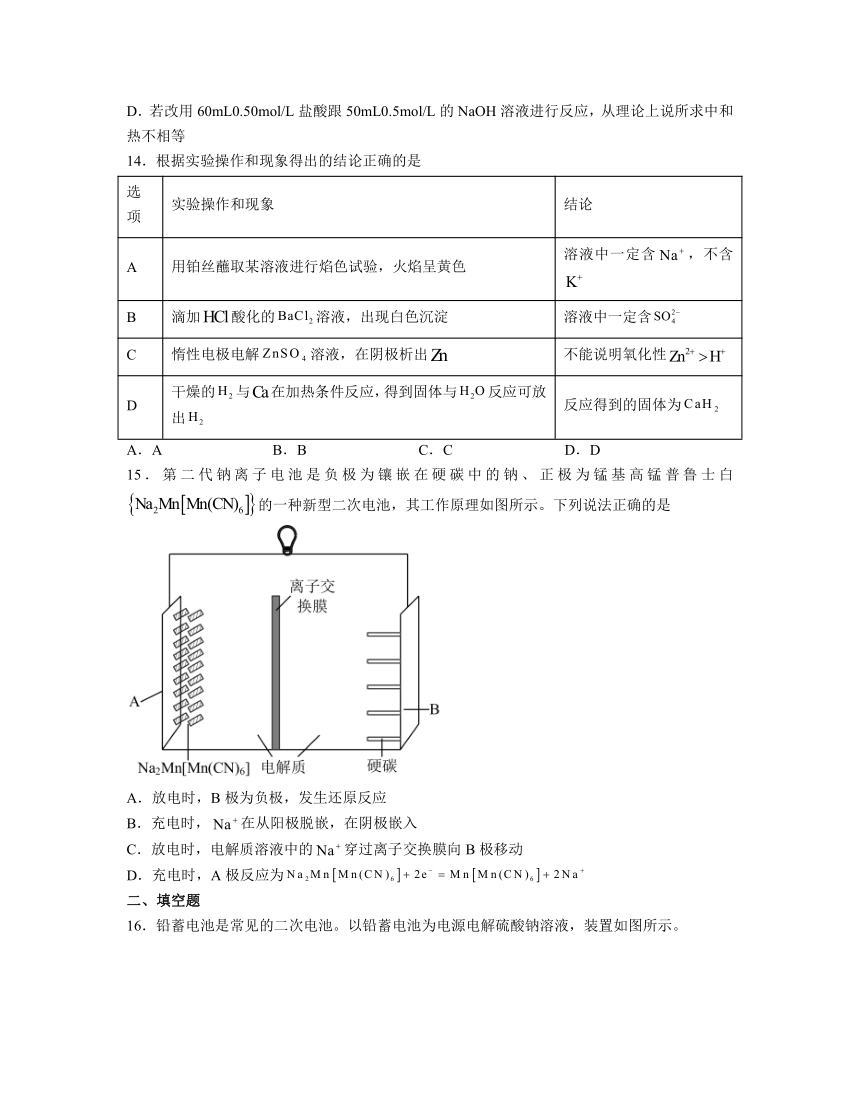
11.一种以太阳能热源分解水的历程如图所示:
已知:过程I:
过程II:
下列说法正确的是
A.转化过程中FeO作催化剂
B.该过程说明,常温下FeO易溶于水
C.
D.2mol液态水所具有的能量高于2mol氢气和1mol氧气的能量
12.已知三种气体燃烧的热化学方程式如下。下列有关说法正确的是
①
②
③
④
A.
B.气化为放出热量
C.
D.乙炔燃烧的火焰温度比乙烯高,是因为其燃烧热的值比乙烯的大
13.某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法正确的是
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60mL0.50mol/L盐酸跟50mL0.5mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
14.根据实验操作和现象得出的结论正确的是
选项 实验操作和现象 结论
A 用铂丝蘸取某溶液进行焰色试验,火焰呈黄色 溶液中一定含,不含
B 滴加酸化的溶液,出现白色沉淀 溶液中一定含
C 惰性电极电解溶液,在阴极析出 不能说明氧化性
D 干燥的与在加热条件反应,得到固体与反应可放出 反应得到的固体为
A.A B.B C.C D.D
15.第二代钠离子电池是负极为镶嵌在硬碳中的钠、正极为锰基高锰普鲁士白的一种新型二次电池,其工作原理如图所示。下列说法正确的是
A.放电时,B极为负极,发生还原反应
B.充电时,在从阳极脱嵌,在阴极嵌入
C.放电时,电解质溶液中的穿过离子交换膜向B极移动
D.充电时,A极反应为
二、填空题
16.铅蓄电池是常见的二次电池。以铅蓄电池为电源电解硫酸钠溶液,装置如图所示。
已知乙池中X、Y均为惰性电极,回答下列问题:
(1)下列判断正确的是___________ (填字母)。
A.为负极,为正极
B.为正极,为负极
C.工作时,电子由电极流出
D.电极发生氧化反应,电极发生还原反应
(2)X的电极反应式为 。
(3)在U形管两端分别滴入几滴酚酞溶液, (填“X”或“Y”)极附近溶液显红色。
(4)若把乙池中的硫酸钠溶液换成氯化钠溶液,电解的总反应方程式为 。
17.如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
(1)甲池是 (填“原电池”或“电解池”,下同)装置;乙池是 装置。
(2)C极为 (填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是 (填“a”或“b”)。
(4)C极上的电极反应式为 。
(5)甲池中反应的化学方程式为 。
18.I.图为铜锌原电池的装置请回答:
(1)铜是 极,铜片上现象是
(2)锌为 极,电极反应式为
(3)电池反应式(离子反应)为
II.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
(4)在导线中电子流动方向为 (用a、b表示)。
(5)负极反应式为 。正极反应式为 。
(6)电极表面镀铂粉的原因为 。
19.(1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的 性。
②误食重金属盐会使人中毒,应口服 来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了 (化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是 。
(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤
①菜谱中富含脂肪的食物是 。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是 (填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式 。青椒、西红柿等蔬菜富含维生素C,维生素C 又称 酸,用淀粉溶液和碘水可检验维生素C的 性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的 (填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式 。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式 。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式 。
20.已知断裂、分子中的化学键需要吸收的能量分别为、,与反应生成的能量变化如图所示:
(1)与反应生成 (填“吸收”或“放出”)的能量为 kJ。
(2)断裂键需要吸收的能量为 kJ。
21.研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式 。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式 。
22.C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
23.电化学在工业有着广泛的应用
(1)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图1所示。
①该电解槽的阴极反应式是 。
②除去杂质后的氢氧化钾溶液从液体 出口(填写“A”或“B”)导出。
(2)甲醇(CH3OH)燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。图2所示为酸性介质甲醇燃料电池。
①通入a的电极是电池的 (填“正”或“负”)极,其电极反应式 。
②甲醇燃料电池(酸性介质)可用于测量阿伏加德罗常数。当电池平稳工作5min后测得电池正极端消耗标准状况下氧气vmL,电流稳定为xA,假设能量转化率100%,计算测得阿伏加德罗常数NA为 mol-1(用x、v表示,已知电子电量e=1.60×10-19C)。
(3)采用如图3所示的简易装置(A、B电极均为惰性电极)电解饱和食盐水可以制备84消毒液。A为 极,制备84消毒液的总反应的化学方程式为 。
【参考答案】
一、选择题
1.D
解析:A.生铁中杂质比较多,易构成原电池加快腐蚀速率,所以比纯铁更容易生锈,A正确;
B.铁管上镶嵌锌块,锌比铁活泼,构成原电池时锌做负极,铁管不易被腐蚀 ,B正确;
C.电解精炼铜时,以待精炼的铜作为阳极,精铜做阴极,C正确;
D.外加电流法是把被保护的钢铁设备作为阴极,使钢铁表面腐蚀电流降至零或接近零,D错误;
故选D。
2.C
【分析】该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应。
解析:A.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,A错误;
B.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,B错误;
C.H2NCONH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+,C正确;
D.当N电极消耗0.5mol氧气时,则转移0.5×4=2.0mol电子,所以铁电极增重mol×64g/mol=64g,D错误;
故选C。
3.B
解析:A.干燥空气中不能形成原电池,铁丝发生化学腐蚀,故A错误;
B.原电池原理保护铜铁输水管,则输水管应作正极,金属M作负极负极金属比正极活泼,即金属性M>Fe,故B正确;
C.该装置中有电源,采用的是外接电流的阴极保护法,故C错误;
D.图③为外接电流的阴极保护法,钢铁闸门连接电源负极作阴极,辅助电极N作阳极,可选用石墨作电极,故D错误;
故选:B。
4.A
解析:A.电解饱和食盐水时,阳极氯离子失电子发生氧化反应,其电极反应为,A正确;
B.酸性氢氧燃料电池的正极电极反应为:,B错误;
C.粗铜精炼时,与电源正极相连的是纯铜,作阴极,其电极反应为,C错误;
D.钢铁发生吸氧腐蚀时,铁作负极被氧化,生成的是亚铁离子,所以其电极反应式为:,D错误;
故选A。
5.A
解析:通电一段时间后,b极显红色说明在b极附近溶液呈碱性,说明水电离出的H+在b极放电,b极为阴极,则Y为负极,X是正极;Pt极为阳极,惰性电极电解CuSO4溶液放出O2同时产生氢离子,酸性逐渐增强;
综上所述正确的有①③,故选A。
6.A
解析:A.Zn与硫酸反应生成氢气,利用秒表测定时间,针筒测定氢气的体积,则图中装置可测定生成氢气的速率,选项A正确;
B.加热固体物质时应选用坩埚而不能用蒸发皿,选项B错误;
C.浓盐酸具有挥发性,无法确定使硅酸钠溶液产生白色沉淀的是氯化氢还是二氧化碳,无法证明酸性:HCl>H2CO3>H2SiO3,选项C错误;
D.图4中蔗糖溶液是非电解质溶液,不能形成原电池,不可实现化学能转变成电能,选项D错误;
答案选A。
7.C
【分析】由题意可知,放电时图示电极为原电池的负极,锂在负极失去电子发生氧化反应生成锂离子,FeF3电极为正极,锂离子作用下FeF3得到电子发生还原反应生成LiFeF3,充电时,图示电极与直流电源负极相连做电解池的阴极,FeF3电极为阳极。
解析:A.由分析可知,当电池处于放电状态时,图示电极图示电极为原电池的负极,锂在负极失去电子发生氧化反应生成锂离子,故A正确;
B.由题给信息可知,充电时锂离子沿MIEC向惰性金属导体迁移,避免局部积聚过多的金属锂,造成电池变形,故B正确;
C.由分析可知,当电池处于放电状态时,FeF3电极为正极,锂离子作用下FeF3得到电子发生还原反应生成LiFeF3,电极反应式为,故C错误;
D.由分析可知,当电池处于放电状态时,图示电极图示电极为原电池的负极,锂在负极失去电子发生氧化反应生成锂离子,则当MIEC上有电荷发生迁移时,电极中的金属锂质量变化为,故D正确;
故选C。
8.C
【分析】图示为原电池装置,实质是a金属与氢离子反应生成氢气的氧化还原反应。a的金属活动性比氢要强,作负极失电子变成金属阳离子进入溶液,表现为溶解;碳棒是正极,氢离子在碳棒表面获得电子变成氢气。
解析:A.氢离子在碳棒表面被还原,碳棒上有气体放出,溶液中c(H+)变小,A正确;
B.a是活泼金属作负极,b是正极,B正确;
C.电子只能通过导线,不能通过溶液,C错误;
D.a是负极,失电子发生氧化反应,D正确;
故选C。
9.A
解析:A.凡是药物都带有一定的毒性和副作用,因此要合理使用以确保用药安全,故A正确;
B.不同的抗生素对不同的细菌感染有抵抗能力,而且会产生耐药性,因此不可以胡乱使用,更不能大量使用,抗生素在对抗细菌感染的同时,它对人体的正常细胞、组织、器官也会造成不同的损害,故B错误;
C.绿色化学的核心是从源头上消除污染,而不是先污染后治理,故C错误;
D.氯气不能与Cu2+、Hg2+等重金属离子反应生成沉淀,无法用氯气处理水中的Cu2+、Hg2+等重金属离子,故D错误;
故答案选A。
10.C
解析:A.Zn与硫酸可发生自发的氧化还原反应,A能形成原电池;
B.Cu与硝酸银可发生自发的氧化还原反应,B能形成原电池;
C.蔗糖为非电解质,C不能形成原电池;
D.Fe与盐酸可发生自发的氧化还原反应,D能形成原电池;
综上所述,答案为C。
11.C
解析:A.FeO作中间产物,故A错误;
B.图示表示在太阳能的作用下FeO和水反应,不能说明常温下FeO易溶于水,故B错误;
C.根据盖斯定律可得反应-(Ⅰ+2Ⅱ)可得,故,故C正确;
D.由C项可知,2mol液态水所具有的能量低于2mol氢气和1mol氧气的能量,故D错误;
故选C。
12.C
解析:A.因为气态水的能量大于液态水,所以生成液态水放出的热量大于生成气态水的热量,所以,故A错误;
B.已知③;④,④-③可得=+(a+571.0) ,气化为应吸收热量,B项错误;
C.根据盖斯定律,得,C项正确;
D.从乙炔和乙烯的燃烧热看出,乙炔的燃烧热的值比乙烯的小,火焰温度的高低,不仅与燃烧热有关,还与生成水的量有关,D项错误;
故选C。
13.B
解析:A.该装置的保温效果并不如量热计那样好,大小烧杯之间要填满纸片,装置存在热量的散失,A错误;
B.根据量热计的构造可以知道该装置的缺少仪器是环形玻璃搅拌棒,B正确;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,C错误;
D.中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关,中和热数值相等,D错误;
故选B。
14.C
解析:A.焰色试验,火焰呈黄色,说明含有,未透过蓝色钴玻璃进行观察火焰颜色,不能说明没有,故A错误;
B.白色沉淀可能为AgCl,不一定为,故B错误;
C.惰性电极电解溶液,在阴极析出,溶液中的、H+均向阴极移动,但由于此时溶液中的浓度远大于H+,先得电子生成,则不能说明氧化性,故C正确;
D.干燥的与在加热条件反应的方程式为: ,CaH2与反应的方程式为:,但氢气也可能是多余的钙与水反应生成的,故D错误。
答案为C。
15.B
解析:A.由题意可知硬碳B为负极,负极失电子发生氧化反应,故A错误;
B.放电时Na失电子生成钠离子,钠离子由负极进入正极,镶嵌在正极,则充电时过程相反,在从阳极脱嵌,在阴极嵌入,故B正确;
C.放电时,电解质溶液中的穿过离子交换膜向正极A极移动,故C错误;
D.充电时,A极作阳极,阳极失电子发生氧化反应,反应为,故D错误;
故选:B。
二、填空题
16.(1)AD
(2)
(3)Y
(4)
【分析】甲池为铅蓄电池,Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,为正极、Pb为负极;乙池为电解池,X与铅蓄电池正极相连,X为阳极;Y与铅蓄电池负极相连,Y为阴极。
解析:(1)A.甲池为铅蓄电池,Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,为正极、Pb为负极,故A正确;
B.甲池为铅蓄电池,Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,为正极、Pb为负极,故B错误;
C.工作时,电子由负极流出、正极流入,Pb为负极,电子由Pb电极流出,故C错误;
D.Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,故D正确;
选AD。
(2)乙池为电解池,X与铅蓄电池正极相连,X为阳极,氢氧根离子在阳极失电子发生氧化反应生成氧气,X的电极反应式为;
(3)X为阳极,阳极反应式为,反应生成氢离子,溶液呈酸性;Y极为阴极,阴极反应式为,反应生成氢氧根离子,溶液呈碱性,在U形管两端分别滴入几滴酚酞溶液, Y极附近溶液显红色。
(4)若把乙池中的硫酸钠溶液换成氯化钠溶液,X电极氯离子失电子生成氯气,Y电极发生反应,电解的总反应方程式为。
17. 电解池 原电池 阳极 a 2Cl-- 2e-==Cl2 ↑ 2CuSO4+2H2O2Cu+O2↑+2H2SO4
解析:A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E为铝,F为镁。根据图示,装置乙为原电池,在镁、铝(NaOH溶液)原电池中铝为负极,镁为正极,即E为负极,F为正极,因此,D、B为阴极,A、C为阳极。
(1)根据上述分析,甲池是电解池;乙池是原电池,故答案为电解池;原电池;
(2)C极与原电池的正极相连,为阳极,故答案为阳极;
(3)中间装置为电解氯化钾溶液,C极为阳极,溶液中的氯离子放电生成氯气,因此a烧杯中氯气与碘化钾反应置换出碘,淀粉溶液变蓝,故答案为a;
(4)根据(3)的分析,C极上的电极反应式为2Cl-- 2e-==Cl2 ↑,故答案为2Cl-- 2e-==Cl2 ↑;
(5)甲池为电解硫酸铜溶液,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,反应的化学方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,故答案为2CuSO4+2H2O 2Cu+O2↑+2H2SO4。
【点睛】本题考查了原电池和电解池的原理,解答本题的关键是正确判断装置的属性。本题中判断装置的属性可以根据电极材料分析判断。本题的易错点为乙中正负极的判断;难点是(4)反应方程式的书写,要首先根据离子的放电顺序判断出电极反应,再根据电极反应书写总反应。
18.(1)正 Cu2+ + 2e=Cu
(2)负 Zn - 2e=Zn2+
(3)Zn + Cu2+=Zn2++Cu
(4)由a到b
(5)2H2+4OH--4e-=4H2O O2+4e-+2H2O=4OH-
(6)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率
【分析】铜锌原电池,活泼的金属作负极,故锌作负极,发生氧化反应,电极反应式为:Zn - 2e=Zn2+;铜作正极,电极反应式为:Cu2+ + 2e=Cu;电池的总反应为:Zn + Cu2+=Zn2++Cu,据此分析。
氢氧燃料电池属于原电池,是将化学能转化为电能的装置,通入燃料的电极是负极,通入氧化剂的电极是正极,电子从负极沿导线流向正极,所以通入氢气的电极是负极,通入氧气的电极是正极,电子流动方向为a到b,据此分析。
解析:(1)铜作正极,电极反应式为:Cu2+ + 2e=Cu,故答案为:正;Cu2+ + 2e=Cu;
(2)锌作负极,发生氧化反应,答案为:负;Zn-2e=Zn2+;
(3)根据电极反应可知电池反应式为:Zn + Cu2+=Zn2++Cu;答案为:Zn + Cu2+=Zn2++Cu;
(4)由上述分析可知,通入氢气的电极是负极,通入氧气的电极是正极,电子流动方向为a到b,故答案为:a到b;
(5)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-=4H2O;通入氧气的电极是正极,氧气得到电子结合水,生成氢氧根,电极反应式为:O2+4e-+2H2O=4OH-,故答案为: 2H2+4OH--4e-=4H2O;O2+4e-+2H2O=4OH-;
(6)反应物与电极接触越充分,反应速率越快,电极表面镀铂粉能增大电极单位面积吸附H2、O2的分子数,所以能增大反应速率,故答案为:增大电极单位面积吸附H2、O2的分子数,加快电极反应速率。
19.吸附性 牛奶或豆浆 电化学腐蚀 可回收垃圾 红烧五花肉 氨基酸 (C6H10O5)n 抗坏血酸 还原性 c 5CO2 +16 H2 C5H12 +10H2O CH4·nH2O+2O2CO2 + (n+2 )H2O
解析:(1)①活性炭的结构疏松多孔能够起到吸附作用而净水,故利用其吸附性;②重金属盐会使身体内蛋白质变性,所以应口服牛奶或豆浆来解毒,减少对身体的伤害;③雨雪天气零件中的铁、碳构成了原电池,铁做负极,碳做正极,故铁发生了电化学腐蚀;④该标志是可回收垃圾。
(2)①肉类中脂肪的量较多,因此菜谱中富含脂肪的食物是红烧五花肉;②蛋白质是由氨基酸构成,所以在人体中完全水解的产物为氨基酸;③淀粉的化学式(C6H10O5)n ;维生素C 又称抗坏血酸;淀粉溶液和碘水混合溶液显蓝色,维生素C具有还原性,可以把碘还原为碘离子,蓝色溶液褪色,故检验维生素C的还原性;④胃酸主要成分为盐酸,需要用碱性物质来中和盐酸,复方氢氧化铝片就能够和盐酸反应,达到中和的目的,故选C。
(3)①由原子守恒可得:CO2与氢气发生反应生成C5H12的方程式为5CO2 +16 H2 C5H12 +10H2O;②可燃冰(CH4·nH2O)在空气中充分燃烧生成二氧化碳和水,根据原子守恒可得方程式为CH4·nH2O+2O2CO2 + (n+2 )H2O ;③乙烯发生加聚反应生成聚乙烯塑料,即结构简式为
20. 放出 46 390.5
解析:(1)由题给示意图可知,和总能量高于的总能量,该反应为放热反应,放出的能量为,故答案为:放出;46;
(2)设形成键需要放出的能量为,由反应中的能量变化=反应物中化学键断裂吸收的能量之和-生成物中化学键形成放出的能量之和可得,(×943kJ+×436kJ)—3a=—46kJ,解得,故答案为:390.5。
21.(1) 0.6
(2)H2(g)+O2(g)=H2O(l) △H=-285.8kJ mol-1
(3)CH4(g)=C(s)+2H2(g) △H=+74.8kJ mol-1
解析:(1)①CO(g)+NO2(g)=NO(g)+CO2(g) △H1=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H2=-b KJ·mol-1 (b>0)
根据盖斯定律,由①×2+②得,反应4CO(g)+2NO2(g)=N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1。
标准状况下3.36LNO2氧化CO至CO2,NO2转化为N2,氮元素化合价由+4价变为0价,n(e-)=×4=0.6 mol,放出的热量为=。答案为:0.6;kJ;
(2)①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H1=-870.3kJ/mol;
②C(s)+O2(g) =CO2(g) ΔH2=-393.5kJ/mol;
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH3=-488.3kJ/mol;
根据盖斯定律,由×①-②+×③得反应H2(g)+O2(g)=H2O(l) △H=×(-870.3kJ/mol)-(-393.5kJ/mol)+×(-488.3kJ/mol) =-285.8kJ mol-1,故H2燃烧热的热化学方程式为H2(g)+O2(g)=H2O(l) △H=-285.8kJ mol-1。答案为:H2(g)+O2(g)=H2O(l) △H=-285.8kJ mol-1;
(3)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
②H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
根据盖斯定律,由③-①-②×2得,CH4(g)=C(s)+2H2(g) △H=[(-890.3kJ/mol)-(-393.5kJ/mol)-(-285.8kJ/mol)×2]-=+74.8kJ/mol。答案为:CH4(g)=C(s)+2H2(g) △H=+74.8kJ mol-1。
22.H2O2 2KCl+2H2O2KOH+Cl2↑+H2↑ Fe2O3+2Al2Fe + Al2O3 在混合物上加少量KClO3,插上Mg条并将其点燃 Al2O3+2OH-===2AlO2-+H2O
【分析】C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质;D的原子最外层电子数是次外层电子数的3倍,则D原子有2个电子层,最外层电子数为6,则D原子为氧原子,所以D为氧气;E的水溶液电解生成F、I、G三种物质,电解质与水都发生电解,其中I、G是短周期元素形成的气体单质,说明E的酸根电解生成气体,应生成氯气,所以另一种气体是氢气,F为碱,E为氯化物,即I、G为氢气和氯气,F为碱,E为氯化物;加热B生成氧气与氯化物,故B应为氯酸钾,E应为氯化钾,F应为氢氧化钾;C、G同周期,且最外层电子数相差4,则G应为氯气,I应为氢气,C、G原子的最外层电子数相差4,C的最外层电子数为3,它们的简单离子电子层结构不同,则C应为Al;电解A得铝与氧气,故A应为氧化铝;C与G反应生成H,故H应为氯化铝,H的水溶液与过量F反应生成J,A与过量F溶液反应生成J,J应为偏铝酸钾;C与K高温得到A与L,则K为氧化铁,L为铁.然后再进行验证符合转化关系,据以上分析解答。
解析:根据上述分析可知,
(1)D为氧气、I为氢气,D与I能形成原子个数比为1:1的共价化合物为H2O2;
综上所述,本题正确答案为:H2O2;
(2)用碳棒作阳极,Fe作阴极,电解1L1mol L-1的KCl水溶液,氯离子在阳极放电,生成氯气,水在阴极放电,生成氢气与氢氧根,反应的化学方程式2KCl+2H2O2KOH+Cl2↑+H2↑;
综上所述,本题正确答案为:2KCl+2H2O2KOH+Cl2↑+H2↑;
(3)化合物K中含有组成单质L的元素,化合物中Fe元素的质量分数为70%,则氧元素的质量分数为30%,所以化学式中铁原子与氧原子个数之比为70%/56:30%/16=2:3,所以化合物K为Fe2O3,铝与氧化铁反应生成氧化铝与铁,反应的化学方程式是 Fe2O3+2AlAl2O3+2Fe;把氧化铁和铝粉混合后,在混合物上加少量KClO3,插上Mg条并将其点燃,反应即可发生;
综上所述,本题正确答案为:Fe2O3+2AlAl2O3+2Fe;在混合物上加少量KClO3,插上Mg条并将其点燃;
(4)A为氧化铝,F为氢氧化钾;J为偏铝酸钾,氧化铝与氢氧化钾反应生成偏铝酸钾与水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
综上所述,本题正确答案为:Al2O3+2OH-=2AlO2-+H2O。
23. 2H2O+2e-=2OH-+H2↑ B 负 CH3OH-6e-+H2O=CO2↑+6H+ 阴 NaCl+H2ONaClO+H2↑
【分析】(1)电解氢氧化钾溶液根据放电顺序相当于电解水,根据电解池原理分析解答;
(2)根据燃料电池原理分析电极反应,根据电子转移守恒及1C=1A·S进行相关计算;
(3)根据次氯酸钠的制备原理及电解原理分析解答。
解析:(1)①该电解槽的阴极是氢离子得电子生成氢气,电极反应式是:2H2O+2e-=2OH-+H2↑,故答案为:2H2O+2e-=2OH-+H2↑;
②阳离子向阴极移动,右侧溶液为除去杂质的KOH溶液,则除去杂质后的氢氧化钾溶液从液体出口B导出,故答案为:B;
(2)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极上是CH3OH失去电子生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2↑+6H+;故答案为:负;CH3OH-6e-+H2O=CO2↑+6H+;
②甲醇燃料电池的正极反应为O2+4H++4e-=2H2O,因为甲醇燃料电池的能量转化率为 100%,n(O2)=,转移的电子数为:,1个电子所带的电量为 1.6×10-19C,根据1C=1A·S得:=,即NA=,故答案为:;
(3)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是84消毒液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极;总反应为:NaCl+H2ONaClO+H2↑;故答案为:阴;NaCl+H2ONaClO+H2↑
一、选择题
1.下列叙述不正确的是
A.生铁比纯铁更容易生锈
B.铁管上镶嵌锌块,铁管不易被腐蚀
C.电解精炼铜时,以待精炼的铜作为阳极
D.外加电流法是把被保护的钢铁设备作为阳极,使钢铁表面腐蚀电流降至零或接近零
2.如图甲是一种利用微生物将废水中的尿素(,氮元素显价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
A.透过质子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极的反应式:
D.当N电极消耗0.5mol气体时,则铁电极增重32g
3.关于金属的腐蚀与防护,下列说法正确的是
A.图①:铁丝发生吸氧腐蚀 B.图②: 金属性M>Fe
C.图③:防护方法为牺牲阳极的阴极保护法 D.图③:N不可选石墨
4.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应为
B.酸性氢氧燃料电池的正极电极反应为
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为
D.钢铁发生吸氧腐蚀时,铁作负极被氧化:
5.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法中正确的是
①X是正极,Y是负极 ②X是负极,Y是正极
③CuSO4溶液的酸性逐渐增强 ④CuSO4溶液的酸性不变
A.①③ B.②③ C.①④ D.②④
6.利用下列装置进行实验,能达到实验目的的是
A.图1可用于测定一定时间内生成H2的反应速率
B.图2用该装置加热硫酸铜晶体制备无水硫酸铜
C.图3可证明酸性:HCl>H2CO3>H2SiO3
D.图4可实现化学能转变成电能
7.某全固态锂电池充电时电解质表面易积聚过多的金属锂,造成电池变形,改良后电极充电过程如图,MIEC材料可同时传导离子和电子,ELI材料两者均不能传导,两种材料均不与锂及其化合物反应,锂离子通过金属锂纳米颗粒的蠕动扩散至MIEC表面,下列说法不正确的是
A.当电池处于放电状态时,图示电极发生氧化反应
B.充电时沿MIEC向惰性金属导体迁移,避免局部积聚
C.另一极的电极材料为,则放电时的电极反应为
D.当MIEC上有电荷发生迁移时,电极中的金属锂质量变化为
8.在如图所示的装置中,a的金属活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是
A.氢离子在碳棒表面被还原,碳棒上有气体放出,溶液中c(H+)变小
B.a是负极,b是正极
C.电子从a极经导线到b极,再经过稀硫酸回到a极,从而形成闭合回路
D.a极上发生了氧化反应
9.下列有关说法正确的是
A.虽然药物能治病,但大部分药物有毒副作用
B.抗生素能抵抗所有细菌感染,可以大量使用
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.用氯气处理水中的Cu2+、Hg2+等重金属离子
10.下列各组材料中,不能组成原电池的是
A B C D
两极材料 Zn片、石墨 Cu片、Ag片 Zn片、Ag片 Fe片、Cu片
插入溶液 稀硫酸 AgNO3溶液 蔗糖溶液 稀盐酸
A.A B.B C.C D.D
11.一种以太阳能热源分解水的历程如图所示:
已知:过程I:
过程II:
下列说法正确的是
A.转化过程中FeO作催化剂
B.该过程说明,常温下FeO易溶于水
C.
D.2mol液态水所具有的能量高于2mol氢气和1mol氧气的能量
12.已知三种气体燃烧的热化学方程式如下。下列有关说法正确的是
①
②
③
④
A.
B.气化为放出热量
C.
D.乙炔燃烧的火焰温度比乙烯高,是因为其燃烧热的值比乙烯的大
13.某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法正确的是
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60mL0.50mol/L盐酸跟50mL0.5mol/L的NaOH溶液进行反应,从理论上说所求中和热不相等
14.根据实验操作和现象得出的结论正确的是
选项 实验操作和现象 结论
A 用铂丝蘸取某溶液进行焰色试验,火焰呈黄色 溶液中一定含,不含
B 滴加酸化的溶液,出现白色沉淀 溶液中一定含
C 惰性电极电解溶液,在阴极析出 不能说明氧化性
D 干燥的与在加热条件反应,得到固体与反应可放出 反应得到的固体为
A.A B.B C.C D.D
15.第二代钠离子电池是负极为镶嵌在硬碳中的钠、正极为锰基高锰普鲁士白的一种新型二次电池,其工作原理如图所示。下列说法正确的是
A.放电时,B极为负极,发生还原反应
B.充电时,在从阳极脱嵌,在阴极嵌入
C.放电时,电解质溶液中的穿过离子交换膜向B极移动
D.充电时,A极反应为
二、填空题
16.铅蓄电池是常见的二次电池。以铅蓄电池为电源电解硫酸钠溶液,装置如图所示。
已知乙池中X、Y均为惰性电极,回答下列问题:
(1)下列判断正确的是___________ (填字母)。
A.为负极,为正极
B.为正极,为负极
C.工作时,电子由电极流出
D.电极发生氧化反应,电极发生还原反应
(2)X的电极反应式为 。
(3)在U形管两端分别滴入几滴酚酞溶液, (填“X”或“Y”)极附近溶液显红色。
(4)若把乙池中的硫酸钠溶液换成氯化钠溶液,电解的总反应方程式为 。
17.如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
(1)甲池是 (填“原电池”或“电解池”,下同)装置;乙池是 装置。
(2)C极为 (填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是 (填“a”或“b”)。
(4)C极上的电极反应式为 。
(5)甲池中反应的化学方程式为 。
18.I.图为铜锌原电池的装置请回答:
(1)铜是 极,铜片上现象是
(2)锌为 极,电极反应式为
(3)电池反应式(离子反应)为
II.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
(4)在导线中电子流动方向为 (用a、b表示)。
(5)负极反应式为 。正极反应式为 。
(6)电极表面镀铂粉的原因为 。
19.(1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的 性。
②误食重金属盐会使人中毒,应口服 来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了 (化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是 。
(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤
①菜谱中富含脂肪的食物是 。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是 (填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式 。青椒、西红柿等蔬菜富含维生素C,维生素C 又称 酸,用淀粉溶液和碘水可检验维生素C的 性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的 (填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式 。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式 。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式 。
20.已知断裂、分子中的化学键需要吸收的能量分别为、,与反应生成的能量变化如图所示:
(1)与反应生成 (填“吸收”或“放出”)的能量为 kJ。
(2)断裂键需要吸收的能量为 kJ。
21.研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式 。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式 。
22.C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
23.电化学在工业有着广泛的应用
(1)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图1所示。
①该电解槽的阴极反应式是 。
②除去杂质后的氢氧化钾溶液从液体 出口(填写“A”或“B”)导出。
(2)甲醇(CH3OH)燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。图2所示为酸性介质甲醇燃料电池。
①通入a的电极是电池的 (填“正”或“负”)极,其电极反应式 。
②甲醇燃料电池(酸性介质)可用于测量阿伏加德罗常数。当电池平稳工作5min后测得电池正极端消耗标准状况下氧气vmL,电流稳定为xA,假设能量转化率100%,计算测得阿伏加德罗常数NA为 mol-1(用x、v表示,已知电子电量e=1.60×10-19C)。
(3)采用如图3所示的简易装置(A、B电极均为惰性电极)电解饱和食盐水可以制备84消毒液。A为 极,制备84消毒液的总反应的化学方程式为 。
【参考答案】
一、选择题
1.D
解析:A.生铁中杂质比较多,易构成原电池加快腐蚀速率,所以比纯铁更容易生锈,A正确;
B.铁管上镶嵌锌块,锌比铁活泼,构成原电池时锌做负极,铁管不易被腐蚀 ,B正确;
C.电解精炼铜时,以待精炼的铜作为阳极,精铜做阴极,C正确;
D.外加电流法是把被保护的钢铁设备作为阴极,使钢铁表面腐蚀电流降至零或接近零,D错误;
故选D。
2.C
【分析】该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应。
解析:A.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,A错误;
B.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,B错误;
C.H2NCONH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+,C正确;
D.当N电极消耗0.5mol氧气时,则转移0.5×4=2.0mol电子,所以铁电极增重mol×64g/mol=64g,D错误;
故选C。
3.B
解析:A.干燥空气中不能形成原电池,铁丝发生化学腐蚀,故A错误;
B.原电池原理保护铜铁输水管,则输水管应作正极,金属M作负极负极金属比正极活泼,即金属性M>Fe,故B正确;
C.该装置中有电源,采用的是外接电流的阴极保护法,故C错误;
D.图③为外接电流的阴极保护法,钢铁闸门连接电源负极作阴极,辅助电极N作阳极,可选用石墨作电极,故D错误;
故选:B。
4.A
解析:A.电解饱和食盐水时,阳极氯离子失电子发生氧化反应,其电极反应为,A正确;
B.酸性氢氧燃料电池的正极电极反应为:,B错误;
C.粗铜精炼时,与电源正极相连的是纯铜,作阴极,其电极反应为,C错误;
D.钢铁发生吸氧腐蚀时,铁作负极被氧化,生成的是亚铁离子,所以其电极反应式为:,D错误;
故选A。
5.A
解析:通电一段时间后,b极显红色说明在b极附近溶液呈碱性,说明水电离出的H+在b极放电,b极为阴极,则Y为负极,X是正极;Pt极为阳极,惰性电极电解CuSO4溶液放出O2同时产生氢离子,酸性逐渐增强;
综上所述正确的有①③,故选A。
6.A
解析:A.Zn与硫酸反应生成氢气,利用秒表测定时间,针筒测定氢气的体积,则图中装置可测定生成氢气的速率,选项A正确;
B.加热固体物质时应选用坩埚而不能用蒸发皿,选项B错误;
C.浓盐酸具有挥发性,无法确定使硅酸钠溶液产生白色沉淀的是氯化氢还是二氧化碳,无法证明酸性:HCl>H2CO3>H2SiO3,选项C错误;
D.图4中蔗糖溶液是非电解质溶液,不能形成原电池,不可实现化学能转变成电能,选项D错误;
答案选A。
7.C
【分析】由题意可知,放电时图示电极为原电池的负极,锂在负极失去电子发生氧化反应生成锂离子,FeF3电极为正极,锂离子作用下FeF3得到电子发生还原反应生成LiFeF3,充电时,图示电极与直流电源负极相连做电解池的阴极,FeF3电极为阳极。
解析:A.由分析可知,当电池处于放电状态时,图示电极图示电极为原电池的负极,锂在负极失去电子发生氧化反应生成锂离子,故A正确;
B.由题给信息可知,充电时锂离子沿MIEC向惰性金属导体迁移,避免局部积聚过多的金属锂,造成电池变形,故B正确;
C.由分析可知,当电池处于放电状态时,FeF3电极为正极,锂离子作用下FeF3得到电子发生还原反应生成LiFeF3,电极反应式为,故C错误;
D.由分析可知,当电池处于放电状态时,图示电极图示电极为原电池的负极,锂在负极失去电子发生氧化反应生成锂离子,则当MIEC上有电荷发生迁移时,电极中的金属锂质量变化为,故D正确;
故选C。
8.C
【分析】图示为原电池装置,实质是a金属与氢离子反应生成氢气的氧化还原反应。a的金属活动性比氢要强,作负极失电子变成金属阳离子进入溶液,表现为溶解;碳棒是正极,氢离子在碳棒表面获得电子变成氢气。
解析:A.氢离子在碳棒表面被还原,碳棒上有气体放出,溶液中c(H+)变小,A正确;
B.a是活泼金属作负极,b是正极,B正确;
C.电子只能通过导线,不能通过溶液,C错误;
D.a是负极,失电子发生氧化反应,D正确;
故选C。
9.A
解析:A.凡是药物都带有一定的毒性和副作用,因此要合理使用以确保用药安全,故A正确;
B.不同的抗生素对不同的细菌感染有抵抗能力,而且会产生耐药性,因此不可以胡乱使用,更不能大量使用,抗生素在对抗细菌感染的同时,它对人体的正常细胞、组织、器官也会造成不同的损害,故B错误;
C.绿色化学的核心是从源头上消除污染,而不是先污染后治理,故C错误;
D.氯气不能与Cu2+、Hg2+等重金属离子反应生成沉淀,无法用氯气处理水中的Cu2+、Hg2+等重金属离子,故D错误;
故答案选A。
10.C
解析:A.Zn与硫酸可发生自发的氧化还原反应,A能形成原电池;
B.Cu与硝酸银可发生自发的氧化还原反应,B能形成原电池;
C.蔗糖为非电解质,C不能形成原电池;
D.Fe与盐酸可发生自发的氧化还原反应,D能形成原电池;
综上所述,答案为C。
11.C
解析:A.FeO作中间产物,故A错误;
B.图示表示在太阳能的作用下FeO和水反应,不能说明常温下FeO易溶于水,故B错误;
C.根据盖斯定律可得反应-(Ⅰ+2Ⅱ)可得,故,故C正确;
D.由C项可知,2mol液态水所具有的能量低于2mol氢气和1mol氧气的能量,故D错误;
故选C。
12.C
解析:A.因为气态水的能量大于液态水,所以生成液态水放出的热量大于生成气态水的热量,所以,故A错误;
B.已知③;④,④-③可得=+(a+571.0) ,气化为应吸收热量,B项错误;
C.根据盖斯定律,得,C项正确;
D.从乙炔和乙烯的燃烧热看出,乙炔的燃烧热的值比乙烯的小,火焰温度的高低,不仅与燃烧热有关,还与生成水的量有关,D项错误;
故选C。
13.B
解析:A.该装置的保温效果并不如量热计那样好,大小烧杯之间要填满纸片,装置存在热量的散失,A错误;
B.根据量热计的构造可以知道该装置的缺少仪器是环形玻璃搅拌棒,B正确;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,C错误;
D.中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关,中和热数值相等,D错误;
故选B。
14.C
解析:A.焰色试验,火焰呈黄色,说明含有,未透过蓝色钴玻璃进行观察火焰颜色,不能说明没有,故A错误;
B.白色沉淀可能为AgCl,不一定为,故B错误;
C.惰性电极电解溶液,在阴极析出,溶液中的、H+均向阴极移动,但由于此时溶液中的浓度远大于H+,先得电子生成,则不能说明氧化性,故C正确;
D.干燥的与在加热条件反应的方程式为: ,CaH2与反应的方程式为:,但氢气也可能是多余的钙与水反应生成的,故D错误。
答案为C。
15.B
解析:A.由题意可知硬碳B为负极,负极失电子发生氧化反应,故A错误;
B.放电时Na失电子生成钠离子,钠离子由负极进入正极,镶嵌在正极,则充电时过程相反,在从阳极脱嵌,在阴极嵌入,故B正确;
C.放电时,电解质溶液中的穿过离子交换膜向正极A极移动,故C错误;
D.充电时,A极作阳极,阳极失电子发生氧化反应,反应为,故D错误;
故选:B。
二、填空题
16.(1)AD
(2)
(3)Y
(4)
【分析】甲池为铅蓄电池,Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,为正极、Pb为负极;乙池为电解池,X与铅蓄电池正极相连,X为阳极;Y与铅蓄电池负极相连,Y为阴极。
解析:(1)A.甲池为铅蓄电池,Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,为正极、Pb为负极,故A正确;
B.甲池为铅蓄电池,Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,为正极、Pb为负极,故B错误;
C.工作时,电子由负极流出、正极流入,Pb为负极,电子由Pb电极流出,故C错误;
D.Pb失电子发生氧化反应生成硫酸铅,得电子发生还原反应生成硫酸铅,故D正确;
选AD。
(2)乙池为电解池,X与铅蓄电池正极相连,X为阳极,氢氧根离子在阳极失电子发生氧化反应生成氧气,X的电极反应式为;
(3)X为阳极,阳极反应式为,反应生成氢离子,溶液呈酸性;Y极为阴极,阴极反应式为,反应生成氢氧根离子,溶液呈碱性,在U形管两端分别滴入几滴酚酞溶液, Y极附近溶液显红色。
(4)若把乙池中的硫酸钠溶液换成氯化钠溶液,X电极氯离子失电子生成氯气,Y电极发生反应,电解的总反应方程式为。
17. 电解池 原电池 阳极 a 2Cl-- 2e-==Cl2 ↑ 2CuSO4+2H2O2Cu+O2↑+2H2SO4
解析:A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E为铝,F为镁。根据图示,装置乙为原电池,在镁、铝(NaOH溶液)原电池中铝为负极,镁为正极,即E为负极,F为正极,因此,D、B为阴极,A、C为阳极。
(1)根据上述分析,甲池是电解池;乙池是原电池,故答案为电解池;原电池;
(2)C极与原电池的正极相连,为阳极,故答案为阳极;
(3)中间装置为电解氯化钾溶液,C极为阳极,溶液中的氯离子放电生成氯气,因此a烧杯中氯气与碘化钾反应置换出碘,淀粉溶液变蓝,故答案为a;
(4)根据(3)的分析,C极上的电极反应式为2Cl-- 2e-==Cl2 ↑,故答案为2Cl-- 2e-==Cl2 ↑;
(5)甲池为电解硫酸铜溶液,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,反应的化学方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,故答案为2CuSO4+2H2O 2Cu+O2↑+2H2SO4。
【点睛】本题考查了原电池和电解池的原理,解答本题的关键是正确判断装置的属性。本题中判断装置的属性可以根据电极材料分析判断。本题的易错点为乙中正负极的判断;难点是(4)反应方程式的书写,要首先根据离子的放电顺序判断出电极反应,再根据电极反应书写总反应。
18.(1)正 Cu2+ + 2e=Cu
(2)负 Zn - 2e=Zn2+
(3)Zn + Cu2+=Zn2++Cu
(4)由a到b
(5)2H2+4OH--4e-=4H2O O2+4e-+2H2O=4OH-
(6)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率
【分析】铜锌原电池,活泼的金属作负极,故锌作负极,发生氧化反应,电极反应式为:Zn - 2e=Zn2+;铜作正极,电极反应式为:Cu2+ + 2e=Cu;电池的总反应为:Zn + Cu2+=Zn2++Cu,据此分析。
氢氧燃料电池属于原电池,是将化学能转化为电能的装置,通入燃料的电极是负极,通入氧化剂的电极是正极,电子从负极沿导线流向正极,所以通入氢气的电极是负极,通入氧气的电极是正极,电子流动方向为a到b,据此分析。
解析:(1)铜作正极,电极反应式为:Cu2+ + 2e=Cu,故答案为:正;Cu2+ + 2e=Cu;
(2)锌作负极,发生氧化反应,答案为:负;Zn-2e=Zn2+;
(3)根据电极反应可知电池反应式为:Zn + Cu2+=Zn2++Cu;答案为:Zn + Cu2+=Zn2++Cu;
(4)由上述分析可知,通入氢气的电极是负极,通入氧气的电极是正极,电子流动方向为a到b,故答案为:a到b;
(5)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-=4H2O;通入氧气的电极是正极,氧气得到电子结合水,生成氢氧根,电极反应式为:O2+4e-+2H2O=4OH-,故答案为: 2H2+4OH--4e-=4H2O;O2+4e-+2H2O=4OH-;
(6)反应物与电极接触越充分,反应速率越快,电极表面镀铂粉能增大电极单位面积吸附H2、O2的分子数,所以能增大反应速率,故答案为:增大电极单位面积吸附H2、O2的分子数,加快电极反应速率。
19.吸附性 牛奶或豆浆 电化学腐蚀 可回收垃圾 红烧五花肉 氨基酸 (C6H10O5)n 抗坏血酸 还原性 c 5CO2 +16 H2 C5H12 +10H2O CH4·nH2O+2O2CO2 + (n+2 )H2O
解析:(1)①活性炭的结构疏松多孔能够起到吸附作用而净水,故利用其吸附性;②重金属盐会使身体内蛋白质变性,所以应口服牛奶或豆浆来解毒,减少对身体的伤害;③雨雪天气零件中的铁、碳构成了原电池,铁做负极,碳做正极,故铁发生了电化学腐蚀;④该标志是可回收垃圾。
(2)①肉类中脂肪的量较多,因此菜谱中富含脂肪的食物是红烧五花肉;②蛋白质是由氨基酸构成,所以在人体中完全水解的产物为氨基酸;③淀粉的化学式(C6H10O5)n ;维生素C 又称抗坏血酸;淀粉溶液和碘水混合溶液显蓝色,维生素C具有还原性,可以把碘还原为碘离子,蓝色溶液褪色,故检验维生素C的还原性;④胃酸主要成分为盐酸,需要用碱性物质来中和盐酸,复方氢氧化铝片就能够和盐酸反应,达到中和的目的,故选C。
(3)①由原子守恒可得:CO2与氢气发生反应生成C5H12的方程式为5CO2 +16 H2 C5H12 +10H2O;②可燃冰(CH4·nH2O)在空气中充分燃烧生成二氧化碳和水,根据原子守恒可得方程式为CH4·nH2O+2O2CO2 + (n+2 )H2O ;③乙烯发生加聚反应生成聚乙烯塑料,即结构简式为
20. 放出 46 390.5
解析:(1)由题给示意图可知,和总能量高于的总能量,该反应为放热反应,放出的能量为,故答案为:放出;46;
(2)设形成键需要放出的能量为,由反应中的能量变化=反应物中化学键断裂吸收的能量之和-生成物中化学键形成放出的能量之和可得,(×943kJ+×436kJ)—3a=—46kJ,解得,故答案为:390.5。
21.(1) 0.6
(2)H2(g)+O2(g)=H2O(l) △H=-285.8kJ mol-1
(3)CH4(g)=C(s)+2H2(g) △H=+74.8kJ mol-1
解析:(1)①CO(g)+NO2(g)=NO(g)+CO2(g) △H1=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H2=-b KJ·mol-1 (b>0)
根据盖斯定律,由①×2+②得,反应4CO(g)+2NO2(g)=N2(g)+4CO2(g) ΔH=-(2a+b)kJ·mol-1。
标准状况下3.36LNO2氧化CO至CO2,NO2转化为N2,氮元素化合价由+4价变为0价,n(e-)=×4=0.6 mol,放出的热量为=。答案为:0.6;kJ;
(2)①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H1=-870.3kJ/mol;
②C(s)+O2(g) =CO2(g) ΔH2=-393.5kJ/mol;
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH3=-488.3kJ/mol;
根据盖斯定律,由×①-②+×③得反应H2(g)+O2(g)=H2O(l) △H=×(-870.3kJ/mol)-(-393.5kJ/mol)+×(-488.3kJ/mol) =-285.8kJ mol-1,故H2燃烧热的热化学方程式为H2(g)+O2(g)=H2O(l) △H=-285.8kJ mol-1。答案为:H2(g)+O2(g)=H2O(l) △H=-285.8kJ mol-1;
(3)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
②H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
根据盖斯定律,由③-①-②×2得,CH4(g)=C(s)+2H2(g) △H=[(-890.3kJ/mol)-(-393.5kJ/mol)-(-285.8kJ/mol)×2]-=+74.8kJ/mol。答案为:CH4(g)=C(s)+2H2(g) △H=+74.8kJ mol-1。
22.H2O2 2KCl+2H2O2KOH+Cl2↑+H2↑ Fe2O3+2Al2Fe + Al2O3 在混合物上加少量KClO3,插上Mg条并将其点燃 Al2O3+2OH-===2AlO2-+H2O
【分析】C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质;D的原子最外层电子数是次外层电子数的3倍,则D原子有2个电子层,最外层电子数为6,则D原子为氧原子,所以D为氧气;E的水溶液电解生成F、I、G三种物质,电解质与水都发生电解,其中I、G是短周期元素形成的气体单质,说明E的酸根电解生成气体,应生成氯气,所以另一种气体是氢气,F为碱,E为氯化物,即I、G为氢气和氯气,F为碱,E为氯化物;加热B生成氧气与氯化物,故B应为氯酸钾,E应为氯化钾,F应为氢氧化钾;C、G同周期,且最外层电子数相差4,则G应为氯气,I应为氢气,C、G原子的最外层电子数相差4,C的最外层电子数为3,它们的简单离子电子层结构不同,则C应为Al;电解A得铝与氧气,故A应为氧化铝;C与G反应生成H,故H应为氯化铝,H的水溶液与过量F反应生成J,A与过量F溶液反应生成J,J应为偏铝酸钾;C与K高温得到A与L,则K为氧化铁,L为铁.然后再进行验证符合转化关系,据以上分析解答。
解析:根据上述分析可知,
(1)D为氧气、I为氢气,D与I能形成原子个数比为1:1的共价化合物为H2O2;
综上所述,本题正确答案为:H2O2;
(2)用碳棒作阳极,Fe作阴极,电解1L1mol L-1的KCl水溶液,氯离子在阳极放电,生成氯气,水在阴极放电,生成氢气与氢氧根,反应的化学方程式2KCl+2H2O2KOH+Cl2↑+H2↑;
综上所述,本题正确答案为:2KCl+2H2O2KOH+Cl2↑+H2↑;
(3)化合物K中含有组成单质L的元素,化合物中Fe元素的质量分数为70%,则氧元素的质量分数为30%,所以化学式中铁原子与氧原子个数之比为70%/56:30%/16=2:3,所以化合物K为Fe2O3,铝与氧化铁反应生成氧化铝与铁,反应的化学方程式是 Fe2O3+2AlAl2O3+2Fe;把氧化铁和铝粉混合后,在混合物上加少量KClO3,插上Mg条并将其点燃,反应即可发生;
综上所述,本题正确答案为:Fe2O3+2AlAl2O3+2Fe;在混合物上加少量KClO3,插上Mg条并将其点燃;
(4)A为氧化铝,F为氢氧化钾;J为偏铝酸钾,氧化铝与氢氧化钾反应生成偏铝酸钾与水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
综上所述,本题正确答案为:Al2O3+2OH-=2AlO2-+H2O。
23. 2H2O+2e-=2OH-+H2↑ B 负 CH3OH-6e-+H2O=CO2↑+6H+ 阴 NaCl+H2ONaClO+H2↑
【分析】(1)电解氢氧化钾溶液根据放电顺序相当于电解水,根据电解池原理分析解答;
(2)根据燃料电池原理分析电极反应,根据电子转移守恒及1C=1A·S进行相关计算;
(3)根据次氯酸钠的制备原理及电解原理分析解答。
解析:(1)①该电解槽的阴极是氢离子得电子生成氢气,电极反应式是:2H2O+2e-=2OH-+H2↑,故答案为:2H2O+2e-=2OH-+H2↑;
②阳离子向阴极移动,右侧溶液为除去杂质的KOH溶液,则除去杂质后的氢氧化钾溶液从液体出口B导出,故答案为:B;
(2)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极上是CH3OH失去电子生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2↑+6H+;故答案为:负;CH3OH-6e-+H2O=CO2↑+6H+;
②甲醇燃料电池的正极反应为O2+4H++4e-=2H2O,因为甲醇燃料电池的能量转化率为 100%,n(O2)=,转移的电子数为:,1个电子所带的电量为 1.6×10-19C,根据1C=1A·S得:=,即NA=,故答案为:;
(3)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是84消毒液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极;总反应为:NaCl+H2ONaClO+H2↑;故答案为:阴;NaCl+H2ONaClO+H2↑
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
