化学人教版(2019)选择性必修1 1.1.1反应热(共56张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.1反应热(共56张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 08:48:47 | ||
图片预览






文档简介
(共56张PPT)
人教版(2019版) 化学
化学反应原理
第一章 化学反应的热效应
第一节 反应热
第1课时
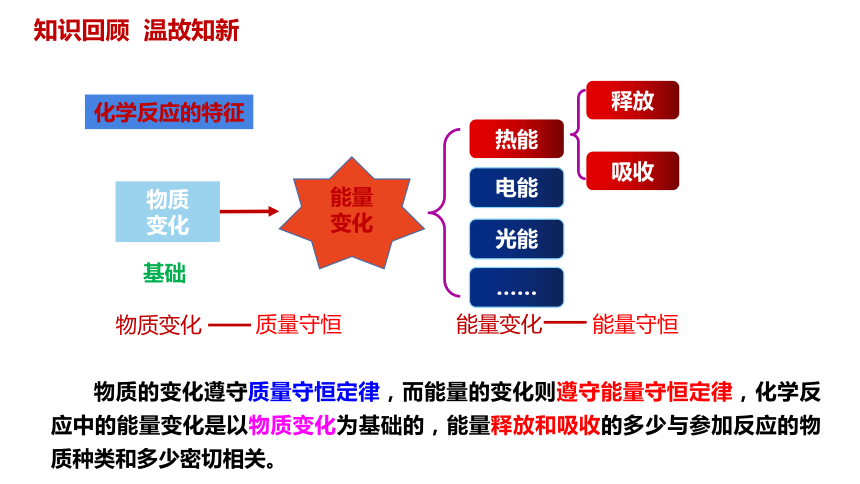
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
知识回顾 温故知新
物质变化
能量变化
质量守恒
能量守恒
物质的变化遵守质量守恒定律,而能量的变化则遵守能量守恒定律,化学反应中的能量变化是以物质变化为基础的,能量释放和吸收的多少与参加反应的物质种类和多少密切相关。
有下列反应:
①氧化钙与水反应 ②碳酸氢钠受热分解 ③硫酸与氢氧化钠溶液混合 ④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水
其中为吸热反应的是 ,放热反应的是 。
②⑥
①③④⑤
常见的吸热放热反应
常见的放热反应:
① 燃烧反应
② 中和反应
③ 大多数化合反应
④ 金属与酸/水反应
⑤铝热反应
①大多数分解反应
②盐的水解反应
③Ba(OH)2与NH4Cl反应
④ C、H2、CO为还原剂的氧化还原反应
常见的吸热反应:
小结
熟记
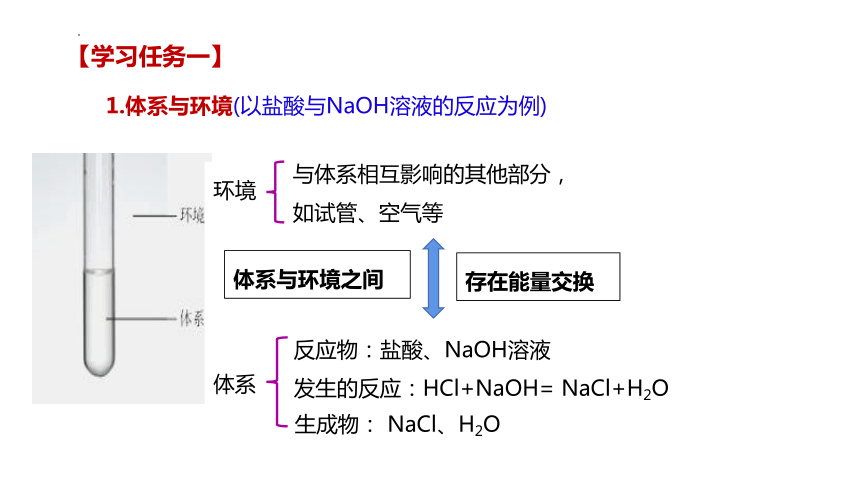
1.体系与环境(以盐酸与NaOH溶液的反应为例)
与体系相互影响的其他部分,
如试管、空气等
反应物:盐酸、NaOH溶液
发生的反应:HCl+NaOH= NaCl+H2O
生成物: NaCl、H2O
环境
体系
【学习任务一】
体系与环境之间
存在能量交换
2.体系与环境的热量交换——反应热
反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
【学习任务一】
测定方法:
测量仪器 测定原理
量热计
用温度计测量反应前后体系的温度变化,根据
有关物质的比热容等来计算反应热
3.反应热与焓变
【学习任务一】
符号:
单位:
在恒压的条件下的反应热
△H
焓变
kJ/mol或kJ·mol-1
焓增加—吸热反应(体系能量升高)
—表示为“ + ”或 ΔH>0
焓减少—放热反应(体系能量降低)
—表示为“- ”或 ΔH<0
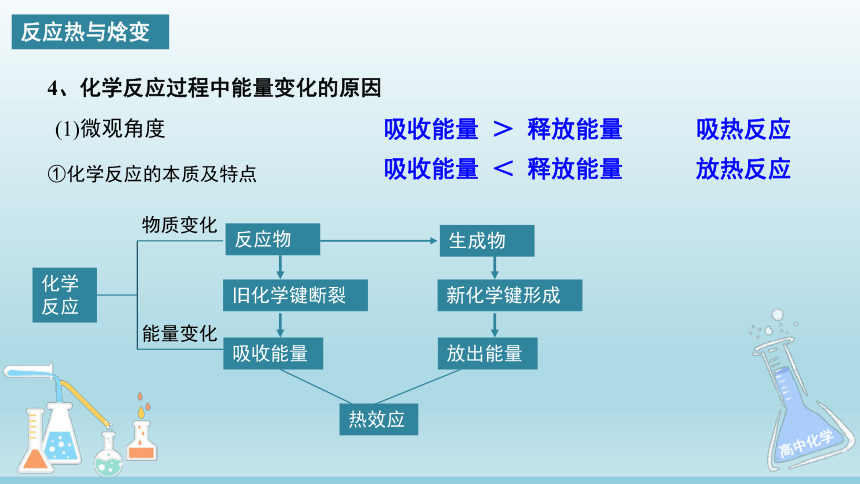
4、化学反应过程中能量变化的原因
(1)微观角度
①化学反应的本质及特点
化学反应
物质变化
能量变化
反应物
旧化学键断裂
吸收能量
生成物
新化学键形成
放出能量
热效应
反应热与焓变
吸收能量 > 释放能量 吸热反应
吸收能量 < 释放能量 放热反应
②举例(以H2(g)和Cl2(g)反应生成HCl(g)的能量转化为例)
反应热与焓变
旧键断裂 — 吸收能量
新键形成 — 放出能量
=
=
679kJ/mol
862 kJ/mol
H =
679kJ/mol - 862kJ/mol = -183kJ/mol
ΔH =
反应物总键能
生成物总键能
–
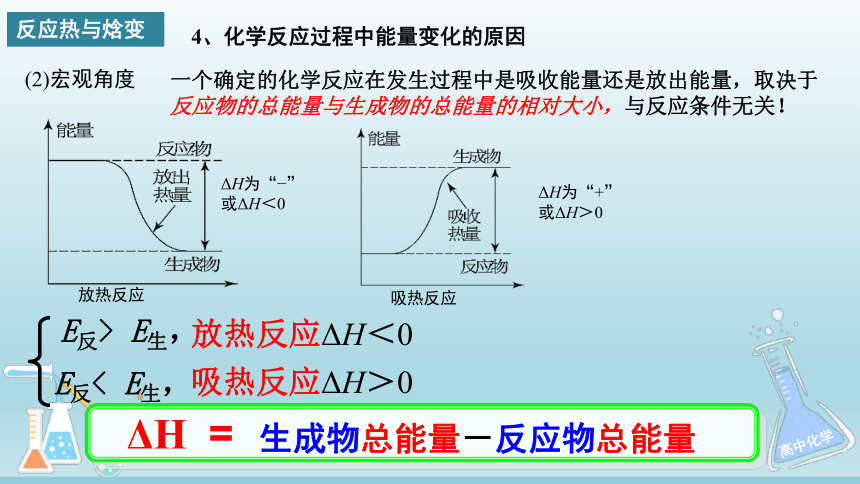
4、化学反应过程中能量变化的原因
(2)宏观角度
放热反应
ΔH为“ ”
或ΔH<0
吸热反应
ΔH为“+”
或ΔH>0
反应热与焓变
一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于
反应物的总能量与生成物的总能量的相对大小,与反应条件无关!
E反> E生,
E反< E生,
放热反应ΔH<0
吸热反应ΔH>0
ΔH =
生成物总能量-反应物总能量
例题1:已知 C(石墨,s)= C(金刚石,s)ΔH = +1.9kj/mol
判断石墨、金刚石哪个更稳定?
金刚石
石墨
物质能量、键能与稳定性的关系:
1.键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定
2.物质能量越低,物质越稳定
石墨更稳定
例题2:
①1molH2 与 1molCl2 反应生成2molHCl释放出184.6kJ的热量,则该反应的△H= 。
②1molC与 1mol水蒸气反应生成1molCO和1molH2 ,需要吸收131.5kJ的热量,则该反应的△H= 。
﹣184.6kJ/mol
+131.5kJ/mol
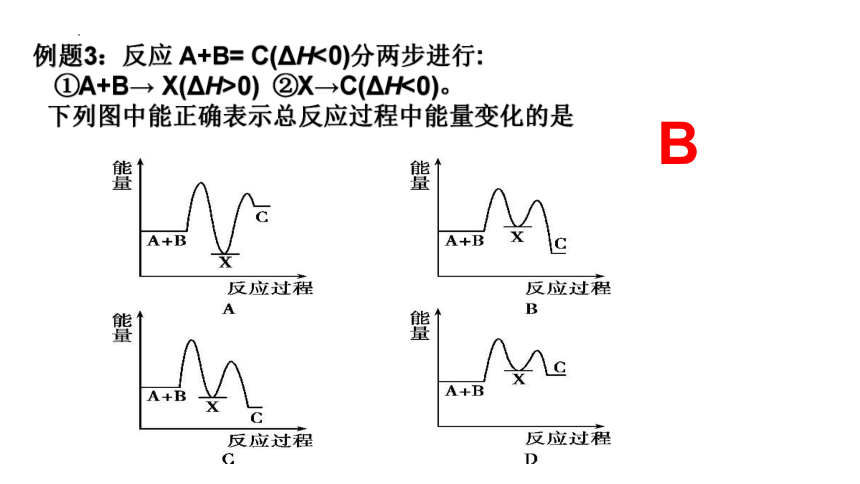
例题3:反应 A+B= C(ΔH<0)分两步进行:
①A+B→ X(ΔH>0) ②X→C(ΔH<0)。
下列图中能正确表示总反应过程中能量变化的是
B
小 结
反应物—— —— 。
生成物—— —— 。
旧键断裂
新键形成
吸热
放热
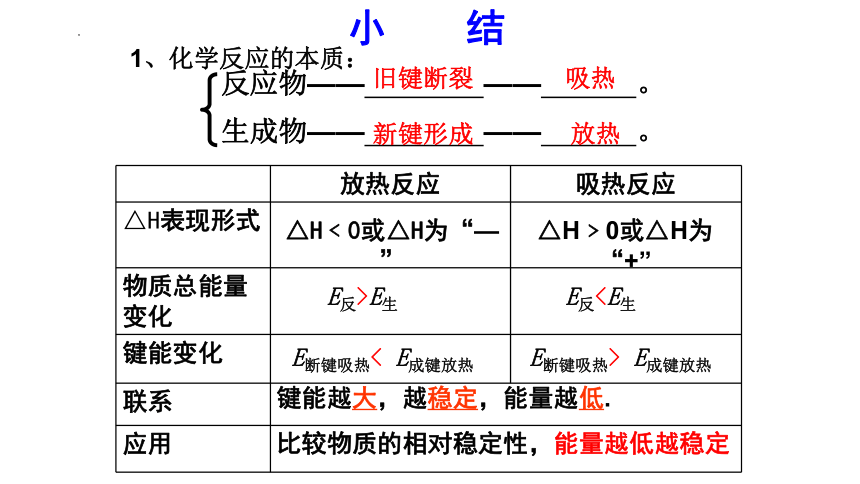
1、化学反应的本质:
放热反应 吸热反应
△H表现形式
物质总能量变化
键能变化
联系 应用 △H﹤0或△H为“—”
△H﹥0或△H为“+”
E反>E生
E反E断键吸热< E成键放热
E断键吸热> E成键放热
比较物质的相对稳定性,能量越低越稳定
键能越大,越稳定,能量越低.
从物质能量角度:
ΔH=生成物总能量-反应物总能量
从键能角度:
ΔH=反应物总键能-生成物总键能
2、如何计算一个化学反应的反应热?
1.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2个AB分子吸收(a-b)kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B
典题精练
2.已知H—H键键能(断裂时吸收或生成时释放的能量)为 436 kJ/mol,H—N键键能为391 kJ/mol,根据:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。则N≡N键的键能是( )
A.431 kJ/mol B.945.6 kJ/mol C.649 kJ/mol D.896 kJ/mol
B
3.单斜硫和正交硫是硫的两种同素异形体,下列说法正确的是( )A.S(s,单斜)===S(s,正交) ΔH3=-0.33 kJ·mol-1B.单斜硫比正交硫稳定C.相同物质的量的正交硫比单斜硫所含有的能量高D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJA4、氢气在氧气中燃烧产生蓝色火焰,已知破坏1 mol H-H键消耗的能量为Q1kJ,破坏1 mol O=O键消耗的能量为Q2kJ,形成1 mol H-O键释放的能量为Q3kJ。下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3
B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3
D. Q1 + Q2 = Q3
B
第二课时 热化学方程式
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
二、热化学方程式
H2(g) + I2 (g) ==== 2HI(g)
200℃
101kPa
ΔH =
-14.9 kJ/mol
表明反应所释放或吸收的热量的化学方程式.
含义:表示1mol气态H2与1mol气态 I2在200℃、101kPa的条件下完全反应,生成2mol气态HI时,放出14.9kJ的热量。
已知2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol ,向密闭容器中通入2molSO2(g)和1molO2(g)发生上述反应,达到平衡后放出的热量 (大于,等于或小于)197kJ。
小于
思考
交流
与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?
二、热化学方程式
二、热化学方程式
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
物质变化
能量变化
1、热化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”, 单位是kJ/mol
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
★kJ/mol的含义:
每mol反应的焓变
二、热化学方程式
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
2、热化学方程式需注明温度和压强,25℃ 101kPa(常温常压)可不注.
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
二、热化学方程式
3、热化学方程式需注明各物质的状态。
( 固体——s、液体——l、气体——g、溶液——aq)
注意:热化学方程式中不用“↑”和“↓”
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(l) △H=-285.8kJ/mol
1
2
对于同一物质,固态时能量最低,气态时能量最高。
冰s 水 l 水蒸气g
吸热
吸热
二、热化学方程式
4、热化学方程式中化学计量数仅表示参加反应的各物质的物质的量,可为整数或分数;
△H与系数对应成正比;
反应逆向进行,则△H数值不变,符号改变。
普通化学方程式中:宏观表示各物质的物质的量,微观表示原子分子数目,只能为整数,不能为分数。
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
2H2(g)+O2(g)==2H2O(g) △H=-483.6kJ/mol
2H2O(g) == 2H2(g)+O2(g) △H=
+483.6kJ/mol
书写热化学方程式的注意点:
1、△H写在右,吸热用“+”,放热用:“-”,单位是kJ/mol;
2、注温度和压强,25℃ 101kPa(常温常压)可不注
3、标聚集状态(s、l、g、aq)
4、化学计量数仅表示物质的量,可整数可分数
5、化学计量数与△H成正比;若反应逆向进行,则△H数值不变,但符号改变;
6、 一般不写反应条件。
例1:当1mol气态H2与1mol气态Cl2反应生成2 mol气态HCl,放出184.6 kJ的热量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) = 2HCl(g) H =-184.6 kJ/mol
2H2(g) + 2Cl2(g) = 4HCl(g) H =-369.2 kJ/mol
H2(g) + Cl2(g) = HCl(g) H =-92.3 kJ/mol
1
2
1
2
二、热化学方程式的书写步骤:
1、写方程
2、标状态
3、标△H(注意单位和+、-)
4、标温度和压强(常温常压可不注明)
2、1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则1mol C2H2完全燃烧放出的热量为 kJ;
写出C2H2燃烧的热化学方程式:
。
1294.8
随堂练习
1、1mol N2与适量O2 反应生成NO2 ,需吸收68kJ的热量;写出热化学方程式。
N2(g) + 2O2(g) = 2NO2 (g) H = + 68 kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=-1294.8KJ/mol
例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和水时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol
B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol
C
ΔH = – 445 kJ/mol
总结 判断热化学方程式正误“四看”:
一、方程是否配平
二、各物质的聚集状态是否正确
三、ΔH的单位和“+”“-”是否正确
四、反应热数值与计量数是否相对应。
例4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
A
总结:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
【例3】1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
S(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol
【例1】依据事实,写出下列反应的热化学方程式。
0.5mol Cu(s)与适量O2(g)反应生成CuO(s),放出78.65kJ的热量。
【例2】已知:(1)1 mol N2(g)中的化学键断裂时需要吸收946kJ的能量。(2)1 mol O2(g)中的化学键断裂时需要吸收498kJ的能量。(3)1 mol NO(g)中的化学键形成时要释放632kJ的能量。请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
例4、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = akJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0
C
比较热量大小时,只比较数值大小,无正负之分。
比较ΔH大小时要区分正负。ΔH >0 时,反应热数值越大,ΔH越大;ΔH <0时,反应热数值越大, ΔH越小。
由于反应的情况不同,反应热可分为燃烧热、中和热、溶解热等,其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一.燃烧热
CH4(g)+2O2 (g) =CO2 (g) +2H2O (l) ΔH= - 890.31kJ/mol
1.反应条件:
101 kPa,因为压强不同,反应热有所不同
2、可燃物物质的量:
1mol
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036KJ/mol
燃烧热△H=-5518KJ/mol
书写燃烧热的热化学方程式时,应以1mol可燃物为标准来配平其余物质的化学计量数(常出现分数)
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
一.燃烧热
3、反应程度:
完全燃烧,即被完全氧化。产物是稳定的氧化物,不能再继续燃烧。
C→CO2(g);H →H2O(l);
S→SO2(g);N→N2(g)
已知C燃烧的热化学方程式为:
C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则C的燃烧热为393.5 kJ/mol
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
一.燃烧热
4、燃烧热反应:
放热,ΔH<0,单位kJ/mol
用文字叙述时,不用考虑正负;若用“ΔH”表示,则为“负值”。如CH4的燃烧热为890.3 kJ·mol-1;
或ΔH=-890.3 kJ·mol-1。
怎样规范描述物质的燃烧热?
二.表示意义
CH4的燃烧热为890.31 kJ·mol-1表示什么含义?
表示:在25 ℃、101 kPa时, 1 mol CH4(g)完全燃烧生成CO2(g)和H2O(l)时放出890.31 kJ的热量。
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
例1、下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g) +1/2O2 (g) =CO2 (g) △H=-283.0 kJ/mol
B.C(s) +1/2O2 (g) =CO(g) △H=-110.5 kJ/mol
C.H2 (g) +1/2O2 (g)=H2 O(g) △H=-241.8 kJ/mol
D.2C8 H18 (l) +25O2 (g)=16CO2 (g)+18H2 O(l)
△H=-11036 kJ/mol
A
2.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);
△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l);
△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);
△H = -2b KJ/mol
D2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);
△H = b KJ/mol
A
5. 表示燃烧的热化学方程式和表示燃烧热的热化学方程式区别
例如,C8H18燃烧的热化学方程式为:
2C8H18(I)+25O2(g)=16CO2(g)+ 18H2O(I) ΔH=-11 036 kJ·mol-1,
表示其燃烧热的热化学方程式为:
C8H18(I)+ O2(g)=8CO2(g)+ 9H2O(I) ΔH=-5 518 kJ·mol-1。
区别在于表示燃烧热的热化学方程式必须是1mol纯物质完全燃烧反应
6. 一些物质的燃烧热:
名称 化学式 H/(kJ/mol) 名称 化学式 H/(kJ/mol)
石墨 C(s) 393.5 乙烷 C2H6(g) 1899.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
【练习】若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2时放热130 kJ。则乙炔燃烧的热化学方程式为:
C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l)
ΔH=-1300 kJ/mol
2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)
ΔH=-2600 kJ/mol
则表示乙炔燃烧热的热化学方程式为:
C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l)
ΔH=-1300 kJ/mol
[例题1]1.在101 kPa时,1 mol CH4 完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解析:1 mol CH4完全燃烧的热化学方程式为:
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.3 kJ/mol
即CH4的燃烧热为890.3 kJ/mol。
1 000 L CH4(标准状况)的物质的量为:n(CH4)= =44.6 mol,44.6 mol CH4 完全燃烧放出的热量为:44.6 mol×890.3 kJ/mol=3.97×104 kJ
三、燃烧热的计算及应用
[例题2]葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧化时所产生的热量。
解析:
根据题意,葡萄糖的燃烧热为2 800 kJ/mol,100 g葡萄糖的物质的量为: n(C6H12O6)==0.556 mol
1 mol C6H12O6完全燃烧放出2 800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为: 0.556 mol×2 800 kJ/mol=1 557 kJ
答案:100 g葡萄糖在人体中完全氧化时产生1 557 kJ的热量。
【练习3】已知下列两个热化学方程式:
2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ mol-1
C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ mol-1
(1)H2的燃烧热为______________,C3H8的燃烧热为_____________
(2)2 g H2和2 mol C3H8组成的混合气体完全燃烧放出的热量为____________
(3)现有H2和C3H8的混合气体5 mol,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____________
3:1
285.8 kJ mol-1
2 220 kJ mol-1
4725.8 kJ
燃烧热
二、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
2.中和热的表示: H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点:
Ⅰ、条件:稀溶液。
Ⅱ、反应物: (强)酸与(强)碱。
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ
容易混淆问题:
酸碱中和反应的热化学方程式≠中和热的热化学方程式
酸碱中和反应的热化学方程式
——水的系数可以是任意的!
中和热的热化学方程式
——水的系数必须是“1”
书写中和热的热化学方程式的时,应该以生成 1mol H2O 为标准来配平其余物质的化学计量数。
【归纳总结】:中和热与中和反应的反应热辨析
(3)有弱酸或弱碱参加的中和反应,其中和热的数值都小于57.3,这是因为反应时弱酸或弱碱发生电离需要吸收热量。
(1)中和热指中和反应每生成1 mol H2O时的反应热,与强酸、强碱的类别无关。
(2)任何中和反应的中和热都相同,但是不同的中和反应的反应热可能不同。
例1、下列反应的反应热是中和热的是( )
A、2NaOH(aq)+ H2SO4 (aq) = Na2SO4 (aq) + 2H2O(l)
△H =- 114.6kJ/mol
B、NaOH(aq)+1/2 H2SO4 (浓) = 1/2 Na2SO4 (aq) + H2O(l)
△H =- 60.3kJ/mol
C、NaOH(aq)+HAc (aq) = NaAc (aq) + H2O(l)
△H =- 47.3kJ/mol
D、NaOH(aq)+HNO3 (aq) = NaNO3 (aq) + H2O(l)
△H =- 57.3kJ/mol
D
例2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为 。
△H1> △H3 > △H2
燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化 ΔH 不 同 点 反应物的量
生成物的量
反应热 的含义
ΔH<0 , 单位 kJ/mol
放热反应
1mol纯物质
1mol水
1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热相同,均为57.3kJ/mol
不限量
不限
3. 中和反应热的测定
(2)反应后体系温度的测量。
打开杯盖,将量简中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温。
(3)重复上述步骤(1)至步骤(2)两次。
【1】实验步骤
(1)反应物温度的测量。
①用量简量取50mL0.50 mol/L盐酸,打开杯盖,例入量热计的内简中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50 mL0.55 moI/L NaOH溶液中,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
【2】实验数据处理
(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度
温度差
盐酸 NaOH溶液 t1/ ℃ t2/ ℃ (t2-t1)/ ℃
1
2
3
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1g·cm3,反应后生成的溶
液的比热容 c=4.18 J/(g·℃)。该实验中盐酸和NaOH反应发出的热量
为 ,中和热为 。
② 计算反应热:
已知:
V酸=V碱=50 mL ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g·℃)
Q = cm△t = C·(m1+m2) ·(t2- t1)
Q = (m1+m2) ·C·(t2- t1)
= (V酸ρ酸+V碱ρ碱)·c·(t2-t1)
=(50g + 50g)×4.18 J/(g·℃) ×(t2- t1) ℃
= 0.418(t2- t1)KJ
n(H20)=0.50mol/L ×0.05L=0.025mol
ΔH= =
-
0.418 (t2-t1)
0.025
kJ/mol
——
—
Q
n
实验 序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠溶液 1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.3 20.3 24.2
4 20.5 20.6 23.6
【解析】四次实验(t2-t1)的值分别是 3.15、
3.1、 3.9、 3.05,
第三次数据明显偏大,故存在误差而舍去,则最终取第1、2、4组三组实验的
平均值,为3.1,将其代入公式
计算即可。
-51.8 kJ·mol-1
假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据
如下:
依据该学生的实验数据计算,
该实验测得的中和热ΔH= (结果保留一位小数)。
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
【注意事项】
使用同一支温度计,测定一种溶液温度后温度计必须用水冲洗干净并用滤纸擦干
减少热量损失:量热过程中操作要快(将NaOH溶液迅速倒入量热计内筒,立即盖上杯盖);量热计杯盖上的孔不要太大,能正好使温度计和玻璃搅拌器通过即可;
操作规范、读数准确。
注意事项 ①防止热量散失的方法:
a.两个烧杯口要相平;b.在两个烧杯之间填充碎泡沫塑料或碎纸片;c.用玻璃搅拌器搅拌,而不能用金属棒(丝)搅拌;
②加过量碱液使酸完全反应,碱过量对中和热测定没有影响;
③数据处理时,相差较大的数据可能是偶然误差引起的,应舍去。
例1、50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一
种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的
中和热数值 (填偏大,偏小,无影响)
环形玻璃搅拌器
减少热量损失
偏小
不等
相等
因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关.
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
例1、50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
偏小
偏小
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
(6)己知在稀溶液中,H2SO4与NaOH发生中和反应生成
1 mol水时,放出57.3kJ的热量,写出该反应的热化学方程式: 。
NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3 kJ/mol
6、据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则表示甲醇燃烧热的热化学方程式
为 。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为 。
(3)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
CH3OH(l)+3/2O2(g)═CO2(g) + 2H2O(l) △H=-725.76 kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)= 2NH3(g)△H=-92kJ/mol
人教版(2019版) 化学
化学反应原理
第一章 化学反应的热效应
第一节 反应热
第1课时
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
知识回顾 温故知新
物质变化
能量变化
质量守恒
能量守恒
物质的变化遵守质量守恒定律,而能量的变化则遵守能量守恒定律,化学反应中的能量变化是以物质变化为基础的,能量释放和吸收的多少与参加反应的物质种类和多少密切相关。
有下列反应:
①氧化钙与水反应 ②碳酸氢钠受热分解 ③硫酸与氢氧化钠溶液混合 ④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水
其中为吸热反应的是 ,放热反应的是 。
②⑥
①③④⑤
常见的吸热放热反应
常见的放热反应:
① 燃烧反应
② 中和反应
③ 大多数化合反应
④ 金属与酸/水反应
⑤铝热反应
①大多数分解反应
②盐的水解反应
③Ba(OH)2与NH4Cl反应
④ C、H2、CO为还原剂的氧化还原反应
常见的吸热反应:
小结
熟记
1.体系与环境(以盐酸与NaOH溶液的反应为例)
与体系相互影响的其他部分,
如试管、空气等
反应物:盐酸、NaOH溶液
发生的反应:HCl+NaOH= NaCl+H2O
生成物: NaCl、H2O
环境
体系
【学习任务一】
体系与环境之间
存在能量交换
2.体系与环境的热量交换——反应热
反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
【学习任务一】
测定方法:
测量仪器 测定原理
量热计
用温度计测量反应前后体系的温度变化,根据
有关物质的比热容等来计算反应热
3.反应热与焓变
【学习任务一】
符号:
单位:
在恒压的条件下的反应热
△H
焓变
kJ/mol或kJ·mol-1
焓增加—吸热反应(体系能量升高)
—表示为“ + ”或 ΔH>0
焓减少—放热反应(体系能量降低)
—表示为“- ”或 ΔH<0
4、化学反应过程中能量变化的原因
(1)微观角度
①化学反应的本质及特点
化学反应
物质变化
能量变化
反应物
旧化学键断裂
吸收能量
生成物
新化学键形成
放出能量
热效应
反应热与焓变
吸收能量 > 释放能量 吸热反应
吸收能量 < 释放能量 放热反应
②举例(以H2(g)和Cl2(g)反应生成HCl(g)的能量转化为例)
反应热与焓变
旧键断裂 — 吸收能量
新键形成 — 放出能量
=
=
679kJ/mol
862 kJ/mol
H =
679kJ/mol - 862kJ/mol = -183kJ/mol
ΔH =
反应物总键能
生成物总键能
–
4、化学反应过程中能量变化的原因
(2)宏观角度
放热反应
ΔH为“ ”
或ΔH<0
吸热反应
ΔH为“+”
或ΔH>0
反应热与焓变
一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于
反应物的总能量与生成物的总能量的相对大小,与反应条件无关!
E反> E生,
E反< E生,
放热反应ΔH<0
吸热反应ΔH>0
ΔH =
生成物总能量-反应物总能量
例题1:已知 C(石墨,s)= C(金刚石,s)ΔH = +1.9kj/mol
判断石墨、金刚石哪个更稳定?
金刚石
石墨
物质能量、键能与稳定性的关系:
1.键能越大,破坏该化学键需要的能量越高,该化学键越难断裂,所以物质越稳定
2.物质能量越低,物质越稳定
石墨更稳定
例题2:
①1molH2 与 1molCl2 反应生成2molHCl释放出184.6kJ的热量,则该反应的△H= 。
②1molC与 1mol水蒸气反应生成1molCO和1molH2 ,需要吸收131.5kJ的热量,则该反应的△H= 。
﹣184.6kJ/mol
+131.5kJ/mol
例题3:反应 A+B= C(ΔH<0)分两步进行:
①A+B→ X(ΔH>0) ②X→C(ΔH<0)。
下列图中能正确表示总反应过程中能量变化的是
B
小 结
反应物—— —— 。
生成物—— —— 。
旧键断裂
新键形成
吸热
放热
1、化学反应的本质:
放热反应 吸热反应
△H表现形式
物质总能量变化
键能变化
联系 应用 △H﹤0或△H为“—”
△H﹥0或△H为“+”
E反>E生
E反
E断键吸热> E成键放热
比较物质的相对稳定性,能量越低越稳定
键能越大,越稳定,能量越低.
从物质能量角度:
ΔH=生成物总能量-反应物总能量
从键能角度:
ΔH=反应物总键能-生成物总键能
2、如何计算一个化学反应的反应热?
1.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,下列叙述中正确的是( )
A.每生成2个AB分子吸收(a-b)kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B
典题精练
2.已知H—H键键能(断裂时吸收或生成时释放的能量)为 436 kJ/mol,H—N键键能为391 kJ/mol,根据:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。则N≡N键的键能是( )
A.431 kJ/mol B.945.6 kJ/mol C.649 kJ/mol D.896 kJ/mol
B
3.单斜硫和正交硫是硫的两种同素异形体,下列说法正确的是( )A.S(s,单斜)===S(s,正交) ΔH3=-0.33 kJ·mol-1B.单斜硫比正交硫稳定C.相同物质的量的正交硫比单斜硫所含有的能量高D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJA4、氢气在氧气中燃烧产生蓝色火焰,已知破坏1 mol H-H键消耗的能量为Q1kJ,破坏1 mol O=O键消耗的能量为Q2kJ,形成1 mol H-O键释放的能量为Q3kJ。下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3
B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3
D. Q1 + Q2 = Q3
B
第二课时 热化学方程式
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
二、热化学方程式
H2(g) + I2 (g) ==== 2HI(g)
200℃
101kPa
ΔH =
-14.9 kJ/mol
表明反应所释放或吸收的热量的化学方程式.
含义:表示1mol气态H2与1mol气态 I2在200℃、101kPa的条件下完全反应,生成2mol气态HI时,放出14.9kJ的热量。
已知2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol ,向密闭容器中通入2molSO2(g)和1molO2(g)发生上述反应,达到平衡后放出的热量 (大于,等于或小于)197kJ。
小于
思考
交流
与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?
二、热化学方程式
二、热化学方程式
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
物质变化
能量变化
1、热化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”, 单位是kJ/mol
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
★kJ/mol的含义:
每mol反应的焓变
二、热化学方程式
H2(g)+I2(g)======2HI(g) △H=-14.9kJ/mol
200℃
101kPa
2、热化学方程式需注明温度和压强,25℃ 101kPa(常温常压)可不注.
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
二、热化学方程式
3、热化学方程式需注明各物质的状态。
( 固体——s、液体——l、气体——g、溶液——aq)
注意:热化学方程式中不用“↑”和“↓”
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(l) △H=-285.8kJ/mol
1
2
对于同一物质,固态时能量最低,气态时能量最高。
冰s 水 l 水蒸气g
吸热
吸热
二、热化学方程式
4、热化学方程式中化学计量数仅表示参加反应的各物质的物质的量,可为整数或分数;
△H与系数对应成正比;
反应逆向进行,则△H数值不变,符号改变。
普通化学方程式中:宏观表示各物质的物质的量,微观表示原子分子数目,只能为整数,不能为分数。
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
2H2(g)+O2(g)==2H2O(g) △H=-483.6kJ/mol
2H2O(g) == 2H2(g)+O2(g) △H=
+483.6kJ/mol
书写热化学方程式的注意点:
1、△H写在右,吸热用“+”,放热用:“-”,单位是kJ/mol;
2、注温度和压强,25℃ 101kPa(常温常压)可不注
3、标聚集状态(s、l、g、aq)
4、化学计量数仅表示物质的量,可整数可分数
5、化学计量数与△H成正比;若反应逆向进行,则△H数值不变,但符号改变;
6、 一般不写反应条件。
例1:当1mol气态H2与1mol气态Cl2反应生成2 mol气态HCl,放出184.6 kJ的热量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) = 2HCl(g) H =-184.6 kJ/mol
2H2(g) + 2Cl2(g) = 4HCl(g) H =-369.2 kJ/mol
H2(g) + Cl2(g) = HCl(g) H =-92.3 kJ/mol
1
2
1
2
二、热化学方程式的书写步骤:
1、写方程
2、标状态
3、标△H(注意单位和+、-)
4、标温度和压强(常温常压可不注明)
2、1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则1mol C2H2完全燃烧放出的热量为 kJ;
写出C2H2燃烧的热化学方程式:
。
1294.8
随堂练习
1、1mol N2与适量O2 反应生成NO2 ,需吸收68kJ的热量;写出热化学方程式。
N2(g) + 2O2(g) = 2NO2 (g) H = + 68 kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=-1294.8KJ/mol
例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和水时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol
B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol
C
ΔH = – 445 kJ/mol
总结 判断热化学方程式正误“四看”:
一、方程是否配平
二、各物质的聚集状态是否正确
三、ΔH的单位和“+”“-”是否正确
四、反应热数值与计量数是否相对应。
例4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
A
总结:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
【例3】1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
S(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol
【例1】依据事实,写出下列反应的热化学方程式。
0.5mol Cu(s)与适量O2(g)反应生成CuO(s),放出78.65kJ的热量。
【例2】已知:(1)1 mol N2(g)中的化学键断裂时需要吸收946kJ的能量。(2)1 mol O2(g)中的化学键断裂时需要吸收498kJ的能量。(3)1 mol NO(g)中的化学键形成时要释放632kJ的能量。请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
例4、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = akJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
C
比较热量大小时,只比较数值大小,无正负之分。
比较ΔH大小时要区分正负。ΔH >0 时,反应热数值越大,ΔH越大;ΔH <0时,反应热数值越大, ΔH越小。
由于反应的情况不同,反应热可分为燃烧热、中和热、溶解热等,其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一.燃烧热
CH4(g)+2O2 (g) =CO2 (g) +2H2O (l) ΔH= - 890.31kJ/mol
1.反应条件:
101 kPa,因为压强不同,反应热有所不同
2、可燃物物质的量:
1mol
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036KJ/mol
燃烧热△H=-5518KJ/mol
书写燃烧热的热化学方程式时,应以1mol可燃物为标准来配平其余物质的化学计量数(常出现分数)
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
一.燃烧热
3、反应程度:
完全燃烧,即被完全氧化。产物是稳定的氧化物,不能再继续燃烧。
C→CO2(g);H →H2O(l);
S→SO2(g);N→N2(g)
已知C燃烧的热化学方程式为:
C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则C的燃烧热为393.5 kJ/mol
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
一.燃烧热
4、燃烧热反应:
放热,ΔH<0,单位kJ/mol
用文字叙述时,不用考虑正负;若用“ΔH”表示,则为“负值”。如CH4的燃烧热为890.3 kJ·mol-1;
或ΔH=-890.3 kJ·mol-1。
怎样规范描述物质的燃烧热?
二.表示意义
CH4的燃烧热为890.31 kJ·mol-1表示什么含义?
表示:在25 ℃、101 kPa时, 1 mol CH4(g)完全燃烧生成CO2(g)和H2O(l)时放出890.31 kJ的热量。
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
例1、下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g) +1/2O2 (g) =CO2 (g) △H=-283.0 kJ/mol
B.C(s) +1/2O2 (g) =CO(g) △H=-110.5 kJ/mol
C.H2 (g) +1/2O2 (g)=H2 O(g) △H=-241.8 kJ/mol
D.2C8 H18 (l) +25O2 (g)=16CO2 (g)+18H2 O(l)
△H=-11036 kJ/mol
A
2.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);
△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l);
△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);
△H = -2b KJ/mol
D2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);
△H = b KJ/mol
A
5. 表示燃烧的热化学方程式和表示燃烧热的热化学方程式区别
例如,C8H18燃烧的热化学方程式为:
2C8H18(I)+25O2(g)=16CO2(g)+ 18H2O(I) ΔH=-11 036 kJ·mol-1,
表示其燃烧热的热化学方程式为:
C8H18(I)+ O2(g)=8CO2(g)+ 9H2O(I) ΔH=-5 518 kJ·mol-1。
区别在于表示燃烧热的热化学方程式必须是1mol纯物质完全燃烧反应
6. 一些物质的燃烧热:
名称 化学式 H/(kJ/mol) 名称 化学式 H/(kJ/mol)
石墨 C(s) 393.5 乙烷 C2H6(g) 1899.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
【练习】若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2时放热130 kJ。则乙炔燃烧的热化学方程式为:
C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l)
ΔH=-1300 kJ/mol
2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)
ΔH=-2600 kJ/mol
则表示乙炔燃烧热的热化学方程式为:
C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l)
ΔH=-1300 kJ/mol
[例题1]1.在101 kPa时,1 mol CH4 完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解析:1 mol CH4完全燃烧的热化学方程式为:
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.3 kJ/mol
即CH4的燃烧热为890.3 kJ/mol。
1 000 L CH4(标准状况)的物质的量为:n(CH4)= =44.6 mol,44.6 mol CH4 完全燃烧放出的热量为:44.6 mol×890.3 kJ/mol=3.97×104 kJ
三、燃烧热的计算及应用
[例题2]葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧化时所产生的热量。
解析:
根据题意,葡萄糖的燃烧热为2 800 kJ/mol,100 g葡萄糖的物质的量为: n(C6H12O6)==0.556 mol
1 mol C6H12O6完全燃烧放出2 800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为: 0.556 mol×2 800 kJ/mol=1 557 kJ
答案:100 g葡萄糖在人体中完全氧化时产生1 557 kJ的热量。
【练习3】已知下列两个热化学方程式:
2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ mol-1
C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ mol-1
(1)H2的燃烧热为______________,C3H8的燃烧热为_____________
(2)2 g H2和2 mol C3H8组成的混合气体完全燃烧放出的热量为____________
(3)现有H2和C3H8的混合气体5 mol,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____________
3:1
285.8 kJ mol-1
2 220 kJ mol-1
4725.8 kJ
燃烧热
二、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
2.中和热的表示: H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点:
Ⅰ、条件:稀溶液。
Ⅱ、反应物: (强)酸与(强)碱。
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ
容易混淆问题:
酸碱中和反应的热化学方程式≠中和热的热化学方程式
酸碱中和反应的热化学方程式
——水的系数可以是任意的!
中和热的热化学方程式
——水的系数必须是“1”
书写中和热的热化学方程式的时,应该以生成 1mol H2O 为标准来配平其余物质的化学计量数。
【归纳总结】:中和热与中和反应的反应热辨析
(3)有弱酸或弱碱参加的中和反应,其中和热的数值都小于57.3,这是因为反应时弱酸或弱碱发生电离需要吸收热量。
(1)中和热指中和反应每生成1 mol H2O时的反应热,与强酸、强碱的类别无关。
(2)任何中和反应的中和热都相同,但是不同的中和反应的反应热可能不同。
例1、下列反应的反应热是中和热的是( )
A、2NaOH(aq)+ H2SO4 (aq) = Na2SO4 (aq) + 2H2O(l)
△H =- 114.6kJ/mol
B、NaOH(aq)+1/2 H2SO4 (浓) = 1/2 Na2SO4 (aq) + H2O(l)
△H =- 60.3kJ/mol
C、NaOH(aq)+HAc (aq) = NaAc (aq) + H2O(l)
△H =- 47.3kJ/mol
D、NaOH(aq)+HNO3 (aq) = NaNO3 (aq) + H2O(l)
△H =- 57.3kJ/mol
D
例2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为 。
△H1> △H3 > △H2
燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化 ΔH 不 同 点 反应物的量
生成物的量
反应热 的含义
ΔH<0 , 单位 kJ/mol
放热反应
1mol纯物质
1mol水
1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热相同,均为57.3kJ/mol
不限量
不限
3. 中和反应热的测定
(2)反应后体系温度的测量。
打开杯盖,将量简中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温。
(3)重复上述步骤(1)至步骤(2)两次。
【1】实验步骤
(1)反应物温度的测量。
①用量简量取50mL0.50 mol/L盐酸,打开杯盖,例入量热计的内简中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50 mL0.55 moI/L NaOH溶液中,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
【2】实验数据处理
(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度
温度差
盐酸 NaOH溶液 t1/ ℃ t2/ ℃ (t2-t1)/ ℃
1
2
3
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1g·cm3,反应后生成的溶
液的比热容 c=4.18 J/(g·℃)。该实验中盐酸和NaOH反应发出的热量
为 ,中和热为 。
② 计算反应热:
已知:
V酸=V碱=50 mL ρ酸=ρ碱=1 g/cm3 c=4.18 J/(g·℃)
Q = cm△t = C·(m1+m2) ·(t2- t1)
Q = (m1+m2) ·C·(t2- t1)
= (V酸ρ酸+V碱ρ碱)·c·(t2-t1)
=(50g + 50g)×4.18 J/(g·℃) ×(t2- t1) ℃
= 0.418(t2- t1)KJ
n(H20)=0.50mol/L ×0.05L=0.025mol
ΔH= =
-
0.418 (t2-t1)
0.025
kJ/mol
——
—
Q
n
实验 序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠溶液 1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.3 20.3 24.2
4 20.5 20.6 23.6
【解析】四次实验(t2-t1)的值分别是 3.15、
3.1、 3.9、 3.05,
第三次数据明显偏大,故存在误差而舍去,则最终取第1、2、4组三组实验的
平均值,为3.1,将其代入公式
计算即可。
-51.8 kJ·mol-1
假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据
如下:
依据该学生的实验数据计算,
该实验测得的中和热ΔH= (结果保留一位小数)。
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
【注意事项】
使用同一支温度计,测定一种溶液温度后温度计必须用水冲洗干净并用滤纸擦干
减少热量损失:量热过程中操作要快(将NaOH溶液迅速倒入量热计内筒,立即盖上杯盖);量热计杯盖上的孔不要太大,能正好使温度计和玻璃搅拌器通过即可;
操作规范、读数准确。
注意事项 ①防止热量散失的方法:
a.两个烧杯口要相平;b.在两个烧杯之间填充碎泡沫塑料或碎纸片;c.用玻璃搅拌器搅拌,而不能用金属棒(丝)搅拌;
②加过量碱液使酸完全反应,碱过量对中和热测定没有影响;
③数据处理时,相差较大的数据可能是偶然误差引起的,应舍去。
例1、50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一
种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的
中和热数值 (填偏大,偏小,无影响)
环形玻璃搅拌器
减少热量损失
偏小
不等
相等
因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关.
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
例1、50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
偏小
偏小
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
(6)己知在稀溶液中,H2SO4与NaOH发生中和反应生成
1 mol水时,放出57.3kJ的热量,写出该反应的热化学方程式: 。
NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3 kJ/mol
6、据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则表示甲醇燃烧热的热化学方程式
为 。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为 。
(3)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
CH3OH(l)+3/2O2(g)═CO2(g) + 2H2O(l) △H=-725.76 kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)= 2NH3(g)△H=-92kJ/mol
