第一章:化学反应与能量转化同步习题(含解析)2023-2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章:化学反应与能量转化同步习题(含解析)2023-2024学年上学期高二化学鲁科版(2019)选择性必修1 | 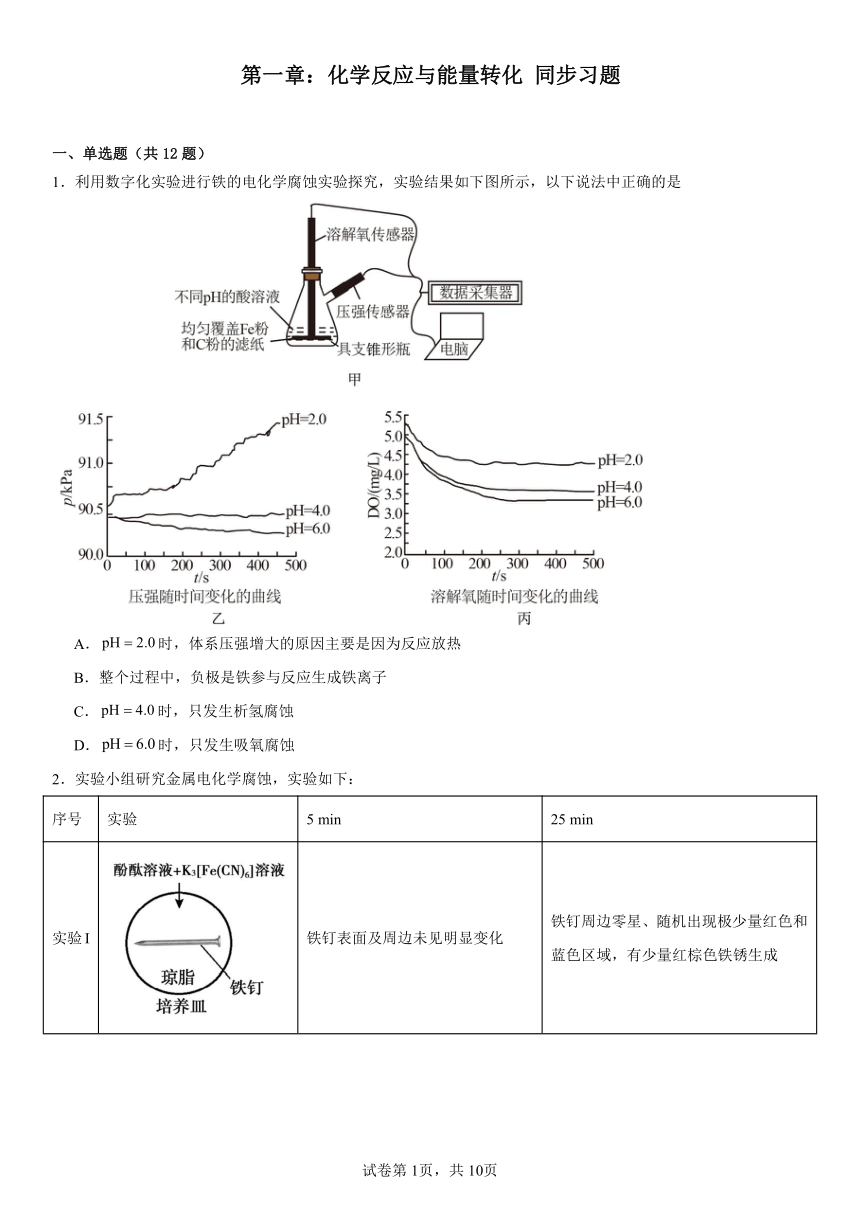 | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 12:47:30 | ||
图片预览



文档简介
第一章:化学反应与能量转化 同步习题
一、单选题(共12题)
1.利用数字化实验进行铁的电化学腐蚀实验探究,实验结果如下图所示,以下说法中正确的是
A.时,体系压强增大的原因主要是因为反应放热
B.整个过程中,负极是铁参与反应生成铁离子
C.时,只发生析氢腐蚀
D.时,只发生吸氧腐蚀
2.实验小组研究金属电化学腐蚀,实验如下:
序号 实验 5 min 25 min
实验I 铁钉表面及周边未见明显变化 铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成
实验Ⅱ 铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化 铁钉周边红色加深,区域变大,未见蓝色出现, 锌片周边未见明显变化
下列说法不正确的是
A.实验I生成铁锈说明铁钉发生了吸氧腐蚀
B.对比实验I,实验Ⅱ中铁钉在5 min即出现红色,说明锌片加速了铁的腐蚀速率
C.实验Ⅱ中正极的电极反应式: O2+ 2H2O+4e- = 4OH-
D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色
3.石墨在一定条件下转化为金刚石,其能量变化如图所示,其中△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是
A.金刚石的稳定性强于石墨的
B.石墨转化为金刚石属于物理变化
C.1 mol金刚石的能量大于1 mol CO2的能量
D.1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
4.下列实验的反应原理用离子方程式表示正确的是
A.少量通入溶液中:
B.用惰性电极电解氯化镁溶液:
C.向溶液中加入足量Ba(OH)2溶液:
D.用双氧水和稀硫酸处理铜印刷电路板:
5.我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是
A.H+在电解质溶液中从右向左定向移动
B.乙中电极上发生氧化反应,溶液进入甲中将H2S转化为S
C.丙中发生的电极反应为-2e-+2H+=
D.丁中在催化剂表面发生电化学反应生成 H4[SiW12O40] 和H2
6.周期表中ⅥA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;是一种易燃的有毒气体(燃烧热为),可制取各种硫化物:硫酸、硫酸盐是重要化工原料;硫酰氯()是重要的化工试剂,常作氯化剂或氯磺化剂。硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含)为原料回收,以电解强碱性,溶液制备。下列化学反应表示正确的是
A.遇水强烈水解生成两种强酸:
B.和浓硫酸反应:
C.电解强碱性溶液的阴极反应:
D.的燃烧:
7.已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
下列说法错误的是
A.CH3OH(l)的燃烧热为726 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,CH3OH(l)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) △H≠-57.3 kJ·mol-1
D.2 mol H2(g)和1 mol O2(g)的总能量大于2 mol H2O(l)的总能量
8.下列我国科技成果所涉及物质的应用中,具体操作或过程不涉及化学变化的是
A.利用阳光将二氧化碳转化为淀粉
B.利用模拟月壤研究从钛铁矿(FeTiO3) 中提取铁
C.利用雷达探测巡视表面土壤厚度、冰层结构
D.利用深海锂电池为“奋斗者”号控制系统提供电能
9.已知某化学反应,其反应过程中体系的能量变化如图所示,则下列说法正确的是
A.该反应的热效应为
B.图中A…B…C过渡态存在是因为使用了催化剂
C.为正反应的活化能
D.该反应中,反应物的键能总和等于
10.新型镁 锂双离子二次电池的工作原理如图。已知:氧化性Mg2+ > Li+。下列关于该电池的说法正确的是
A.放电时,Li+通过离子交换膜向左移动
B.放电时,正极的电极反应式为:Li1-x FePO4 +xLi+ xe-= LiFePO4
C.充电时,左侧电极的电势高于右侧电极的电势
D.充电时,导线中每通过0.4 mol e-,左室中溶液的质量减少2 g
11.近日报道的表面锂掺杂的锡(s-SnLi)催化剂通过电化学法将转化为甲酸盐,同时产生电能,工作原理如图所示。下列说法正确的是
A.放电时,Zn电极周围pH升高
B.放电时,每生成,转移个电子
C.充电时,阳极反应式为
D.充电时,向Zn电极迁移
12.一种光照充电电池工作原理如下图所示,光照时,光催化电极产生电子和空穴,对电池进行充电。下列说法正确的是。
A.该电池交换膜为交换膜
B.电池的总反应:
C.放电时,正极反应:
D.充电时阳极反应:
二、填空题(共9题)
13.回答下列问题:
(1)丙烷(C3H8)热值较高,污染较小,是一种优良的气态燃料。如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,写出表示丙烷燃烧热的热化学方程式: 。
(2)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H= 。
(3)已知25℃、101kpa时,一些物质的燃烧热为:
化学式 CO(g) H2(g) CH3OH(l)
△H/(kJ/mol) -283.0 -285.8 -726.5
完成CO和H2生成CH3OH的热化学方程式 。
(4)已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为 kJ mol-1。
14.(1)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷(或氢气、一氧化碳等可燃性气体)和氧气构成燃料电池,则通入甲烷气体的一极是原电池的 极,该极的电极反应式是 ,电池工作时的总反应的离子方程式是 。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极气体,空气与CO2的混合气体为正极气体,制得650 ℃下工作的燃料电池,完成下列反应式:
正极: ,
负极:2CO+2CO32--4e-=4CO2。
总反应: 。
(3)铅蓄电池放电时,总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,由此可以判断:
①原电池的电极材料:负极: 。
②电极反应式:正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,负极反应式为 。
③工作后,铅蓄电池里电解质溶液的pH (填“变大”“变小”或“不变”),理由是 。
15.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)在中和热测定实验中,用醋酸代替盐酸进行实验,测得的 (填“偏大”或“偏小”),产生偏差的原因是 。
(2)相同条件下,石墨比金刚石更稳定,则 0(填“>”或“<”)。
(3)实验测得,完全燃烧生成和时放热23 kJ。该状态下燃烧热的热化学方程式为 。
(4)已知在298.15 K、100 kPa条件下, 。
①结合表格数据计算a= 。
化学键
键能 a 391 436
②、和的比热容分别为29.1、28.9和。一定压强下反应中,反应物[]、生成物[]的能量随温度T的变化示意图合理的是 (填标号)。
A. B.
C. D.
16.依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
(3)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) H=+67.7kJ mol-1;
N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1;
H2O(l)=H2O(g) H=+44.0kJ mol-1;
则N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH= 。
请写出N2H4和NO2反应生成氮气和水蒸气的热化学方程式: 。
17.为了避免对海洋氮循环系统产生影响,含氮废水需经处理后排放。如图是用间接氧化法去除工业废水中氨态氮()的示意图。
(1)结合电极反应式简述间接氧化法去除氨态氮的原理: 。
(2)若生成和的物质的量之比为3:1,则处理后废酸性氨氮废水的将 (填“增大”“不变”或“减小”),请简述原因: 。
18.认真观察图中装置,回答下列问题:
(1)下列说法中正确的是 (填序号)。
a.甲中铜片质量减少 b.乙中锌片质量减少
c.乙中铜片上没有明显变化 d.甲装置为原电池,乙装置为电解池
(2)同等条件下,两烧杯中产生气泡的速率:甲 (填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为 (正极或负极),写出铜极的反应电极方程式 。
(4)当甲中产生2.24 L(标准状况)气体时,理论上通过导线的电子数目为 mol。
19.通过下列反应均可获取氢气。
①太阳光催化分解水制氢气:
②焦炭与水反应制氢气:
③甲烷与水反应制氢气:
(1)反应①中主要能量转化形式为 能转化为 能。
(2)从能量转化角度分析,反应②为 反应。
(3)反应③如果使用催化剂, (填“增大”“减小”或“不变”)。
(4)反应的 。
20.根据所给信息及要求填空。
(1)已知CH3OH(l)的燃烧热ΔH1,CH3OH(l)+O2(g)=CO2(g)+2H2(g) ΔH2,则ΔH2 ΔH1(填“>”、“<”或“=”)。
(2)1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热量,写出甲烷燃烧热的热化学方程式: 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为 。
(4)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=xkJ mol-1
已知:碳的燃烧热 ΔH1=akJ mol-1
S(s)+2K(s)=K2S(s) ΔH2=bkJ mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=ckJ mol-1,则x为 kJ/mol。
21.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)制作冷敷袋可利用 (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”为生活带来便利,它可利用下面________(填字母)反应放热加热食物。
A.浓硫酸和水 B.生石灰和水 C.纯碱和水 D.食盐和白醋
(3)已知:与足量充分燃烧生成液态水时放出热量。
①该反应的能量变化可用图中的 (填字母)表示。
②写出燃烧生成液态水的热化学反应方程式 。
③关于热化学方程式:的说法正确的是 。
A.热化学方程式中化学计量数表示分子数 B.该反应大于零
C.该反应的 D.该反应可表示水分解时的热效应
(4)神舟系列火箭用偏二甲肼作燃料,作氧化剂,反应后产物无污染。
已知:反应1:
反应2:
写出和反应生成、、的热化学方程式:
(5)已知某金属氧化物催化丙烷脱氢过程中,部分反应进程如图,则过程中的焓变为 (列式表示)。
(6)已知,在和下,部分化学键的键能数据如表所示。
化学键
键能/() 436 391 a 498 414 803 462 193
①在和下,工业合成氨,每生成就会放出热量,在该条件下,向某容器中加入、及合适的催化剂,充分反应后测得其放出的热量小于,原因可能是 ,表中的 。
②科学家发现一种新的气态分子( )。在和下转化为的热化学方程式为 。由此可知,与中更稳定的是 (填化学式)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,故A错误;
B.锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作原电池的负极,发生氧化反应,电极反应式为,故B错误;
C.若时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降,而图中时,锥形瓶内的压强几乎不变,说明除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,故C错误;
D.由图可知,时,锥形瓶内的溶解氧减少,说明有消耗氧气的吸氧腐蚀发生;同时锥形瓶内的气压也减小,说明没有产生氢气的析氢腐蚀发生,故D正确;
故选D。
2.B
【详解】A.实验I出现极少量红色说明有OH-生成,Fe失去电子生成Fe2+,K3[Fe(CN)6]溶液与Fe2+发生反应生成特征蓝色沉淀,则铁钉发生了吸氧腐蚀,A正确;
B.实验II中Zn比Fe活泼,作原电池的负极,发生吸氧腐蚀生成OH-,Fe作正极,被保护,铁的腐蚀速率比实验I慢,B错误;
C.实验II中Fe作正极,氧气发生得电子的还原反应,其电极反应式:O2 + 2H2O + 4e- =4OH-,C正确;
D.若将Zn片换成Cu片,因为Fe比Cu活泼,推测Cu片周边氧气发生得电子的还原反应生成氢氧根离子,酚酞溶液会出现红色,铁钉作原电池的负极,发生失电子的氧化反应生成亚铁离子,与K3[Fe(CN)6]溶液反应,使其周边会出现蓝色,D正确;
故选:B。
3.D
【详解】A.石墨能量低,则石墨比金刚石稳定,故A错误;
B.石墨和金刚石为两种不同单质,二者转化为化学变化,故B错误;
C.放热反应中反应物的总能量大于生成物的总能量,即1mol金刚石和1mol氧气的总能量大于1molCO2的能量,而1mol金刚石的能量与1molCO2的能量大小无法比较,故C错误;
D.由图可知,△E2-△E1=1.9kJ,即石墨转化为金刚石吸收能量,则1mol石墨完全转化为金刚石需吸收1.9kJ热量,故D正确;
故选:D
4.D
【详解】A.SO2少量无法生成CO2,离子方程式应为SO2+2CO+H2O=SO+2HCO,A错误;
B.电解氯化镁溶液时阴极产生的氢氧根会和镁离子生成沉淀,离子方程式为Mg2++2Cl-+2H2OCl2↑+H2↑+Mg(OH)2↓,B错误;
C.Ba(OH)2足量,最终会得到偏铝酸根,正确离子方程式为Al3++2SO+2Ba2++4OH-=2BaSO4↓+AlO+2H2O,C错误;
D.双氧水在酸性环境中会将Cu氧化为Cu2+,选项所给离子方程式无误,D正确;
综上所述答案为D。
5.B
【分析】由图可知:H2S在甲区中与Fe3+发生氧化反应生成S单质,反应为2Fe3++H2S=2Fe2++2H++S↓,乙区Fe2+发生失电子的氧化反应转化为Fe3+,所以乙区为阳极区,丙区为阴极区,H4[SiW12O40]得电子生成H6[SiW12O40],电极反应为:H4[SiW12O40]+2e- +2H+=H6[SiW12O40];丁区H6[SiW12O40]在催化剂表面发生分解反应生成H4[SiW12O40]和H2,结合电子守恒进行计算,据此分析解答。
【详解】A.在理论上甲区每生成1 mol S时,转移2 mol电子,由于电子和质子电荷数相等,又乙区为阳极区,丙区为阴极区,所以H+由质子交换膜左侧向右侧移动的物质的量为2 mol,A错误;
B.乙区Fe2+发生失电子的氧化反应转化为Fe3+,在甲装置中Fe3+与H2S发生氧化还原反应为:2Fe3++H2S=2Fe2++2H++S↓,B正确;
C.丙区为阴极区,H4[SiW12O40]得电子生成H6[SiW12O40],电极反应为:H4[SiW12O40]+2e- +2H+=H6[SiW12O40],C错误;
D.丁区H6[SiW12O40]在催化剂表面发生分解反应生成H4[SiW12O40]和H2,没有发生电化学反应,D错误;
故合理选项是B。
6.D
【详解】A.反应生成硫酸与盐酸,故不应该出现亚硫酸根,应该为硫酸根,,故A错误;
B.浓硫酸具有强氧化性,可以氧化Se2-,,故B错误;
C.强碱性环境,反应物中不应该出现氢离子,,故C错误;
D.革命剧题意可知燃烧热为,燃烧的热化学方程式为:,故D正确;
故答案为D。
7.B
【详解】A.由2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol-1可知,1mol CH3OH(l)完全燃烧生成1mol CO2(g)和2molH2O(l)时放出的热量为:kJ=726 kJ,则CH3OH(l)的燃烧热为726 kJ·mol-1,故A正确;
B.设H2(g)和CH3OH(l)的质量均为32g,则H2(g)和CH3OH(l)的物质的量分别为:16mol、1mol,由热化学方程式可知,H2(g)和CH3OH(l)完全燃烧放出的热量分别为:4572.8kJ、726 kJ,则同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故B错误;
C.因硫酸根离子和钡离子反应生成硫酸钡沉淀时也有热量放出,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) △H≠-57.3 kJ·mol-1,故C正确;
D.由2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1可知,该反应为放热反应,则2 mol H2(g)和1 mol O2(g)的总能量大于2 mol H2O(l)的总能量,故D正确;
答案选B。
8.C
【详解】A.利用阳光将废二氧化碳转化为淀粉的过程中产生新物质, 是化学变化,A不符合题意;
B.利用模拟月壤研究从钛铁矿(FeTiO3)中提取铁的过程中有新物质生成,是化学变化,B不符合题意;
C.利用雷达探测巡视表面土壤厚度、冰层结构过程中没有产生新物质,属于物理变化,C符合题意;
D.利用深海锂电池为“奋斗者”号控制系统提供电能,属于原电池原理,是化学变化,D不符合题意;
故选C。
9.A
【详解】A.由图可知:该反应的热效应为,故A正确;
B.不使用催化剂的反应也可能存在过渡态,故B错误;
C..E1为正反应的活化能,E2为逆反应活化能,故C错误;
D.键能是气态分子中1 mol化学键离解变到气态原子吸收的能量,过渡态中化学键并没有完全离解,所以反应物的键能总和不等于,故D错误;
故答案:A。
10.D
【分析】新型镁 锂双离子二次电池,放电时,Mg失去电子变为镁离子即左边为负极,右边Fe化合价降低得到电子即为正极,充电时,左边电极为阴极,右边电极为阳极,据此答题。
【详解】A.放电时作为原电池,左边为负极,右边为正极,Li+通过离子交换膜向正极即向右移动,A项错误;
B.放电时作为原电池,正极的电极反应式为: Li1-x FePO4 +xLi++xe-= LiFePO4,B项错误;
C.充电时作为电解池,氧化性Mg2+ > Li+,则Mg为阴极与电源负极相连,左侧电极的电势低于右侧电极的电势,C项错误;
D.充电时,Mg为阴极,阴极是Mg2++2e-=Mg,溶液中Li+向阴极即左室移动,导线上每通过0.4 mol e-,则有0.2mol Mg2+消耗,有0.4mol Li+移向左室,左室中溶液的质量减少0.2mol×24g mol 1-0.4mol×7g mol 1=2 g,D项正确;
答案选D。
11.D
【详解】A.放电时,Zn电极的反应为,氢氧根离子浓度减少,pH减小,A错误;
B.放电时,装置右侧的电极反应为,生成1molHCOO-,转移的电子量为2mol,B错误;
C.充电时,阳极反应式为,C错误;
D.充电时,锌离子是阳离子,向负极锌电极移动,D正确。
故选D。
12.D
【分析】由图可知,放电时,锂发生氧化反应生成锂离子,锂为负极,则光催化电极为正极;
【详解】A.该电池交换膜在充放电时要能顺利通过阳离子锂离子的迁移,故为阳离子交换膜,A错误;
B.由分析可知,放电时锂发生氧化反应生成锂离子,氧气得到电子发生还原反应与迁移过来的锂离子生成Li2O2;充电时发生相反的反应,故总反应为:,B错误;
C.放电时,光催化电极为正极,氧气得到电子发生还原反应生成Li2O2,反应为,C错误;
D.光照时,光催化电极产生电子和空穴,对电池进行充电;充电时光催化电极为阳极,Li2O2发生氧化反应生成锂离子和氧气,阳极反应:,D正确;
故选D。
13.(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H1=-2215.0kJ/mol
(2)△H=227kJ/mol
(3)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ mol-1
(4)-(5x-0.5y)
【解析】(1)
由图可知,反应物总能量大于生成物总能量,该反应为放热反应;一定量丙烷完全燃烧生成CO2和1molH2O(l),放出热量为553.75kJ,所以1molC3H8(g)完全燃烧,生成4mol H2O(l)时,放出的热量为4×553.75kJ=2215.0kJ,表示丙烷燃烧热的热化学方程式:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H1=-2215.0kJ/mol;
(2)
①C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,①×2+②×-③×可得:2C(s,石墨)+H2(g)= C2H2(g) △H=2△H1+△H2- △H3=2×(-393)+ ×(-572)- ×(-2598)= 227kJ/mol;
(3)
一氧化碳燃烧的热化学方程式:①CO(g)+ O2(g)=CO2(g) △H1=-283.0kJ·mol-1
氢气燃烧的热化学方程式:②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
甲醇燃烧的热化学方程式:③CH3OH(l) +O2(g)=CO2(g)+2H2O(l) △H3=-726.5kJ·mol-1
根据盖斯定律:①+②-③可得:CO(g)+2H2(g)=CH3OH(l) △H=-283.0+(-571.6)-( -726.5)=-128.1kJ mol-1;
(4)
3.6g碳的物质的量为=0.3mol,6.4g氧气的物质的量为=0.2mol;根据氧气不足:2C+O22CO,氧气足量:C+O2CO2分析,n(C):n(O2)=3:2,介于2:1与1:1之间,上述反应都发生;设生成CO为xmol,CO2为ymol;根据碳元素守恒:x+y=0.3,根据氧元素守恒:x+2y=0.2×2,联立方程解得x=0.2mol,y=0.1mol;单质碳的燃烧热为ykJ/mol,所以生成0.1molCO2放出热量为0.1ykJ,生成0.2molCO放出的热量为x kJ-0.1ykJ,由于碳燃烧为放热反应,所以△H的符号为“-”,故1molC与氧气反应生成CO的反应热△H=-=-(5x-0.5y) kJ·mol-1。
14. 负极 CH4-8e-+10OH-=CO32-+7H2O CH4+2O2+2OH-=CO32-+3H2O O2+2CO2+4e-=2CO32- 2CO+O22CO2 Pb Pb-2e-+SO42-=PbSO4 变大 铅蓄电池在放电过程中消耗了H2SO4
【分析】(1)甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,在得失电子相等的条件下,将电极反应式相加即得电池反应式;
(2)该燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,在得失电子相同条件下将正负极电极反应式相加即可得电池反应式,据此分析解答;
(3)在原电池中得电子化合价降低的作正极;Pb为负极,负极上Pb失电子和硫酸根离子反应生成硫酸铅;根据方程式知,硫酸参加反应生成硫酸铅沉淀和水,所以溶液中氢离子浓度降低。
【详解】(1)根据上述分析可知,负极上电极反应式为CH4-8e-+10OH-=CO32-+7H2O,正极上电极反应式为为O2+2H2O+4e-=4OH-,在得失电子相等的条件下,将电极反应式相加即得电池反应式,所以电池反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,
故答案为负极;CH4-8e-+10OH-=CO32-+7H2O;CH4+2O2+2OH-=CO32-+3H2O;
(2)该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-=2CO32-,又负极电极反应式为2CO+2CO32- 4e ═4CO2,在得失电子相同条件下将正负极电极反应式相加得电池反应式2CO+O22CO2,
故答案为O2+2CO2+4e-=2CO32-;2CO+O22CO2;
(3)①在原电池中得电子化合价降低的作正极,放电时,Pb元素化合价由0价、+4价变为+2价,所以Pb作负极、PbO2作正极,故答案为Pb;
②Pb为负极,负极上Pb失电子和硫酸根离子反应生成硫酸铅,电极反应式为Pb+SO42--2e-═PbSO4;
③根据方程式知,硫酸参加反应生成硫酸铅沉淀和水,所以溶液浓度降低,溶液中氢离子浓度降低,则溶液的pH变大,故答案为变大;铅蓄电池在放电过程中消耗了H2SO4。
【点睛】书写燃料电池电极反应式时要注意溶液的酸碱性不同,电极反应式不同。如甲烷燃料电池中,若为酸性溶液,则CH4在负极氧化产物为CO2,若为碱性环境,则CH4在负极氧化产物为CO32-,根据产物不同,结合电荷守恒、原子守恒书写正确的电极反应式。
15.(1) 偏大 醋酸是弱酸,电离过程吸收热量
(2)<
(3)
(4) 946 B
【详解】(1)醋酸为弱酸,电离要吸热,若用醋酸代替HCl做实验,会使放出的热量减少,由于放热反应<0,放热越小,越大,所以导致测定结果偏大;
(2)石墨比金刚石更稳定,则是放热反应,<0;
(3)燃烧热指1mol纯物质完全燃烧生成指定物质放出的热量,完全燃烧生成和时放热23 kJ,则1mol完全燃烧放出的热量=23 kJ×32=736kJ,所以燃烧热的热化学方程式为: ;
(4)①方程式的反应热等于反应物的键能和与生成物键能和之差,所以,解得a=946;
②N2(g)、H2(g)合成NH3(g)的反应为放热反应,所以反应物能量高于生成物,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1,升高相同温度时,N2(g)和H2(g)能量升高的更多,能量随温度T的变化示意图合理的是B,答案为:B。
16.(1)
(2)
(3) -622kJ/mol
【详解】(1)1g甲醇的物质的量为,故1mol甲醇完全燃烧生成液态水放出的热量为:,表示甲醇燃烧热的热化学方程式为:;
(2)反应热等于反应物的总键能减去生成物的总键能,,反应热为:,热化学方程式为:;
(3)题干中三个热化学方程式依次记为I、II、III,,故;N2H4和NO2反应生成氮气和水蒸气的化学方程式:,, ,热化学方程式为:。
17.(1)阳极反应:2Cl--2e-=Cl2,产生的氯气氧化废水中的释放出N2。
(2) 减小 电路中通过相同电量时,若生成和的物质的量之比为3:1,则阳极产生的H+比阴极消耗的H+多。
【分析】由装置图分析可知,此装置为电解池装置,电解质溶液为酸性溶液。与电源正极相连的为阳极,阳极氯离子失去电子生成氯气,阳极反应为:2Cl--2e-=Cl2,氯气具有氧化性,酸性溶液中将氧化成N2,该反应的离子方程式为:3Cl2+2=N2+6Cl-+8H+。与电源负极相连的为阴极,阴极氢离子得到电子生成氢气,阴极反应为:2H++2e-=H2。
【详解】(1)由分析可知,与电源正极相连的为阳极,阳极反应为:2Cl--2e-=Cl2,氯气具有氧化性,酸性溶液中将氧化成N2。
(2)电解池中阳极反应为:2Cl--2e-=Cl2,生成的氯气氧化,离子方程式为:3Cl2+2=N2+6Cl-+8H+;阴极反应为:2H++2e-=H2。若生成和的物质的量之比为3:1,根据电子守恒可得:6H+~3H2~6e-~3Cl2~ N2~8H+,转移相同电子时,阳极产生的H+比阴极消耗的H+多,故溶液减小。
【点睛】本题突破点电解池阴阳极判断。电解池中与电源正极相连的是阳极,与电源负极相连的是阴极,再根据电解池原理解题。此题还涉及陌生化学反应方程式的书写,陌生化学反应方程式书写一定要注意反应发生的环境,酸性溶液还是碱性溶液。
18. bc > 负 2H++2e-=H2↑ 0.2
【分析】(1)根据原电池构成条件及反应原理分析解答;
(2)原电池反应可以加快反应速率;
(3)活动性强的电极为负极,负极失去电子,发生氧化反应;活动性弱的电极为正极,正极上溶液中的H+得到电子被还原产生H2;
(4)根据同一闭合回路中电子转移数目相等,结合物质的量的有关计算公式计算。
【详解】(1)a.甲构成了原电池,Cu活动性比Zn弱,为正极,正极上溶液中的H+得到电子被还原产生H2,Cu电极本身不参加反应,因此甲中铜片质量不变,a错误;
b.在金属活动性顺序表中Zn位于H的前边,可以与酸发生置换反应而被氧化,因此锌的质量会不断减少,b正确;
c.Cu的活动性比H弱,因此不能与酸发生反应,所以乙中铜片上没有明显变化,c正确;
d. 甲装置具备原电池构成条件,形成了原电池,乙装置没有形成闭合回路,也没有电源,因此既没有构成原电池,也没有形成电解池,d错误;
故合理选项是bc;
(2)甲装置构成了原电池,Zn为负极,失去电子,被氧化变为Zn2+;Cu活动性弱,为原电池的正极,正极上溶液中的的H+得到电子被还原产生H2,原电池反应加快了放出氢气的速率,而乙装置没有形成原电池,因此同等条件下,两烧杯中产生气泡的速率:甲>乙;
(3)甲烧杯中形成原电池,由于金属活动性Zn>Cu,锌电极为负极,失去电子被氧化;铜为正极,正极上溶液中的的H+得到电子被还原产生H2,电极反应式为:2H++2e-=H2↑;
(4)2.24 L标准状况下的氢气的物质的量n(H2)==0.1 mol,根据电极反应式2H++2e-=H2↑可知:每反应产生1 mol H2,转移2 mol电子,则产生0.1 mol H2时转移电子的物质的量是0.2 mol。
【点睛】本题考查原电池的反应原理、电极反应式的书写与判断、转移电子数目的计算的知识。原电池构成必须同时具备四个条件:活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应,且在同一闭合回路中电子转移数目相等。一般情况下,活动性强的电极为负极,失去电子,发生氧化反应;活动性弱的电极为正极,正极上溶液中离子得到电子,发生还原反应。
19.(1) 太阳 化学
(2)吸热
(3)不变
(4)74.8
【详解】(1)水在太阳光催化下反应生成氢气和氧气,是将太阳能转化为化学能;
(2)反应②的ΔH>0,为吸热反应;
(3)催化剂会通过改变反应途径降低活化能,进而加快反应速率,但不会改变反应的焓变。反应的热效应只与反应体系的始末状态有关,与反应途径无关;
(4)根据盖斯定律,反应等于反应③-反应②,故可得该反应。
20.(1)>
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16akJ·mol-1
(3)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600kJ·mol-1
(4)3a+b-c
【详解】(1)甲醇完全燃烧放热多,由于焓变小于0,所以ΔH2>ΔH1。
(2)1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热量,则1mol甲烷即16g甲烷完全燃烧生成二氧化碳和液态水放出16akJ的热量,所以甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16akJ·mol-1。
(3)1mol乙炔完全燃烧转移10mol电子,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,即0.5mol乙炔完全燃烧生成CO2和液态水放出650kJ的热量,则2mol乙炔完全燃烧生成CO2和液态水放出2600kJ的热量,所以表示该反应的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600kJ·mol-1。
(4)已知:碳的燃烧热 ΔH1=akJ mol-1,则
①O2(g)+C(s)=CO2(g) ΔH1=akJ mol-1
②S(s)+2K(s)=K2S(s) ΔH2=bkJ mol-1
③2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=ckJ mol-1
依据盖斯定律可知①×3+②-③即得到S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=(3a+b-c)kJ/mol,则x=3a+b-c。
21.(1)吸热
(2)B
(3) a B
(4)+2=3++
(5)[(E1 E2)+△H+(E3 E4)] kJ mol 1
(6) 该反应是可逆反应,2mol氮气反应不完全,因此放出的热量小于92kJ 946
【详解】(1)制作冷敷袋可利用吸收周围的热量的化学变化或物理变化;故答案为:吸热。
(2)A.浓硫酸和水混合会放出大量热,大不安全,故A不符合题意;B.生石灰和水混合放出大量的热,相对安全,故B符合题意;C.纯碱和水混合后热量变化很小,故C不符合题意;D.食盐和白醋混合后热量变化很小,故D不符合题意;综上所述,答案为:B。
(3)①图a是反应物总能量大于生成物总能量,图b是反应物总能量小于生成物总能量,因此该反应的能量变化可用图中的a表示;故答案为:a。
②与足量充分燃烧生成液态水时放出热量,则燃烧生成液态水的热化学反应方程式。;故答案为:。
③A.热化学方程式中化学计量数表示物质的量,故A错误;B.该反应是吸热反应即大于零,故B正确;C.该反应的,故C错误;D.该反应可表示液态水分解生成4g气态氢气和32g气态氧气时的热效应,故D错误;综上所述,答案为:B。
(4)根据盖斯定律,反应2减去反应1的2倍得到+2=3++ ;故答案为:+2=3++ 。
(5)根据焓变等于反应物的活化能减去生成物的活化能,则过程中的焓变为[(E1 E2)+△H+(E3 E4)] kJ mol 1;故答案为:[(E1 E2)+△H+(E3 E4)] kJ mol 1。
(6)①在和下,工业合成氨,每生成就会放出热量,在该条件下,向某容器中加入、及合适的催化剂,充分反应后测得其放出的热量小于,原因可能是该反应是可逆反应,2mol氮气反应不完全,因此放出的热量小于92kJ,根据每生成就会放出热量,则每生成就会放出热量,则,解得a=946;故答案为:该反应是可逆反应,2mol氮气反应不完全,因此放出的热量小于92kJ;946。
②根据题意得到在和下转化为的热化学方程式为 ,该反应是放热反应,根据能量越低越稳定,则与中更稳定的是;故答案为: ;。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.利用数字化实验进行铁的电化学腐蚀实验探究,实验结果如下图所示,以下说法中正确的是
A.时,体系压强增大的原因主要是因为反应放热
B.整个过程中,负极是铁参与反应生成铁离子
C.时,只发生析氢腐蚀
D.时,只发生吸氧腐蚀
2.实验小组研究金属电化学腐蚀,实验如下:
序号 实验 5 min 25 min
实验I 铁钉表面及周边未见明显变化 铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成
实验Ⅱ 铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化 铁钉周边红色加深,区域变大,未见蓝色出现, 锌片周边未见明显变化
下列说法不正确的是
A.实验I生成铁锈说明铁钉发生了吸氧腐蚀
B.对比实验I,实验Ⅱ中铁钉在5 min即出现红色,说明锌片加速了铁的腐蚀速率
C.实验Ⅱ中正极的电极反应式: O2+ 2H2O+4e- = 4OH-
D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色
3.石墨在一定条件下转化为金刚石,其能量变化如图所示,其中△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是
A.金刚石的稳定性强于石墨的
B.石墨转化为金刚石属于物理变化
C.1 mol金刚石的能量大于1 mol CO2的能量
D.1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
4.下列实验的反应原理用离子方程式表示正确的是
A.少量通入溶液中:
B.用惰性电极电解氯化镁溶液:
C.向溶液中加入足量Ba(OH)2溶液:
D.用双氧水和稀硫酸处理铜印刷电路板:
5.我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是
A.H+在电解质溶液中从右向左定向移动
B.乙中电极上发生氧化反应,溶液进入甲中将H2S转化为S
C.丙中发生的电极反应为-2e-+2H+=
D.丁中在催化剂表面发生电化学反应生成 H4[SiW12O40] 和H2
6.周期表中ⅥA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;是一种易燃的有毒气体(燃烧热为),可制取各种硫化物:硫酸、硫酸盐是重要化工原料;硫酰氯()是重要的化工试剂,常作氯化剂或氯磺化剂。硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含)为原料回收,以电解强碱性,溶液制备。下列化学反应表示正确的是
A.遇水强烈水解生成两种强酸:
B.和浓硫酸反应:
C.电解强碱性溶液的阴极反应:
D.的燃烧:
7.已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
下列说法错误的是
A.CH3OH(l)的燃烧热为726 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,CH3OH(l)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) △H≠-57.3 kJ·mol-1
D.2 mol H2(g)和1 mol O2(g)的总能量大于2 mol H2O(l)的总能量
8.下列我国科技成果所涉及物质的应用中,具体操作或过程不涉及化学变化的是
A.利用阳光将二氧化碳转化为淀粉
B.利用模拟月壤研究从钛铁矿(FeTiO3) 中提取铁
C.利用雷达探测巡视表面土壤厚度、冰层结构
D.利用深海锂电池为“奋斗者”号控制系统提供电能
9.已知某化学反应,其反应过程中体系的能量变化如图所示,则下列说法正确的是
A.该反应的热效应为
B.图中A…B…C过渡态存在是因为使用了催化剂
C.为正反应的活化能
D.该反应中,反应物的键能总和等于
10.新型镁 锂双离子二次电池的工作原理如图。已知:氧化性Mg2+ > Li+。下列关于该电池的说法正确的是
A.放电时,Li+通过离子交换膜向左移动
B.放电时,正极的电极反应式为:Li1-x FePO4 +xLi+ xe-= LiFePO4
C.充电时,左侧电极的电势高于右侧电极的电势
D.充电时,导线中每通过0.4 mol e-,左室中溶液的质量减少2 g
11.近日报道的表面锂掺杂的锡(s-SnLi)催化剂通过电化学法将转化为甲酸盐,同时产生电能,工作原理如图所示。下列说法正确的是
A.放电时,Zn电极周围pH升高
B.放电时,每生成,转移个电子
C.充电时,阳极反应式为
D.充电时,向Zn电极迁移
12.一种光照充电电池工作原理如下图所示,光照时,光催化电极产生电子和空穴,对电池进行充电。下列说法正确的是。
A.该电池交换膜为交换膜
B.电池的总反应:
C.放电时,正极反应:
D.充电时阳极反应:
二、填空题(共9题)
13.回答下列问题:
(1)丙烷(C3H8)热值较高,污染较小,是一种优良的气态燃料。如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,写出表示丙烷燃烧热的热化学方程式: 。
(2)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H= 。
(3)已知25℃、101kpa时,一些物质的燃烧热为:
化学式 CO(g) H2(g) CH3OH(l)
△H/(kJ/mol) -283.0 -285.8 -726.5
完成CO和H2生成CH3OH的热化学方程式 。
(4)已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为 kJ mol-1。
14.(1)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷(或氢气、一氧化碳等可燃性气体)和氧气构成燃料电池,则通入甲烷气体的一极是原电池的 极,该极的电极反应式是 ,电池工作时的总反应的离子方程式是 。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极气体,空气与CO2的混合气体为正极气体,制得650 ℃下工作的燃料电池,完成下列反应式:
正极: ,
负极:2CO+2CO32--4e-=4CO2。
总反应: 。
(3)铅蓄电池放电时,总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,由此可以判断:
①原电池的电极材料:负极: 。
②电极反应式:正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,负极反应式为 。
③工作后,铅蓄电池里电解质溶液的pH (填“变大”“变小”或“不变”),理由是 。
15.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)在中和热测定实验中,用醋酸代替盐酸进行实验,测得的 (填“偏大”或“偏小”),产生偏差的原因是 。
(2)相同条件下,石墨比金刚石更稳定,则 0(填“>”或“<”)。
(3)实验测得,完全燃烧生成和时放热23 kJ。该状态下燃烧热的热化学方程式为 。
(4)已知在298.15 K、100 kPa条件下, 。
①结合表格数据计算a= 。
化学键
键能 a 391 436
②、和的比热容分别为29.1、28.9和。一定压强下反应中,反应物[]、生成物[]的能量随温度T的变化示意图合理的是 (填标号)。
A. B.
C. D.
16.依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
(3)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) H=+67.7kJ mol-1;
N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1;
H2O(l)=H2O(g) H=+44.0kJ mol-1;
则N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH= 。
请写出N2H4和NO2反应生成氮气和水蒸气的热化学方程式: 。
17.为了避免对海洋氮循环系统产生影响,含氮废水需经处理后排放。如图是用间接氧化法去除工业废水中氨态氮()的示意图。
(1)结合电极反应式简述间接氧化法去除氨态氮的原理: 。
(2)若生成和的物质的量之比为3:1,则处理后废酸性氨氮废水的将 (填“增大”“不变”或“减小”),请简述原因: 。
18.认真观察图中装置,回答下列问题:
(1)下列说法中正确的是 (填序号)。
a.甲中铜片质量减少 b.乙中锌片质量减少
c.乙中铜片上没有明显变化 d.甲装置为原电池,乙装置为电解池
(2)同等条件下,两烧杯中产生气泡的速率:甲 (填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为 (正极或负极),写出铜极的反应电极方程式 。
(4)当甲中产生2.24 L(标准状况)气体时,理论上通过导线的电子数目为 mol。
19.通过下列反应均可获取氢气。
①太阳光催化分解水制氢气:
②焦炭与水反应制氢气:
③甲烷与水反应制氢气:
(1)反应①中主要能量转化形式为 能转化为 能。
(2)从能量转化角度分析,反应②为 反应。
(3)反应③如果使用催化剂, (填“增大”“减小”或“不变”)。
(4)反应的 。
20.根据所给信息及要求填空。
(1)已知CH3OH(l)的燃烧热ΔH1,CH3OH(l)+O2(g)=CO2(g)+2H2(g) ΔH2,则ΔH2 ΔH1(填“>”、“<”或“=”)。
(2)1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热量,写出甲烷燃烧热的热化学方程式: 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为 。
(4)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=xkJ mol-1
已知:碳的燃烧热 ΔH1=akJ mol-1
S(s)+2K(s)=K2S(s) ΔH2=bkJ mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=ckJ mol-1,则x为 kJ/mol。
21.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)制作冷敷袋可利用 (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”为生活带来便利,它可利用下面________(填字母)反应放热加热食物。
A.浓硫酸和水 B.生石灰和水 C.纯碱和水 D.食盐和白醋
(3)已知:与足量充分燃烧生成液态水时放出热量。
①该反应的能量变化可用图中的 (填字母)表示。
②写出燃烧生成液态水的热化学反应方程式 。
③关于热化学方程式:的说法正确的是 。
A.热化学方程式中化学计量数表示分子数 B.该反应大于零
C.该反应的 D.该反应可表示水分解时的热效应
(4)神舟系列火箭用偏二甲肼作燃料,作氧化剂,反应后产物无污染。
已知:反应1:
反应2:
写出和反应生成、、的热化学方程式:
(5)已知某金属氧化物催化丙烷脱氢过程中,部分反应进程如图,则过程中的焓变为 (列式表示)。
(6)已知,在和下,部分化学键的键能数据如表所示。
化学键
键能/() 436 391 a 498 414 803 462 193
①在和下,工业合成氨,每生成就会放出热量,在该条件下,向某容器中加入、及合适的催化剂,充分反应后测得其放出的热量小于,原因可能是 ,表中的 。
②科学家发现一种新的气态分子( )。在和下转化为的热化学方程式为 。由此可知,与中更稳定的是 (填化学式)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,故A错误;
B.锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作原电池的负极,发生氧化反应,电极反应式为,故B错误;
C.若时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降,而图中时,锥形瓶内的压强几乎不变,说明除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,故C错误;
D.由图可知,时,锥形瓶内的溶解氧减少,说明有消耗氧气的吸氧腐蚀发生;同时锥形瓶内的气压也减小,说明没有产生氢气的析氢腐蚀发生,故D正确;
故选D。
2.B
【详解】A.实验I出现极少量红色说明有OH-生成,Fe失去电子生成Fe2+,K3[Fe(CN)6]溶液与Fe2+发生反应生成特征蓝色沉淀,则铁钉发生了吸氧腐蚀,A正确;
B.实验II中Zn比Fe活泼,作原电池的负极,发生吸氧腐蚀生成OH-,Fe作正极,被保护,铁的腐蚀速率比实验I慢,B错误;
C.实验II中Fe作正极,氧气发生得电子的还原反应,其电极反应式:O2 + 2H2O + 4e- =4OH-,C正确;
D.若将Zn片换成Cu片,因为Fe比Cu活泼,推测Cu片周边氧气发生得电子的还原反应生成氢氧根离子,酚酞溶液会出现红色,铁钉作原电池的负极,发生失电子的氧化反应生成亚铁离子,与K3[Fe(CN)6]溶液反应,使其周边会出现蓝色,D正确;
故选:B。
3.D
【详解】A.石墨能量低,则石墨比金刚石稳定,故A错误;
B.石墨和金刚石为两种不同单质,二者转化为化学变化,故B错误;
C.放热反应中反应物的总能量大于生成物的总能量,即1mol金刚石和1mol氧气的总能量大于1molCO2的能量,而1mol金刚石的能量与1molCO2的能量大小无法比较,故C错误;
D.由图可知,△E2-△E1=1.9kJ,即石墨转化为金刚石吸收能量,则1mol石墨完全转化为金刚石需吸收1.9kJ热量,故D正确;
故选:D
4.D
【详解】A.SO2少量无法生成CO2,离子方程式应为SO2+2CO+H2O=SO+2HCO,A错误;
B.电解氯化镁溶液时阴极产生的氢氧根会和镁离子生成沉淀,离子方程式为Mg2++2Cl-+2H2OCl2↑+H2↑+Mg(OH)2↓,B错误;
C.Ba(OH)2足量,最终会得到偏铝酸根,正确离子方程式为Al3++2SO+2Ba2++4OH-=2BaSO4↓+AlO+2H2O,C错误;
D.双氧水在酸性环境中会将Cu氧化为Cu2+,选项所给离子方程式无误,D正确;
综上所述答案为D。
5.B
【分析】由图可知:H2S在甲区中与Fe3+发生氧化反应生成S单质,反应为2Fe3++H2S=2Fe2++2H++S↓,乙区Fe2+发生失电子的氧化反应转化为Fe3+,所以乙区为阳极区,丙区为阴极区,H4[SiW12O40]得电子生成H6[SiW12O40],电极反应为:H4[SiW12O40]+2e- +2H+=H6[SiW12O40];丁区H6[SiW12O40]在催化剂表面发生分解反应生成H4[SiW12O40]和H2,结合电子守恒进行计算,据此分析解答。
【详解】A.在理论上甲区每生成1 mol S时,转移2 mol电子,由于电子和质子电荷数相等,又乙区为阳极区,丙区为阴极区,所以H+由质子交换膜左侧向右侧移动的物质的量为2 mol,A错误;
B.乙区Fe2+发生失电子的氧化反应转化为Fe3+,在甲装置中Fe3+与H2S发生氧化还原反应为:2Fe3++H2S=2Fe2++2H++S↓,B正确;
C.丙区为阴极区,H4[SiW12O40]得电子生成H6[SiW12O40],电极反应为:H4[SiW12O40]+2e- +2H+=H6[SiW12O40],C错误;
D.丁区H6[SiW12O40]在催化剂表面发生分解反应生成H4[SiW12O40]和H2,没有发生电化学反应,D错误;
故合理选项是B。
6.D
【详解】A.反应生成硫酸与盐酸,故不应该出现亚硫酸根,应该为硫酸根,,故A错误;
B.浓硫酸具有强氧化性,可以氧化Se2-,,故B错误;
C.强碱性环境,反应物中不应该出现氢离子,,故C错误;
D.革命剧题意可知燃烧热为,燃烧的热化学方程式为:,故D正确;
故答案为D。
7.B
【详解】A.由2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol-1可知,1mol CH3OH(l)完全燃烧生成1mol CO2(g)和2molH2O(l)时放出的热量为:kJ=726 kJ,则CH3OH(l)的燃烧热为726 kJ·mol-1,故A正确;
B.设H2(g)和CH3OH(l)的质量均为32g,则H2(g)和CH3OH(l)的物质的量分别为:16mol、1mol,由热化学方程式可知,H2(g)和CH3OH(l)完全燃烧放出的热量分别为:4572.8kJ、726 kJ,则同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故B错误;
C.因硫酸根离子和钡离子反应生成硫酸钡沉淀时也有热量放出,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) △H≠-57.3 kJ·mol-1,故C正确;
D.由2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1可知,该反应为放热反应,则2 mol H2(g)和1 mol O2(g)的总能量大于2 mol H2O(l)的总能量,故D正确;
答案选B。
8.C
【详解】A.利用阳光将废二氧化碳转化为淀粉的过程中产生新物质, 是化学变化,A不符合题意;
B.利用模拟月壤研究从钛铁矿(FeTiO3)中提取铁的过程中有新物质生成,是化学变化,B不符合题意;
C.利用雷达探测巡视表面土壤厚度、冰层结构过程中没有产生新物质,属于物理变化,C符合题意;
D.利用深海锂电池为“奋斗者”号控制系统提供电能,属于原电池原理,是化学变化,D不符合题意;
故选C。
9.A
【详解】A.由图可知:该反应的热效应为,故A正确;
B.不使用催化剂的反应也可能存在过渡态,故B错误;
C..E1为正反应的活化能,E2为逆反应活化能,故C错误;
D.键能是气态分子中1 mol化学键离解变到气态原子吸收的能量,过渡态中化学键并没有完全离解,所以反应物的键能总和不等于,故D错误;
故答案:A。
10.D
【分析】新型镁 锂双离子二次电池,放电时,Mg失去电子变为镁离子即左边为负极,右边Fe化合价降低得到电子即为正极,充电时,左边电极为阴极,右边电极为阳极,据此答题。
【详解】A.放电时作为原电池,左边为负极,右边为正极,Li+通过离子交换膜向正极即向右移动,A项错误;
B.放电时作为原电池,正极的电极反应式为: Li1-x FePO4 +xLi++xe-= LiFePO4,B项错误;
C.充电时作为电解池,氧化性Mg2+ > Li+,则Mg为阴极与电源负极相连,左侧电极的电势低于右侧电极的电势,C项错误;
D.充电时,Mg为阴极,阴极是Mg2++2e-=Mg,溶液中Li+向阴极即左室移动,导线上每通过0.4 mol e-,则有0.2mol Mg2+消耗,有0.4mol Li+移向左室,左室中溶液的质量减少0.2mol×24g mol 1-0.4mol×7g mol 1=2 g,D项正确;
答案选D。
11.D
【详解】A.放电时,Zn电极的反应为,氢氧根离子浓度减少,pH减小,A错误;
B.放电时,装置右侧的电极反应为,生成1molHCOO-,转移的电子量为2mol,B错误;
C.充电时,阳极反应式为,C错误;
D.充电时,锌离子是阳离子,向负极锌电极移动,D正确。
故选D。
12.D
【分析】由图可知,放电时,锂发生氧化反应生成锂离子,锂为负极,则光催化电极为正极;
【详解】A.该电池交换膜在充放电时要能顺利通过阳离子锂离子的迁移,故为阳离子交换膜,A错误;
B.由分析可知,放电时锂发生氧化反应生成锂离子,氧气得到电子发生还原反应与迁移过来的锂离子生成Li2O2;充电时发生相反的反应,故总反应为:,B错误;
C.放电时,光催化电极为正极,氧气得到电子发生还原反应生成Li2O2,反应为,C错误;
D.光照时,光催化电极产生电子和空穴,对电池进行充电;充电时光催化电极为阳极,Li2O2发生氧化反应生成锂离子和氧气,阳极反应:,D正确;
故选D。
13.(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H1=-2215.0kJ/mol
(2)△H=227kJ/mol
(3)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ mol-1
(4)-(5x-0.5y)
【解析】(1)
由图可知,反应物总能量大于生成物总能量,该反应为放热反应;一定量丙烷完全燃烧生成CO2和1molH2O(l),放出热量为553.75kJ,所以1molC3H8(g)完全燃烧,生成4mol H2O(l)时,放出的热量为4×553.75kJ=2215.0kJ,表示丙烷燃烧热的热化学方程式:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H1=-2215.0kJ/mol;
(2)
①C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,①×2+②×-③×可得:2C(s,石墨)+H2(g)= C2H2(g) △H=2△H1+△H2- △H3=2×(-393)+ ×(-572)- ×(-2598)= 227kJ/mol;
(3)
一氧化碳燃烧的热化学方程式:①CO(g)+ O2(g)=CO2(g) △H1=-283.0kJ·mol-1
氢气燃烧的热化学方程式:②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
甲醇燃烧的热化学方程式:③CH3OH(l) +O2(g)=CO2(g)+2H2O(l) △H3=-726.5kJ·mol-1
根据盖斯定律:①+②-③可得:CO(g)+2H2(g)=CH3OH(l) △H=-283.0+(-571.6)-( -726.5)=-128.1kJ mol-1;
(4)
3.6g碳的物质的量为=0.3mol,6.4g氧气的物质的量为=0.2mol;根据氧气不足:2C+O22CO,氧气足量:C+O2CO2分析,n(C):n(O2)=3:2,介于2:1与1:1之间,上述反应都发生;设生成CO为xmol,CO2为ymol;根据碳元素守恒:x+y=0.3,根据氧元素守恒:x+2y=0.2×2,联立方程解得x=0.2mol,y=0.1mol;单质碳的燃烧热为ykJ/mol,所以生成0.1molCO2放出热量为0.1ykJ,生成0.2molCO放出的热量为x kJ-0.1ykJ,由于碳燃烧为放热反应,所以△H的符号为“-”,故1molC与氧气反应生成CO的反应热△H=-=-(5x-0.5y) kJ·mol-1。
14. 负极 CH4-8e-+10OH-=CO32-+7H2O CH4+2O2+2OH-=CO32-+3H2O O2+2CO2+4e-=2CO32- 2CO+O22CO2 Pb Pb-2e-+SO42-=PbSO4 变大 铅蓄电池在放电过程中消耗了H2SO4
【分析】(1)甲烷、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,在得失电子相等的条件下,将电极反应式相加即得电池反应式;
(2)该燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,在得失电子相同条件下将正负极电极反应式相加即可得电池反应式,据此分析解答;
(3)在原电池中得电子化合价降低的作正极;Pb为负极,负极上Pb失电子和硫酸根离子反应生成硫酸铅;根据方程式知,硫酸参加反应生成硫酸铅沉淀和水,所以溶液中氢离子浓度降低。
【详解】(1)根据上述分析可知,负极上电极反应式为CH4-8e-+10OH-=CO32-+7H2O,正极上电极反应式为为O2+2H2O+4e-=4OH-,在得失电子相等的条件下,将电极反应式相加即得电池反应式,所以电池反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,
故答案为负极;CH4-8e-+10OH-=CO32-+7H2O;CH4+2O2+2OH-=CO32-+3H2O;
(2)该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-=2CO32-,又负极电极反应式为2CO+2CO32- 4e ═4CO2,在得失电子相同条件下将正负极电极反应式相加得电池反应式2CO+O22CO2,
故答案为O2+2CO2+4e-=2CO32-;2CO+O22CO2;
(3)①在原电池中得电子化合价降低的作正极,放电时,Pb元素化合价由0价、+4价变为+2价,所以Pb作负极、PbO2作正极,故答案为Pb;
②Pb为负极,负极上Pb失电子和硫酸根离子反应生成硫酸铅,电极反应式为Pb+SO42--2e-═PbSO4;
③根据方程式知,硫酸参加反应生成硫酸铅沉淀和水,所以溶液浓度降低,溶液中氢离子浓度降低,则溶液的pH变大,故答案为变大;铅蓄电池在放电过程中消耗了H2SO4。
【点睛】书写燃料电池电极反应式时要注意溶液的酸碱性不同,电极反应式不同。如甲烷燃料电池中,若为酸性溶液,则CH4在负极氧化产物为CO2,若为碱性环境,则CH4在负极氧化产物为CO32-,根据产物不同,结合电荷守恒、原子守恒书写正确的电极反应式。
15.(1) 偏大 醋酸是弱酸,电离过程吸收热量
(2)<
(3)
(4) 946 B
【详解】(1)醋酸为弱酸,电离要吸热,若用醋酸代替HCl做实验,会使放出的热量减少,由于放热反应<0,放热越小,越大,所以导致测定结果偏大;
(2)石墨比金刚石更稳定,则是放热反应,<0;
(3)燃烧热指1mol纯物质完全燃烧生成指定物质放出的热量,完全燃烧生成和时放热23 kJ,则1mol完全燃烧放出的热量=23 kJ×32=736kJ,所以燃烧热的热化学方程式为: ;
(4)①方程式的反应热等于反应物的键能和与生成物键能和之差,所以,解得a=946;
②N2(g)、H2(g)合成NH3(g)的反应为放热反应,所以反应物能量高于生成物,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1,升高相同温度时,N2(g)和H2(g)能量升高的更多,能量随温度T的变化示意图合理的是B,答案为:B。
16.(1)
(2)
(3) -622kJ/mol
【详解】(1)1g甲醇的物质的量为,故1mol甲醇完全燃烧生成液态水放出的热量为:,表示甲醇燃烧热的热化学方程式为:;
(2)反应热等于反应物的总键能减去生成物的总键能,,反应热为:,热化学方程式为:;
(3)题干中三个热化学方程式依次记为I、II、III,,故;N2H4和NO2反应生成氮气和水蒸气的化学方程式:,, ,热化学方程式为:。
17.(1)阳极反应:2Cl--2e-=Cl2,产生的氯气氧化废水中的释放出N2。
(2) 减小 电路中通过相同电量时,若生成和的物质的量之比为3:1,则阳极产生的H+比阴极消耗的H+多。
【分析】由装置图分析可知,此装置为电解池装置,电解质溶液为酸性溶液。与电源正极相连的为阳极,阳极氯离子失去电子生成氯气,阳极反应为:2Cl--2e-=Cl2,氯气具有氧化性,酸性溶液中将氧化成N2,该反应的离子方程式为:3Cl2+2=N2+6Cl-+8H+。与电源负极相连的为阴极,阴极氢离子得到电子生成氢气,阴极反应为:2H++2e-=H2。
【详解】(1)由分析可知,与电源正极相连的为阳极,阳极反应为:2Cl--2e-=Cl2,氯气具有氧化性,酸性溶液中将氧化成N2。
(2)电解池中阳极反应为:2Cl--2e-=Cl2,生成的氯气氧化,离子方程式为:3Cl2+2=N2+6Cl-+8H+;阴极反应为:2H++2e-=H2。若生成和的物质的量之比为3:1,根据电子守恒可得:6H+~3H2~6e-~3Cl2~ N2~8H+,转移相同电子时,阳极产生的H+比阴极消耗的H+多,故溶液减小。
【点睛】本题突破点电解池阴阳极判断。电解池中与电源正极相连的是阳极,与电源负极相连的是阴极,再根据电解池原理解题。此题还涉及陌生化学反应方程式的书写,陌生化学反应方程式书写一定要注意反应发生的环境,酸性溶液还是碱性溶液。
18. bc > 负 2H++2e-=H2↑ 0.2
【分析】(1)根据原电池构成条件及反应原理分析解答;
(2)原电池反应可以加快反应速率;
(3)活动性强的电极为负极,负极失去电子,发生氧化反应;活动性弱的电极为正极,正极上溶液中的H+得到电子被还原产生H2;
(4)根据同一闭合回路中电子转移数目相等,结合物质的量的有关计算公式计算。
【详解】(1)a.甲构成了原电池,Cu活动性比Zn弱,为正极,正极上溶液中的H+得到电子被还原产生H2,Cu电极本身不参加反应,因此甲中铜片质量不变,a错误;
b.在金属活动性顺序表中Zn位于H的前边,可以与酸发生置换反应而被氧化,因此锌的质量会不断减少,b正确;
c.Cu的活动性比H弱,因此不能与酸发生反应,所以乙中铜片上没有明显变化,c正确;
d. 甲装置具备原电池构成条件,形成了原电池,乙装置没有形成闭合回路,也没有电源,因此既没有构成原电池,也没有形成电解池,d错误;
故合理选项是bc;
(2)甲装置构成了原电池,Zn为负极,失去电子,被氧化变为Zn2+;Cu活动性弱,为原电池的正极,正极上溶液中的的H+得到电子被还原产生H2,原电池反应加快了放出氢气的速率,而乙装置没有形成原电池,因此同等条件下,两烧杯中产生气泡的速率:甲>乙;
(3)甲烧杯中形成原电池,由于金属活动性Zn>Cu,锌电极为负极,失去电子被氧化;铜为正极,正极上溶液中的的H+得到电子被还原产生H2,电极反应式为:2H++2e-=H2↑;
(4)2.24 L标准状况下的氢气的物质的量n(H2)==0.1 mol,根据电极反应式2H++2e-=H2↑可知:每反应产生1 mol H2,转移2 mol电子,则产生0.1 mol H2时转移电子的物质的量是0.2 mol。
【点睛】本题考查原电池的反应原理、电极反应式的书写与判断、转移电子数目的计算的知识。原电池构成必须同时具备四个条件:活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应,且在同一闭合回路中电子转移数目相等。一般情况下,活动性强的电极为负极,失去电子,发生氧化反应;活动性弱的电极为正极,正极上溶液中离子得到电子,发生还原反应。
19.(1) 太阳 化学
(2)吸热
(3)不变
(4)74.8
【详解】(1)水在太阳光催化下反应生成氢气和氧气,是将太阳能转化为化学能;
(2)反应②的ΔH>0,为吸热反应;
(3)催化剂会通过改变反应途径降低活化能,进而加快反应速率,但不会改变反应的焓变。反应的热效应只与反应体系的始末状态有关,与反应途径无关;
(4)根据盖斯定律,反应等于反应③-反应②,故可得该反应。
20.(1)>
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16akJ·mol-1
(3)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600kJ·mol-1
(4)3a+b-c
【详解】(1)甲醇完全燃烧放热多,由于焓变小于0,所以ΔH2>ΔH1。
(2)1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热量,则1mol甲烷即16g甲烷完全燃烧生成二氧化碳和液态水放出16akJ的热量,所以甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16akJ·mol-1。
(3)1mol乙炔完全燃烧转移10mol电子,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,即0.5mol乙炔完全燃烧生成CO2和液态水放出650kJ的热量,则2mol乙炔完全燃烧生成CO2和液态水放出2600kJ的热量,所以表示该反应的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600kJ·mol-1。
(4)已知:碳的燃烧热 ΔH1=akJ mol-1,则
①O2(g)+C(s)=CO2(g) ΔH1=akJ mol-1
②S(s)+2K(s)=K2S(s) ΔH2=bkJ mol-1
③2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=ckJ mol-1
依据盖斯定律可知①×3+②-③即得到S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=(3a+b-c)kJ/mol,则x=3a+b-c。
21.(1)吸热
(2)B
(3) a B
(4)+2=3++
(5)[(E1 E2)+△H+(E3 E4)] kJ mol 1
(6) 该反应是可逆反应,2mol氮气反应不完全,因此放出的热量小于92kJ 946
【详解】(1)制作冷敷袋可利用吸收周围的热量的化学变化或物理变化;故答案为:吸热。
(2)A.浓硫酸和水混合会放出大量热,大不安全,故A不符合题意;B.生石灰和水混合放出大量的热,相对安全,故B符合题意;C.纯碱和水混合后热量变化很小,故C不符合题意;D.食盐和白醋混合后热量变化很小,故D不符合题意;综上所述,答案为:B。
(3)①图a是反应物总能量大于生成物总能量,图b是反应物总能量小于生成物总能量,因此该反应的能量变化可用图中的a表示;故答案为:a。
②与足量充分燃烧生成液态水时放出热量,则燃烧生成液态水的热化学反应方程式。;故答案为:。
③A.热化学方程式中化学计量数表示物质的量,故A错误;B.该反应是吸热反应即大于零,故B正确;C.该反应的,故C错误;D.该反应可表示液态水分解生成4g气态氢气和32g气态氧气时的热效应,故D错误;综上所述,答案为:B。
(4)根据盖斯定律,反应2减去反应1的2倍得到+2=3++ ;故答案为:+2=3++ 。
(5)根据焓变等于反应物的活化能减去生成物的活化能,则过程中的焓变为[(E1 E2)+△H+(E3 E4)] kJ mol 1;故答案为:[(E1 E2)+△H+(E3 E4)] kJ mol 1。
(6)①在和下,工业合成氨,每生成就会放出热量,在该条件下,向某容器中加入、及合适的催化剂,充分反应后测得其放出的热量小于,原因可能是该反应是可逆反应,2mol氮气反应不完全,因此放出的热量小于92kJ,根据每生成就会放出热量,则每生成就会放出热量,则,解得a=946;故答案为:该反应是可逆反应,2mol氮气反应不完全,因此放出的热量小于92kJ;946。
②根据题意得到在和下转化为的热化学方程式为 ,该反应是放热反应,根据能量越低越稳定,则与中更稳定的是;故答案为: ;。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
