1.2 化学能转化为电能——电池 同步练习(含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.2 化学能转化为电能——电池 同步练习(含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 544.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 00:00:00 | ||
图片预览


文档简介
1.2 化学能转化为电能——电池 同步练习
一、单选题
1.在刚刚过去的2022年,我国的科技发展成果举世瞩目。下列说法不正确的是( )
A.2022年冬奥会中,国家速滑馆“冰丝带”采用CO2跨临界制冰,比氟利昂更环保
B.2022年我国风电、光伏发电量突破一万亿千瓦时,光伏发电符合绿色发展理念
C.2022年我国锂离子电池产量同比增长超130%,锂离子电池属于二次电池
D.2022年中国空间站全面建成,空间站所使用太阳能电池的主要成分为SiO2
2.如图所示,有关化学反应和能量变化的说法正确的是( )
A.铝热反应属于氧化还原反应,故能量变化不符合该图
B.Ba(OH)2·8H2O晶体和NH4Cl品体反应能量变化如图所示
C.反应物总键能小于产物总键能的反应符合该图的能量变化
D.符合该能量变化的化学反应均可用于设计成原电池
3.2019年诺贝尔化学奖是关于锂电池研究的。我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6) Al+C6+Li++PF 6,下列说法正确的是( )
A.放电时外电路中电子向铝锂电极移动
B.放电时负极反应为AlLi-e =Al+Li+
C.充电时,应将石墨烯电极与电源负极相连
D.充电时,若电路中转移1 mol电子,则阴极质量增加9g
4.下列说法正确的是( )
A.锌锰电池是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应原理是氧化还原反应
D.铅蓄电池放电时正极是Pb
5.下列各装置能构成原电池的是( )
A. B.
C. D.
6.2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时, 与 在多孔碳材料电极处生成 ( 或1)。下列说法正确的是( )
A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:
7.将两个铂电极放置在KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,称为燃料电池,下列叙述正确的是( )
①通入CO的电极为正极;
②正极的电极反应式是O2+2H2O+4e-=4OH-;
③通入CO的电极反应式是2CO+O2-4e-=2CO2;
④负极的电极反应式是CO+4OH--2e-=CO32-+2H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③
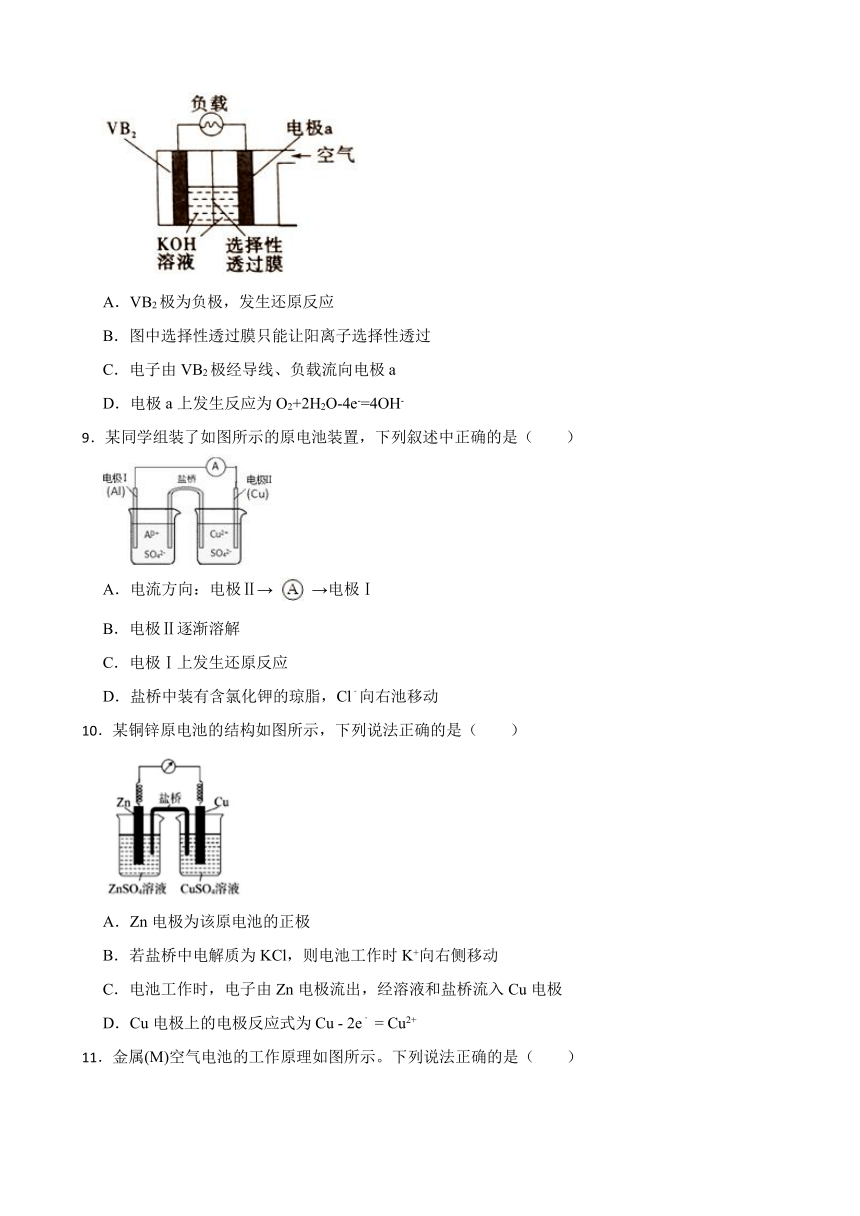
8.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为4VB2+ 11O2=4B2O3+2V2O5。下列说法正确的是( )
A.VB2极为负极,发生还原反应
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经导线、负载流向电极a
D.电极a上发生反应为O2+2H2O-4e-=4OH-
9.某同学组装了如图所示的原电池装置,下列叙述中正确的是( )
A.电流方向:电极Ⅱ→ →电极Ⅰ
B.电极Ⅱ逐渐溶解
C.电极Ⅰ上发生还原反应
D.盐桥中装有含氯化钾的琼脂,Cl﹣向右池移动
10.某铜锌原电池的结构如图所示,下列说法正确的是( )
A.Zn电极为该原电池的正极
B.若盐桥中电解质为KCl,则电池工作时K+向右侧移动
C.电池工作时,电子由Zn电极流出,经溶液和盐桥流入Cu电极
D.Cu电极上的电极反应式为Cu - 2e﹣ = Cu2+
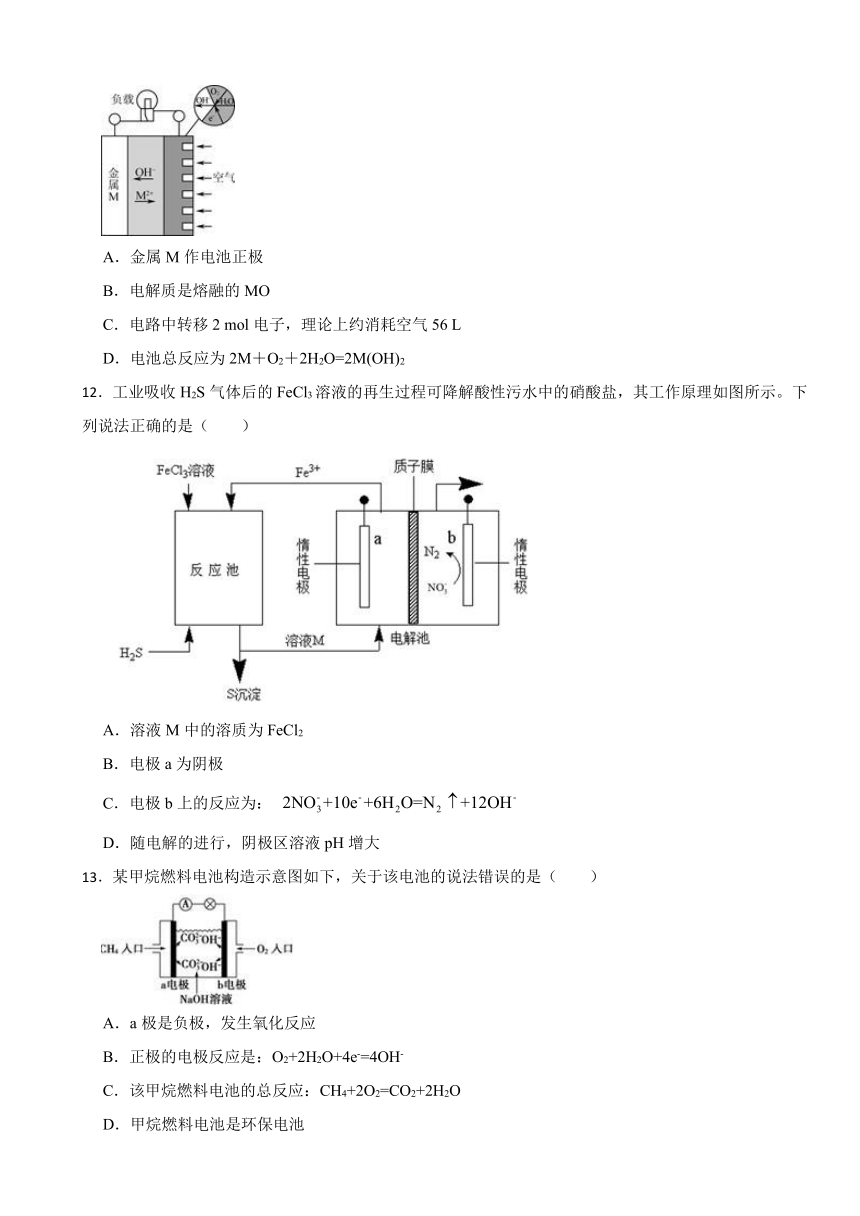
11.金属(M)空气电池的工作原理如图所示。下列说法正确的是( )
A.金属M作电池正极
B.电解质是熔融的MO
C.电路中转移2 mol电子,理论上约消耗空气56 L
D.电池总反应为2M+O2+2H2O=2M(OH)2
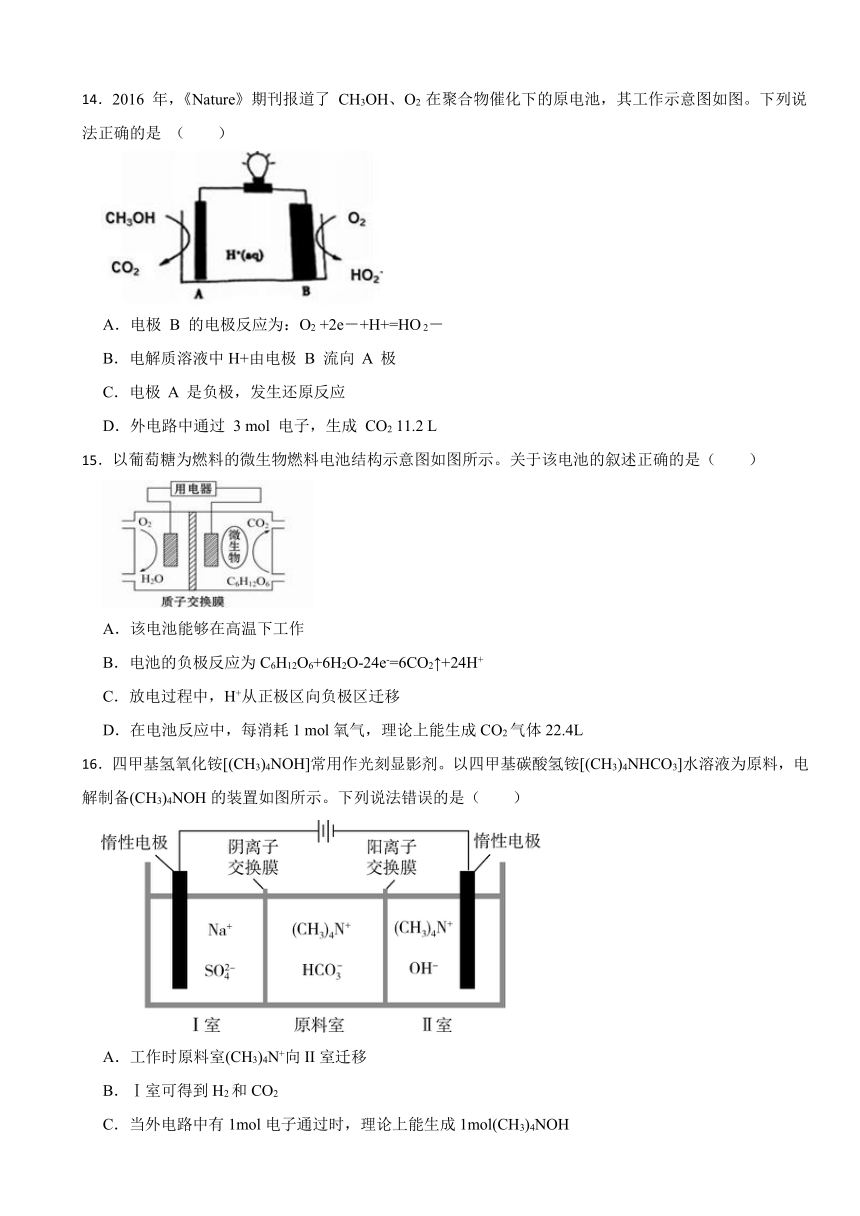
12.工业吸收H2S气体后的FeCl3溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法正确的是( )
A.溶液M中的溶质为FeCl2
B.电极a为阴极
C.电极b上的反应为:
D.随电解的进行,阴极区溶液pH增大
13.某甲烷燃料电池构造示意图如下,关于该电池的说法错误的是( )
A.a极是负极,发生氧化反应
B.正极的电极反应是:O2+2H2O+4e-=4OH-
C.该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
D.甲烷燃料电池是环保电池
14.2016 年,《Nature》期刊报道了 CH3OH、O2 在聚合物催化下的原电池,其工作示意图如图。下列说法正确的是 ( )
A.电极 B 的电极反应为:O2 +2e-+H+=HO 2-
B.电解质溶液中H+由电极 B 流向 A 极
C.电极 A 是负极,发生还原反应
D.外电路中通过 3 mol 电子,生成 CO2 11.2 L
15.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成CO2气体22.4L
16.四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法错误的是( )
A.工作时原料室(CH3)4N+向II室迁移
B.Ⅰ室可得到H2和CO2
C.当外电路中有1mol电子通过时,理论上能生成1mol(CH3)4NOH
D.电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑
二、综合题
17.
(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是 ,负极反应为 ;正极材料是 ,正极反应为 。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO -4e-=4CO2,阴极反应式: ,电池总反应式: 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(4)“镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为 。
18.可燃冰(mCH4 nH2O)、氢气既是高效洁净的能源,又是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量,则该条件下CH4完全燃烧的热化学方程式为 。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是 。
(3)某种氢燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:H2+O2--2e-=H2O
B极:O2+4e-=2O2-
该燃料电池工作时能量转化关系为 ,A极是电池的 极。
(4)已知某甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO+3H2O,则电池负极的电极反应为 ,随着电池不断放电,负极附近溶液的pH 。(填“增大”、“减小”或“不变”)
19.中国力争2030年前实现碳达峰。CO2催化加氢制甲醇,有利于减少温室气体CO2排放。某温度下,CO2加氢制甲醇的总反应为。在体积为的密闭容器中,充入和,测得的物质的量随时间变化如图。
(1)末时, (填“>”、“<”或“=”)。
(2)在恒温恒容条件下,能说明该反应已达平衡状态的是____。
A.CO2体积分数保持不变
B.容器中浓度与浓度之比为1∶1
C.容器中气体压强保持不变
D.混合气体的密度保持不变
E.的生成速率是生成速率的3倍
(3)请在图中画出从反应开始到时混合气体平均摩尔质量随时间的变化趋势图 (无须计算数值)。
(4)甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如图所示。电极A的反应式为 。
20.钛及钛合金在航空航天领城具有重要的应用价值。钛铁矿主要成分为钛酸亚铁(FeTiO3),另含有少量SiO2、Fe2O3等杂质。以钛铁矿为原料制备钛的工艺流程如下图所示。
(1)为提高钛铁矿酸浸时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,还可以采用 (写一种方法)。
(2)硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为 。
钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式: 。
(3)查阅资料可知:TiO2+与Fe3+水解转化为沉淀的pH接近;反应①Fe3++H2Y2=FeY-+2H+,K=1024.3);反应②TiO2++H2Y2-= TiO Y2-+2H+,K=1017.3。含钛铁溶液经EDTA(H2Y2-)处理后再调节pH,TiO2+水解生成偏钛酸[TiO (OH)2]沉淀,则TiO2+水解的离子方程式为: ;Fe3+未转化为沉淀的原因是 。
(4)若将滤液2经 冷却结晶、过滤一系列操作还可获得副产品绿矾(FsO4·7H2O)。滤液2经处理后,还可返回流程中使用的物质是 。
(5)利用下图所示装置在一定条件下由TiO2制取金属钛的化学方程式为 。阳极的电极反应式为 。
21.
(1)由铜、铁和硫酸铜溶液组成的原电池中,作正极的是 (填化学式),正极的电极反应式为 ;电子由 (填“正”或“负”,下同)极经导线移向 极,总反应的离子方程式为 。
(2)若以反应 来设计原电池,则电池的负极材料是 (填化学式,下同),电解质溶液为 溶液。
答案解析部分
1.【答案】D
【解析】【解答】 A、氟利昂破坏臭氧层,导致生物受到严重紫外线伤害,故 采用CO2跨临界制冰,比氟利昂更环保 ,A正确;
B、 光伏发电绿色无污染,符合绿色发展理念,B正确;
C、锂离子电池是充电电池,是二次电池,C正确;
D、 太阳能电池的主要成分为晶体硅,D错误
故答案为:D
【分析】依据元素及其化合物的性质分析,D中 太阳能电池的主要成分为晶体硅。
2.【答案】C
【解析】【解答】A.铝热反应属于氧化还原反应,也属于放热反应,放热反应中反应物总能量高于生成物总能量,能量变化符合该图,A不符合题意;
B.二者的反应为吸热反应,反应物总能量低于生成物总能量,因此能量变化不能用图示表示,B不符合题意;
C.符合图示能量变化的反应为放热反应,反应物总键能小于生成物总键能的反应为放热反应,C符合题意;
D.是否可设计为原电池,与反应过程中放热或吸热无关,可设计成原电池的反应为氧化还原反应,而氧化还原反应可以是吸热反应或放热反应,D不符合题意;
故答案为:C
【分析】A.铝热反应为氧化还原反应,也为放热反应;
B.Ba(OH)2·8H2O与NH4Cl的反应为吸热反应;
C.根据图示能量大小分析;
D.是否可设计为原电池与放热或吸热无关;
3.【答案】B
【解析】【解答】A.放电时电子由负极经过外电路流向正极,所以放电时外电路中电子由负极铝锂电极流出,故A不符合题意;
B.放电时负极发生氧化反应,所以电极反应式: AlLi -e-=Al +Li+,故B符合题意;
C.充电时,应将负极铝锂电极与电源负极相连,故C不符合题意;
D.充电时,阴极锂离子发生还原反应,电极反应为:Al+Li+ +e-=AlLi,所以若电路中转移1mol电子,阴极电极将增重7g,故D不符合题意;
故答案为:B。
【分析】A.放电时Li失去电子,电子从铝锂电极中流出;
B.放电时负极为AlLi 电极,Li失去电子;
C.充电时负极应在AlLi电极将锂离子还原为锂;
D.锂的物质的量为7,1mol锂离子接受1mol电子后生成1mol锂质量为7g。
4.【答案】C
【解析】【解答】A.锌锰电池是一次电池,放电后不能再充电进行使用,A错误;
B.燃料电池产物多为二氧化碳和水,不会污染环境,B错误;
C.化学电池的原理是氧化还原反应,C正确;
D. 铅蓄电池放电的时候,Pb被氧化,为原电池的负极,D错误;
故答案为:C。
【分析】本题主要考查原电池和新型电池的原理和应用。
A.一次电池是放电后不能再充电使用的电池,二次电池是可以放电后充电再使用的电池;
B.燃料电池产物不会污染环境;
C.化学电池的原理是氧化还原反应;
D.铅蓄电池放电的时候,Pb被氧化,为原电池的负极,PbO2被还原,为原电池的正极。
5.【答案】B
【解析】【解答】A. 两个电极活动性相同,不能构成原电池,A不符合题意;
B. 有活动性不同的电极、电解质溶液,形成了闭合回路,能够自发进行氧化还原反应,具备原电池构成条件,B符合题意;
C. 无电解质溶液,不能构成原电池,C不符合题意;
D. 没有形成闭合回路,不能构成原电池,D不符合题意;
故合理选项是B。
【分析】原电池的构成条件为:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④原电池反应是能自发的进行氧化还原反应,据此解答。
6.【答案】A
【解析】【解答】A.电池放电时,Li转化为Li+,Li元素的化合价升高,锂电极发生氧化反应,故A符合题意;
B.电池放电时,O2中O元素的化合价降低,过程为得电子的过程,所以放电时,多孔碳材料电极为正极,故B不符合题意;
C.放电时,Li转化为Li+电子经外电路从锂电极流向多孔碳材料,故C不符合题意;
D.因为该电池是非水介质,所以正极的电极反应式为:O2+4e-=2O2-,故D不符合题意;
故答案为:A。
【分析】根据原电池工作原理进行判断。活泼金属Li做负极,发生氧化反应,电子流出端,通入氧气一端做正极,发生还原反应,电子流入端。
7.【答案】B
【解析】【解答】①CO发生氧化反应,因此通入CO的电极为负极,不符合题意;
②氧气在正极发生还原反应,正极的电极反应式是O2+2H2O+4e-=4OH-,符合题意;
③CO发生氧化反应,在碱性环境下生成为CO32-,通入CO的电极反应式是CO-2e-+4OH-=CO32-+2H2O,不符合题意;
④CO发生氧化反应,在碱性环境下生成为CO32-,负极的电极反应式是CO+4OH--2e-= CO32-+2H2O,符合题意;
⑤放电时溶液中的阳离子向正极移动,不符合题意;
⑥放电时溶液中的阴离子向负极移动,符合题意;
结合以上分析可知,正确的选项有②④⑥;
故答案为:B。
【分析】根据题意可知,发生的反应为2CO+O2=2CO2,反应产生的CO2在KOH溶液中,又会转化为CO32-;一氧化碳在负极发生氧化反应,氧气在正极发生还原反应,阳离子移向正极,阴离子移向负极,据此进行分析。
8.【答案】C
【解析】【解答】A.根据电池总反应,VB2发生氧化反应,所以VB2是负极,故A不符合题意;
B.该电池正极生成氢氧根离子、负极消耗氢氧根离子,所以选择性透过膜能让氢氧根离子选择性透过,故B不符合题意;
C.VB2极为负极,a是正极,所以电子由VB2极经导线、负载流向电极a,故C符合题意;
D.a是正极,电极a上得电子发生还原反应, O2+2H2O+4e-=4OH-,故D不符合题意。
【分析】A.原电池的负极发生氧化反应;
B.电解质溶液中需要运动的离子是氢氧根离子;
C.原电池中电子由负极流向正极;
D.正极发生还原反应,据此书写电极方程式。
9.【答案】A
【解析】【解答】解:A、电流与电子的流向相反,由正极到负极,即电极Ⅱ→→电极Ⅰ,故A正确;
B、电极Ⅱ上铜离子放电生成单质铜,应是有固体析出,而不是溶解,故B错误;
C、电极Ⅰ是负极,发生氧化反应,故C错误;
D、Cl﹣向负极移动,则向左池移动,故D错误;
故选A.
【分析】A、电流与电子的流向相反,由正极到负极,即电极Ⅱ→→电极Ⅰ;
B、电极Ⅱ上铜离子放电生成单质铜,应是有固体析出;
C、电极Ⅰ是负极,发生氧化反应;
D、Cl﹣向负极移动.
10.【答案】B
【解析】【解答】A.根据总反应,Zn失电子,故为该原电池的负极,故A不符合题意;
B.原电池中阳离子移向正极,故电池工作时K+向右侧移动,故B符合题意;
C.电池工作时,电子不能通过溶液和盐桥,故C不符合题意;
D.Cu电极上发生得电子的反应,故电极反应式为Cu2+ +2e﹣ = Cu,故D不符合题意;
故答案为:B。
【分析】原电池中发生总反应Zn+Cu2+= Zn2++Cu。
11.【答案】D
【解析】【解答】A.从图中可以看出M失电子生成M2+,故M电极为原电池的负极,A不符合题意;
B.从图中可以看出,M2+离子和OH-离子可在两电极之间移动,说明电解质为熔融M(OH)2,B不符合题意;
C.阳极反应为O2+2H2O+4e-=4OH-,电路中转移2mol电子,正极需要消耗氧气0.5mol,标准状况为11.2L,C不符合题意;
D.根据电池的正负极方程式可知,电池的总反应为2M+O2+2H2O=2M(OH)2,D符合题意;
故答案为:D。
【分析】从电池示意图中可以看出,左侧金属M失去电子变成M2+,为电池负极;右侧空气中的氧气得到电子与水反应生成OH-,为电池正极,据此答题。
12.【答案】D
【解析】【解答】A.溶液M为吸收H2S气体后的FeCl3溶液,硫化氢与氯化铁反应生成硫单质、氯化亚铁和HCl,同时还有剩余的氯化铁,故A不符合题意;
B.由装置可知b电极的反应为硝酸根转变成氮气,得电子的电极应为阴极,则a为阳极,故B不符合题意;
C.电解质溶液呈酸性,电极b上的反应为: ,故C不符合题意;
D.由b电极的反应可知,反应消耗氢离子,氢离子浓度减小,pH值增大,故D符合题意;
故答案为:D。
【分析】根据右侧判断b是阴极区,发生的还原反应,a是阳极区,发生的是氧化反应。铁离子进入反应池发生氧化还原反应,得到的产物除了氯化亚铁还有其他的物质,在酸性溶液发生电解时氢离子参与反应。
13.【答案】C
【解析】【解答】A、a极通入甲烷,甲烷发生氧化反应,所以a极是负极,不符合题意;
B、正极是氧气发生还原反应,得到电子,结合电解质溶液中的水生成氢氧根离子,不符合题意;
C、因为电解质为碱性,所以生成的二氧化碳与氢氧根离子反应生成碳酸根离子和水,符合题意;
D、甲烷燃料电池最终的不符合题意是碳酸根离子和水,对环境无污染,为环保电池,不符合题意,
故答案为:C。
【分析】原电池的负极失去电子,发生氧化反应,正极得到电子发生还原反应,正极得到的电子和负极失去的电子是相等的,在电解液中,阴离子移向负极,阳离子移向正极。
14.【答案】A
【解析】【解答】A.B为正极,正极为氧气得电子生成HO2-,反应为O2+H++2e-=HO2-,A符合题意;
B.原电池工作时,阳离子向正极移动,H+向电极B移动,B不符合题意;
C.A为负极,负极上CH3OH被氧化生成二氧化碳和水,C不符合题意;
D.未告知气体所处状态,无法计算气体的体积,D不符合题意;
故答案为:A
【分析】原电池工作时,CH3OH在负极上失电子发生氧化反应生成二氧化碳和水,则A为负极,正极B上为氧气得电子生成HO2-。据此结合选项进行分析。
15.【答案】B
【解析】【解答】A、微生物是蛋白质,在高温下变性,所以该电池不能在高温下工作,故A不符合题意;
B. 电池的负极为C6H12O6失电子发生氧化反应,电极反应式是C6H12O6+6H2O-24e-=6CO2↑+24H+,故B符合题意;
C. 放电过程中,H+从负极区向正极区迁移,故C不符合题意;
D、根据得失电子守恒,每消耗1 mol氧气,理论上能生成1mol CO2,在标准状况下的体积是22.4L,故D不符合题意。
【分析】在原电池中,负极失去电子,化合价升高,发生氧化反应,正极得到电子,化合价降低,发生还原反应,负极失去的电子等于正极得到的电子。也就是电子在外电路的流向是负极到正极,在电解液中,阴离子移向负极,阳离子移向正极。
16.【答案】B
【解析】【解答】A.电解池中阳离子向阴极运动,(CH3)4N+向II室迁移,A不符合题意;
B.Ⅰ室为阳极室,水电离出的氢氧根离子放电发生氧化反应生成氧气,2H2O- 4e- =4H++O2↑,向Ⅰ室迁移与生成的氢离子生成水和二氧化碳气体,B符合题意;
C.阴极室中水电离出的氢离子放电发生还原反应生成氢气,2H2O+2e- =2OH-+H2↑,溶液中氢氧根离子浓度变大,原料室中(CH3)4N+向II室迁移生成(CH3)4NOH,(CH3)4N++ OH-=(CH3)4NOH,当外电路中有1mol电子通过时,理论上能生成1mol(CH3)4NOH,C不符合题意;
D.由BC分析可知,总反应为 (CH3)4NHCO3和H2O反应生成氧气、二氧化碳、氢气、(CH3)4NOH,电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑,D不符合题意;
故答案为:B。
【分析】结合题目可知,要制备 四甲基氢氧化铵[(CH3)4NOH] ,(CH3)4N+向II室迁移动,与OH-结合,II室发生2H2O+2e- =2OH-+H2↑,阳极水放电,产生氧气,该过程实质就是电解水的过程
17.【答案】(1)铝;4Al-12e-=4Al3+;石墨等惰性电极;3O2+6H2O+12e-=12OH-
(2)O2+2CO2+4e-=2CO ;2CO+O2=2CO2
(3)负;4Al2Cl7-+3e-=Al+7AlCl4-;H2
(4)ClO-+2e-+H2O=Cl-+2OH
【解析】【解答】(1)该电池为原电池,负极材料为铝,铝失去电子,电极反应式为:4Al-12e-=4Al3+;正极材料为石墨等惰性电极,氧气在正极上得到电子发生还原反应,电极反应式为:3O2+6H2O+12e-=12OH-。
(2)空气中的O2在阴极得到电子并与CO2反应生成CO32-,阴极反应式为:. O2+2CO2+4e-=2CO32- ;将两个电极方程式相加得到电池总反应式:2CO+O2=2CO2。
(3) 钢制品上电镀铝,所以钢制品作阴极,连接电源的负极;Al2Cl7—在阴极上得到电子生成Al,从而铝镀在钢制品上,阴极电极反应式为4Al2Cl7- + 3e- = Al + 7AlCl4-;若改用AlCl3水溶液作电解液,阴极上将是水溶液中的H+得到电子生成H2,故阴极产物为H2。
(4) “镁-次氯酸盐”燃料电池,镁作负极,ClO-在正极上得到电子生成Cl-,同时溶液中产生OH-,所以正极反应式为ClO-+2e-+H2O=Cl-+2OH。
【分析】(1)原电池中负极失电子发生氧化反应,正极得电子发生还原反应
(2)CO为阳极燃气,空气与CO2的混合气为阴极助燃气,则阴极为空气发生反应
(3)电镀时,镀件做阴极,镀层做阳极
(4)正极化合价降低由此可得因为次氯酸根变成铝离子的反应, 电极反应方程式配平:先写反应物生成物,根据化合价升降配平转移电子数,再看条件配平电荷守恒,最后观察法配原子守恒。
18.【答案】(1)CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.24kJ·mol-1
(2)为甲烷分解提供高温(能量)条件
(3)化学能转化为电能;负
(4)CH4-8e-+10OH-=CO +7H2O;减小
【解析】【解答】(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量,1mol甲烷燃烧对应的反应热 ,故则该条件下 完全燃烧的热化学方程式为CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.24kJ·mol-1。
(2)由“高温分解”不难推出通入适量空气使部分甲烷燃烧的目的是为甲烷分解提供高温(能量);
(3)燃料电池能量转化形式为化学能转化为电能,其中失去电子的电极为负极,A极电极反应式为H2+O2--2e-=H2O,所以A极是电池的负极。
(4)由电池反应总式可知,甲烷在负极失去电子转化为 (注意到介质为碱性),故电极反应式为CH4-8e-+10OH-=CO +7H2O,负极消耗 ,故pH减小。
【分析】(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量;
(2)依据“高温分解”推出能量的来源;
(3)燃料电池能量转化形式为化学能转化为电能,根据燃料电池中通入燃料的一极为负极,通入氧气的一极为正极判断;
(4)燃料电池中,燃料在负极失电子发生氧化反应;氧气在正极得电子,发生还原反应。
19.【答案】(1)>
(2)A;C;E
(3)(前达到平衡)
(4)
【解析】【解答】(1)依据反应图像,末时,反应继续向正方向进行着,因此正反应速率比逆反应速率大。
(2)对于反应:
A.CO2体积分数保持不变,符合平衡特征、能说明上述反应达到化学平衡状态,符合;
B.容器中浓度与浓度之比为1∶1,取决于起始时成分的量,不能说明上述反应达到化学平衡状态,不符合;
C.该反应气体分子总数会随着反应而改变、故压强也会改变,当体系压强不随时间变化时,则气体分子总数不变、各成分的物质的量及浓度保持不变,符合;
D.混合气体的密度保持一直保持不变,不可作为平衡标志的判断,不符合;
E.的生成速率是生成速率的3倍,即正反应速率和逆反应速率相等,符合;
因此选择ACE。
(3)从反应开始到时,就达到了平衡状态,因此混合气体平均摩尔质量随时间的变化趋势应该是先增大后不变,但是,起点不能为0,题目要求不需要计算,因此只要有趋势变化即可。图如下:
。
(4)燃料电池中通入甲醇的电极A为负极,因此发生失去电子的氧化反应,碱性条件下C元素最终转化为碳酸根离子,故电极反应为。
【分析】(1)3分钟还未达到平衡,正反应速率大于逆反应速率;
(2)化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
(3)结合公式Mr=m/n进行判断;
(4)新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒。
20.【答案】(1)连续搅拌(或适当升高温度的合理答案均给分)
(2)80~85%;FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(3)TiO2-+2H2O TiO(OH)2+2H+;反应①的K远大于反应②,Fe3+主要转化为FeY-
(4)蒸发浓缩;H2SO4
(5)TiO2 O2↑+Ti;2O2—4e-=O2↑
【解析】【解答】(1)提高钛铁矿酸浸时的浸出率,即加快反应速率,可以连续搅拌或适当升高温度;
故答案为:连续搅拌或适当升高温度;(2)由图可知,硫酸质量分数为80~85%时钛、铁浸出率最高;
FeTiO3与浓硫酸反应生成TiOSO4和FeSO4,化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;
故答案为:80~85%;FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;(3)TiO2+水解生成TiO(OH)2,离子方程式为:TiO2-+2H2O TiO(OH)2+2H+;由于反应①的K远大于反应②,Fe3+主要转化为FeY-,Fe3+未转化为沉淀;
故答案为:TiO2-+2H2O TiO(OH)2+2H+;反应①的K远大于反应②,Fe3+主要转化为FeY-;(4)由流程可知,滤液2含有FeSO4和剩余硫酸,经蒸发浓缩、冷却结晶、过滤一系列操作还可获得副产品绿矾(FsO4·7H2O)。滤液2经处理后,还可返回流程中使用的物质是H2SO4;
故答案为:蒸发浓缩;H2SO4;(5)该装置为电解装置,由TiO2制取金属钛,化学方程式为TiO2 O2↑+Ti;阳极发生氧化反应,电极反应式为2O2—4e-=O2↑;
故答案为:TiO2 O2↑+Ti;2O2—4e-=O2↑。
【分析】(1)搅拌也可以加大反应物的接触面积;
(2)根据浸出率曲线,可知酸浸时所加硫酸的质量分数应为80~85%;
钛酸铁会溶解在硫酸中;
(3)TiO2-属于弱碱阳离子,会发生水解反应使溶液显酸性;
(4)在流程图中,即做反应物又做生成物的物质就可以循环使用;
(5)在电解池中,阳极失去电子,化合价升高,阴极得到电子,化合价降低,在电解液中,阴离子移向阳极,阳离子移向阴极。
21.【答案】(1)Cu;Cu2++2e-=Cu;负;正;Fe+Cu2+=Fe2++Cu
(2)Fe;FeCl3 (或其他可溶性的铁盐)
【解析】【解答】(1)由铜、铁和硫酸铜溶液组成的原电池中,铁作负极,则作正极的是Cu;在正极,溶液中的Cu2+得电子生成Cu,电极反应式为Cu2++2e-=Cu;负极材料铁失电子,从而使电子由负极经导线移向正极,总反应的离子方程式为Fe+Cu2+=Fe2++Cu。答案为:Cu;Cu2++2e-=Cu;负;正;Fe+Cu2+=Fe2++Cu;
(2)若以反应 来设计原电池,则电池的负极材料应为失电子的反应物,所以是Fe,电解质溶液为FeCl3(或其他可溶性的铁盐)溶液。答案为:Fe;FeCl3(或其他可溶性的铁盐)。
【分析】在原电池中,相对活泼的金属电极为负极,相对不活泼的金属电极或非金属电极作正极,且负极材料能与电解质溶液发生氧化还原反应。设计原电池时,需分析电池反应,失电子的反应物作负极,得电子的离子来自电解质。
一、单选题
1.在刚刚过去的2022年,我国的科技发展成果举世瞩目。下列说法不正确的是( )
A.2022年冬奥会中,国家速滑馆“冰丝带”采用CO2跨临界制冰,比氟利昂更环保
B.2022年我国风电、光伏发电量突破一万亿千瓦时,光伏发电符合绿色发展理念
C.2022年我国锂离子电池产量同比增长超130%,锂离子电池属于二次电池
D.2022年中国空间站全面建成,空间站所使用太阳能电池的主要成分为SiO2
2.如图所示,有关化学反应和能量变化的说法正确的是( )
A.铝热反应属于氧化还原反应,故能量变化不符合该图
B.Ba(OH)2·8H2O晶体和NH4Cl品体反应能量变化如图所示
C.反应物总键能小于产物总键能的反应符合该图的能量变化
D.符合该能量变化的化学反应均可用于设计成原电池
3.2019年诺贝尔化学奖是关于锂电池研究的。我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6) Al+C6+Li++PF 6,下列说法正确的是( )
A.放电时外电路中电子向铝锂电极移动
B.放电时负极反应为AlLi-e =Al+Li+
C.充电时,应将石墨烯电极与电源负极相连
D.充电时,若电路中转移1 mol电子,则阴极质量增加9g
4.下列说法正确的是( )
A.锌锰电池是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应原理是氧化还原反应
D.铅蓄电池放电时正极是Pb
5.下列各装置能构成原电池的是( )
A. B.
C. D.
6.2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时, 与 在多孔碳材料电极处生成 ( 或1)。下列说法正确的是( )
A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:
7.将两个铂电极放置在KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,称为燃料电池,下列叙述正确的是( )
①通入CO的电极为正极;
②正极的电极反应式是O2+2H2O+4e-=4OH-;
③通入CO的电极反应式是2CO+O2-4e-=2CO2;
④负极的电极反应式是CO+4OH--2e-=CO32-+2H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③
8.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时反应为4VB2+ 11O2=4B2O3+2V2O5。下列说法正确的是( )
A.VB2极为负极,发生还原反应
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经导线、负载流向电极a
D.电极a上发生反应为O2+2H2O-4e-=4OH-
9.某同学组装了如图所示的原电池装置,下列叙述中正确的是( )
A.电流方向:电极Ⅱ→ →电极Ⅰ
B.电极Ⅱ逐渐溶解
C.电极Ⅰ上发生还原反应
D.盐桥中装有含氯化钾的琼脂,Cl﹣向右池移动
10.某铜锌原电池的结构如图所示,下列说法正确的是( )
A.Zn电极为该原电池的正极
B.若盐桥中电解质为KCl,则电池工作时K+向右侧移动
C.电池工作时,电子由Zn电极流出,经溶液和盐桥流入Cu电极
D.Cu电极上的电极反应式为Cu - 2e﹣ = Cu2+
11.金属(M)空气电池的工作原理如图所示。下列说法正确的是( )
A.金属M作电池正极
B.电解质是熔融的MO
C.电路中转移2 mol电子,理论上约消耗空气56 L
D.电池总反应为2M+O2+2H2O=2M(OH)2
12.工业吸收H2S气体后的FeCl3溶液的再生过程可降解酸性污水中的硝酸盐,其工作原理如图所示。下列说法正确的是( )
A.溶液M中的溶质为FeCl2
B.电极a为阴极
C.电极b上的反应为:
D.随电解的进行,阴极区溶液pH增大
13.某甲烷燃料电池构造示意图如下,关于该电池的说法错误的是( )
A.a极是负极,发生氧化反应
B.正极的电极反应是:O2+2H2O+4e-=4OH-
C.该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
D.甲烷燃料电池是环保电池
14.2016 年,《Nature》期刊报道了 CH3OH、O2 在聚合物催化下的原电池,其工作示意图如图。下列说法正确的是 ( )
A.电极 B 的电极反应为:O2 +2e-+H+=HO 2-
B.电解质溶液中H+由电极 B 流向 A 极
C.电极 A 是负极,发生还原反应
D.外电路中通过 3 mol 电子,生成 CO2 11.2 L
15.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成CO2气体22.4L
16.四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法错误的是( )
A.工作时原料室(CH3)4N+向II室迁移
B.Ⅰ室可得到H2和CO2
C.当外电路中有1mol电子通过时,理论上能生成1mol(CH3)4NOH
D.电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑
二、综合题
17.
(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是 ,负极反应为 ;正极材料是 ,正极反应为 。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO -4e-=4CO2,阴极反应式: ,电池总反应式: 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(4)“镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为 。
18.可燃冰(mCH4 nH2O)、氢气既是高效洁净的能源,又是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量,则该条件下CH4完全燃烧的热化学方程式为 。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是 。
(3)某种氢燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:H2+O2--2e-=H2O
B极:O2+4e-=2O2-
该燃料电池工作时能量转化关系为 ,A极是电池的 极。
(4)已知某甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO+3H2O,则电池负极的电极反应为 ,随着电池不断放电,负极附近溶液的pH 。(填“增大”、“减小”或“不变”)
19.中国力争2030年前实现碳达峰。CO2催化加氢制甲醇,有利于减少温室气体CO2排放。某温度下,CO2加氢制甲醇的总反应为。在体积为的密闭容器中,充入和,测得的物质的量随时间变化如图。
(1)末时, (填“>”、“<”或“=”)。
(2)在恒温恒容条件下,能说明该反应已达平衡状态的是____。
A.CO2体积分数保持不变
B.容器中浓度与浓度之比为1∶1
C.容器中气体压强保持不变
D.混合气体的密度保持不变
E.的生成速率是生成速率的3倍
(3)请在图中画出从反应开始到时混合气体平均摩尔质量随时间的变化趋势图 (无须计算数值)。
(4)甲醇是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如图所示。电极A的反应式为 。
20.钛及钛合金在航空航天领城具有重要的应用价值。钛铁矿主要成分为钛酸亚铁(FeTiO3),另含有少量SiO2、Fe2O3等杂质。以钛铁矿为原料制备钛的工艺流程如下图所示。
(1)为提高钛铁矿酸浸时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,还可以采用 (写一种方法)。
(2)硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为 。
钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式: 。
(3)查阅资料可知:TiO2+与Fe3+水解转化为沉淀的pH接近;反应①Fe3++H2Y2=FeY-+2H+,K=1024.3);反应②TiO2++H2Y2-= TiO Y2-+2H+,K=1017.3。含钛铁溶液经EDTA(H2Y2-)处理后再调节pH,TiO2+水解生成偏钛酸[TiO (OH)2]沉淀,则TiO2+水解的离子方程式为: ;Fe3+未转化为沉淀的原因是 。
(4)若将滤液2经 冷却结晶、过滤一系列操作还可获得副产品绿矾(FsO4·7H2O)。滤液2经处理后,还可返回流程中使用的物质是 。
(5)利用下图所示装置在一定条件下由TiO2制取金属钛的化学方程式为 。阳极的电极反应式为 。
21.
(1)由铜、铁和硫酸铜溶液组成的原电池中,作正极的是 (填化学式),正极的电极反应式为 ;电子由 (填“正”或“负”,下同)极经导线移向 极,总反应的离子方程式为 。
(2)若以反应 来设计原电池,则电池的负极材料是 (填化学式,下同),电解质溶液为 溶液。
答案解析部分
1.【答案】D
【解析】【解答】 A、氟利昂破坏臭氧层,导致生物受到严重紫外线伤害,故 采用CO2跨临界制冰,比氟利昂更环保 ,A正确;
B、 光伏发电绿色无污染,符合绿色发展理念,B正确;
C、锂离子电池是充电电池,是二次电池,C正确;
D、 太阳能电池的主要成分为晶体硅,D错误
故答案为:D
【分析】依据元素及其化合物的性质分析,D中 太阳能电池的主要成分为晶体硅。
2.【答案】C
【解析】【解答】A.铝热反应属于氧化还原反应,也属于放热反应,放热反应中反应物总能量高于生成物总能量,能量变化符合该图,A不符合题意;
B.二者的反应为吸热反应,反应物总能量低于生成物总能量,因此能量变化不能用图示表示,B不符合题意;
C.符合图示能量变化的反应为放热反应,反应物总键能小于生成物总键能的反应为放热反应,C符合题意;
D.是否可设计为原电池,与反应过程中放热或吸热无关,可设计成原电池的反应为氧化还原反应,而氧化还原反应可以是吸热反应或放热反应,D不符合题意;
故答案为:C
【分析】A.铝热反应为氧化还原反应,也为放热反应;
B.Ba(OH)2·8H2O与NH4Cl的反应为吸热反应;
C.根据图示能量大小分析;
D.是否可设计为原电池与放热或吸热无关;
3.【答案】B
【解析】【解答】A.放电时电子由负极经过外电路流向正极,所以放电时外电路中电子由负极铝锂电极流出,故A不符合题意;
B.放电时负极发生氧化反应,所以电极反应式: AlLi -e-=Al +Li+,故B符合题意;
C.充电时,应将负极铝锂电极与电源负极相连,故C不符合题意;
D.充电时,阴极锂离子发生还原反应,电极反应为:Al+Li+ +e-=AlLi,所以若电路中转移1mol电子,阴极电极将增重7g,故D不符合题意;
故答案为:B。
【分析】A.放电时Li失去电子,电子从铝锂电极中流出;
B.放电时负极为AlLi 电极,Li失去电子;
C.充电时负极应在AlLi电极将锂离子还原为锂;
D.锂的物质的量为7,1mol锂离子接受1mol电子后生成1mol锂质量为7g。
4.【答案】C
【解析】【解答】A.锌锰电池是一次电池,放电后不能再充电进行使用,A错误;
B.燃料电池产物多为二氧化碳和水,不会污染环境,B错误;
C.化学电池的原理是氧化还原反应,C正确;
D. 铅蓄电池放电的时候,Pb被氧化,为原电池的负极,D错误;
故答案为:C。
【分析】本题主要考查原电池和新型电池的原理和应用。
A.一次电池是放电后不能再充电使用的电池,二次电池是可以放电后充电再使用的电池;
B.燃料电池产物不会污染环境;
C.化学电池的原理是氧化还原反应;
D.铅蓄电池放电的时候,Pb被氧化,为原电池的负极,PbO2被还原,为原电池的正极。
5.【答案】B
【解析】【解答】A. 两个电极活动性相同,不能构成原电池,A不符合题意;
B. 有活动性不同的电极、电解质溶液,形成了闭合回路,能够自发进行氧化还原反应,具备原电池构成条件,B符合题意;
C. 无电解质溶液,不能构成原电池,C不符合题意;
D. 没有形成闭合回路,不能构成原电池,D不符合题意;
故合理选项是B。
【分析】原电池的构成条件为:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④原电池反应是能自发的进行氧化还原反应,据此解答。
6.【答案】A
【解析】【解答】A.电池放电时,Li转化为Li+,Li元素的化合价升高,锂电极发生氧化反应,故A符合题意;
B.电池放电时,O2中O元素的化合价降低,过程为得电子的过程,所以放电时,多孔碳材料电极为正极,故B不符合题意;
C.放电时,Li转化为Li+电子经外电路从锂电极流向多孔碳材料,故C不符合题意;
D.因为该电池是非水介质,所以正极的电极反应式为:O2+4e-=2O2-,故D不符合题意;
故答案为:A。
【分析】根据原电池工作原理进行判断。活泼金属Li做负极,发生氧化反应,电子流出端,通入氧气一端做正极,发生还原反应,电子流入端。
7.【答案】B
【解析】【解答】①CO发生氧化反应,因此通入CO的电极为负极,不符合题意;
②氧气在正极发生还原反应,正极的电极反应式是O2+2H2O+4e-=4OH-,符合题意;
③CO发生氧化反应,在碱性环境下生成为CO32-,通入CO的电极反应式是CO-2e-+4OH-=CO32-+2H2O,不符合题意;
④CO发生氧化反应,在碱性环境下生成为CO32-,负极的电极反应式是CO+4OH--2e-= CO32-+2H2O,符合题意;
⑤放电时溶液中的阳离子向正极移动,不符合题意;
⑥放电时溶液中的阴离子向负极移动,符合题意;
结合以上分析可知,正确的选项有②④⑥;
故答案为:B。
【分析】根据题意可知,发生的反应为2CO+O2=2CO2,反应产生的CO2在KOH溶液中,又会转化为CO32-;一氧化碳在负极发生氧化反应,氧气在正极发生还原反应,阳离子移向正极,阴离子移向负极,据此进行分析。
8.【答案】C
【解析】【解答】A.根据电池总反应,VB2发生氧化反应,所以VB2是负极,故A不符合题意;
B.该电池正极生成氢氧根离子、负极消耗氢氧根离子,所以选择性透过膜能让氢氧根离子选择性透过,故B不符合题意;
C.VB2极为负极,a是正极,所以电子由VB2极经导线、负载流向电极a,故C符合题意;
D.a是正极,电极a上得电子发生还原反应, O2+2H2O+4e-=4OH-,故D不符合题意。
【分析】A.原电池的负极发生氧化反应;
B.电解质溶液中需要运动的离子是氢氧根离子;
C.原电池中电子由负极流向正极;
D.正极发生还原反应,据此书写电极方程式。
9.【答案】A
【解析】【解答】解:A、电流与电子的流向相反,由正极到负极,即电极Ⅱ→→电极Ⅰ,故A正确;
B、电极Ⅱ上铜离子放电生成单质铜,应是有固体析出,而不是溶解,故B错误;
C、电极Ⅰ是负极,发生氧化反应,故C错误;
D、Cl﹣向负极移动,则向左池移动,故D错误;
故选A.
【分析】A、电流与电子的流向相反,由正极到负极,即电极Ⅱ→→电极Ⅰ;
B、电极Ⅱ上铜离子放电生成单质铜,应是有固体析出;
C、电极Ⅰ是负极,发生氧化反应;
D、Cl﹣向负极移动.
10.【答案】B
【解析】【解答】A.根据总反应,Zn失电子,故为该原电池的负极,故A不符合题意;
B.原电池中阳离子移向正极,故电池工作时K+向右侧移动,故B符合题意;
C.电池工作时,电子不能通过溶液和盐桥,故C不符合题意;
D.Cu电极上发生得电子的反应,故电极反应式为Cu2+ +2e﹣ = Cu,故D不符合题意;
故答案为:B。
【分析】原电池中发生总反应Zn+Cu2+= Zn2++Cu。
11.【答案】D
【解析】【解答】A.从图中可以看出M失电子生成M2+,故M电极为原电池的负极,A不符合题意;
B.从图中可以看出,M2+离子和OH-离子可在两电极之间移动,说明电解质为熔融M(OH)2,B不符合题意;
C.阳极反应为O2+2H2O+4e-=4OH-,电路中转移2mol电子,正极需要消耗氧气0.5mol,标准状况为11.2L,C不符合题意;
D.根据电池的正负极方程式可知,电池的总反应为2M+O2+2H2O=2M(OH)2,D符合题意;
故答案为:D。
【分析】从电池示意图中可以看出,左侧金属M失去电子变成M2+,为电池负极;右侧空气中的氧气得到电子与水反应生成OH-,为电池正极,据此答题。
12.【答案】D
【解析】【解答】A.溶液M为吸收H2S气体后的FeCl3溶液,硫化氢与氯化铁反应生成硫单质、氯化亚铁和HCl,同时还有剩余的氯化铁,故A不符合题意;
B.由装置可知b电极的反应为硝酸根转变成氮气,得电子的电极应为阴极,则a为阳极,故B不符合题意;
C.电解质溶液呈酸性,电极b上的反应为: ,故C不符合题意;
D.由b电极的反应可知,反应消耗氢离子,氢离子浓度减小,pH值增大,故D符合题意;
故答案为:D。
【分析】根据右侧判断b是阴极区,发生的还原反应,a是阳极区,发生的是氧化反应。铁离子进入反应池发生氧化还原反应,得到的产物除了氯化亚铁还有其他的物质,在酸性溶液发生电解时氢离子参与反应。
13.【答案】C
【解析】【解答】A、a极通入甲烷,甲烷发生氧化反应,所以a极是负极,不符合题意;
B、正极是氧气发生还原反应,得到电子,结合电解质溶液中的水生成氢氧根离子,不符合题意;
C、因为电解质为碱性,所以生成的二氧化碳与氢氧根离子反应生成碳酸根离子和水,符合题意;
D、甲烷燃料电池最终的不符合题意是碳酸根离子和水,对环境无污染,为环保电池,不符合题意,
故答案为:C。
【分析】原电池的负极失去电子,发生氧化反应,正极得到电子发生还原反应,正极得到的电子和负极失去的电子是相等的,在电解液中,阴离子移向负极,阳离子移向正极。
14.【答案】A
【解析】【解答】A.B为正极,正极为氧气得电子生成HO2-,反应为O2+H++2e-=HO2-,A符合题意;
B.原电池工作时,阳离子向正极移动,H+向电极B移动,B不符合题意;
C.A为负极,负极上CH3OH被氧化生成二氧化碳和水,C不符合题意;
D.未告知气体所处状态,无法计算气体的体积,D不符合题意;
故答案为:A
【分析】原电池工作时,CH3OH在负极上失电子发生氧化反应生成二氧化碳和水,则A为负极,正极B上为氧气得电子生成HO2-。据此结合选项进行分析。
15.【答案】B
【解析】【解答】A、微生物是蛋白质,在高温下变性,所以该电池不能在高温下工作,故A不符合题意;
B. 电池的负极为C6H12O6失电子发生氧化反应,电极反应式是C6H12O6+6H2O-24e-=6CO2↑+24H+,故B符合题意;
C. 放电过程中,H+从负极区向正极区迁移,故C不符合题意;
D、根据得失电子守恒,每消耗1 mol氧气,理论上能生成1mol CO2,在标准状况下的体积是22.4L,故D不符合题意。
【分析】在原电池中,负极失去电子,化合价升高,发生氧化反应,正极得到电子,化合价降低,发生还原反应,负极失去的电子等于正极得到的电子。也就是电子在外电路的流向是负极到正极,在电解液中,阴离子移向负极,阳离子移向正极。
16.【答案】B
【解析】【解答】A.电解池中阳离子向阴极运动,(CH3)4N+向II室迁移,A不符合题意;
B.Ⅰ室为阳极室,水电离出的氢氧根离子放电发生氧化反应生成氧气,2H2O- 4e- =4H++O2↑,向Ⅰ室迁移与生成的氢离子生成水和二氧化碳气体,B符合题意;
C.阴极室中水电离出的氢离子放电发生还原反应生成氢气,2H2O+2e- =2OH-+H2↑,溶液中氢氧根离子浓度变大,原料室中(CH3)4N+向II室迁移生成(CH3)4NOH,(CH3)4N++ OH-=(CH3)4NOH,当外电路中有1mol电子通过时,理论上能生成1mol(CH3)4NOH,C不符合题意;
D.由BC分析可知,总反应为 (CH3)4NHCO3和H2O反应生成氧气、二氧化碳、氢气、(CH3)4NOH,电解总反应:4(CH3)4NHCO3+2H2O4(CH3)4NOH+2H2↑+O2↑+4CO2↑,D不符合题意;
故答案为:B。
【分析】结合题目可知,要制备 四甲基氢氧化铵[(CH3)4NOH] ,(CH3)4N+向II室迁移动,与OH-结合,II室发生2H2O+2e- =2OH-+H2↑,阳极水放电,产生氧气,该过程实质就是电解水的过程
17.【答案】(1)铝;4Al-12e-=4Al3+;石墨等惰性电极;3O2+6H2O+12e-=12OH-
(2)O2+2CO2+4e-=2CO ;2CO+O2=2CO2
(3)负;4Al2Cl7-+3e-=Al+7AlCl4-;H2
(4)ClO-+2e-+H2O=Cl-+2OH
【解析】【解答】(1)该电池为原电池,负极材料为铝,铝失去电子,电极反应式为:4Al-12e-=4Al3+;正极材料为石墨等惰性电极,氧气在正极上得到电子发生还原反应,电极反应式为:3O2+6H2O+12e-=12OH-。
(2)空气中的O2在阴极得到电子并与CO2反应生成CO32-,阴极反应式为:. O2+2CO2+4e-=2CO32- ;将两个电极方程式相加得到电池总反应式:2CO+O2=2CO2。
(3) 钢制品上电镀铝,所以钢制品作阴极,连接电源的负极;Al2Cl7—在阴极上得到电子生成Al,从而铝镀在钢制品上,阴极电极反应式为4Al2Cl7- + 3e- = Al + 7AlCl4-;若改用AlCl3水溶液作电解液,阴极上将是水溶液中的H+得到电子生成H2,故阴极产物为H2。
(4) “镁-次氯酸盐”燃料电池,镁作负极,ClO-在正极上得到电子生成Cl-,同时溶液中产生OH-,所以正极反应式为ClO-+2e-+H2O=Cl-+2OH。
【分析】(1)原电池中负极失电子发生氧化反应,正极得电子发生还原反应
(2)CO为阳极燃气,空气与CO2的混合气为阴极助燃气,则阴极为空气发生反应
(3)电镀时,镀件做阴极,镀层做阳极
(4)正极化合价降低由此可得因为次氯酸根变成铝离子的反应, 电极反应方程式配平:先写反应物生成物,根据化合价升降配平转移电子数,再看条件配平电荷守恒,最后观察法配原子守恒。
18.【答案】(1)CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.24kJ·mol-1
(2)为甲烷分解提供高温(能量)条件
(3)化学能转化为电能;负
(4)CH4-8e-+10OH-=CO +7H2O;减小
【解析】【解答】(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量,1mol甲烷燃烧对应的反应热 ,故则该条件下 完全燃烧的热化学方程式为CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.24kJ·mol-1。
(2)由“高温分解”不难推出通入适量空气使部分甲烷燃烧的目的是为甲烷分解提供高温(能量);
(3)燃料电池能量转化形式为化学能转化为电能,其中失去电子的电极为负极,A极电极反应式为H2+O2--2e-=H2O,所以A极是电池的负极。
(4)由电池反应总式可知,甲烷在负极失去电子转化为 (注意到介质为碱性),故电极反应式为CH4-8e-+10OH-=CO +7H2O,负极消耗 ,故pH减小。
【分析】(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量;
(2)依据“高温分解”推出能量的来源;
(3)燃料电池能量转化形式为化学能转化为电能,根据燃料电池中通入燃料的一极为负极,通入氧气的一极为正极判断;
(4)燃料电池中,燃料在负极失电子发生氧化反应;氧气在正极得电子,发生还原反应。
19.【答案】(1)>
(2)A;C;E
(3)(前达到平衡)
(4)
【解析】【解答】(1)依据反应图像,末时,反应继续向正方向进行着,因此正反应速率比逆反应速率大。
(2)对于反应:
A.CO2体积分数保持不变,符合平衡特征、能说明上述反应达到化学平衡状态,符合;
B.容器中浓度与浓度之比为1∶1,取决于起始时成分的量,不能说明上述反应达到化学平衡状态,不符合;
C.该反应气体分子总数会随着反应而改变、故压强也会改变,当体系压强不随时间变化时,则气体分子总数不变、各成分的物质的量及浓度保持不变,符合;
D.混合气体的密度保持一直保持不变,不可作为平衡标志的判断,不符合;
E.的生成速率是生成速率的3倍,即正反应速率和逆反应速率相等,符合;
因此选择ACE。
(3)从反应开始到时,就达到了平衡状态,因此混合气体平均摩尔质量随时间的变化趋势应该是先增大后不变,但是,起点不能为0,题目要求不需要计算,因此只要有趋势变化即可。图如下:
。
(4)燃料电池中通入甲醇的电极A为负极,因此发生失去电子的氧化反应,碱性条件下C元素最终转化为碳酸根离子,故电极反应为。
【分析】(1)3分钟还未达到平衡,正反应速率大于逆反应速率;
(2)化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
(3)结合公式Mr=m/n进行判断;
(4)新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒。
20.【答案】(1)连续搅拌(或适当升高温度的合理答案均给分)
(2)80~85%;FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(3)TiO2-+2H2O TiO(OH)2+2H+;反应①的K远大于反应②,Fe3+主要转化为FeY-
(4)蒸发浓缩;H2SO4
(5)TiO2 O2↑+Ti;2O2—4e-=O2↑
【解析】【解答】(1)提高钛铁矿酸浸时的浸出率,即加快反应速率,可以连续搅拌或适当升高温度;
故答案为:连续搅拌或适当升高温度;(2)由图可知,硫酸质量分数为80~85%时钛、铁浸出率最高;
FeTiO3与浓硫酸反应生成TiOSO4和FeSO4,化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;
故答案为:80~85%;FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;(3)TiO2+水解生成TiO(OH)2,离子方程式为:TiO2-+2H2O TiO(OH)2+2H+;由于反应①的K远大于反应②,Fe3+主要转化为FeY-,Fe3+未转化为沉淀;
故答案为:TiO2-+2H2O TiO(OH)2+2H+;反应①的K远大于反应②,Fe3+主要转化为FeY-;(4)由流程可知,滤液2含有FeSO4和剩余硫酸,经蒸发浓缩、冷却结晶、过滤一系列操作还可获得副产品绿矾(FsO4·7H2O)。滤液2经处理后,还可返回流程中使用的物质是H2SO4;
故答案为:蒸发浓缩;H2SO4;(5)该装置为电解装置,由TiO2制取金属钛,化学方程式为TiO2 O2↑+Ti;阳极发生氧化反应,电极反应式为2O2—4e-=O2↑;
故答案为:TiO2 O2↑+Ti;2O2—4e-=O2↑。
【分析】(1)搅拌也可以加大反应物的接触面积;
(2)根据浸出率曲线,可知酸浸时所加硫酸的质量分数应为80~85%;
钛酸铁会溶解在硫酸中;
(3)TiO2-属于弱碱阳离子,会发生水解反应使溶液显酸性;
(4)在流程图中,即做反应物又做生成物的物质就可以循环使用;
(5)在电解池中,阳极失去电子,化合价升高,阴极得到电子,化合价降低,在电解液中,阴离子移向阳极,阳离子移向阴极。
21.【答案】(1)Cu;Cu2++2e-=Cu;负;正;Fe+Cu2+=Fe2++Cu
(2)Fe;FeCl3 (或其他可溶性的铁盐)
【解析】【解答】(1)由铜、铁和硫酸铜溶液组成的原电池中,铁作负极,则作正极的是Cu;在正极,溶液中的Cu2+得电子生成Cu,电极反应式为Cu2++2e-=Cu;负极材料铁失电子,从而使电子由负极经导线移向正极,总反应的离子方程式为Fe+Cu2+=Fe2++Cu。答案为:Cu;Cu2++2e-=Cu;负;正;Fe+Cu2+=Fe2++Cu;
(2)若以反应 来设计原电池,则电池的负极材料应为失电子的反应物,所以是Fe,电解质溶液为FeCl3(或其他可溶性的铁盐)溶液。答案为:Fe;FeCl3(或其他可溶性的铁盐)。
【分析】在原电池中,相对活泼的金属电极为负极,相对不活泼的金属电极或非金属电极作正极,且负极材料能与电解质溶液发生氧化还原反应。设计原电池时,需分析电池反应,失电子的反应物作负极,得电子的离子来自电解质。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
