化学人教版(2019)必修一4.1.1原子结构(共15张ppt)
文档属性
| 名称 | 化学人教版(2019)必修一4.1.1原子结构(共15张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 876.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 18:33:23 | ||
图片预览





文档简介
(共15张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构
1.了解原子的表示方法,知道原子的结构及构成原子的微粒间的关系。掌握有关质量数、质子数、中子数、电子数的相关计算。
2.在复习核电荷数为1-20的元素原子的核外电子排布,分析、总结其排布规律并建构模型,运用规律画出原子或简单离子的结构示意图。发展学生”微观探析和模型认知”核心素养。
核心素养
情境导学
元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。元素周期表的建立成为化学发展史上的重要里程碑之一。20世纪初,原子结构的奥秘被揭示之后,人们对元素周期表的认识更加完善。那么,原子结构与元素周期表之间有怎样的关系呢?
道尔顿模型(1803年):
实心模型
汤姆孙原子模型(1904年):
葡萄干模型
卢瑟福原子模型
(1911年):
行星模型
玻尔原子模型(1913年):
量子化模型
现代物质结构学说(1926年):
电子云模型
原子结构的探索历程(科学史话)
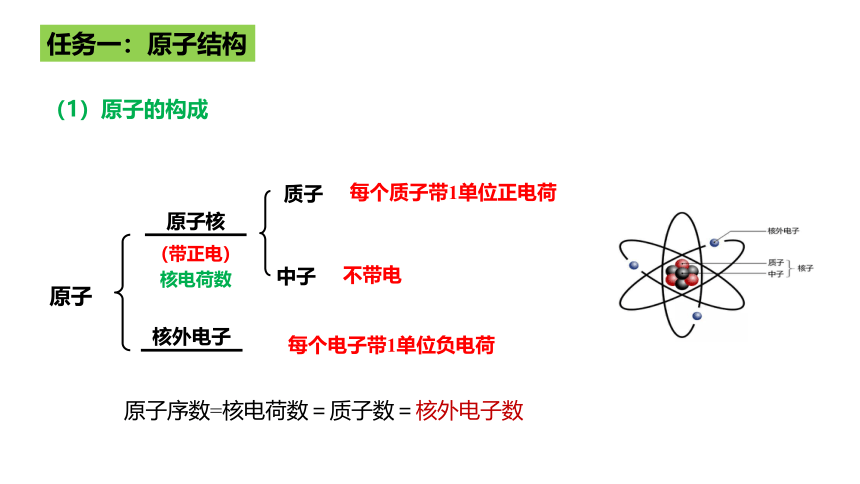
质子
中子
(带正电)
核电荷数
原子核
原子
核外电子
每个质子带1单位正电荷
不带电
每个电子带1单位负电荷
任务一:原子结构
(1)原子的构成
原子序数=核电荷数=质子数=核外电子数
任务一:原子结构
(2)质量数
原子的质量主要集中在原子核上。质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值,相加,所得的数值叫做质量数,常用A表示。
质量数(A)=质子数(Z)+中子数(N)。
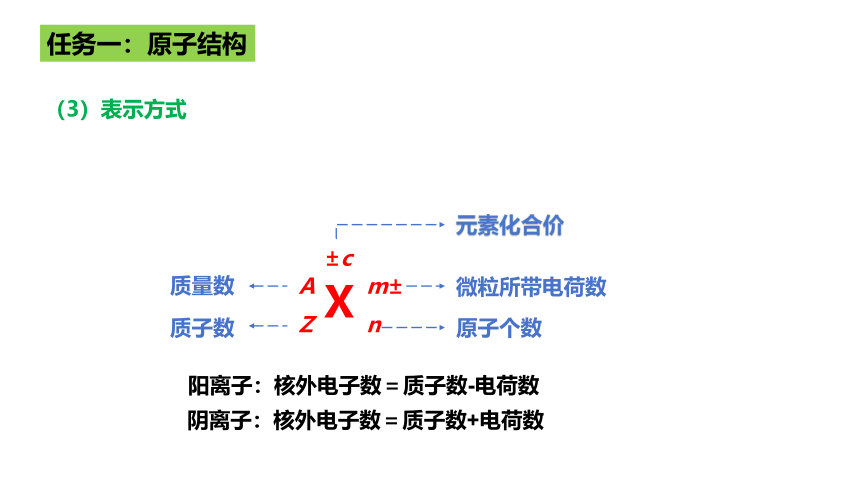
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
任务一:原子结构
(3)表示方式
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
例2 原子的质量主要由原子核决定。已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为( )
A.A-X B.A-X-n
C.A-X+n D.A+X-n
B
例1 广泛用于文物年代测定。下列关于 说法不正确的是( )
A.质子数为6
B.电子数为8
C.中子数为8
D.质量数为14
6C
14
6C
14
B
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层。
序数 1 2 3 4 5 6 7
符号 K L M N O P Q
(2)电子层的表示方法
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(3)电子的运动规律:
任务二:核外电子排布
离核距离: 近 → 远
电子能量: 低 → 高
能量最低原理
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
① 各电子层最多容纳_______个电子
② 最外层电子数不超过_____个
(K层为最外层时不超过___个)
③ 次外层电子数不超过____个
(当K层为次外层时不超过___个)
(当L层为次外层时不超过___个)
④ 倒数第三层电子数不超过____个
2n2
8
2
18
2
8
32
(4)核外电子排布规律
【核外电子排布规律】
任务二:核外电子排布
(5)核外电子排布的表示方法
原子(或离子)结构示意图
粒子符号
原子核
质子数(或核电荷数)
电子层
该电子层上的电子数
+11
2 8 1
Na
【评价训练】画出下列原子或离子的结构示意图
①S: ,S2-: ; ②Ca: ,Ca2+: 。
任务二:核外电子排布
(1)最外层电子数与电子层数相等的元素有___________;
(2)最外层电子数是电子层数2倍的元素有___________;
(3)最外层电子数是电子层数3倍的元素有___________;
(4)最外层电子数与次外层电子数相等的元素有________;
(5)最外层电子数是次外层电子数2倍的元素是_________;
(6)最外层电子数是次外层电子数3倍的元素是_________;
(7)次外层电子数是最外层电子数2倍的元素有_________;
(8)内层电子总数是最外层电子数2倍的元素有_________;
C、
H、
Be、
Al
He、
S
O
1-20号元素原子核外电子排布特征
Be、
Ar
C
O
Li、
Si
Li、
P
例4 下列各组微粒中,核外电子层结构相同的是 ( )
A.Mg2+ 、Al3+、 Cl-、 Ne
B.Na+、 F- 、S2- 、Ar
C.K+、 Ca2+ 、S2-、Ar
D.Mg2+ 、O2-、Na+、 Cl-
例3 元素X的离子结构示意图为 ,元素Y的原子结构示意图为 ,则元素X与元素Y形成常见化合物的化学式为( )
A.XY B.XY2 C.X2Y2 D.XY3
C
C
(1)常见的10e-微粒
(2)常见的18e-微粒
F-、O2-、N3-、OH-
HF、H2O、NH3、CH4
Na+、Mg2+、Al3+、、H3O+
H2S
F2
K+、Ca2+
课堂延伸
例5 已知X、Y、Z、W四种元素是1-18号元素,其中X是最轻的元素;Y元素原子最外层电子数是内层电子总数的2倍;Z元素原子最外层电子数比次外层电子数多4;W原子最外层有1个电子,其阳离子与Z的简单阴离子的核外电子总数相同。请完成下列问题:
(1)W元素的原子结构示意图 ;由X、Z元素组成的10电子微粒可能有: 。
(2)含X、Y、Z、W四种元素的化合物是 。
(3)化合物W、Z、X与Cl2反应的化学方程式:
。
H2O、OH-
NaHCO3
2NaOH+Cl2=NaCl+NaClO+H2O
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时 原子结构
1.了解原子的表示方法,知道原子的结构及构成原子的微粒间的关系。掌握有关质量数、质子数、中子数、电子数的相关计算。
2.在复习核电荷数为1-20的元素原子的核外电子排布,分析、总结其排布规律并建构模型,运用规律画出原子或简单离子的结构示意图。发展学生”微观探析和模型认知”核心素养。
核心素养
情境导学
元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。元素周期表的建立成为化学发展史上的重要里程碑之一。20世纪初,原子结构的奥秘被揭示之后,人们对元素周期表的认识更加完善。那么,原子结构与元素周期表之间有怎样的关系呢?
道尔顿模型(1803年):
实心模型
汤姆孙原子模型(1904年):
葡萄干模型
卢瑟福原子模型
(1911年):
行星模型
玻尔原子模型(1913年):
量子化模型
现代物质结构学说(1926年):
电子云模型
原子结构的探索历程(科学史话)
质子
中子
(带正电)
核电荷数
原子核
原子
核外电子
每个质子带1单位正电荷
不带电
每个电子带1单位负电荷
任务一:原子结构
(1)原子的构成
原子序数=核电荷数=质子数=核外电子数
任务一:原子结构
(2)质量数
原子的质量主要集中在原子核上。质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值,相加,所得的数值叫做质量数,常用A表示。
质量数(A)=质子数(Z)+中子数(N)。
X
A
Z
m±
n
±c
元素化合价
微粒所带电荷数
原子个数
质子数
质量数
任务一:原子结构
(3)表示方式
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
例2 原子的质量主要由原子核决定。已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为( )
A.A-X B.A-X-n
C.A-X+n D.A+X-n
B
例1 广泛用于文物年代测定。下列关于 说法不正确的是( )
A.质子数为6
B.电子数为8
C.中子数为8
D.质量数为14
6C
14
6C
14
B
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层。
序数 1 2 3 4 5 6 7
符号 K L M N O P Q
(2)电子层的表示方法
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(3)电子的运动规律:
任务二:核外电子排布
离核距离: 近 → 远
电子能量: 低 → 高
能量最低原理
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
① 各电子层最多容纳_______个电子
② 最外层电子数不超过_____个
(K层为最外层时不超过___个)
③ 次外层电子数不超过____个
(当K层为次外层时不超过___个)
(当L层为次外层时不超过___个)
④ 倒数第三层电子数不超过____个
2n2
8
2
18
2
8
32
(4)核外电子排布规律
【核外电子排布规律】
任务二:核外电子排布
(5)核外电子排布的表示方法
原子(或离子)结构示意图
粒子符号
原子核
质子数(或核电荷数)
电子层
该电子层上的电子数
+11
2 8 1
Na
【评价训练】画出下列原子或离子的结构示意图
①S: ,S2-: ; ②Ca: ,Ca2+: 。
任务二:核外电子排布
(1)最外层电子数与电子层数相等的元素有___________;
(2)最外层电子数是电子层数2倍的元素有___________;
(3)最外层电子数是电子层数3倍的元素有___________;
(4)最外层电子数与次外层电子数相等的元素有________;
(5)最外层电子数是次外层电子数2倍的元素是_________;
(6)最外层电子数是次外层电子数3倍的元素是_________;
(7)次外层电子数是最外层电子数2倍的元素有_________;
(8)内层电子总数是最外层电子数2倍的元素有_________;
C、
H、
Be、
Al
He、
S
O
1-20号元素原子核外电子排布特征
Be、
Ar
C
O
Li、
Si
Li、
P
例4 下列各组微粒中,核外电子层结构相同的是 ( )
A.Mg2+ 、Al3+、 Cl-、 Ne
B.Na+、 F- 、S2- 、Ar
C.K+、 Ca2+ 、S2-、Ar
D.Mg2+ 、O2-、Na+、 Cl-
例3 元素X的离子结构示意图为 ,元素Y的原子结构示意图为 ,则元素X与元素Y形成常见化合物的化学式为( )
A.XY B.XY2 C.X2Y2 D.XY3
C
C
(1)常见的10e-微粒
(2)常见的18e-微粒
F-、O2-、N3-、OH-
HF、H2O、NH3、CH4
Na+、Mg2+、Al3+、、H3O+
H2S
F2
K+、Ca2+
课堂延伸
例5 已知X、Y、Z、W四种元素是1-18号元素,其中X是最轻的元素;Y元素原子最外层电子数是内层电子总数的2倍;Z元素原子最外层电子数比次外层电子数多4;W原子最外层有1个电子,其阳离子与Z的简单阴离子的核外电子总数相同。请完成下列问题:
(1)W元素的原子结构示意图 ;由X、Z元素组成的10电子微粒可能有: 。
(2)含X、Y、Z、W四种元素的化合物是 。
(3)化合物W、Z、X与Cl2反应的化学方程式:
。
H2O、OH-
NaHCO3
2NaOH+Cl2=NaCl+NaClO+H2O
