第八单元海水中的化学:“皮蛋”中的化学课件(共18张PPT)---2023-2024学年九年级化学鲁教版下册
文档属性
| 名称 | 第八单元海水中的化学:“皮蛋”中的化学课件(共18张PPT)---2023-2024学年九年级化学鲁教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 18:47:34 | ||
图片预览





文档简介
(共18张PPT)
“皮蛋”中的化学
酸碱盐的相关知识及应用
活动1——初识皮蛋
起源
松花蛋
碱蛋
皮蛋又名松花蛋、碱蛋,相传明代江苏一家茶馆,店主在应客时将泡过的茶叶倒在有鸭蛋的炉灰中,主人在清茶渣时发现剥开的鸭蛋黝黑光亮有花纹,闻到一种特殊香味,尝起来香滑爽口
功效
. 含较多矿物质,促进营养的消化吸收、中和胃酸
. 降压、润肺、养阴止血
. 保护血管、提高智商的作用
活动2——识皮蛋制作原理
查阅资料
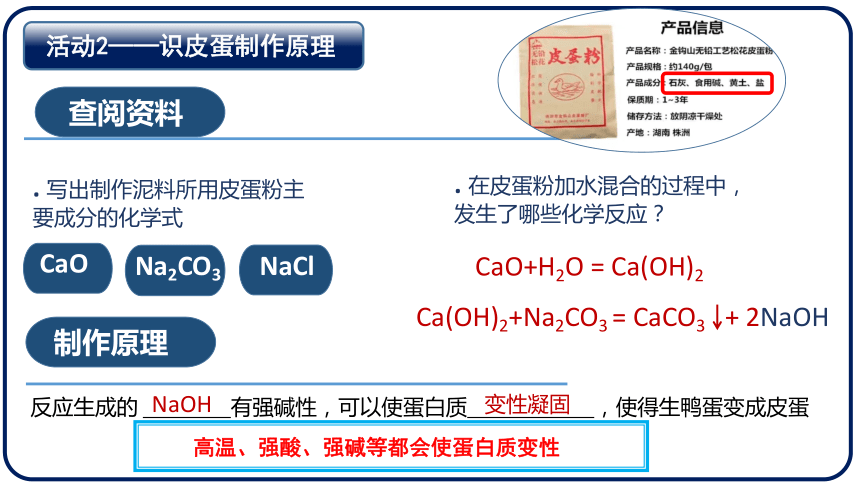
腌制皮蛋的传统方法是将泥料敷在鲜鸭蛋外,皮蛋粉的主要成分一般包括生石灰、纯碱和食盐。用水调制皮蛋粉成浆糊状的泥料,敷在蛋上,密封保存,数天后即可食用
活动2——识皮蛋制作原理
查阅资料
. 写出制作泥料所用皮蛋粉主要成分的化学式
CaO
Na2CO3
NaCl
. 在皮蛋粉加水混合的过程中,发生了哪些化学反应?
CaO+H2O = Ca(OH)2
Ca(OH)2+Na2CO3 = CaCO3 + 2NaOH
制作原理
反应生成的 有强碱性,可以使蛋白质 ,使得生鸭蛋变成皮蛋
NaOH
变性凝固
高温、强酸、强碱等都会使蛋白质变性
活动3——析泥料浸出液之成分
滤出泥料浸出液
. 将泥料放入烧杯中,加水后搅拌、静置
. 用注射器
取上层清液,约10ml
. 连接(旋上)过滤头
. 取2支试管,对准试管口,推动活塞
活动3——析泥料浸出液之成分
验证泥料浸出液之碱性
选择合适的方法检验泥料浸出液的碱性(化学性质)浸出液之碱性
最简单
一
二
四
三
测
测滤液pH
用pH试纸测定,pH>7
与酸碱指示剂
向滤液中滴入1-2滴酚酞或石蕊溶液,酚酞变红,石蕊变蓝
与非金属氧化物
如二氧化碳
部分
与酸反应
如稀盐酸
与盐溶液反应
向滤液中滴加CuSO4溶液,产生蓝色沉淀
活动3——析泥料浸出液之成分
猜想泥料浸出液之成分
主要成分
CaO
CaO
Na2CO3
NaCl
CaO+H2O = Ca(OH)2
Ca(OH)2+Na2CO3 = CaCO3 + 2NaOH
将泥料过滤,得到滤液,你知道滤液的成分吗?
猜想
① NaCl ,NaOH
② NaCl ,NaOH ,Ca(OH)2
③NaCl ,NaOH ,Na2CO3
活动3——析泥料浸出液之成分
探究泥料浸出液之成分
供选择药品
稀盐酸
石灰水
氯化钡溶液
碳酸钠溶液
酚酞试液
预测现象
实验方案
微观本质
探究是否有Ca(OH)2
探究是否有Na2CO3
取样,加入
取样,加入
取样,加入
取样,加入
Na2CO3溶液
足量稀HCl
Ca(OH)2溶液
BaCl2溶液
若有,则产生
若有,则产生
白色沉淀
白色沉淀
气泡
CO32- + Ca2+ = CaCO3
Ca2+ + CO32- = CaCO3
2H+ + CO32- = H2O+CO2
Ba2+ + CO32- = BaCO3
活动3——析泥料浸出液之成分
验证泥料浸出液之成分
实验现象
实验结论
实验操作
往滤液中加入检验试剂,分别验证
加碳酸钠溶液,振荡,产生白色沉淀
泥料浸出液的成分为:NaCl ,NaOH,Ca(OH)2
活动4——解制作注意事项
皮蛋在制作过程中有一些注意事项,解释原因
01
制作过程中不能用手触摸泥料
02
用调制成糊状的泥料,敷在鸭蛋上,需密封保存
泥料中有强腐蚀性物质(NaOH)
防止氢氧化钠变质
泥料浸出液的成分为:NaCl ,NaOH,Ca(OH)2
活动5——再品皮蛋之美味
食用的时候通常要加醋更美味,为什么?
H+ + OH- = H2O
2NaOH+CO2====Na2CO3 + H2O
活动6——自制皮蛋配方
你的收获......
某化学兴趣小组的同学为探究碳酸钠的化学性质,进行了如下实验,向盛有适量碳酸钠溶液的四支试管中分别加入下列试剂,实验现象记录如表,请将表格内容补充完整。
试管3中发生反应的化学方程式为 。化学兴趣小组的同学对反应后溶液中溶质的成分进一步探究:将试管3中的物质过滤,得到滤液A。
试管编号 1 2 3 4
加入试剂 无色酚酞试液 稀盐酸 澄清石灰水 氯化钡溶液
实验现象 有气泡产生 有白色沉淀产生 有白色沉淀产生
溶液变为红色
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
活动7——随堂测试
【提出问题】 滤液A中溶质的成分是什么
【猜想与假设】 猜想一:NaOH;猜想二:NaOH和Na2CO3;猜想三:
;猜想四:NaOH、Na2CO3和Ca(OH)2。
【活动探究】
(1) 小组讨论:有同学认为猜想四不成立,原因是
。
NaOH和
Ca(OH)2与Na2CO3能发
生反应,不能共存
Ca(OH)2
(2) 甲、乙两名同学分别用不同的方法进行实验,实验记录如表,请将表格内容补充完整。
【反思与评价】 要验证反应后物质的成分,既要考虑生成物,还应考虑
。
实验操作 实验现象 实验结论
甲:取少量滤液A于试管中,加入过量的 稀盐酸 有气泡生成 猜想
成立
乙:取少量滤液A于试管中,加入适量的 Ba(NO3)2溶液
有白色沉淀
生成
二
反应物是否有剩余
活动7——跟踪练习
实验现象
实验论
实验操作
1.小刘和小赵对一瓶久置的氢氧化钙粉末[Ca(OH)2]的组成进行了实验探究。
【提出问题】这瓶氢氧化钙是否已经生成碳酸钙而变质?
【进行猜想】
A.氢氧化钙全部变为碳酸钙;B.氢氧化钙部分变为碳酸钙;
C.氢氧化钙没有变质。
【设计并进行实验】
实验步骤 实验现象 实验结论
取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 ①滤液不变 ②
氢氧化钙全部变为碳酸钙
(1)氢氧化钙俗称 ,农业上一般采用氢氧化钙改良 (填“酸”或“碱”)性土壤。
(2)氢氧化钙变质是由于与空气中的 发生反应的缘故,
反应的化学方程式是 ,因此氢氧化钙应 保存。
2、一瓶久置的氢氧化钠溶液,瓶口出现了一些白色固体
【提出问题】
白色固体的成分是什么物质?
【作出猜想】
猜想一: ;
猜想三: 。
【实验探究】
NaOH
Na2CO3
NaOH、 Na2CO3
【得出结论】
【变质原理】 2NaOH +CO2 = Na2CO3 + H2O
供选择药品:
稀盐酸、氯化钡溶液、石灰水、酚酞溶液
白色固体的成分是 。
实验步骤 实验现象 实验结论
①取少量白色固体于试管中,加水溶解,加入 溶液; ②静置,在上层清液中加 . ① ; ② 。
BaCl2
有白色沉淀产生
足量
猜想二: ;
“皮蛋”中的化学
酸碱盐的相关知识及应用
活动1——初识皮蛋
起源
松花蛋
碱蛋
皮蛋又名松花蛋、碱蛋,相传明代江苏一家茶馆,店主在应客时将泡过的茶叶倒在有鸭蛋的炉灰中,主人在清茶渣时发现剥开的鸭蛋黝黑光亮有花纹,闻到一种特殊香味,尝起来香滑爽口
功效
. 含较多矿物质,促进营养的消化吸收、中和胃酸
. 降压、润肺、养阴止血
. 保护血管、提高智商的作用
活动2——识皮蛋制作原理
查阅资料
腌制皮蛋的传统方法是将泥料敷在鲜鸭蛋外,皮蛋粉的主要成分一般包括生石灰、纯碱和食盐。用水调制皮蛋粉成浆糊状的泥料,敷在蛋上,密封保存,数天后即可食用
活动2——识皮蛋制作原理
查阅资料
. 写出制作泥料所用皮蛋粉主要成分的化学式
CaO
Na2CO3
NaCl
. 在皮蛋粉加水混合的过程中,发生了哪些化学反应?
CaO+H2O = Ca(OH)2
Ca(OH)2+Na2CO3 = CaCO3 + 2NaOH
制作原理
反应生成的 有强碱性,可以使蛋白质 ,使得生鸭蛋变成皮蛋
NaOH
变性凝固
高温、强酸、强碱等都会使蛋白质变性
活动3——析泥料浸出液之成分
滤出泥料浸出液
. 将泥料放入烧杯中,加水后搅拌、静置
. 用注射器
取上层清液,约10ml
. 连接(旋上)过滤头
. 取2支试管,对准试管口,推动活塞
活动3——析泥料浸出液之成分
验证泥料浸出液之碱性
选择合适的方法检验泥料浸出液的碱性(化学性质)浸出液之碱性
最简单
一
二
四
三
测
测滤液pH
用pH试纸测定,pH>7
与酸碱指示剂
向滤液中滴入1-2滴酚酞或石蕊溶液,酚酞变红,石蕊变蓝
与非金属氧化物
如二氧化碳
部分
与酸反应
如稀盐酸
与盐溶液反应
向滤液中滴加CuSO4溶液,产生蓝色沉淀
活动3——析泥料浸出液之成分
猜想泥料浸出液之成分
主要成分
CaO
CaO
Na2CO3
NaCl
CaO+H2O = Ca(OH)2
Ca(OH)2+Na2CO3 = CaCO3 + 2NaOH
将泥料过滤,得到滤液,你知道滤液的成分吗?
猜想
① NaCl ,NaOH
② NaCl ,NaOH ,Ca(OH)2
③NaCl ,NaOH ,Na2CO3
活动3——析泥料浸出液之成分
探究泥料浸出液之成分
供选择药品
稀盐酸
石灰水
氯化钡溶液
碳酸钠溶液
酚酞试液
预测现象
实验方案
微观本质
探究是否有Ca(OH)2
探究是否有Na2CO3
取样,加入
取样,加入
取样,加入
取样,加入
Na2CO3溶液
足量稀HCl
Ca(OH)2溶液
BaCl2溶液
若有,则产生
若有,则产生
白色沉淀
白色沉淀
气泡
CO32- + Ca2+ = CaCO3
Ca2+ + CO32- = CaCO3
2H+ + CO32- = H2O+CO2
Ba2+ + CO32- = BaCO3
活动3——析泥料浸出液之成分
验证泥料浸出液之成分
实验现象
实验结论
实验操作
往滤液中加入检验试剂,分别验证
加碳酸钠溶液,振荡,产生白色沉淀
泥料浸出液的成分为:NaCl ,NaOH,Ca(OH)2
活动4——解制作注意事项
皮蛋在制作过程中有一些注意事项,解释原因
01
制作过程中不能用手触摸泥料
02
用调制成糊状的泥料,敷在鸭蛋上,需密封保存
泥料中有强腐蚀性物质(NaOH)
防止氢氧化钠变质
泥料浸出液的成分为:NaCl ,NaOH,Ca(OH)2
活动5——再品皮蛋之美味
食用的时候通常要加醋更美味,为什么?
H+ + OH- = H2O
2NaOH+CO2====Na2CO3 + H2O
活动6——自制皮蛋配方
你的收获......
某化学兴趣小组的同学为探究碳酸钠的化学性质,进行了如下实验,向盛有适量碳酸钠溶液的四支试管中分别加入下列试剂,实验现象记录如表,请将表格内容补充完整。
试管3中发生反应的化学方程式为 。化学兴趣小组的同学对反应后溶液中溶质的成分进一步探究:将试管3中的物质过滤,得到滤液A。
试管编号 1 2 3 4
加入试剂 无色酚酞试液 稀盐酸 澄清石灰水 氯化钡溶液
实验现象 有气泡产生 有白色沉淀产生 有白色沉淀产生
溶液变为红色
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
活动7——随堂测试
【提出问题】 滤液A中溶质的成分是什么
【猜想与假设】 猜想一:NaOH;猜想二:NaOH和Na2CO3;猜想三:
;猜想四:NaOH、Na2CO3和Ca(OH)2。
【活动探究】
(1) 小组讨论:有同学认为猜想四不成立,原因是
。
NaOH和
Ca(OH)2与Na2CO3能发
生反应,不能共存
Ca(OH)2
(2) 甲、乙两名同学分别用不同的方法进行实验,实验记录如表,请将表格内容补充完整。
【反思与评价】 要验证反应后物质的成分,既要考虑生成物,还应考虑
。
实验操作 实验现象 实验结论
甲:取少量滤液A于试管中,加入过量的 稀盐酸 有气泡生成 猜想
成立
乙:取少量滤液A于试管中,加入适量的 Ba(NO3)2溶液
有白色沉淀
生成
二
反应物是否有剩余
活动7——跟踪练习
实验现象
实验论
实验操作
1.小刘和小赵对一瓶久置的氢氧化钙粉末[Ca(OH)2]的组成进行了实验探究。
【提出问题】这瓶氢氧化钙是否已经生成碳酸钙而变质?
【进行猜想】
A.氢氧化钙全部变为碳酸钙;B.氢氧化钙部分变为碳酸钙;
C.氢氧化钙没有变质。
【设计并进行实验】
实验步骤 实验现象 实验结论
取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 ①滤液不变 ②
氢氧化钙全部变为碳酸钙
(1)氢氧化钙俗称 ,农业上一般采用氢氧化钙改良 (填“酸”或“碱”)性土壤。
(2)氢氧化钙变质是由于与空气中的 发生反应的缘故,
反应的化学方程式是 ,因此氢氧化钙应 保存。
2、一瓶久置的氢氧化钠溶液,瓶口出现了一些白色固体
【提出问题】
白色固体的成分是什么物质?
【作出猜想】
猜想一: ;
猜想三: 。
【实验探究】
NaOH
Na2CO3
NaOH、 Na2CO3
【得出结论】
【变质原理】 2NaOH +CO2 = Na2CO3 + H2O
供选择药品:
稀盐酸、氯化钡溶液、石灰水、酚酞溶液
白色固体的成分是 。
实验步骤 实验现象 实验结论
①取少量白色固体于试管中,加水溶解,加入 溶液; ②静置,在上层清液中加 . ① ; ② 。
BaCl2
有白色沉淀产生
足量
猜想二: ;
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
