第二章 化学反应的方向、限度与速率 测试题 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章 化学反应的方向、限度与速率 测试题 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 20:58:00 | ||
图片预览




文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题
1.将一定物质的量的HI(g)置于2L的恒容密闭容器中,只发生反应2HI(g)H2(g)+I2(g),在其他条件相同时,反应物HI(g)的物质的量n随反应时间t的变化情况如表所示:
t/min n/mol 实验序号(反应温度) 0 10 20 30 40 50 60
1(800℃) 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2(800℃) 1.2 0.92 0.75 0.63 0.60 0.60 0.60
3(820℃) 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据表中数据,下列说法正确的是
A.在实验1中,反应在10~20min内v(HI)=1.3×10-2mol L-1 min-1
B.在实验2中,40min时反应恰好达到平衡状态
C.根据实验2和实验3,无法说明浓度对反应速率的影响趋势
D.根据实验1和实验3,可得出温度越高,的分解率越小
2.为比较 Fe3+和 Cu2+对 H2O2分解反应的催化效果, 甲、乙两位同学分别设计了如图甲、乙所示的实验。下列说法不正确的是( )
A.图甲所示实验可通过观察气泡产生的快慢来比较反应速率的大小
B.若图甲实验中反应速率① > ②,则可说明Fe3+比Cu2+对 H2O2分解反应的催化效果好
C.用图乙所示装置测定反应速率,放置药品前需检验装置气密性。具体操作为:关闭活塞 A, 然后拉动注射器活塞。一段时间后松开活塞,观察其是否能够恢复原位
D.用图乙所示装置测定反应速率,可在锥形瓶中放置 H2O2溶液,分液漏斗中 Fe3+或 Cu2+溶液。测定并记录反应产生一定气体体积所需的时间
3.对于反应 。下列说法正确的是
A.使用高效催化剂能提高的平衡产率
B.降低温度,该反应的平衡常数减小
C.每消耗22.4L,转移电子的数目约为
D.断裂4H-H键的同时断裂4H-O键,说明反应达到平衡状态
4.下列根据实验现象得出的结论错误的是
选项 实验目的 实验设计 实验现象和结论
A 检验某无色溶液中是否含有 取少量该溶液于试管中,加稀硝酸酸化,再加入硝酸钡溶液 若有白色沉淀生成,则该溶液中一定含有
B 探究和对分解速率的影响 在两支试管中分别加入2mL5%溶液,再向溶液中分别滴入和溶液各1mL,摇匀(已知:对该反应无影响) 相同时间内产生气泡多的,则催化效果好
C 探究乙酸和碳酸的酸性强弱 用乙酸溶液浸泡水壶中的水垢 水垢溶解并有气泡冒出,则乙酸的酸性比碳酸的强
D 检验某气体是否为 将气体通入酸性溶液中 若溶液褪色,则该气体不一定是
A.A B.B C.C D.D
5.分解反应过程中能量变化如图,其中①有加入,②无加入。有加入时的反应历程为;。下列判断错误的是
A.加入后改变了反应的路径
B.加入后不改变总反应的能量变化
C.过程①生成中间产物的反应为决速步
D.过程②正反应活化能大于逆反应活化能
6.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确的是
A.8min前A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等均为4
7.由工业废铜泥(主要成分为、、,含少量)制备难溶于水的氯化亚铜,其工艺流程如图。下列说法错误的是
A.“灼烧”可将、等转化为
B.“除杂”①过程中升高温度或增大一定能加快化学反应速率
C.流程中的可循环使用
D.“还原”中每消耗还原剂,理论上可获得
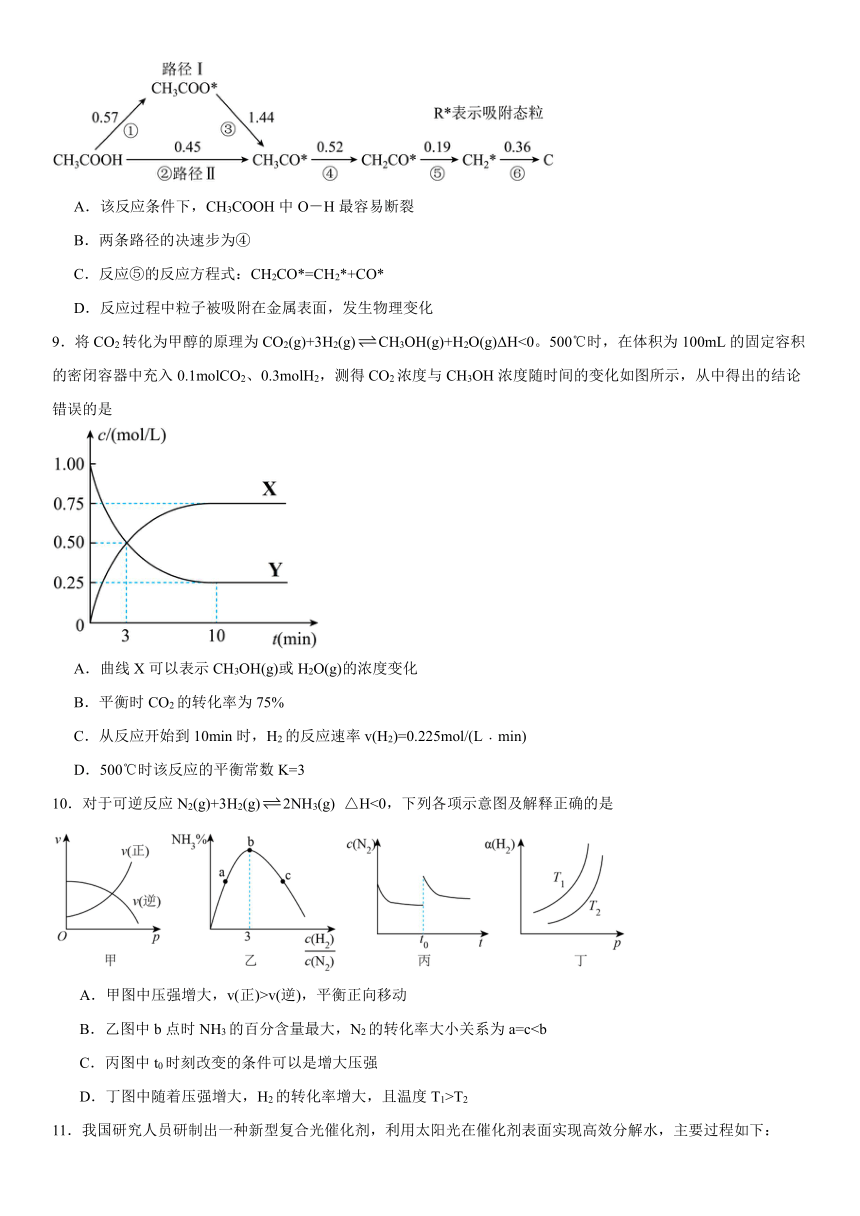
8.乙酸是常见的化工原料,在过渡金属的催化作用下有两种反应路径,种路径和能垒数据(单位:eV)如图,已知每一步生成的粒子均为吸态。下列说法正确的是
A.该反应条件下,CH3COOH中O-H最容易断裂
B.两条路径的决速步为④
C.反应⑤的反应方程式:CH2CO*=CH2*+CO*
D.反应过程中粒子被吸附在金属表面,发生物理变化
9.将CO2转化为甲醇的原理为CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH<0。500℃时,在体积为100mL的固定容积的密闭容器中充入0.1molCO2、0.3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,从中得出的结论错误的是
A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B.平衡时CO2的转化率为75%
C.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min)
D.500℃时该反应的平衡常数K=3
10.对于可逆反应N2(g)+3H2(g)2NH3(g) △H<0,下列各项示意图及解释正确的是
A.甲图中压强增大,v(正)>v(逆),平衡正向移动
B.乙图中b点时NH3的百分含量最大,N2的转化率大小关系为a=cC.丙图中t0时刻改变的条件可以是增大压强
D.丁图中随着压强增大,H2的转化率增大,且温度T1>T2
11.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下:
下列说法不正确的是
A.催化剂能够降低反应的活化能,增大反应物分子中活化分子的百分数
B.过程I吸收能量
C.表示H2燃烧热的热化学方程式为:H2(g) +O2(g)=H2O(g) ΔH=-241kJ/mol
D.该反应的中间过程中有双氧水的生成
12.下列叙述中,能用勒夏特列原理解释的是
A.合成氨工业中,选择500℃有利于氨的合成
B.用饱和食盐水吸收氯气中的HCl
C.由、、HI三种气体组成的平衡体系加压后颜色变深
D.向双氧水中加入二氧化锰有利于氧气生成
13.在25℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是
物质 X Y Z
起始浓度/ 0.1 0.2 0
平衡浓度/ 0.05 0.05 0.1
A.反应达到平衡时,Y的转化率为75%
B.反应可表示为,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.若升温后该反应的平衡常数减小,则该反应为放热反应
14.在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
A.A的百分含量不再改变
B.各组分的浓度不再改变
C.反应速率υ(A):υ(B):υ(C):υ(D)=m:n:p:q
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
15.在一密闭容器中,反应 aA(气)bB(气)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达到新平衡时,A的浓度是原来的1.5倍,则下列说法不正确的是
A.平衡向正反应方向移动 B.物质A的转化率变小
C.物质B的质量分数增加了 D.a>b
二、填空题
16.(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L 1·min 1,则以物质B表示此反应的化学反应速率为 mol·L 1·min 1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为 。
(3)①将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L 1·s 1,则在2s时,容器中有 mol A,此时C的物质的量浓度为 。
②能说明该反应已达到平衡状态的是 (填字母)。
a.v(A)=2v(B) b.容器内压强保持不变
c.3v逆(A)=v正(B) d.容器内混合气体的密度保持不变
③在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是 (填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
17.Ⅰ、在容积为2.0 L的密闭容器内,物质D在 T ℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据上图写出该反应的化学方程式______________,该反应的平衡常数K=____________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(4)若在第7 min时增加D的物质的量,A的物质的量变化正确的是_______(用图中a、b、c的编号回答)。
Ⅱ、可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
(5)达平衡(I)时体系的压强与反应开始时体系的压强之比为_____________
(6)达平衡(I)时,X的转化率为_______________
(7)X(g)+2Y(g)2Z(g) 是_______热反应。
18.已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化和化学平衡的移动方向。
t1时刻,增大反应物浓度,使v′正增大,而v′逆不变,则v′正>v′逆,平衡向正反应方向移动。请参照上图,画出t1时刻,减小反应物浓度,其反应速率的变化,并分析化学平衡的移动方向。
19.将3molA和1molB混合于2L的密闭容器中,发生如下反应:4A(g)+ B(g)2C(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,则:
(1)用B表示该反应的反应速率为 。
(2)A的转化率为 。
20.(1)用O2将HCl转化为Cl2,可提高效益、减少污染。新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图,则总反应的ΔH 0(填“>”、“=”或“<”);A、B两点的反应速率中较大的是 。
②下列措施有利于提高αHCl的有 (填字母)。
A.增大n(HCl) B.增大n(O2)
C. 使用更好的催化剂 D.移去H2O
(2)乙苯催化脱氢制苯乙烯反应: ,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实: 。
②控制反应温度为600 ℃的理由是 。
21.回答下列问题:
(1)某温度下在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是 。
②从反应开始到5min时,用Y表示的反应速率为 。
(2)800℃、2L密闭容器反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(S) 0 1 2 3 4 5
n(NO)mol 0.020 0.010 0.008 0.007 0.007 0.007
计算并回答下列问题:
①反应进行到2s时c(NO)= 。
②反应达到平衡状态时NO的转化率= 。
22.一定温度下,在密闭容器中发生反应 ,正反应速率表达式为(是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
序号
Ⅰ 0.10 0.10 0.15
Ⅱ 0.20 0.20 2.40
Ⅲ 0.20 0.10 1.20
(1) , 。
(2)向容积为的恒容密闭容器中仅充入和,发生上述反应,测得随时间的变化如图所示。
①T1 T2(填“>”、“<”或“=”,下同),物质的聚集状态为 ;点时气体的 点时气体的。
②、、三点气体的逆反应速率由大到小的顺序为 (用、、表示)。
③时,此反应的平衡常数 (不写单位)。
23.在一密闭容器中发生反应N2+3H22NH3。达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
回答下列问题:
(1)t1、t2、t3时刻分别改变的一个条件,t1时刻 t3时刻 t4时刻 。
(2)氨的百分含量最高的时间段是 。
(3)如果在t6对刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化情况;
(4)实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。
在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
24.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
(1)上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),反应I的化学平衡常数表达式K= 。
(2)下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 250℃ 300℃ 350℃
K 2.041 0.270 0.012
①由表中数据判断ΔH2 0(填“>”、“<”或“=”);
②若容器容积不变,下列措施可增加甲醇产率的是 ;
A、升高温度 B、将CH3OH(g)从体系中分离 C、使用合适的催化剂 D、充入He,使体系总压强增大 E、按原比例再充入CO和H2
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
25.丙烯是重要的有机化工原料,工业上丙烷脱氢制丙烯的反应:C3H8(g)C3H6(g)+H2(g) ΔH1。
(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8发生反应,经过 10 min 达到平衡状态, 测得平衡时气体压强是开始的 1.75 倍。
①0~10min 内丙烯的反应速率 v(C3H6)= 。
②下列情况能说明该反应达到平衡状态的是 。
A.气体密度保持不变 B. 保持不变
C.装置内总压强保持不变 D .C3H8 分解速率与 C3H6生成速率相等
(2)总压强分别为 p1和 p2时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数 如图所示:
①压强:p1 p2;ΔH1 0(填“>”或“<”),该反应自发进行的条件是 (填“高温”“低温” 或“任意温度”)。
②若 p1=0.1MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,某气体分压=总压×某气体物质的量分数)。
③在恒温恒压条件下,向容器中通入丙烷和稀有气体的混合气体发生丙烷脱氢反应,随着起始混合气体中稀有气体所占比例增大,丙烷脱氢转化率逐渐增大。试解释原因: 。
试卷第1页,共3页
参考答案:
1.C
【详解】A.实验1中,反应在10~20min内,v(HI)==0.0065 mol L-1 min-1,A错误;
B.在实验2中,40min后HI(g)的物质的量不再变化,说明40min后反应处于平衡状态,但不能说明40min时反应恰好达到平衡状态,B错误;
C.实验2和实验3的反应温度不同,且HI(g)的起始物质的量不同,则无法说明浓度对反应速率的影响趋势,C正确;
D.比较实验1和实验3,开始时加入的n(HI)相同,反应温度不同,平衡时实验3中HI(g)的物质的量少,说明温度越高,HI的分解率越大,D错误;
综上所述答案为C。
2.B
【详解】A.反应越剧烈,产生气泡越快,说明反应速率越大,A正确;
B.若图甲所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜对H2O2分解反应的催化效果好,但因题图甲两试管中所加试剂所含的阴离子不同,故不能证明Fe3+比Cu2+对H2O2分解反应的催化效果好,若要证明Fe3+比Cu2+对H2O2分解反应的催化效果好,还要使选择的试剂中阴离子的种类相同,B错误;
C.若气密性良好,关闭活塞 A, 然后拉动注射器活塞,一段时间后松开活塞,活塞会恢复原位,C正确;
D.H2O2 溶液中加Fe3+或 Cu2+,H2O2分解,用注射器测量体积,记录时间,可计算反应速率,D正确;
故选B。
3.D
【详解】A.催化剂不能使平衡发生移动,故使用高效催化剂不能提高的平衡产率,A项错误;
B.降低温度,该反应正向移动,平衡常数增大,B项错误;
C.未给定标准状况,不能计算,C项错误;
D.断裂4键的同时断裂4键表明正逆反应的速率相同,说明反应达到平衡状态,D项正确;
故选D。
4.A
【详解】A.稀硝酸具有很强的氧化性,能将氧化成,若原无色溶液中不含有,而含有,加稀硝酸酸化,再加入硝酸钡溶液,也会产生白色沉淀,A错误;
B.向相同浓度相同体积的溶液中加入相同浓度、体积的和,相同时间内产生气泡多的,则催化效果更好,B正确;
C.用乙酸溶液浸泡水壶中的水垢,水垢溶解并有气泡冒出,则乙酸的酸性比碳酸的强,C正确;
D.将气体通入酸性溶液中,若溶液褪色,则该气体可能为,也可能为、HCl、乙烯、乙炔等气体,D正确;
故选A。
5.D
【详解】A.由题干信息可知KI在反应中作催化剂,结合图示可知KI改变了反应的路径,故A正确;
B.加入KI改变了反应过程,但未影响反应物和生成物的能量,不改变总反应的能量变化,故B正确;
C.由图可知过程①中生成大于生成的活化能,活化能越大,反应速率越慢,慢反应决定总反应速率,故C正确;
D.由能量变化图可知正反应活化能均小于逆反应活化能,故D错误;
故选:D。
6.B
【详解】A.反应从开始到8min内A浓度减少了0.64mol/L,所以A的反应速率为0.08 mol/( min),故A错误;
B.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是该反应前后气体系数之和相等,然后扩大容器降低了压强;40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,且正反应为放热反应,故B正确;
C.开始到达到平衡,A、B的浓度减少的量相同,可知x=1,根据B选项可知该反应正反应为放热反应,故C错误;
D.根据B选项分析可知40min时升高了温度,所以30min和54min时温度不一样,所以平衡常数不相等,故D错误;
综上所述答案为B。
7.B
【分析】工业废铜泥(主要成分为、、,含少量),在空气中灼烧将、、转化为CuO,将Fe转化为铁的氧化物,加入硫酸酸浸后CuO和铁的氧化物溶解成硫酸铜和硫酸铁、硫酸亚铁等,除杂过程中加入过氧化氢和氢氧化钠溶液后,将亚铁离子氧化成铁离子,然后变成氢氧化铁沉淀除去,滤液为硫酸铜溶液,加入亚硫酸钠和氯化钠后得到CuCl。
【详解】A.灼烧过程中,空气中氧气可将、等转化为,A正确;
B.除杂过程中加入过氧化氢溶液,若温度过高,则过氧化氢会分解,化学反应速率可能变慢,B错误;
C.还原过程生成硫酸,酸浸过程消耗硫酸,所以硫酸可以循环使用,C正确;
D.根据电子守恒,还原剂为亚硫酸钠,设CuCl的物质的量为xmol,则有以下关系: x=2mol,D正确;
故答案选B。
8.C
【详解】A.第⑤步能垒最小,CH3COOH中C-C最容易断裂,故A错误;
B.能垒大的步骤为决速步骤,途径Ⅰ的决速步骤是③,途径Ⅱ的决速步骤是④,故B错误;
C.由图可得,反应⑤的反应方程式:CH2CO*=CH2*+CO*,故C正确;
D.由图可知,反应过程中是存在物质变化的,所以发生的是化学变化,故D错误;
故答案选C。
9.D
【详解】A.随反应进行X的浓度增大,X表示生成物,由方程式可知CH3OH(g)、H2O(g)的浓度变化相等,曲线X可以表示CH3OH(g)或H2O(g)的浓度变化,A结论正确;
B.平衡时二氧化碳的浓度为0.25mol/L,二氧化碳的浓度变化量为1mol/L-0.25mol/L=0.75mol/L,由方程式可知氢气的浓度变化为3×0.75mol/L=2.25mol/L,氢气的转化率=×100%=75%,B结论正确;
C.Y的起始浓度为1mol/L,故Y表示二氧化碳,平衡时二氧化碳的浓度为0.25mol/L,故v(CO2)==0.075mol/(L min),速率之比等于化学计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L min)=0.225mol/(L min),C结论正确;
D.平衡时二氧化碳的浓度为0.25mol/L,则:
平衡常数K==5.33,D结论错误;
答案为D。
10.C
【详解】A.反应物和生成物均为气体,增大压强,正逆反应速率均增大,A错误;
B.a、b、c三点所处的平衡状态中,反应物N2的转化率与投入的另一种反应物氢气的量有关,氢气初始量越多,N2的转化率越高,B错误;
C.改变的条件是增大压强,容器体积减小,N2浓度增大,平衡正向移动,导致N2浓度减小,C正确;
D.正反应为放热反应,升高温度化学平衡逆向移动,如果温度T1>T2,相同压强下,T1时H2的转化率应该比T2时小,D错误;
故选C。
11.C
【详解】A.催化剂能够改变反应的路径,降低反应的活化能,增大活化分子百分数,从而使反应物分子中活化分子的百分数增大,A正确;
B.过程I中,断裂O-H共价键,所以需要吸收能量,B正确;
C.表示H2燃烧热的热化学方程式中,生成物水应呈液态,而本方程式中生成了H2O(g),C不正确;
D.从图中可以看出,由过程Ⅱ转化为过程Ⅲ,生成了H-O-O-H,所以该反应的中间过程中有双氧水的生成,D正确;
故选C。
12.B
【详解】A.合成氨为放热反应,升高温度平衡逆向进行,但升高温度为加快反应速率,与平衡移动无关,不能用勒夏特列原理解释,A不符合;
B.排饱和食盐水的方法吸收氯气,利用的是氯离子浓度增大,使平衡逆向进行,减少氯气的溶解性,能用勒夏特列原理解释,B符合;
C.由 H2 、 I2 、HI三种气体组成的平衡体系加压后平衡不移动,不能用勒夏特列原理解释,C不符合;
D.向双氧水中加入二氧化锰,起到催化作用,与化学平衡无关,不能用勒夏特列原理解释,D不符合;
故答案为:B。
13.C
【分析】列三行式计算题目所求数据
Cy转= (0.2-0.05) mol L-1 = 0.15 mol L-1
【详解】A.达到平衡时,Y的转化率,A项正确,不符题意;
B.化学平衡常数,代入平衡浓度值得,B项正确,不符题意;
C.化学平衡常数只受温度的影响,温度变,平衡常数变,与浓度、压强无关;所以增大压强时,化学平衡常数不变,C项错误,符合题意;
D.升温,化学平衡向吸热反应一侧移动,现升温后平衡常数减小,说明平衡逆向移动,故正向为放热反应,D项正确,不符题意;
综上,本题选C。
14.C
【详解】A.A的百分含量不再改变是反应达到平衡状态的特征标志之一,A不选 ;
B.各组分的浓度不再改变是反应达到平衡状态的特征标志之一,B不选;
C.没有指明是正反应速率还是逆反应速率,不能说明反应达到平衡状态,C选;
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应,说明正、逆反应速率相等,是反应处于平衡状态的本质标志,D不选;
答案选C。
15.B
【分析】
保持温度不变,将容器体积缩小一半,假设平衡不移动,A和B的浓度应均是原来的2倍,但当达到新的平衡时,A的浓度是原来的1.5倍,说明增大压强平衡正向移动,则说明a>b;
【详解】
A. 由上述分析可知,平衡正反应方向移动,A正确;
B. 平衡向正反应方向移动,A的转化率增大,B错误;
C. 平衡向正反应方向移动,B的质量增大,混合气体的总质量不变,故B的质量分数增大,C正确;
D. 增大压强平衡向正反应方向移动,则说明a>b,D正确;
答案选B。
16. 0.6 0.05 mol·L 1·s 1 8.8 0.08 mol·L 1 b ①③
【详解】(1)根据同一反应中用不同的物质来表示反应速率时,其数值之比等于各物质的化学计量数之比,可知,v(A): v(B)=1:3,则v(B)=。答案为:0.6;
(2) 由题可知, 3s后N2的物质的量为1.9mol,根据反应方程式:N2(g)+3H2(g)2NH3(g),可知,3s后消耗H2的物质的量为。根据化学反应速率的定义,可知,v(H2)=。答案为:0.05 mol·L 1·s 1;
(3)①根据化学反应速率的定义,可知在最初2s内,消耗A的物质的量=,则2s时,容器中A的物质的量=10mol-1.2mol=8.8mol。根据反应方程式,可知2s时生成C的物质的量=,此时C的物质的量浓度=。答案为:8.8;0.08mol L-1;
②a.v(A)=2v(B)不能说明v正=v逆,即不能说明该反应达到平衡状态,a项错误;
b.该可逆反应反应前后气体分子数不相等,则总压强一定,说明反应达到平衡状态。b项正确;
c.根据化学反应方程式,可知,3v逆(A)=9v逆(B)=v正(B),即v逆(B)≠v正(B),不能说明反应达到平衡状态,c项错误;
d.恒容条件下,该可逆反应前后气体质量不变,密度不变,不能说明该反应达到平衡状态。d项错误;
答案选b;
③①降低温度,化学反应速率减小;
②正催化剂能显著加快反应速率,负催化剂能减慢反应速率;
③增大容器体积,该反应中的物质的浓度减小,化学反应速率减小;
综上所述,改变条件①③,反应速率会减小。答案为:①③。
17.(14分) Ⅰ、(1) 0.067 mol/(L·min)(2分)
(2) 2D(s) 2A(g)+B(g) (2分,必须标出D的状态,A、B状态可以不标)0.004(2分)
(3) 减小(1分) (4) b(1分)
Ⅱ、(4) 5:6 (2分) (5) 83.3% (写成5/6不给分)(2分) (6) 吸热 (2分)
【详解】试题分析:Ⅰ、(1)根据图示可知从反应开始到第一次达到平衡时 n(A)=0.4mol,所以A物质的平均反应速率为0.4mol÷2L÷3min=0.067 mol/(L·min);(2)根据图示可知:在相同时间内D减小0.4mol,A 增加0.4mol,B增加0.2mol。则D是反应物,A、B是生成物。它们改变的物质的量的比是2:2:1,应用最终各种物质的浓度都不能改变,而且三种物质都存在,因此该反应是可逆反应,根据提示的物质状态可得方程式是:2D(s) 2A(g)+B(g) ;该反应的平衡常数K=c2(A)·c(B)=0.22×0.1=0.004;(3)由于在第5 min时,升高温度,A、B、浓度增大,说明升高温度平衡正向移动,正反应方向是吸热反应,则降温时,平衡向放热的逆反应方向移动,此时该反应的平衡常数减小;(4)若在第7 min时增加D的物质的量,由于D是固体,增加其物质的量,物质的浓度不变,所以化学平衡不发生移动,A的物质的量变化正确的是b;Ⅱ、(4)①是反应前后气体体积减小的反应,而②是反应前后气体体积不变的反应。由于反应②的气体的物质的量不变,平衡是与反应①体积相同,则①平衡时气体的物质的量也是2mol。对于在密闭容器中进行的可逆反应,气体的物质的量的比等于压强的比。所以达平衡(I)时体系的压强与反应开始时体系的压强之比为2:2.4=5:6;(6)②反应是气体的物质的量不变的反应。由于左右两边气体的压强相等,假设反应①平衡时气体的物质的量是x,则2:2.4=x:2.6,解得x=13/6mol。减少5/6mol.根据方程式X(g)+2Y(g) 2Z(g)可知,每有1mol的X发生反应,达到平衡时气体的物质的量减小1mol,现在气体的物质的量减小0.6mol,所以达平衡(I)时,X的转化率为(5/6mol÷1mol)×100%=83.3%;(7)由于降低温度,X(g)+2Y(g) 2Z(g) 平衡是气体的体积增大,说明降低温度,平衡向逆向移动,逆反应方向是放热反应,所以该反应的正反应是吸热反应。
考点:考查化学反应速率的计算、反应方程式的书写、温度、压强对化学平衡移动的影响-物质转化率的计算的知识。
18.
t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动。
【详解】t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动,图像为 。
19.(1)
(2)50%
【分析】经5min后测得D的物质的量为0.5mol/L×2L=1mol,以此解题。
【详解】(1)由题给消息可得三段式:
则用B表示该反应的反应速率为;
(2)A的转化率为。
20. < B BD 正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积增大,平衡向正反应方向移动 600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大
【分析】(1)①根据图象结合温度对化学反应速率与化学平衡的影响效果作答;
②改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;
(2) ①保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由。
【详解】(1)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;升高温度化学反应速率增大,则A、B两点的反应速率中较大的是B,故答案为<;B;
②A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,A项错误;
B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,B项正确;
C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,C项错误;
D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,D项正确,
故选BD;
(2) ①正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
②600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大。
故选择600℃左右。
21.(1) 3X(g)+Y(g)2Z(g) 0.02mol·L-1·min-1
(2) 0.004mol/L 65%
【详解】(1)①参加反应的物质的量之比等于反应的系数比,由图可知,反应XYZ的物质的量之比为(1.0-0.4): (1.0-0.8): (0.5-0.1)=3:1:2,故该反应的化学方程式是3X(g)+Y(g)2Z(g)。
②从反应开始到5min时,用Y表示的反应速率为;
(2)①反应进行到2s时c(NO)= 。
②反应达到平衡状态时N的转化率为。
22.(1) 3 1
(2) > 气体 > 0.675或
【详解】(1)将Ⅰ和Ⅲ数据代入正反应速率表达式可得:解得m=3;将Ⅱ和Ⅲ数据代入正反应速率表达式可得:解得n=1。故答案为:3;1;
(2)①比较T1、p2和T2、p2:压强相同,由T1到T2,n(C)增大,平衡正移,由于反应放热,故此过程温度降低,故T1>T2;
比较T1、p1和T1、p2:温度相同,p2时反应速率大于p1,故p2>p1,从p1到p2,n(C)减小,平衡逆移,即压强增大,平衡逆移,故该反应正方向气体系数增大,则D为气体;
a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故a点的v(正)大于b点的v(正),又b点v(正)=v(逆),所以a点时的v(正)>b点时的v(逆);
②b点和c点都处于平衡状态,逆反应速率达到最大值,但c点的温度比b点高,故c>b,又a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故b大于a,综上a、b、c三点气体C的逆反应速率由大到小的顺序:c>b>a;
③,=0.675或,故答案为:>;气体;>;;0.675或。
23. 升高温度 加催化剂 减小压强 t0~t1
【详解】试题分析:(1)t1时,v(正)、v(逆)同时增大,且v(逆)增大得更快,平衡向逆反应方向移动,由于正反应是体积减小的、放热的可逆反应,所以t1时改变的条件是升高温度。t3时,v(正)、v(逆)同时增大且增大量相同,平衡不移动,t3时改变的条件是加催化剂。t4时,v(正)、v(逆)同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(2)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最大。
(3)t6时刻分离出NH3,v(逆)马上减小,而v(正)逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为
。
(4)在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,升高温度平衡向吸热方向移动,即平衡向逆反应方向移动,实验Ⅲ平衡时NH3的浓度比实验Ⅰ小;温度越高,反应速率越快,实验Ⅲ先达到平衡状态,所以图象可表示为
。
【考点】本题主要是考查化学平衡状态及移动,影响化学反应速率的因素,化学反应速率的计算与图象分析等
【点晴】该题的难点是可逆反应图象分析,再进行化学平衡图象题的分析时需要掌握以下几方面知识:首先要搞清楚可逆反应的特点,例如正反应是吸热还是放热,体积增大、减小还是不变,有无固体、纯液体物质参与反应等。其次要依据先拐先平的特点分析,即先出现拐点的则先达到平衡,说明该曲线反应速率快,对应的温度较高、有催化剂、压强较大等。最后如果图象中有三个量时,首先确定一个量不变,再讨论另外两个量的关系。
24. Ⅱ K=c(CH3OH)c(H2O)/c(CO2)c3(H2) < BE 80% 250℃
【分析】(1)反应在不同温度下的化学平衡常数随温度变化判断平衡移动方向,结合平衡移动规律分析反应热量变化;
(2)①根据表中数据可判断,随着温度的升高,平衡常数逐渐减小;
②依据平衡移动影响因素结合产率的计算概念分析判断,正向进行可以提高甲醇的产率;
③依据化学平衡三段式列式计算,根据转化率概念,平衡常数概念计算,依据平衡常数判断反应温度;
【详解】(1)原子利用率达到100%的即符合绿色化学原则,所以反应Ⅱ符合“原子经济”原则;反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(g) 化学平衡常数表达式K=c(CH3OH)c(H2O)/c(CO2)c3(H2);
综上所述,本题正确答案:Ⅱ,K=c(CH3OH)c(H2O)/c(CO2)c3(H2);
(2)①根据表中数据可判断,随着温度的升高,平衡常数逐渐减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,即ΔH2 <0;
综上所述,本题正确答案:<;
②A.该反应为吸热反应,升高温度平衡向逆反应方向移动,生成物的产率降低,A不正确;
B.相当于降低生成物浓度,平衡向逆反应方向移动,增大产率,B正确;
C.催化剂只影响反应速率,不影响平衡状态,C不正确;
D.只是体系的压强增大,但反应物的浓度并没有增大,平衡不移动,D不正确;
E.相当于增大反应物的浓度平衡平衡向正反应方向移动,产率增大,E正确;
综上所述,本题正确选项BE。
③平衡时剩余一氧化碳的物质的量=0.2×2=0.4mol,一氧化碳的转化率=(2-0.4)/2×100%=80%;
CO(g)+2H2(g) CH3OH(g)
起始量 1 3 0
变量 0.8 1.6 0.8
平衡量 0.2 1.4 0.8
K=0.8/0.2×1.42=2.041,对照图表数据判断温度为250℃;
因此,本题正确答案是:80%,250℃。
25. 0.015mol·L-1·min-1 BC > > 高温 0.0125 MPa 该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压 ,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率。
【分析】(1)①根据方程式计算,平衡时压强之比等于物质的量之比,根据v=计算;
②A.混合气体密度为ρ=;B.平衡时Qc=K;C.反应前后气体分子数发生改变,压强改变;D.平衡时v正=v逆,化学反应速率之比等于化学计量数之比;
(2)①相同温度下,增大压强平衡正向移动,丙烷转化率增大,达到平衡状态时丙烷物质的量分数减小,根据温度对平衡的影响判断正反应吸放热情况,根据△G=△H-T△S判断自发反应的条件;
②根据方程式计算平衡时各组分的浓度,代入平衡常数表达式计算平衡常数的值;
③该反应的气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,减小压强平衡向气体体积增大的方向移动。
【详解】(1)①令消耗C3H8的物质的量为xmol:
利用压强之比等于物质的量之比,得出 =,x=1.5mol,根据化学反应速率的数学表达式,v(C3H6)==0.015 mol/(L·min),故答案为:0.015mol·L-1·min-1;
②A.根据ρ=,C3H8、C3H6、H2都是气体,即气体质量保持不变,容器为恒容,V保持不变,密度不变,不能说明反应达到平衡,故A不选;
B. ,,当Qc=K时反应达到平衡,即随着反应进行该比值不再改变,说明反应达到平衡,故B选;
C.反应前后气体系数之和不相等,利用压强之比等于物质的量之比,因此当压强不再改变,说明反应达到平衡,故C选;
D.分解C3H8,生成C3H6,反应都是向正反应方向进行,因此C3H8分解速率与C3H6生成速率相等,不能说明反应达到平衡,故D不选;
故答案为:BC;
(2)①根据图象,作等温线,增大压强,平衡向逆反应方向进行,C3H8的物质的量增大,物质的量分数增大,即p1>p2;根据图象,随着温度升高,C3H8物质的量分数降低,升高温度,平衡向正反应方向进行,即△H1>0;根据符合判据△G=△H-T△S,△H>0,根据方程式,该反应为熵增,即△S>0,能够自发进行,△G<0,即需要在高温下;故答案为:>;>;高温;
②假设起始时丙烷的物质的量为1mol,根据方程式可知:
Q点:丙烷的物质的量分数为50%,则1-y=0.5(1+y),解得y=,则C3H8(g)、C3H6(g)、H2(g)平衡时的物质的量分数分别为:、、,则Q 点对应温度下该反应的平衡常数 Kp== =0.0125MPa,故答案为:0.0125MPa;
③由反应方程式C3H8(g)C3H6(g)+H2(g)可知,该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率,故答案为:该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率。
【点睛】本题考查化学平衡计算、化学平衡状态判断,侧重考查分析计算能力,明确化学平衡常数计算方法、化学平衡状态判断方法是解本题关键,易错点(1)②,注意:只有反应前后改变的物理量才能作为平衡状态判断标准
一、单选题
1.将一定物质的量的HI(g)置于2L的恒容密闭容器中,只发生反应2HI(g)H2(g)+I2(g),在其他条件相同时,反应物HI(g)的物质的量n随反应时间t的变化情况如表所示:
t/min n/mol 实验序号(反应温度) 0 10 20 30 40 50 60
1(800℃) 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2(800℃) 1.2 0.92 0.75 0.63 0.60 0.60 0.60
3(820℃) 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据表中数据,下列说法正确的是
A.在实验1中,反应在10~20min内v(HI)=1.3×10-2mol L-1 min-1
B.在实验2中,40min时反应恰好达到平衡状态
C.根据实验2和实验3,无法说明浓度对反应速率的影响趋势
D.根据实验1和实验3,可得出温度越高,的分解率越小
2.为比较 Fe3+和 Cu2+对 H2O2分解反应的催化效果, 甲、乙两位同学分别设计了如图甲、乙所示的实验。下列说法不正确的是( )
A.图甲所示实验可通过观察气泡产生的快慢来比较反应速率的大小
B.若图甲实验中反应速率① > ②,则可说明Fe3+比Cu2+对 H2O2分解反应的催化效果好
C.用图乙所示装置测定反应速率,放置药品前需检验装置气密性。具体操作为:关闭活塞 A, 然后拉动注射器活塞。一段时间后松开活塞,观察其是否能够恢复原位
D.用图乙所示装置测定反应速率,可在锥形瓶中放置 H2O2溶液,分液漏斗中 Fe3+或 Cu2+溶液。测定并记录反应产生一定气体体积所需的时间
3.对于反应 。下列说法正确的是
A.使用高效催化剂能提高的平衡产率
B.降低温度,该反应的平衡常数减小
C.每消耗22.4L,转移电子的数目约为
D.断裂4H-H键的同时断裂4H-O键,说明反应达到平衡状态
4.下列根据实验现象得出的结论错误的是
选项 实验目的 实验设计 实验现象和结论
A 检验某无色溶液中是否含有 取少量该溶液于试管中,加稀硝酸酸化,再加入硝酸钡溶液 若有白色沉淀生成,则该溶液中一定含有
B 探究和对分解速率的影响 在两支试管中分别加入2mL5%溶液,再向溶液中分别滴入和溶液各1mL,摇匀(已知:对该反应无影响) 相同时间内产生气泡多的,则催化效果好
C 探究乙酸和碳酸的酸性强弱 用乙酸溶液浸泡水壶中的水垢 水垢溶解并有气泡冒出,则乙酸的酸性比碳酸的强
D 检验某气体是否为 将气体通入酸性溶液中 若溶液褪色,则该气体不一定是
A.A B.B C.C D.D
5.分解反应过程中能量变化如图,其中①有加入,②无加入。有加入时的反应历程为;。下列判断错误的是
A.加入后改变了反应的路径
B.加入后不改变总反应的能量变化
C.过程①生成中间产物的反应为决速步
D.过程②正反应活化能大于逆反应活化能
6.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确的是
A.8min前A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等均为4
7.由工业废铜泥(主要成分为、、,含少量)制备难溶于水的氯化亚铜,其工艺流程如图。下列说法错误的是
A.“灼烧”可将、等转化为
B.“除杂”①过程中升高温度或增大一定能加快化学反应速率
C.流程中的可循环使用
D.“还原”中每消耗还原剂,理论上可获得
8.乙酸是常见的化工原料,在过渡金属的催化作用下有两种反应路径,种路径和能垒数据(单位:eV)如图,已知每一步生成的粒子均为吸态。下列说法正确的是
A.该反应条件下,CH3COOH中O-H最容易断裂
B.两条路径的决速步为④
C.反应⑤的反应方程式:CH2CO*=CH2*+CO*
D.反应过程中粒子被吸附在金属表面,发生物理变化
9.将CO2转化为甲醇的原理为CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH<0。500℃时,在体积为100mL的固定容积的密闭容器中充入0.1molCO2、0.3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,从中得出的结论错误的是
A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B.平衡时CO2的转化率为75%
C.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min)
D.500℃时该反应的平衡常数K=3
10.对于可逆反应N2(g)+3H2(g)2NH3(g) △H<0,下列各项示意图及解释正确的是
A.甲图中压强增大,v(正)>v(逆),平衡正向移动
B.乙图中b点时NH3的百分含量最大,N2的转化率大小关系为a=c
D.丁图中随着压强增大,H2的转化率增大,且温度T1>T2
11.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下:
下列说法不正确的是
A.催化剂能够降低反应的活化能,增大反应物分子中活化分子的百分数
B.过程I吸收能量
C.表示H2燃烧热的热化学方程式为:H2(g) +O2(g)=H2O(g) ΔH=-241kJ/mol
D.该反应的中间过程中有双氧水的生成
12.下列叙述中,能用勒夏特列原理解释的是
A.合成氨工业中,选择500℃有利于氨的合成
B.用饱和食盐水吸收氯气中的HCl
C.由、、HI三种气体组成的平衡体系加压后颜色变深
D.向双氧水中加入二氧化锰有利于氧气生成
13.在25℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是
物质 X Y Z
起始浓度/ 0.1 0.2 0
平衡浓度/ 0.05 0.05 0.1
A.反应达到平衡时,Y的转化率为75%
B.反应可表示为,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.若升温后该反应的平衡常数减小,则该反应为放热反应
14.在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
A.A的百分含量不再改变
B.各组分的浓度不再改变
C.反应速率υ(A):υ(B):υ(C):υ(D)=m:n:p:q
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
15.在一密闭容器中,反应 aA(气)bB(气)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达到新平衡时,A的浓度是原来的1.5倍,则下列说法不正确的是
A.平衡向正反应方向移动 B.物质A的转化率变小
C.物质B的质量分数增加了 D.a>b
二、填空题
16.(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L 1·min 1,则以物质B表示此反应的化学反应速率为 mol·L 1·min 1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为 。
(3)①将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L 1·s 1,则在2s时,容器中有 mol A,此时C的物质的量浓度为 。
②能说明该反应已达到平衡状态的是 (填字母)。
a.v(A)=2v(B) b.容器内压强保持不变
c.3v逆(A)=v正(B) d.容器内混合气体的密度保持不变
③在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是 (填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
17.Ⅰ、在容积为2.0 L的密闭容器内,物质D在 T ℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据上图写出该反应的化学方程式______________,该反应的平衡常数K=____________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(4)若在第7 min时增加D的物质的量,A的物质的量变化正确的是_______(用图中a、b、c的编号回答)。
Ⅱ、可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
(5)达平衡(I)时体系的压强与反应开始时体系的压强之比为_____________
(6)达平衡(I)时,X的转化率为_______________
(7)X(g)+2Y(g)2Z(g) 是_______热反应。
18.已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化和化学平衡的移动方向。
t1时刻,增大反应物浓度,使v′正增大,而v′逆不变,则v′正>v′逆,平衡向正反应方向移动。请参照上图,画出t1时刻,减小反应物浓度,其反应速率的变化,并分析化学平衡的移动方向。
19.将3molA和1molB混合于2L的密闭容器中,发生如下反应:4A(g)+ B(g)2C(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,则:
(1)用B表示该反应的反应速率为 。
(2)A的转化率为 。
20.(1)用O2将HCl转化为Cl2,可提高效益、减少污染。新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图,则总反应的ΔH 0(填“>”、“=”或“<”);A、B两点的反应速率中较大的是 。
②下列措施有利于提高αHCl的有 (填字母)。
A.增大n(HCl) B.增大n(O2)
C. 使用更好的催化剂 D.移去H2O
(2)乙苯催化脱氢制苯乙烯反应: ,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实: 。
②控制反应温度为600 ℃的理由是 。
21.回答下列问题:
(1)某温度下在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是 。
②从反应开始到5min时,用Y表示的反应速率为 。
(2)800℃、2L密闭容器反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(S) 0 1 2 3 4 5
n(NO)mol 0.020 0.010 0.008 0.007 0.007 0.007
计算并回答下列问题:
①反应进行到2s时c(NO)= 。
②反应达到平衡状态时NO的转化率= 。
22.一定温度下,在密闭容器中发生反应 ,正反应速率表达式为(是正反应速率常数,只与温度有关)。测得正反应速率常数与浓度关系如表所示:
序号
Ⅰ 0.10 0.10 0.15
Ⅱ 0.20 0.20 2.40
Ⅲ 0.20 0.10 1.20
(1) , 。
(2)向容积为的恒容密闭容器中仅充入和,发生上述反应,测得随时间的变化如图所示。
①T1 T2(填“>”、“<”或“=”,下同),物质的聚集状态为 ;点时气体的 点时气体的。
②、、三点气体的逆反应速率由大到小的顺序为 (用、、表示)。
③时,此反应的平衡常数 (不写单位)。
23.在一密闭容器中发生反应N2+3H22NH3。达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
回答下列问题:
(1)t1、t2、t3时刻分别改变的一个条件,t1时刻 t3时刻 t4时刻 。
(2)氨的百分含量最高的时间段是 。
(3)如果在t6对刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化情况;
(4)实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1。
在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
24.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
(1)上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),反应I的化学平衡常数表达式K= 。
(2)下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 250℃ 300℃ 350℃
K 2.041 0.270 0.012
①由表中数据判断ΔH2 0(填“>”、“<”或“=”);
②若容器容积不变,下列措施可增加甲醇产率的是 ;
A、升高温度 B、将CH3OH(g)从体系中分离 C、使用合适的催化剂 D、充入He,使体系总压强增大 E、按原比例再充入CO和H2
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
25.丙烯是重要的有机化工原料,工业上丙烷脱氢制丙烯的反应:C3H8(g)C3H6(g)+H2(g) ΔH1。
(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8发生反应,经过 10 min 达到平衡状态, 测得平衡时气体压强是开始的 1.75 倍。
①0~10min 内丙烯的反应速率 v(C3H6)= 。
②下列情况能说明该反应达到平衡状态的是 。
A.气体密度保持不变 B. 保持不变
C.装置内总压强保持不变 D .C3H8 分解速率与 C3H6生成速率相等
(2)总压强分别为 p1和 p2时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数 如图所示:
①压强:p1 p2;ΔH1 0(填“>”或“<”),该反应自发进行的条件是 (填“高温”“低温” 或“任意温度”)。
②若 p1=0.1MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,某气体分压=总压×某气体物质的量分数)。
③在恒温恒压条件下,向容器中通入丙烷和稀有气体的混合气体发生丙烷脱氢反应,随着起始混合气体中稀有气体所占比例增大,丙烷脱氢转化率逐渐增大。试解释原因: 。
试卷第1页,共3页
参考答案:
1.C
【详解】A.实验1中,反应在10~20min内,v(HI)==0.0065 mol L-1 min-1,A错误;
B.在实验2中,40min后HI(g)的物质的量不再变化,说明40min后反应处于平衡状态,但不能说明40min时反应恰好达到平衡状态,B错误;
C.实验2和实验3的反应温度不同,且HI(g)的起始物质的量不同,则无法说明浓度对反应速率的影响趋势,C正确;
D.比较实验1和实验3,开始时加入的n(HI)相同,反应温度不同,平衡时实验3中HI(g)的物质的量少,说明温度越高,HI的分解率越大,D错误;
综上所述答案为C。
2.B
【详解】A.反应越剧烈,产生气泡越快,说明反应速率越大,A正确;
B.若图甲所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜对H2O2分解反应的催化效果好,但因题图甲两试管中所加试剂所含的阴离子不同,故不能证明Fe3+比Cu2+对H2O2分解反应的催化效果好,若要证明Fe3+比Cu2+对H2O2分解反应的催化效果好,还要使选择的试剂中阴离子的种类相同,B错误;
C.若气密性良好,关闭活塞 A, 然后拉动注射器活塞,一段时间后松开活塞,活塞会恢复原位,C正确;
D.H2O2 溶液中加Fe3+或 Cu2+,H2O2分解,用注射器测量体积,记录时间,可计算反应速率,D正确;
故选B。
3.D
【详解】A.催化剂不能使平衡发生移动,故使用高效催化剂不能提高的平衡产率,A项错误;
B.降低温度,该反应正向移动,平衡常数增大,B项错误;
C.未给定标准状况,不能计算,C项错误;
D.断裂4键的同时断裂4键表明正逆反应的速率相同,说明反应达到平衡状态,D项正确;
故选D。
4.A
【详解】A.稀硝酸具有很强的氧化性,能将氧化成,若原无色溶液中不含有,而含有,加稀硝酸酸化,再加入硝酸钡溶液,也会产生白色沉淀,A错误;
B.向相同浓度相同体积的溶液中加入相同浓度、体积的和,相同时间内产生气泡多的,则催化效果更好,B正确;
C.用乙酸溶液浸泡水壶中的水垢,水垢溶解并有气泡冒出,则乙酸的酸性比碳酸的强,C正确;
D.将气体通入酸性溶液中,若溶液褪色,则该气体可能为,也可能为、HCl、乙烯、乙炔等气体,D正确;
故选A。
5.D
【详解】A.由题干信息可知KI在反应中作催化剂,结合图示可知KI改变了反应的路径,故A正确;
B.加入KI改变了反应过程,但未影响反应物和生成物的能量,不改变总反应的能量变化,故B正确;
C.由图可知过程①中生成大于生成的活化能,活化能越大,反应速率越慢,慢反应决定总反应速率,故C正确;
D.由能量变化图可知正反应活化能均小于逆反应活化能,故D错误;
故选:D。
6.B
【详解】A.反应从开始到8min内A浓度减少了0.64mol/L,所以A的反应速率为0.08 mol/( min),故A错误;
B.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是该反应前后气体系数之和相等,然后扩大容器降低了压强;40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,且正反应为放热反应,故B正确;
C.开始到达到平衡,A、B的浓度减少的量相同,可知x=1,根据B选项可知该反应正反应为放热反应,故C错误;
D.根据B选项分析可知40min时升高了温度,所以30min和54min时温度不一样,所以平衡常数不相等,故D错误;
综上所述答案为B。
7.B
【分析】工业废铜泥(主要成分为、、,含少量),在空气中灼烧将、、转化为CuO,将Fe转化为铁的氧化物,加入硫酸酸浸后CuO和铁的氧化物溶解成硫酸铜和硫酸铁、硫酸亚铁等,除杂过程中加入过氧化氢和氢氧化钠溶液后,将亚铁离子氧化成铁离子,然后变成氢氧化铁沉淀除去,滤液为硫酸铜溶液,加入亚硫酸钠和氯化钠后得到CuCl。
【详解】A.灼烧过程中,空气中氧气可将、等转化为,A正确;
B.除杂过程中加入过氧化氢溶液,若温度过高,则过氧化氢会分解,化学反应速率可能变慢,B错误;
C.还原过程生成硫酸,酸浸过程消耗硫酸,所以硫酸可以循环使用,C正确;
D.根据电子守恒,还原剂为亚硫酸钠,设CuCl的物质的量为xmol,则有以下关系: x=2mol,D正确;
故答案选B。
8.C
【详解】A.第⑤步能垒最小,CH3COOH中C-C最容易断裂,故A错误;
B.能垒大的步骤为决速步骤,途径Ⅰ的决速步骤是③,途径Ⅱ的决速步骤是④,故B错误;
C.由图可得,反应⑤的反应方程式:CH2CO*=CH2*+CO*,故C正确;
D.由图可知,反应过程中是存在物质变化的,所以发生的是化学变化,故D错误;
故答案选C。
9.D
【详解】A.随反应进行X的浓度增大,X表示生成物,由方程式可知CH3OH(g)、H2O(g)的浓度变化相等,曲线X可以表示CH3OH(g)或H2O(g)的浓度变化,A结论正确;
B.平衡时二氧化碳的浓度为0.25mol/L,二氧化碳的浓度变化量为1mol/L-0.25mol/L=0.75mol/L,由方程式可知氢气的浓度变化为3×0.75mol/L=2.25mol/L,氢气的转化率=×100%=75%,B结论正确;
C.Y的起始浓度为1mol/L,故Y表示二氧化碳,平衡时二氧化碳的浓度为0.25mol/L,故v(CO2)==0.075mol/(L min),速率之比等于化学计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L min)=0.225mol/(L min),C结论正确;
D.平衡时二氧化碳的浓度为0.25mol/L,则:
平衡常数K==5.33,D结论错误;
答案为D。
10.C
【详解】A.反应物和生成物均为气体,增大压强,正逆反应速率均增大,A错误;
B.a、b、c三点所处的平衡状态中,反应物N2的转化率与投入的另一种反应物氢气的量有关,氢气初始量越多,N2的转化率越高,B错误;
C.改变的条件是增大压强,容器体积减小,N2浓度增大,平衡正向移动,导致N2浓度减小,C正确;
D.正反应为放热反应,升高温度化学平衡逆向移动,如果温度T1>T2,相同压强下,T1时H2的转化率应该比T2时小,D错误;
故选C。
11.C
【详解】A.催化剂能够改变反应的路径,降低反应的活化能,增大活化分子百分数,从而使反应物分子中活化分子的百分数增大,A正确;
B.过程I中,断裂O-H共价键,所以需要吸收能量,B正确;
C.表示H2燃烧热的热化学方程式中,生成物水应呈液态,而本方程式中生成了H2O(g),C不正确;
D.从图中可以看出,由过程Ⅱ转化为过程Ⅲ,生成了H-O-O-H,所以该反应的中间过程中有双氧水的生成,D正确;
故选C。
12.B
【详解】A.合成氨为放热反应,升高温度平衡逆向进行,但升高温度为加快反应速率,与平衡移动无关,不能用勒夏特列原理解释,A不符合;
B.排饱和食盐水的方法吸收氯气,利用的是氯离子浓度增大,使平衡逆向进行,减少氯气的溶解性,能用勒夏特列原理解释,B符合;
C.由 H2 、 I2 、HI三种气体组成的平衡体系加压后平衡不移动,不能用勒夏特列原理解释,C不符合;
D.向双氧水中加入二氧化锰,起到催化作用,与化学平衡无关,不能用勒夏特列原理解释,D不符合;
故答案为:B。
13.C
【分析】列三行式计算题目所求数据
Cy转= (0.2-0.05) mol L-1 = 0.15 mol L-1
【详解】A.达到平衡时,Y的转化率,A项正确,不符题意;
B.化学平衡常数,代入平衡浓度值得,B项正确,不符题意;
C.化学平衡常数只受温度的影响,温度变,平衡常数变,与浓度、压强无关;所以增大压强时,化学平衡常数不变,C项错误,符合题意;
D.升温,化学平衡向吸热反应一侧移动,现升温后平衡常数减小,说明平衡逆向移动,故正向为放热反应,D项正确,不符题意;
综上,本题选C。
14.C
【详解】A.A的百分含量不再改变是反应达到平衡状态的特征标志之一,A不选 ;
B.各组分的浓度不再改变是反应达到平衡状态的特征标志之一,B不选;
C.没有指明是正反应速率还是逆反应速率,不能说明反应达到平衡状态,C选;
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应,说明正、逆反应速率相等,是反应处于平衡状态的本质标志,D不选;
答案选C。
15.B
【分析】
保持温度不变,将容器体积缩小一半,假设平衡不移动,A和B的浓度应均是原来的2倍,但当达到新的平衡时,A的浓度是原来的1.5倍,说明增大压强平衡正向移动,则说明a>b;
【详解】
A. 由上述分析可知,平衡正反应方向移动,A正确;
B. 平衡向正反应方向移动,A的转化率增大,B错误;
C. 平衡向正反应方向移动,B的质量增大,混合气体的总质量不变,故B的质量分数增大,C正确;
D. 增大压强平衡向正反应方向移动,则说明a>b,D正确;
答案选B。
16. 0.6 0.05 mol·L 1·s 1 8.8 0.08 mol·L 1 b ①③
【详解】(1)根据同一反应中用不同的物质来表示反应速率时,其数值之比等于各物质的化学计量数之比,可知,v(A): v(B)=1:3,则v(B)=。答案为:0.6;
(2) 由题可知, 3s后N2的物质的量为1.9mol,根据反应方程式:N2(g)+3H2(g)2NH3(g),可知,3s后消耗H2的物质的量为。根据化学反应速率的定义,可知,v(H2)=。答案为:0.05 mol·L 1·s 1;
(3)①根据化学反应速率的定义,可知在最初2s内,消耗A的物质的量=,则2s时,容器中A的物质的量=10mol-1.2mol=8.8mol。根据反应方程式,可知2s时生成C的物质的量=,此时C的物质的量浓度=。答案为:8.8;0.08mol L-1;
②a.v(A)=2v(B)不能说明v正=v逆,即不能说明该反应达到平衡状态,a项错误;
b.该可逆反应反应前后气体分子数不相等,则总压强一定,说明反应达到平衡状态。b项正确;
c.根据化学反应方程式,可知,3v逆(A)=9v逆(B)=v正(B),即v逆(B)≠v正(B),不能说明反应达到平衡状态,c项错误;
d.恒容条件下,该可逆反应前后气体质量不变,密度不变,不能说明该反应达到平衡状态。d项错误;
答案选b;
③①降低温度,化学反应速率减小;
②正催化剂能显著加快反应速率,负催化剂能减慢反应速率;
③增大容器体积,该反应中的物质的浓度减小,化学反应速率减小;
综上所述,改变条件①③,反应速率会减小。答案为:①③。
17.(14分) Ⅰ、(1) 0.067 mol/(L·min)(2分)
(2) 2D(s) 2A(g)+B(g) (2分,必须标出D的状态,A、B状态可以不标)0.004(2分)
(3) 减小(1分) (4) b(1分)
Ⅱ、(4) 5:6 (2分) (5) 83.3% (写成5/6不给分)(2分) (6) 吸热 (2分)
【详解】试题分析:Ⅰ、(1)根据图示可知从反应开始到第一次达到平衡时 n(A)=0.4mol,所以A物质的平均反应速率为0.4mol÷2L÷3min=0.067 mol/(L·min);(2)根据图示可知:在相同时间内D减小0.4mol,A 增加0.4mol,B增加0.2mol。则D是反应物,A、B是生成物。它们改变的物质的量的比是2:2:1,应用最终各种物质的浓度都不能改变,而且三种物质都存在,因此该反应是可逆反应,根据提示的物质状态可得方程式是:2D(s) 2A(g)+B(g) ;该反应的平衡常数K=c2(A)·c(B)=0.22×0.1=0.004;(3)由于在第5 min时,升高温度,A、B、浓度增大,说明升高温度平衡正向移动,正反应方向是吸热反应,则降温时,平衡向放热的逆反应方向移动,此时该反应的平衡常数减小;(4)若在第7 min时增加D的物质的量,由于D是固体,增加其物质的量,物质的浓度不变,所以化学平衡不发生移动,A的物质的量变化正确的是b;Ⅱ、(4)①是反应前后气体体积减小的反应,而②是反应前后气体体积不变的反应。由于反应②的气体的物质的量不变,平衡是与反应①体积相同,则①平衡时气体的物质的量也是2mol。对于在密闭容器中进行的可逆反应,气体的物质的量的比等于压强的比。所以达平衡(I)时体系的压强与反应开始时体系的压强之比为2:2.4=5:6;(6)②反应是气体的物质的量不变的反应。由于左右两边气体的压强相等,假设反应①平衡时气体的物质的量是x,则2:2.4=x:2.6,解得x=13/6mol。减少5/6mol.根据方程式X(g)+2Y(g) 2Z(g)可知,每有1mol的X发生反应,达到平衡时气体的物质的量减小1mol,现在气体的物质的量减小0.6mol,所以达平衡(I)时,X的转化率为(5/6mol÷1mol)×100%=83.3%;(7)由于降低温度,X(g)+2Y(g) 2Z(g) 平衡是气体的体积增大,说明降低温度,平衡向逆向移动,逆反应方向是放热反应,所以该反应的正反应是吸热反应。
考点:考查化学反应速率的计算、反应方程式的书写、温度、压强对化学平衡移动的影响-物质转化率的计算的知识。
18.
t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动。
【详解】t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动,图像为 。
19.(1)
(2)50%
【分析】经5min后测得D的物质的量为0.5mol/L×2L=1mol,以此解题。
【详解】(1)由题给消息可得三段式:
则用B表示该反应的反应速率为;
(2)A的转化率为。
20. < B BD 正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积增大,平衡向正反应方向移动 600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大
【分析】(1)①根据图象结合温度对化学反应速率与化学平衡的影响效果作答;
②改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;
(2) ①保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由。
【详解】(1)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;升高温度化学反应速率增大,则A、B两点的反应速率中较大的是B,故答案为<;B;
②A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,A项错误;
B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,B项正确;
C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,C项错误;
D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,D项正确,
故选BD;
(2) ①正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
②600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大。
故选择600℃左右。
21.(1) 3X(g)+Y(g)2Z(g) 0.02mol·L-1·min-1
(2) 0.004mol/L 65%
【详解】(1)①参加反应的物质的量之比等于反应的系数比,由图可知,反应XYZ的物质的量之比为(1.0-0.4): (1.0-0.8): (0.5-0.1)=3:1:2,故该反应的化学方程式是3X(g)+Y(g)2Z(g)。
②从反应开始到5min时,用Y表示的反应速率为;
(2)①反应进行到2s时c(NO)= 。
②反应达到平衡状态时N的转化率为。
22.(1) 3 1
(2) > 气体 > 0.675或
【详解】(1)将Ⅰ和Ⅲ数据代入正反应速率表达式可得:解得m=3;将Ⅱ和Ⅲ数据代入正反应速率表达式可得:解得n=1。故答案为:3;1;
(2)①比较T1、p2和T2、p2:压强相同,由T1到T2,n(C)增大,平衡正移,由于反应放热,故此过程温度降低,故T1>T2;
比较T1、p1和T1、p2:温度相同,p2时反应速率大于p1,故p2>p1,从p1到p2,n(C)减小,平衡逆移,即压强增大,平衡逆移,故该反应正方向气体系数增大,则D为气体;
a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故a点的v(正)大于b点的v(正),又b点v(正)=v(逆),所以a点时的v(正)>b点时的v(逆);
②b点和c点都处于平衡状态,逆反应速率达到最大值,但c点的温度比b点高,故c>b,又a点到b点过程中,n(C)继续增大,平衡正移,正反应速率不断减小,逆反应速率不断增大,故b大于a,综上a、b、c三点气体C的逆反应速率由大到小的顺序:c>b>a;
③,=0.675或,故答案为:>;气体;>;;0.675或。
23. 升高温度 加催化剂 减小压强 t0~t1
【详解】试题分析:(1)t1时,v(正)、v(逆)同时增大,且v(逆)增大得更快,平衡向逆反应方向移动,由于正反应是体积减小的、放热的可逆反应,所以t1时改变的条件是升高温度。t3时,v(正)、v(逆)同时增大且增大量相同,平衡不移动,t3时改变的条件是加催化剂。t4时,v(正)、v(逆)同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(2)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最大。
(3)t6时刻分离出NH3,v(逆)马上减小,而v(正)逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为
。
(4)在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,升高温度平衡向吸热方向移动,即平衡向逆反应方向移动,实验Ⅲ平衡时NH3的浓度比实验Ⅰ小;温度越高,反应速率越快,实验Ⅲ先达到平衡状态,所以图象可表示为
。
【考点】本题主要是考查化学平衡状态及移动,影响化学反应速率的因素,化学反应速率的计算与图象分析等
【点晴】该题的难点是可逆反应图象分析,再进行化学平衡图象题的分析时需要掌握以下几方面知识:首先要搞清楚可逆反应的特点,例如正反应是吸热还是放热,体积增大、减小还是不变,有无固体、纯液体物质参与反应等。其次要依据先拐先平的特点分析,即先出现拐点的则先达到平衡,说明该曲线反应速率快,对应的温度较高、有催化剂、压强较大等。最后如果图象中有三个量时,首先确定一个量不变,再讨论另外两个量的关系。
24. Ⅱ K=c(CH3OH)c(H2O)/c(CO2)c3(H2) < BE 80% 250℃
【分析】(1)反应在不同温度下的化学平衡常数随温度变化判断平衡移动方向,结合平衡移动规律分析反应热量变化;
(2)①根据表中数据可判断,随着温度的升高,平衡常数逐渐减小;
②依据平衡移动影响因素结合产率的计算概念分析判断,正向进行可以提高甲醇的产率;
③依据化学平衡三段式列式计算,根据转化率概念,平衡常数概念计算,依据平衡常数判断反应温度;
【详解】(1)原子利用率达到100%的即符合绿色化学原则,所以反应Ⅱ符合“原子经济”原则;反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(g) 化学平衡常数表达式K=c(CH3OH)c(H2O)/c(CO2)c3(H2);
综上所述,本题正确答案:Ⅱ,K=c(CH3OH)c(H2O)/c(CO2)c3(H2);
(2)①根据表中数据可判断,随着温度的升高,平衡常数逐渐减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,即ΔH2 <0;
综上所述,本题正确答案:<;
②A.该反应为吸热反应,升高温度平衡向逆反应方向移动,生成物的产率降低,A不正确;
B.相当于降低生成物浓度,平衡向逆反应方向移动,增大产率,B正确;
C.催化剂只影响反应速率,不影响平衡状态,C不正确;
D.只是体系的压强增大,但反应物的浓度并没有增大,平衡不移动,D不正确;
E.相当于增大反应物的浓度平衡平衡向正反应方向移动,产率增大,E正确;
综上所述,本题正确选项BE。
③平衡时剩余一氧化碳的物质的量=0.2×2=0.4mol,一氧化碳的转化率=(2-0.4)/2×100%=80%;
CO(g)+2H2(g) CH3OH(g)
起始量 1 3 0
变量 0.8 1.6 0.8
平衡量 0.2 1.4 0.8
K=0.8/0.2×1.42=2.041,对照图表数据判断温度为250℃;
因此,本题正确答案是:80%,250℃。
25. 0.015mol·L-1·min-1 BC > > 高温 0.0125 MPa 该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压 ,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率。
【分析】(1)①根据方程式计算,平衡时压强之比等于物质的量之比,根据v=计算;
②A.混合气体密度为ρ=;B.平衡时Qc=K;C.反应前后气体分子数发生改变,压强改变;D.平衡时v正=v逆,化学反应速率之比等于化学计量数之比;
(2)①相同温度下,增大压强平衡正向移动,丙烷转化率增大,达到平衡状态时丙烷物质的量分数减小,根据温度对平衡的影响判断正反应吸放热情况,根据△G=△H-T△S判断自发反应的条件;
②根据方程式计算平衡时各组分的浓度,代入平衡常数表达式计算平衡常数的值;
③该反应的气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,减小压强平衡向气体体积增大的方向移动。
【详解】(1)①令消耗C3H8的物质的量为xmol:
利用压强之比等于物质的量之比,得出 =,x=1.5mol,根据化学反应速率的数学表达式,v(C3H6)==0.015 mol/(L·min),故答案为:0.015mol·L-1·min-1;
②A.根据ρ=,C3H8、C3H6、H2都是气体,即气体质量保持不变,容器为恒容,V保持不变,密度不变,不能说明反应达到平衡,故A不选;
B. ,,当Qc=K时反应达到平衡,即随着反应进行该比值不再改变,说明反应达到平衡,故B选;
C.反应前后气体系数之和不相等,利用压强之比等于物质的量之比,因此当压强不再改变,说明反应达到平衡,故C选;
D.分解C3H8,生成C3H6,反应都是向正反应方向进行,因此C3H8分解速率与C3H6生成速率相等,不能说明反应达到平衡,故D不选;
故答案为:BC;
(2)①根据图象,作等温线,增大压强,平衡向逆反应方向进行,C3H8的物质的量增大,物质的量分数增大,即p1>p2;根据图象,随着温度升高,C3H8物质的量分数降低,升高温度,平衡向正反应方向进行,即△H1>0;根据符合判据△G=△H-T△S,△H>0,根据方程式,该反应为熵增,即△S>0,能够自发进行,△G<0,即需要在高温下;故答案为:>;>;高温;
②假设起始时丙烷的物质的量为1mol,根据方程式可知:
Q点:丙烷的物质的量分数为50%,则1-y=0.5(1+y),解得y=,则C3H8(g)、C3H6(g)、H2(g)平衡时的物质的量分数分别为:、、,则Q 点对应温度下该反应的平衡常数 Kp== =0.0125MPa,故答案为:0.0125MPa;
③由反应方程式C3H8(g)C3H6(g)+H2(g)可知,该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率,故答案为:该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率。
【点睛】本题考查化学平衡计算、化学平衡状态判断,侧重考查分析计算能力,明确化学平衡常数计算方法、化学平衡状态判断方法是解本题关键,易错点(1)②,注意:只有反应前后改变的物理量才能作为平衡状态判断标准
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
