2024中考化学 第一部分 成都中考考点研究 第十单元 酸和碱 课件(共79张PPT)
文档属性
| 名称 | 2024中考化学 第一部分 成都中考考点研究 第十单元 酸和碱 课件(共79张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 21:46:14 | ||
图片预览







文档简介
(共79张PPT)
第十单元 酸和碱
考点特训营
2
纵横过实验 · 纵向实验逐个过
3
1
成都10年真题子母题+2年诊断检测
命题点2 常见酸和碱的性质(10年10考)
课标要求
2022课标 2011课标
◎以盐酸、硫酸、氢氧化钠和氢氧化钙为例,通过实验探究认识酸、碱的主要性质和用途。 ◎认识常见酸碱的主要性质和用途,知道酸碱的腐蚀性。
◎初步学会常见酸碱溶液的稀释方法。
◎学生必做实验及实践活动:常见酸、碱的化学性质。 ◎完成基础的学生实验:酸、碱的化学性质。
【内容要求】
2022课标 2011课标
◎跨学科实践活动:探究土壤酸碱性对植物生长的影响。(新增)
【学业要求】
◎能通过实验说明酸和碱的主要性质,并能用化学方程式表示。
◎能举例说明物质性质的广泛应用及性质与用途的关系;能利用常见物质的性质,分析、解释一些简单的化学现象和事实。
◎能说明必做实验的基本思路与方法,分析实验实施的合理性,能体现严谨求实、敢于质疑的科学态度。
◎能基于必做实验形成的探究思路与方法,结合物质的组成及变化等相关知识,分析解决真实情境中的简单实验问题。
◎能运用研究物质性质的一般思路与方法,从物质类别的视角, 依据中和反应等,初步预测酸和碱的主要性质,设计实验方案,分析、解释有关的实验现象,进行证据推理,得出合理的结论。
◎能基于真实问题情境,依据常见物质的性质,初步分析和解决相关的综合问题。
考情分析
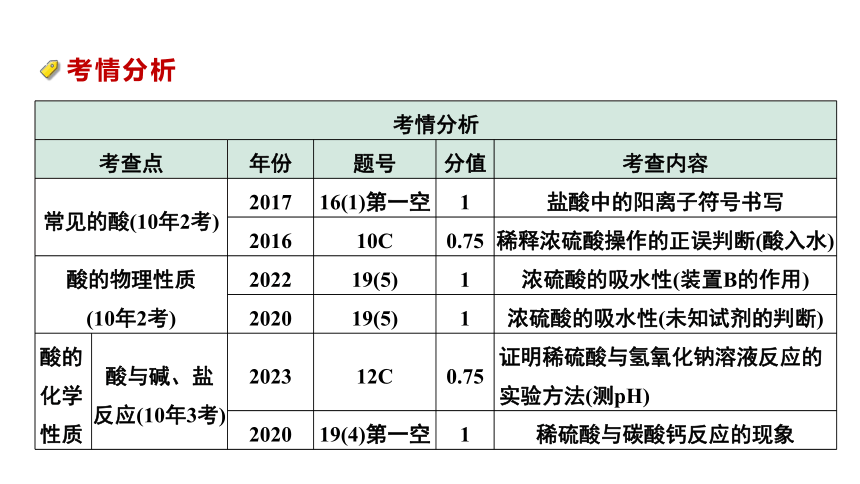
考情分析 考查点 年份 题号 分值 考查内容
常见的酸(10年2考) 2017 16(1)第一空 1 盐酸中的阳离子符号书写
2016 10C 0.75 稀释浓硫酸操作的正误判断(酸入水)
酸的物理性质 (10年2考) 2022 19(5) 1 浓硫酸的吸水性(装置B的作用)
2020 19(5) 1 浓硫酸的吸水性(未知试剂的判断)
酸的化学性质 酸与碱、盐反应(10年3考) 2023 12C 0.75 证明稀硫酸与氢氧化钠溶液反应的实验方法(测pH)
2020 19(4)第一空 1 稀硫酸与碳酸钙反应的现象
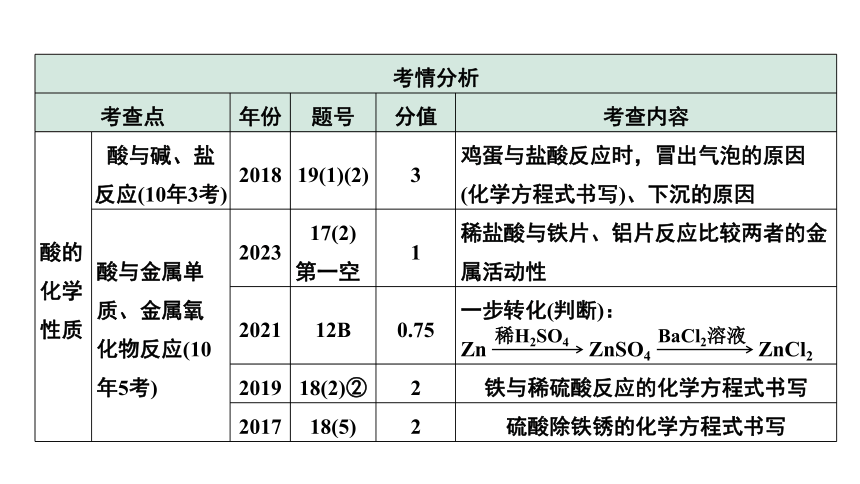
考情分析 考查点 年份 题号 分值 考查内容
酸的化学性质 酸与碱、盐反应(10年3考) 2018 19(1)(2) 3 鸡蛋与盐酸反应时,冒出气泡的原因(化学方程式书写)、下沉的原因
酸与金属单质、金属氧化物反应(10年5考) 2023 17(2) 第一空 1 稀盐酸与铁片、铝片反应比较两者的金属活动性
2021 12B 0.75 一步转化(判断):
Zn ZnSO4 ZnCl2
2019 18(2)② 2 铁与稀硫酸反应的化学方程式书写
2017 18(5) 2 硫酸除铁锈的化学方程式书写
稀H2SO4
BaCl2溶液
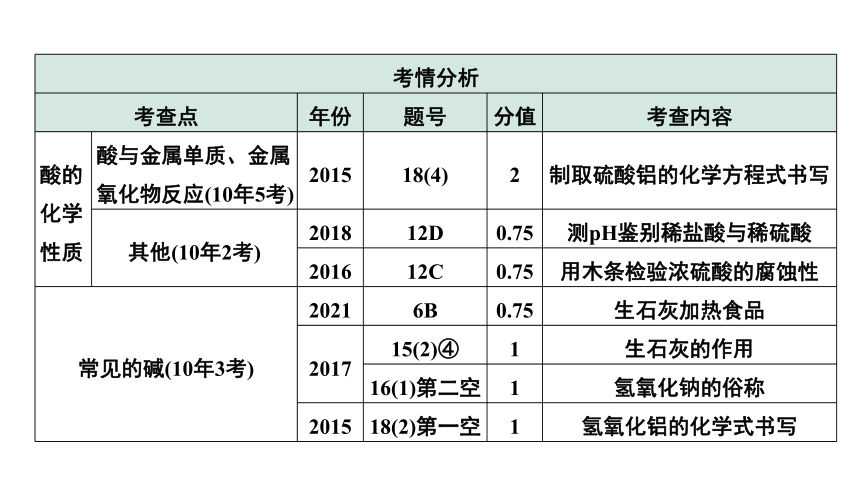
考情分析 考查点 年份 题号 分值 考查内容
酸的化学性质 酸与金属单质、金属氧化物反应(10年5考) 2015 18(4) 2 制取硫酸铝的化学方程式书写
其他(10年2考) 2018 12D 0.75 测pH鉴别稀盐酸与稀硫酸
2016 12C 0.75 用木条检验浓硫酸的腐蚀性
常见的碱(10年3考) 2021 6B 0.75 生石灰加热食品
2017 15(2)④ 1 生石灰的作用
16(1)第二空 1 氢氧化钠的俗称
2015 18(2)第一空 1 氢氧化铝的化学式书写
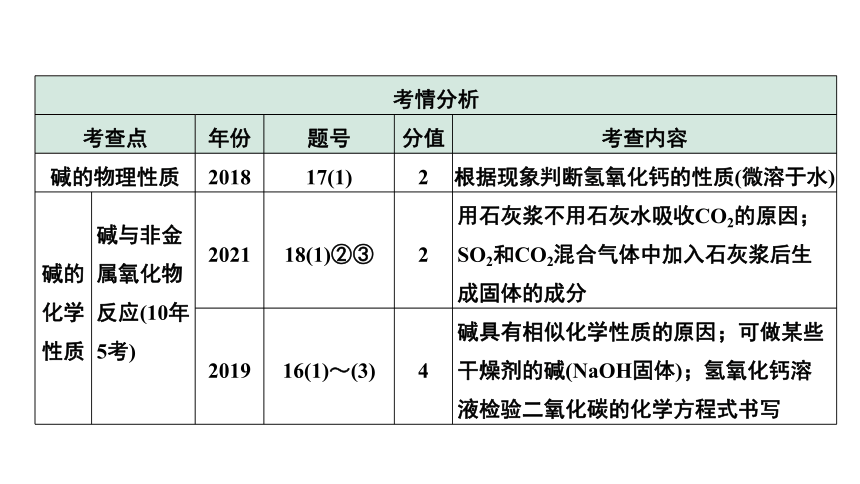
考情分析 考查点 年份 题号 分值 考查内容
碱的物理性质 2018 17(1) 2 根据现象判断氢氧化钙的性质(微溶于水)
碱的化学性质 碱与非金属氧化物反应(10年5考) 2021 18(1)②③ 2 用石灰浆不用石灰水吸收CO2的原因;SO2和CO2混合气体中加入石灰浆后生成固体的成分
2019 16(1)~(3) 4 碱具有相似化学性质的原因;可做某些干燥剂的碱(NaOH固体);氢氧化钙溶液检验二氧化碳的化学方程式书写
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与非金属氧化物反应(10年5考) 2018 17(3) 第二空 2 二氧化碳通入澄清石灰水中发生反应的化学方程式书写
2017 19(2) 第二空 2 氢氧化钠与二氧化碳反应的化学方程式书写
2016 19 13 二氧化碳与氢氧化钠溶液是否反应的探究
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与酸、盐反应 (10年5考) 2023 12C 0.75 证明稀硫酸与氢氧化钠溶液反应的实验方法(测pH)
考情分析 考查点 年份 题号 分值 考查内容
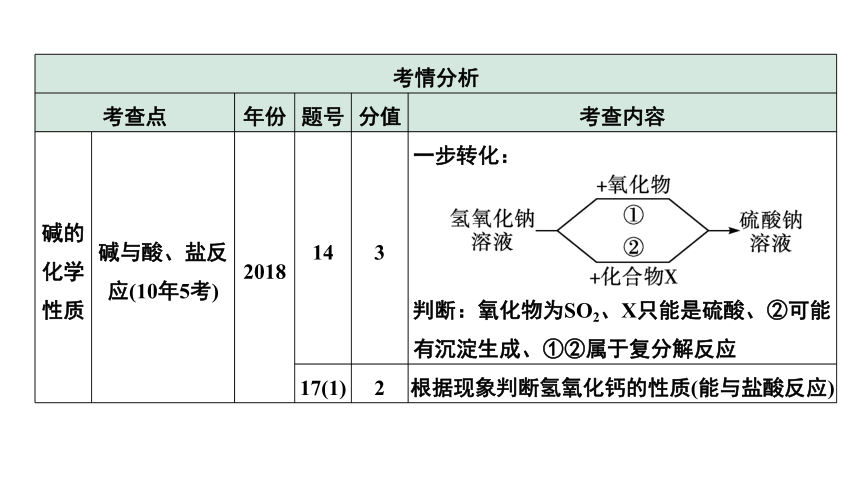
碱的化学性质 碱与酸、盐反应(10年5考) 2018 14 3 一步转化:
判断:氧化物为SO2、X只能是硫酸、②可能有沉淀生成、①②属于复分解反应
17(1) 2 根据现象判断氢氧化钙的性质(能与盐酸反应)
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与酸、盐反应 (10年5考) 2017 12 3 能鉴别氢氧化钠、氢氧化钙溶液的物质(K2CO3)
2015 14AB 1.5 硫酸铜与氢氧化钠反应的现象判断、硫酸铜与氯化钡反应的化学方程式书写
2014 18(2) 1 石灰浆的作用(除去烟气中含有的SO2、HCl)
19 13 石灰石与稀盐酸反应生成二氧化碳的质量和体积的测定
考情分析
【考情总结】
1.考查物质:硫酸、盐酸、氢氧化钠、氢氧化钙。
2.考查内容及特点:
(1)①酸的物理性质:均考查浓硫酸的吸水性。
②酸的化学性质:酸分别与碱(NaOH)、盐(CaCO3)、金属单质(Fe、Al、Zn)、金属氧化物(Fe2O3)反应;浓硫酸的腐蚀性。
③其他:盐酸中阳离子符号的书写、浓硫酸稀释操作的正误判断。
(2)①碱的物理性质:考查氢氧化钙的溶解性。
②碱的化学性质:碱分别与非金属氧化物(SO2、CO2)、酸(H2SO4、HCl)、盐(CaCO3、K2CO3)反应。
溶液的酸碱性和pH(10年8考)
1. (2022成都8题3分)部分水果及饮料的pH如下:
下列说法正确的是( )
A. 西瓜汁显碱性 B. 橘子汁中滴入酚酞,溶液变红
C. 苏打水显酸性 D. 胃酸过多的人应该少饮柠檬水
成都10年真题子母题+2年诊断检测
命题点
1
D
2. (成都真题组合)根据图文回答下列问题。
(1)汽水的pH是2.2~4.9,呈____(填“酸”“碱”或“中”)性。[2017成都15(1)④题1分]
(2)如图在自制汽水的配料中,柠檬酸溶液的pH____7(填“<”“=”或“>”),能使紫色石蕊溶液变____色。[2014成都15(2)①题2分]
红
酸
<
常见酸和碱的性质(10年10考)
3. (2020成都13题3分)饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A. 氢氧化铝 B. 氯化钠 C. 碳酸镁 D. 碳酸氢钠
4. (2017成都12题3分)能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是
( )
A. HCl B. KNO3 C. K2CO3 D. FeCl3
命题点
2
B
C
5. [2017成都15(2)④题1分]纸袋内的生石灰的作用是__________。
6. [2017成都16(1)题2分]盐酸溶液中阳离子符号是_____,氢氧化钠的俗称是_____________________(写一种)。
烧碱(或苛性钠或火碱)
作干燥剂
H+
7. (2016成都12C改编0.75分)判断下列说法是否正确(正确的在括号内打“√”,错误的打“ ”)
用木条蘸少量浓硫酸,可验证浓硫酸有腐蚀性( )
8. (2019成都16题节选4分)氢氧化钠、氢氧化钙是两种常见的碱。
(1)它们有一些相似的化学性质,其原因是溶液中都含有_______。
(2)可作某些气体干燥剂的是___________。
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为________________________________。
×
√
Ca(OH)2+CO2===CaCO3↓+H2O
OH-
NaOH固体
2年诊断检测
9. (2022锦江区二诊)某同学以氢氧化钙为主题,绘制了“多彩碱世界”的思维导图(如图)。下列说法正确的是( )
A. 实现①,是选用氢氧化钙溶液与石蕊溶液作用
B. 实现③,若选用FeCl3溶液,反应的化学方程式为:
2FeCl3+3Ca(OH)2===2Fe(OH)3+3CaCl2
C. 实现④,可选用CuO、CuCl2溶液、
CuSO4溶液与氢氧化钙溶液发生反应
D. 实现⑤,可选用CO2、Na2CO3溶液、
MgCl2溶液与氢氧化钙溶液发生反应
【答案】D
中和反应及其应用(10年6考)
10. (2022成都13题3分)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
命题点
3
图1
图2
A. 烧杯中只能盛放稀氢氧化钠溶液
B. 图2不能证明反应是放热反应
C. 60 s时溶液中溶质只有氯化钠
D. 实验证明氢氧化钠与盐酸能反应
图1
图2
【答案】D
10. 1 变图像——时间—pH曲线
利用图1装置重新进行实验,并将温度传感器换为pH传感器监测溶液pH的变化情况,测得数据如图3。下列分析正确的是( )
A. 向b点时的溶液中加入酚酞溶液一定呈红色
图3
图1
B. c点时的溶液能与纯碱发生反应
C. a→b过程中溶液的碱性逐渐增强
D. a→c过程中生成的氯化钠不断增加
图3
【答案】B
图1
11. (2023成都12C改编0.75分)判断下列说法是否正确(正确的在括号内打“√”,错误的打“ ”)
为证明稀硫酸与氢氧化钠溶液反应,可采用取样,滴加稀硫酸至pH基本不变的方法( )
×
√
12. (2015成都17题8分)用氢氧化钠溶液、稀盐酸和酚酞溶液,按如图步骤进行实验。
回答下列问题:
(1)无色溶液A是______________________,仪器C的名称是________。
(2)实验中滴入酚酞溶液的目的是__________________________________
___________________________。
(3)实验中反应的化学方程式是__________________________。
通过酚酞溶液的颜色变化判断稀盐酸和氢氧化钠溶液是否发生反应
NaOH+HCl===NaCl+H2O
氢氧化钠(或NaOH)溶液
酒精灯
(4)步骤⑤的操作名称是__________,当出现较多固体时应____________
___________________。
(5)实验步骤②和③两次使用了滴管,用完后需要洗涤的是____(填“②”或“③”)。
停止加热,用余热蒸干剩余液体
③
蒸发结晶
13. (2017成都16题节选7分)(1)向稀氢氧化钠溶液中滴入酚酞溶液。当滴入稀盐酸至完全中和时,溶液的颜色变化是____________________。
(2)根据化学方程式计算,含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为多少?
溶液由红色变为无色
(2)解:设含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为x
NaOH+HCl===NaCl+H2O
40 36.5
x 7.3 g x=8 g
答:含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为8 g。
2年诊断检测
14. (2022锦江区二诊改编)用温度传感器测定相同浓度盐酸、相同浓度氢氧化钠溶液在实验过程中的温度变化情况,得到如图所示的三条曲线。下列说法错误的是( )
Ⅰ
Ⅱ
Ⅲ
实验Ⅰ:50 mL稀盐酸与50 mL氢氧化钠溶液混合(曲线a)
实验Ⅱ:50 mL稀盐酸与50 mL蒸馏水混合(曲线b)
实验Ⅲ:50 mL氢氧化钠溶液与50 mL蒸馏水混合(曲线c)
A. 分析实验Ⅱ、Ⅲ曲线,说明酸、碱溶液稀释都是放热反应
Ⅰ
Ⅱ
Ⅲ
B. 增加实验Ⅱ、Ⅲ的目的是与实验Ⅰ进行对比,排除干扰
C. 28 s时,向实验Ⅰ的混合溶液中加入酚酞溶液,溶液呈无色
D. 实验Ⅰ的化学方程式为:HCl+NaOH===NaCl+H2O,属于中和反应
Ⅰ
Ⅱ
Ⅲ
【答案】A
化学性质
碱
与指示剂作用
氢氧化钠
氢氧化钙
与酸反应
与某些非金属氧化物反应
与某些盐反应
酸和碱
(浓)盐酸
(浓)硫酸
酸
化学性质
与指示剂作用
与活泼金属反应
与某些金属氧化物反应
与某些盐反应
与碱反应
思维导图
碱
酸
溶液的酸碱性和pH
酸和碱的中和反应
pH
pH与溶液酸碱性的关系
应用
考点特训营
一、溶液的酸碱性和pH
酸碱
指示剂
紫色石蕊溶液:遇酸性溶液变___色,遇碱性溶液变___色,遇中性溶液为
紫色
无色酚酞溶液:遇酸性溶液为_____色,遇碱性溶液变___色,遇中性溶液
为无色
红
蓝
不变
红
测定溶液的pH(详见第一单元)
pH与溶液酸碱性的关系
一、溶液的酸碱性和pH
___性增强 ___性 ___性增强
酸
中
碱
应用
了解土壤的酸碱性,提供土壤改良的依据
测定雨水的pH(pH<____的雨水称为酸雨),判断空气的污染情况
测定人体内或排出的液体的pH,了解人体健康状况等
5.6
二、酸
定义:在水溶液中解离时产生的阳离子全部是_____________的化合物,即酸→H+
+酸根离子
H+(或氢离子)
常见
的酸
物质 浓盐酸 浓硫酸
化学式 ______ _______
色、态、味 无色、有_______的液体 无色、无味、粘稠的油状液体
特性 易_____,打开瓶盖产生_____ 不易挥发;_____性,可干燥O2、CO2、H2等;腐蚀性(脱水性);溶解时放热
HCl
H2SO4
刺激性
挥发
白雾
吸水
二、酸
常见
的酸
浓硫酸的稀释(详见第一单元)
其他常见的酸:醋酸(CH3COOH)也叫乙酸;硝酸(HNO3)
化学性
质(“酸
五条”)
与指示剂作用:能使紫色石蕊溶液变___色;不能使无色酚酞溶液变色
红
与金属反应
通式:酸+活泼金属→盐+氢气
举例:Fe+H2SO4===____________(补全化学方程式,下同)
FeSO4+H2↑
与金属氧
化物反应
举例
二、酸
化学性
质(“酸
五条”)
通式:酸+金属氧化物→盐+水
6HCl+Fe2O3===______________,(用途:_______)
H2SO4+CuO===_____________,
现象:_________________________________
2FeCl3+3H2O
除铁锈
CuSO4+H2O
固体逐渐溶解,溶液由无色变为蓝色
与碱反应
通式:酸+碱→盐+水
举例:HCl+NaOH===___________;
Cu(OH)2+H2SO4===______________
NaCl+H2O
CuSO4+2H2O
二、酸
化学性
质(“酸
五条”)
与盐
反应
举例
通式:酸+某些盐→新酸+新盐
2HCl+CaCO3===__________________,
现象:_________________________
H2SO4+Na2CO3===____________________
检验 :H2SO4+BaCl2===______________
检验Cl-:HCl+AgNO3===______________
CaCl2+H2O+CO2↑
固体逐渐溶解,有气泡产生
Na2SO4+H2O+CO2↑
AgCl↓+HNO3
BaSO4↓+2HCl
现象:
__________________
有白色沉
淀产生
总结:不同酸具有通性的原因________________________________;不同
酸具有个性的原因:___________________________
在水溶液中解离出的阳离子都是H+
不同酸溶液中的酸根离子不同
二、酸
用途
盐酸:用于金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化
硫酸:用于生产化肥、农药和金属表面除锈等;浓硫酸具有吸水性,实验室
常用做干燥剂
醋酸:可用作调味品;也可除去水壶中的水垢
三、碱
常见
的碱
定义:在水溶液中解离时产生的阴离子全部是___________________的化合物,即碱
→金属离子(或铵根离子)+OH-
物质 氢氧化钠 氢氧化钙
化学式 _______ _________
俗名 _____、_____、_______ _______、_______
物理性质 白色固体,___溶于水,溶解时___热 白色粉末状固体,___溶于水
腐蚀性 有较强的腐蚀性,易吸收水分而潮解 有腐蚀性
OH-(或氢氧根离子)
NaOH
Ca(OH)2
火碱
烧碱
苛性钠
熟石灰
消石灰
易
放
微
三、碱
常见
的碱
物质 氢氧化钠 氢氧化钙
用途 用于生产肥皂、造纸、纺织等工业;生活中用于除油污;作气体干燥剂等 作建筑材料;_____________;配制农药波尔多液;石灰浆用于吸收_________等
改良酸性土壤
酸性气体
【特别提醒】氧化钙:俗称_______,白色固体,能与水反应生成氢氧化钙,
该反应的化学方程式为______________________,反应过程中____(填
“吸收”或“放出”)热量,因此氧化钙可作干燥剂
其他常见的碱:KOH、Ba(OH)2、NH3·H2O(氨水)、Cu(OH)2等
生石灰
CaO+H2O===Ca(OH)2
放出
与非金属氧化物反应
举例
三、碱
化学性质
(“碱四条”)
与指示剂作用:能使紫色石蕊溶液变___色;无色酚酞溶液变___色
蓝
红
通式:碱+非金属氧化物→盐+水
______________________________(实验室检验CO2),
现象:_________________
2NaOH+CO2===______________(实验室吸收CO2)
Ca(OH)2+CO2===CaCO3↓+H2O
澄清石灰水变浑浊
Na2CO3+H2O
探究二氧化碳与氢氧化钠溶液的反应(详见微专题10)
与酸反应
举例
三、碱
化学性质
(“碱四条”)
通式:碱+酸→盐+水
2NaOH+H2SO4===______________
Cu(OH)2+2HCl===_____________,
现象:_________________________________
Na2SO4+2H2O
CuCl2+2H2O
固体逐渐溶解,溶液由无色变为蓝色
三、碱
与盐反应
举例
化学性质
(“碱四条”)
通式:可溶(或微溶)性碱+可溶性盐→新碱+新盐
Ca(OH)2+Na2CO3===_________________,
现象:_______________
Ca(OH)2+CuSO4===_________________(配制农药波尔
多液),现象:_______________
CaCO3↓+2NaOH
有白色沉淀生成
Cu(OH)2↓+CaSO4
有蓝色沉淀生成
总结:不同碱具有通性的原因__________________________________;
不同碱具有个性的原因是_________________________
在水溶液中解离出的阴离子都是OH-
不同碱溶液中的阳离子不同
四、酸和碱的中和反应
定义:_______作用生成_______的反应
表达式:酸+碱→盐+水
酸碱中和反应(详见纵横过实验)
酸和碱
盐和水
应用
农业:改良土壤的酸碱性,如用熟石灰改良酸性土壤
工业:处理工业废水,如用熟石灰处理酸性废水
医疗:如用含氢氧化镁[Mg(OH)2]、氢氧化铝[Al(OH)3]的药物治疗胃酸过多症
日常生活:如蚊虫叮咬后涂抹肥皂水、牙膏等
微点诊断
下列说法正确的是________。
①能使无色酚酞溶液变红的溶液一定是碱溶液
②将某固体加入稀盐酸中观察到有气泡产生,则该固体一定为活泼金属
③碱能与非金属氧化物反应,因此氢氧化钠可以吸收一氧化碳气体
④氢氧化钙、氢氧化钠均能用来改良酸性土壤
⑤氢氧化钠固体易吸水潮解,可用于干燥二氧化碳
⑥碱中一定含有氢、氧和金属元素
⑦pH<7的溶液一定是酸性溶液
⑧pH>7的溶液一定是碱的溶液
⑨碱性溶液中加水稀释会导致pH增大
⑩生成盐和水的反应一定是中和反应
【答案】⑦
构建物质网络
一、常见酸(HCl、H2SO4)的化学性质(“酸五条”)
1. 请写出下列物质的化学式(填一种即可)
甲:___________
乙:___________
丙:___________
2. 写出化学方程式
①___________________________
_____________________________
Zn+2HCl===ZnCl2+H2↑
Zn+H2SO4===ZnSO4+H2↑
AgNO3
Fe2O3
NaOH
②__________________________________
____________________________________
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
③__________________________________
____________________________________
NaOH+HCl===NaCl+H2O
2NaOH+H2SO4===Na2SO4+2H2O
④________________________________________
__________________________________________
Na2CO3+2HCl===2NaCl+H2O+CO2↑
Na2CO3+H2SO4===Na2SO4+H2O+CO2 ↑
⑤_________________________________
⑥_________________________________
H2SO4+BaCl2===BaSO4↓+2HCl
AgNO3+HCl===AgCl↓+HNO3
二、常见碱[NaOH、Ca(OH)2]的化学性质(“碱四条”)
1. 请写出下列物质的化学式(填一种即可)
甲:_________ 乙:___________
Na2CO3
CO2
2. 写出化学方程式
①__________________________________
____________________________________
CO2+2NaOH===Na2CO3+H2O
CO2+Ca(OH)2===CaCO3↓+H2O
②____________________________________________________________
____________________________________________________________________________________________________________________________
HCl+NaOH===NaCl+H2O(或H2SO4+2NaOH===Na2SO4+2H2O)
2HCl+Ca(OH)2===CaCl2+2H2O
[或H2SO4+Ca(OH)2===CaSO4+2H2O]
③_______________________________________
_________________________________________
④_______________________________________
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
Ca(OH)2+CuSO4===Cu(OH)2↓+CaSO4
纵横过实验 · 纵向实验逐个过
小实验满分练
酸、碱的化学性质[2018.17(1)(2)(3)]
1. 常见酸的性质
(1)观察到有气泡产生的孔穴是______(填数字)。
实验
1
人教下P54图10-7改编
1、6
(2)孔穴2中发生反应的化学方程式为
__________________________________。
(3)孔穴3中溶液变红,则甲溶液是_____________。
(4)孔穴4可观察到的现象是________________。
人教下P54图10-7改编
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
有白色沉淀产生
紫色石蕊溶液
(5)孔穴5无明显现象,若要证明孔穴5中发生了化学反应,请你设计一个实验验证______________________________________________________
_____________________________________________________。
先向孔穴5中滴加适量的酚酞溶液,再向其中滴加稀硫酸,若观察到溶液由红色变为无色,说明孔穴5中发生了化学反应
人教下P54图10-7改编
2. 常见碱的化学性质
(1)图1观察到溶液变为蓝色,得出的结论是____________________。
(2)图2观察到的现象是____________________。
人教下P56探究改编
溶液由红色变为无色
氢氧化钠溶液显碱性
(3)图3观察到的现象是___________________________________,可得出氢氧化钙能与_____________(填“金属氧化物”或“非金属氧化物”)反应。
(4)图4中发生反应的化学方程式为
____________________________________。
人教下P56探究改编
2NaOH+CuCl2===Cu(OH)2↓+2NaCl
澄清石灰水变浑浊(或有白色沉淀生成)
非金属氧化物
通过酸碱化学性质的实验,构建出探究物质性质的方法如下:
(5)[迁移应用]醋酸属于____(填“酸”“碱”或“盐”),能和_______________
________________(填物质类别)发生化学反应,请选择一种具体物质设计实验,验证与其对应的化学性质________________________________
_________________________________________(写实验操作及现象)。
金属单质、金属氧化物、盐、碱
2022课标·实验探究思路与方法
将醋酸滴入盛有碳酸钠溶液的试管中,有气泡产生,证明其能与盐发生化学反应
酸
酸碱中和反应(10年5考)
重难实验突破
实验
2
【实验现象和结论】
(1)向稀氢氧化钠溶液中加入无色酚酞溶液时,观察到________________
_____。
(2)向含有酚酞的稀氢氧化钠溶液中滴加
稀盐酸,当观察到___________________,说明氢氧化钠与稀
盐酸发生了反应。
图1
溶液由红色变为无色
溶液由无色变为红色
如图1所示是实验课上甲组进行酸碱中和反应的实验操作图。请回答下列问题:
图1
【反应原理】
(3)写出上述实验中发生反应的化学方程式____________________________。
HCl+NaOH===NaCl +H2O
【微观实质】
(4)结合图2可知,中和反应的微观实质是酸中的_____(填化学符号,后同)与碱中的______结合生成______。
图2
H2O
H+
OH-
新考法
(5) [意外现象分析]乙组在进行实验时发现了一些异常现象,请你一起参与分析:
①小刚在做该实验前忘记加入酚酞溶液,实验过程中再加酚酞溶液,发现溶液未变色,能否证明二者恰好完全反应,并说明理由____________
_______________________________________。
②小红实验时将稀盐酸滴入氢氧化钠溶液中,观察到有气泡冒出,可能的原因是___________________。
氢氧化钠已经变质
不能,酚酞在酸性溶液中也不变色,此时可能盐酸过量
③小王将烧杯改为试管,边滴加稀盐酸边振荡试管,待溶液变色符合恰好反应的状态时,测得溶液pH<7,造成该结果的原因可能是_________
______________________________________________________。
将盐酸滴加到试管内壁,使部分酸未及时参与反应,导致最终酸过量
(6)[2022课标·数字化实验](2022扬州改编)丙组同学借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图3,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。
图3
①小明同学用pH传感器测得三颈烧瓶内溶液pH的变化如图4,判断溶液X是________,实验进行到60 s时溶液中的溶质为______________(填化学式)。
稀盐酸
NaCl、NaOH
图4
图3
②小花同学用温度传感器测得三颈烧瓶内温度变化如图5(实验过程中热量散失忽略不计),据此可得出反应过程中______(填“吸收”或“释放”)能量的结论。
③小朱同学提出,通过监测三颈烧瓶内压强变化,也可以推导出小花同学的实验结论,其理由是_______________________________________
_____________________________________。
释放
图5
实验中无气体生成,瓶内温度变化导致了压强变化,由此可确定反应中的能量变化
图3
拓展探究
(7)[跨物理学科]已知:同电压下,等体积溶液中(两体积溶液混合后,体积约为两体积之和),所含离子数目越多,电流(Ⅰ)就越大;利用溶液导电性探究稀盐酸与氢氧化钠溶液的反应,涉及试剂及电流强度相关数据如下表:
试剂 蒸馏水 稀盐酸 NaOH溶液 NaCl溶液
电流强度/mA 约为0 0.09 0.09 0.09
请选择表中的试剂,设计方案验证稀盐酸和氢氧化钠发生了反应______
______________________________________________________________________________________________________________________________________________________________________________________________________________________。
各取10 mL相同浓度的NaOH溶液于两个小烧杯中,分别加入10 mL NaCl溶液和10 mL稀盐酸(加入前需确保两溶液的电流强度一致),等待一段时间,测两种混合溶液的导电性,电流示数依次为I1和I2,若I1>I2,可证明氢氧化钠和盐酸发生了反应
试剂 蒸馏水 稀盐酸 NaOH溶液 NaCl溶液
电流强度/mA 约为0 0.09 0.09 0.09
解题有策略
第(7)题
实验方案的设计[2023.16(3)]
成都考法:根据已给结论,设计实验验证金属活动性。
解题对策如下:
第1步:明确实验目的→ 验证稀盐酸和氢氧化钠发生反应。
解题有策略
第2步:选择合理的化学药品→ 两份10 mL NaOH溶液、10 mL NaCl溶液、 10 mL稀盐酸。
第3步:设计实验方案→将10 mL NaCl溶液、 10 mL稀盐酸分别加入
10 mL NaOH溶液,测其混合后的导电性。
第4步:记录现象和数据。
第5步:分析得到结论。
试剂 蒸馏水 稀盐酸 NaOH溶液 NaCl溶液
电流强度/mA 约为0 0.09 0.09 0.09
命题趋势·新考法分析 五育 2023重庆A卷13题(劳育)、连云港36题(体育)
请完成精练本习题
第十单元 酸和碱
考点特训营
2
纵横过实验 · 纵向实验逐个过
3
1
成都10年真题子母题+2年诊断检测
命题点2 常见酸和碱的性质(10年10考)
课标要求
2022课标 2011课标
◎以盐酸、硫酸、氢氧化钠和氢氧化钙为例,通过实验探究认识酸、碱的主要性质和用途。 ◎认识常见酸碱的主要性质和用途,知道酸碱的腐蚀性。
◎初步学会常见酸碱溶液的稀释方法。
◎学生必做实验及实践活动:常见酸、碱的化学性质。 ◎完成基础的学生实验:酸、碱的化学性质。
【内容要求】
2022课标 2011课标
◎跨学科实践活动:探究土壤酸碱性对植物生长的影响。(新增)
【学业要求】
◎能通过实验说明酸和碱的主要性质,并能用化学方程式表示。
◎能举例说明物质性质的广泛应用及性质与用途的关系;能利用常见物质的性质,分析、解释一些简单的化学现象和事实。
◎能说明必做实验的基本思路与方法,分析实验实施的合理性,能体现严谨求实、敢于质疑的科学态度。
◎能基于必做实验形成的探究思路与方法,结合物质的组成及变化等相关知识,分析解决真实情境中的简单实验问题。
◎能运用研究物质性质的一般思路与方法,从物质类别的视角, 依据中和反应等,初步预测酸和碱的主要性质,设计实验方案,分析、解释有关的实验现象,进行证据推理,得出合理的结论。
◎能基于真实问题情境,依据常见物质的性质,初步分析和解决相关的综合问题。
考情分析
考情分析 考查点 年份 题号 分值 考查内容
常见的酸(10年2考) 2017 16(1)第一空 1 盐酸中的阳离子符号书写
2016 10C 0.75 稀释浓硫酸操作的正误判断(酸入水)
酸的物理性质 (10年2考) 2022 19(5) 1 浓硫酸的吸水性(装置B的作用)
2020 19(5) 1 浓硫酸的吸水性(未知试剂的判断)
酸的化学性质 酸与碱、盐反应(10年3考) 2023 12C 0.75 证明稀硫酸与氢氧化钠溶液反应的实验方法(测pH)
2020 19(4)第一空 1 稀硫酸与碳酸钙反应的现象
考情分析 考查点 年份 题号 分值 考查内容
酸的化学性质 酸与碱、盐反应(10年3考) 2018 19(1)(2) 3 鸡蛋与盐酸反应时,冒出气泡的原因(化学方程式书写)、下沉的原因
酸与金属单质、金属氧化物反应(10年5考) 2023 17(2) 第一空 1 稀盐酸与铁片、铝片反应比较两者的金属活动性
2021 12B 0.75 一步转化(判断):
Zn ZnSO4 ZnCl2
2019 18(2)② 2 铁与稀硫酸反应的化学方程式书写
2017 18(5) 2 硫酸除铁锈的化学方程式书写
稀H2SO4
BaCl2溶液
考情分析 考查点 年份 题号 分值 考查内容
酸的化学性质 酸与金属单质、金属氧化物反应(10年5考) 2015 18(4) 2 制取硫酸铝的化学方程式书写
其他(10年2考) 2018 12D 0.75 测pH鉴别稀盐酸与稀硫酸
2016 12C 0.75 用木条检验浓硫酸的腐蚀性
常见的碱(10年3考) 2021 6B 0.75 生石灰加热食品
2017 15(2)④ 1 生石灰的作用
16(1)第二空 1 氢氧化钠的俗称
2015 18(2)第一空 1 氢氧化铝的化学式书写
考情分析 考查点 年份 题号 分值 考查内容
碱的物理性质 2018 17(1) 2 根据现象判断氢氧化钙的性质(微溶于水)
碱的化学性质 碱与非金属氧化物反应(10年5考) 2021 18(1)②③ 2 用石灰浆不用石灰水吸收CO2的原因;SO2和CO2混合气体中加入石灰浆后生成固体的成分
2019 16(1)~(3) 4 碱具有相似化学性质的原因;可做某些干燥剂的碱(NaOH固体);氢氧化钙溶液检验二氧化碳的化学方程式书写
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与非金属氧化物反应(10年5考) 2018 17(3) 第二空 2 二氧化碳通入澄清石灰水中发生反应的化学方程式书写
2017 19(2) 第二空 2 氢氧化钠与二氧化碳反应的化学方程式书写
2016 19 13 二氧化碳与氢氧化钠溶液是否反应的探究
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与酸、盐反应 (10年5考) 2023 12C 0.75 证明稀硫酸与氢氧化钠溶液反应的实验方法(测pH)
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与酸、盐反应(10年5考) 2018 14 3 一步转化:
判断:氧化物为SO2、X只能是硫酸、②可能有沉淀生成、①②属于复分解反应
17(1) 2 根据现象判断氢氧化钙的性质(能与盐酸反应)
考情分析 考查点 年份 题号 分值 考查内容
碱的化学性质 碱与酸、盐反应 (10年5考) 2017 12 3 能鉴别氢氧化钠、氢氧化钙溶液的物质(K2CO3)
2015 14AB 1.5 硫酸铜与氢氧化钠反应的现象判断、硫酸铜与氯化钡反应的化学方程式书写
2014 18(2) 1 石灰浆的作用(除去烟气中含有的SO2、HCl)
19 13 石灰石与稀盐酸反应生成二氧化碳的质量和体积的测定
考情分析
【考情总结】
1.考查物质:硫酸、盐酸、氢氧化钠、氢氧化钙。
2.考查内容及特点:
(1)①酸的物理性质:均考查浓硫酸的吸水性。
②酸的化学性质:酸分别与碱(NaOH)、盐(CaCO3)、金属单质(Fe、Al、Zn)、金属氧化物(Fe2O3)反应;浓硫酸的腐蚀性。
③其他:盐酸中阳离子符号的书写、浓硫酸稀释操作的正误判断。
(2)①碱的物理性质:考查氢氧化钙的溶解性。
②碱的化学性质:碱分别与非金属氧化物(SO2、CO2)、酸(H2SO4、HCl)、盐(CaCO3、K2CO3)反应。
溶液的酸碱性和pH(10年8考)
1. (2022成都8题3分)部分水果及饮料的pH如下:
下列说法正确的是( )
A. 西瓜汁显碱性 B. 橘子汁中滴入酚酞,溶液变红
C. 苏打水显酸性 D. 胃酸过多的人应该少饮柠檬水
成都10年真题子母题+2年诊断检测
命题点
1
D
2. (成都真题组合)根据图文回答下列问题。
(1)汽水的pH是2.2~4.9,呈____(填“酸”“碱”或“中”)性。[2017成都15(1)④题1分]
(2)如图在自制汽水的配料中,柠檬酸溶液的pH____7(填“<”“=”或“>”),能使紫色石蕊溶液变____色。[2014成都15(2)①题2分]
红
酸
<
常见酸和碱的性质(10年10考)
3. (2020成都13题3分)饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A. 氢氧化铝 B. 氯化钠 C. 碳酸镁 D. 碳酸氢钠
4. (2017成都12题3分)能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是
( )
A. HCl B. KNO3 C. K2CO3 D. FeCl3
命题点
2
B
C
5. [2017成都15(2)④题1分]纸袋内的生石灰的作用是__________。
6. [2017成都16(1)题2分]盐酸溶液中阳离子符号是_____,氢氧化钠的俗称是_____________________(写一种)。
烧碱(或苛性钠或火碱)
作干燥剂
H+
7. (2016成都12C改编0.75分)判断下列说法是否正确(正确的在括号内打“√”,错误的打“ ”)
用木条蘸少量浓硫酸,可验证浓硫酸有腐蚀性( )
8. (2019成都16题节选4分)氢氧化钠、氢氧化钙是两种常见的碱。
(1)它们有一些相似的化学性质,其原因是溶液中都含有_______。
(2)可作某些气体干燥剂的是___________。
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为________________________________。
×
√
Ca(OH)2+CO2===CaCO3↓+H2O
OH-
NaOH固体
2年诊断检测
9. (2022锦江区二诊)某同学以氢氧化钙为主题,绘制了“多彩碱世界”的思维导图(如图)。下列说法正确的是( )
A. 实现①,是选用氢氧化钙溶液与石蕊溶液作用
B. 实现③,若选用FeCl3溶液,反应的化学方程式为:
2FeCl3+3Ca(OH)2===2Fe(OH)3+3CaCl2
C. 实现④,可选用CuO、CuCl2溶液、
CuSO4溶液与氢氧化钙溶液发生反应
D. 实现⑤,可选用CO2、Na2CO3溶液、
MgCl2溶液与氢氧化钙溶液发生反应
【答案】D
中和反应及其应用(10年6考)
10. (2022成都13题3分)实验小组用图1装置探究稀氢氧化钠溶液与稀盐酸能否反应,测得数据如图2。下列说法正确的是( )
命题点
3
图1
图2
A. 烧杯中只能盛放稀氢氧化钠溶液
B. 图2不能证明反应是放热反应
C. 60 s时溶液中溶质只有氯化钠
D. 实验证明氢氧化钠与盐酸能反应
图1
图2
【答案】D
10. 1 变图像——时间—pH曲线
利用图1装置重新进行实验,并将温度传感器换为pH传感器监测溶液pH的变化情况,测得数据如图3。下列分析正确的是( )
A. 向b点时的溶液中加入酚酞溶液一定呈红色
图3
图1
B. c点时的溶液能与纯碱发生反应
C. a→b过程中溶液的碱性逐渐增强
D. a→c过程中生成的氯化钠不断增加
图3
【答案】B
图1
11. (2023成都12C改编0.75分)判断下列说法是否正确(正确的在括号内打“√”,错误的打“ ”)
为证明稀硫酸与氢氧化钠溶液反应,可采用取样,滴加稀硫酸至pH基本不变的方法( )
×
√
12. (2015成都17题8分)用氢氧化钠溶液、稀盐酸和酚酞溶液,按如图步骤进行实验。
回答下列问题:
(1)无色溶液A是______________________,仪器C的名称是________。
(2)实验中滴入酚酞溶液的目的是__________________________________
___________________________。
(3)实验中反应的化学方程式是__________________________。
通过酚酞溶液的颜色变化判断稀盐酸和氢氧化钠溶液是否发生反应
NaOH+HCl===NaCl+H2O
氢氧化钠(或NaOH)溶液
酒精灯
(4)步骤⑤的操作名称是__________,当出现较多固体时应____________
___________________。
(5)实验步骤②和③两次使用了滴管,用完后需要洗涤的是____(填“②”或“③”)。
停止加热,用余热蒸干剩余液体
③
蒸发结晶
13. (2017成都16题节选7分)(1)向稀氢氧化钠溶液中滴入酚酞溶液。当滴入稀盐酸至完全中和时,溶液的颜色变化是____________________。
(2)根据化学方程式计算,含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为多少?
溶液由红色变为无色
(2)解:设含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为x
NaOH+HCl===NaCl+H2O
40 36.5
x 7.3 g x=8 g
答:含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为8 g。
2年诊断检测
14. (2022锦江区二诊改编)用温度传感器测定相同浓度盐酸、相同浓度氢氧化钠溶液在实验过程中的温度变化情况,得到如图所示的三条曲线。下列说法错误的是( )
Ⅰ
Ⅱ
Ⅲ
实验Ⅰ:50 mL稀盐酸与50 mL氢氧化钠溶液混合(曲线a)
实验Ⅱ:50 mL稀盐酸与50 mL蒸馏水混合(曲线b)
实验Ⅲ:50 mL氢氧化钠溶液与50 mL蒸馏水混合(曲线c)
A. 分析实验Ⅱ、Ⅲ曲线,说明酸、碱溶液稀释都是放热反应
Ⅰ
Ⅱ
Ⅲ
B. 增加实验Ⅱ、Ⅲ的目的是与实验Ⅰ进行对比,排除干扰
C. 28 s时,向实验Ⅰ的混合溶液中加入酚酞溶液,溶液呈无色
D. 实验Ⅰ的化学方程式为:HCl+NaOH===NaCl+H2O,属于中和反应
Ⅰ
Ⅱ
Ⅲ
【答案】A
化学性质
碱
与指示剂作用
氢氧化钠
氢氧化钙
与酸反应
与某些非金属氧化物反应
与某些盐反应
酸和碱
(浓)盐酸
(浓)硫酸
酸
化学性质
与指示剂作用
与活泼金属反应
与某些金属氧化物反应
与某些盐反应
与碱反应
思维导图
碱
酸
溶液的酸碱性和pH
酸和碱的中和反应
pH
pH与溶液酸碱性的关系
应用
考点特训营
一、溶液的酸碱性和pH
酸碱
指示剂
紫色石蕊溶液:遇酸性溶液变___色,遇碱性溶液变___色,遇中性溶液为
紫色
无色酚酞溶液:遇酸性溶液为_____色,遇碱性溶液变___色,遇中性溶液
为无色
红
蓝
不变
红
测定溶液的pH(详见第一单元)
pH与溶液酸碱性的关系
一、溶液的酸碱性和pH
___性增强 ___性 ___性增强
酸
中
碱
应用
了解土壤的酸碱性,提供土壤改良的依据
测定雨水的pH(pH<____的雨水称为酸雨),判断空气的污染情况
测定人体内或排出的液体的pH,了解人体健康状况等
5.6
二、酸
定义:在水溶液中解离时产生的阳离子全部是_____________的化合物,即酸→H+
+酸根离子
H+(或氢离子)
常见
的酸
物质 浓盐酸 浓硫酸
化学式 ______ _______
色、态、味 无色、有_______的液体 无色、无味、粘稠的油状液体
特性 易_____,打开瓶盖产生_____ 不易挥发;_____性,可干燥O2、CO2、H2等;腐蚀性(脱水性);溶解时放热
HCl
H2SO4
刺激性
挥发
白雾
吸水
二、酸
常见
的酸
浓硫酸的稀释(详见第一单元)
其他常见的酸:醋酸(CH3COOH)也叫乙酸;硝酸(HNO3)
化学性
质(“酸
五条”)
与指示剂作用:能使紫色石蕊溶液变___色;不能使无色酚酞溶液变色
红
与金属反应
通式:酸+活泼金属→盐+氢气
举例:Fe+H2SO4===____________(补全化学方程式,下同)
FeSO4+H2↑
与金属氧
化物反应
举例
二、酸
化学性
质(“酸
五条”)
通式:酸+金属氧化物→盐+水
6HCl+Fe2O3===______________,(用途:_______)
H2SO4+CuO===_____________,
现象:_________________________________
2FeCl3+3H2O
除铁锈
CuSO4+H2O
固体逐渐溶解,溶液由无色变为蓝色
与碱反应
通式:酸+碱→盐+水
举例:HCl+NaOH===___________;
Cu(OH)2+H2SO4===______________
NaCl+H2O
CuSO4+2H2O
二、酸
化学性
质(“酸
五条”)
与盐
反应
举例
通式:酸+某些盐→新酸+新盐
2HCl+CaCO3===__________________,
现象:_________________________
H2SO4+Na2CO3===____________________
检验 :H2SO4+BaCl2===______________
检验Cl-:HCl+AgNO3===______________
CaCl2+H2O+CO2↑
固体逐渐溶解,有气泡产生
Na2SO4+H2O+CO2↑
AgCl↓+HNO3
BaSO4↓+2HCl
现象:
__________________
有白色沉
淀产生
总结:不同酸具有通性的原因________________________________;不同
酸具有个性的原因:___________________________
在水溶液中解离出的阳离子都是H+
不同酸溶液中的酸根离子不同
二、酸
用途
盐酸:用于金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化
硫酸:用于生产化肥、农药和金属表面除锈等;浓硫酸具有吸水性,实验室
常用做干燥剂
醋酸:可用作调味品;也可除去水壶中的水垢
三、碱
常见
的碱
定义:在水溶液中解离时产生的阴离子全部是___________________的化合物,即碱
→金属离子(或铵根离子)+OH-
物质 氢氧化钠 氢氧化钙
化学式 _______ _________
俗名 _____、_____、_______ _______、_______
物理性质 白色固体,___溶于水,溶解时___热 白色粉末状固体,___溶于水
腐蚀性 有较强的腐蚀性,易吸收水分而潮解 有腐蚀性
OH-(或氢氧根离子)
NaOH
Ca(OH)2
火碱
烧碱
苛性钠
熟石灰
消石灰
易
放
微
三、碱
常见
的碱
物质 氢氧化钠 氢氧化钙
用途 用于生产肥皂、造纸、纺织等工业;生活中用于除油污;作气体干燥剂等 作建筑材料;_____________;配制农药波尔多液;石灰浆用于吸收_________等
改良酸性土壤
酸性气体
【特别提醒】氧化钙:俗称_______,白色固体,能与水反应生成氢氧化钙,
该反应的化学方程式为______________________,反应过程中____(填
“吸收”或“放出”)热量,因此氧化钙可作干燥剂
其他常见的碱:KOH、Ba(OH)2、NH3·H2O(氨水)、Cu(OH)2等
生石灰
CaO+H2O===Ca(OH)2
放出
与非金属氧化物反应
举例
三、碱
化学性质
(“碱四条”)
与指示剂作用:能使紫色石蕊溶液变___色;无色酚酞溶液变___色
蓝
红
通式:碱+非金属氧化物→盐+水
______________________________(实验室检验CO2),
现象:_________________
2NaOH+CO2===______________(实验室吸收CO2)
Ca(OH)2+CO2===CaCO3↓+H2O
澄清石灰水变浑浊
Na2CO3+H2O
探究二氧化碳与氢氧化钠溶液的反应(详见微专题10)
与酸反应
举例
三、碱
化学性质
(“碱四条”)
通式:碱+酸→盐+水
2NaOH+H2SO4===______________
Cu(OH)2+2HCl===_____________,
现象:_________________________________
Na2SO4+2H2O
CuCl2+2H2O
固体逐渐溶解,溶液由无色变为蓝色
三、碱
与盐反应
举例
化学性质
(“碱四条”)
通式:可溶(或微溶)性碱+可溶性盐→新碱+新盐
Ca(OH)2+Na2CO3===_________________,
现象:_______________
Ca(OH)2+CuSO4===_________________(配制农药波尔
多液),现象:_______________
CaCO3↓+2NaOH
有白色沉淀生成
Cu(OH)2↓+CaSO4
有蓝色沉淀生成
总结:不同碱具有通性的原因__________________________________;
不同碱具有个性的原因是_________________________
在水溶液中解离出的阴离子都是OH-
不同碱溶液中的阳离子不同
四、酸和碱的中和反应
定义:_______作用生成_______的反应
表达式:酸+碱→盐+水
酸碱中和反应(详见纵横过实验)
酸和碱
盐和水
应用
农业:改良土壤的酸碱性,如用熟石灰改良酸性土壤
工业:处理工业废水,如用熟石灰处理酸性废水
医疗:如用含氢氧化镁[Mg(OH)2]、氢氧化铝[Al(OH)3]的药物治疗胃酸过多症
日常生活:如蚊虫叮咬后涂抹肥皂水、牙膏等
微点诊断
下列说法正确的是________。
①能使无色酚酞溶液变红的溶液一定是碱溶液
②将某固体加入稀盐酸中观察到有气泡产生,则该固体一定为活泼金属
③碱能与非金属氧化物反应,因此氢氧化钠可以吸收一氧化碳气体
④氢氧化钙、氢氧化钠均能用来改良酸性土壤
⑤氢氧化钠固体易吸水潮解,可用于干燥二氧化碳
⑥碱中一定含有氢、氧和金属元素
⑦pH<7的溶液一定是酸性溶液
⑧pH>7的溶液一定是碱的溶液
⑨碱性溶液中加水稀释会导致pH增大
⑩生成盐和水的反应一定是中和反应
【答案】⑦
构建物质网络
一、常见酸(HCl、H2SO4)的化学性质(“酸五条”)
1. 请写出下列物质的化学式(填一种即可)
甲:___________
乙:___________
丙:___________
2. 写出化学方程式
①___________________________
_____________________________
Zn+2HCl===ZnCl2+H2↑
Zn+H2SO4===ZnSO4+H2↑
AgNO3
Fe2O3
NaOH
②__________________________________
____________________________________
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
③__________________________________
____________________________________
NaOH+HCl===NaCl+H2O
2NaOH+H2SO4===Na2SO4+2H2O
④________________________________________
__________________________________________
Na2CO3+2HCl===2NaCl+H2O+CO2↑
Na2CO3+H2SO4===Na2SO4+H2O+CO2 ↑
⑤_________________________________
⑥_________________________________
H2SO4+BaCl2===BaSO4↓+2HCl
AgNO3+HCl===AgCl↓+HNO3
二、常见碱[NaOH、Ca(OH)2]的化学性质(“碱四条”)
1. 请写出下列物质的化学式(填一种即可)
甲:_________ 乙:___________
Na2CO3
CO2
2. 写出化学方程式
①__________________________________
____________________________________
CO2+2NaOH===Na2CO3+H2O
CO2+Ca(OH)2===CaCO3↓+H2O
②____________________________________________________________
____________________________________________________________________________________________________________________________
HCl+NaOH===NaCl+H2O(或H2SO4+2NaOH===Na2SO4+2H2O)
2HCl+Ca(OH)2===CaCl2+2H2O
[或H2SO4+Ca(OH)2===CaSO4+2H2O]
③_______________________________________
_________________________________________
④_______________________________________
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
Ca(OH)2+CuSO4===Cu(OH)2↓+CaSO4
纵横过实验 · 纵向实验逐个过
小实验满分练
酸、碱的化学性质[2018.17(1)(2)(3)]
1. 常见酸的性质
(1)观察到有气泡产生的孔穴是______(填数字)。
实验
1
人教下P54图10-7改编
1、6
(2)孔穴2中发生反应的化学方程式为
__________________________________。
(3)孔穴3中溶液变红,则甲溶液是_____________。
(4)孔穴4可观察到的现象是________________。
人教下P54图10-7改编
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
有白色沉淀产生
紫色石蕊溶液
(5)孔穴5无明显现象,若要证明孔穴5中发生了化学反应,请你设计一个实验验证______________________________________________________
_____________________________________________________。
先向孔穴5中滴加适量的酚酞溶液,再向其中滴加稀硫酸,若观察到溶液由红色变为无色,说明孔穴5中发生了化学反应
人教下P54图10-7改编
2. 常见碱的化学性质
(1)图1观察到溶液变为蓝色,得出的结论是____________________。
(2)图2观察到的现象是____________________。
人教下P56探究改编
溶液由红色变为无色
氢氧化钠溶液显碱性
(3)图3观察到的现象是___________________________________,可得出氢氧化钙能与_____________(填“金属氧化物”或“非金属氧化物”)反应。
(4)图4中发生反应的化学方程式为
____________________________________。
人教下P56探究改编
2NaOH+CuCl2===Cu(OH)2↓+2NaCl
澄清石灰水变浑浊(或有白色沉淀生成)
非金属氧化物
通过酸碱化学性质的实验,构建出探究物质性质的方法如下:
(5)[迁移应用]醋酸属于____(填“酸”“碱”或“盐”),能和_______________
________________(填物质类别)发生化学反应,请选择一种具体物质设计实验,验证与其对应的化学性质________________________________
_________________________________________(写实验操作及现象)。
金属单质、金属氧化物、盐、碱
2022课标·实验探究思路与方法
将醋酸滴入盛有碳酸钠溶液的试管中,有气泡产生,证明其能与盐发生化学反应
酸
酸碱中和反应(10年5考)
重难实验突破
实验
2
【实验现象和结论】
(1)向稀氢氧化钠溶液中加入无色酚酞溶液时,观察到________________
_____。
(2)向含有酚酞的稀氢氧化钠溶液中滴加
稀盐酸,当观察到___________________,说明氢氧化钠与稀
盐酸发生了反应。
图1
溶液由红色变为无色
溶液由无色变为红色
如图1所示是实验课上甲组进行酸碱中和反应的实验操作图。请回答下列问题:
图1
【反应原理】
(3)写出上述实验中发生反应的化学方程式____________________________。
HCl+NaOH===NaCl +H2O
【微观实质】
(4)结合图2可知,中和反应的微观实质是酸中的_____(填化学符号,后同)与碱中的______结合生成______。
图2
H2O
H+
OH-
新考法
(5) [意外现象分析]乙组在进行实验时发现了一些异常现象,请你一起参与分析:
①小刚在做该实验前忘记加入酚酞溶液,实验过程中再加酚酞溶液,发现溶液未变色,能否证明二者恰好完全反应,并说明理由____________
_______________________________________。
②小红实验时将稀盐酸滴入氢氧化钠溶液中,观察到有气泡冒出,可能的原因是___________________。
氢氧化钠已经变质
不能,酚酞在酸性溶液中也不变色,此时可能盐酸过量
③小王将烧杯改为试管,边滴加稀盐酸边振荡试管,待溶液变色符合恰好反应的状态时,测得溶液pH<7,造成该结果的原因可能是_________
______________________________________________________。
将盐酸滴加到试管内壁,使部分酸未及时参与反应,导致最终酸过量
(6)[2022课标·数字化实验](2022扬州改编)丙组同学借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图3,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。
图3
①小明同学用pH传感器测得三颈烧瓶内溶液pH的变化如图4,判断溶液X是________,实验进行到60 s时溶液中的溶质为______________(填化学式)。
稀盐酸
NaCl、NaOH
图4
图3
②小花同学用温度传感器测得三颈烧瓶内温度变化如图5(实验过程中热量散失忽略不计),据此可得出反应过程中______(填“吸收”或“释放”)能量的结论。
③小朱同学提出,通过监测三颈烧瓶内压强变化,也可以推导出小花同学的实验结论,其理由是_______________________________________
_____________________________________。
释放
图5
实验中无气体生成,瓶内温度变化导致了压强变化,由此可确定反应中的能量变化
图3
拓展探究
(7)[跨物理学科]已知:同电压下,等体积溶液中(两体积溶液混合后,体积约为两体积之和),所含离子数目越多,电流(Ⅰ)就越大;利用溶液导电性探究稀盐酸与氢氧化钠溶液的反应,涉及试剂及电流强度相关数据如下表:
试剂 蒸馏水 稀盐酸 NaOH溶液 NaCl溶液
电流强度/mA 约为0 0.09 0.09 0.09
请选择表中的试剂,设计方案验证稀盐酸和氢氧化钠发生了反应______
______________________________________________________________________________________________________________________________________________________________________________________________________________________。
各取10 mL相同浓度的NaOH溶液于两个小烧杯中,分别加入10 mL NaCl溶液和10 mL稀盐酸(加入前需确保两溶液的电流强度一致),等待一段时间,测两种混合溶液的导电性,电流示数依次为I1和I2,若I1>I2,可证明氢氧化钠和盐酸发生了反应
试剂 蒸馏水 稀盐酸 NaOH溶液 NaCl溶液
电流强度/mA 约为0 0.09 0.09 0.09
解题有策略
第(7)题
实验方案的设计[2023.16(3)]
成都考法:根据已给结论,设计实验验证金属活动性。
解题对策如下:
第1步:明确实验目的→ 验证稀盐酸和氢氧化钠发生反应。
解题有策略
第2步:选择合理的化学药品→ 两份10 mL NaOH溶液、10 mL NaCl溶液、 10 mL稀盐酸。
第3步:设计实验方案→将10 mL NaCl溶液、 10 mL稀盐酸分别加入
10 mL NaOH溶液,测其混合后的导电性。
第4步:记录现象和数据。
第5步:分析得到结论。
试剂 蒸馏水 稀盐酸 NaOH溶液 NaCl溶液
电流强度/mA 约为0 0.09 0.09 0.09
命题趋势·新考法分析 五育 2023重庆A卷13题(劳育)、连云港36题(体育)
请完成精练本习题
同课章节目录
