2024中考化学 第一部分 成都中考考点研究 微专题6 溶解度的应用 课件(共33张PPT)
文档属性
| 名称 | 2024中考化学 第一部分 成都中考考点研究 微专题6 溶解度的应用 课件(共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 684.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 21:39:11 | ||
图片预览







文档简介
(共33张PPT)
微专题6 溶解度的应用
跟踪训练
2
1
典例串方法
典例串方法
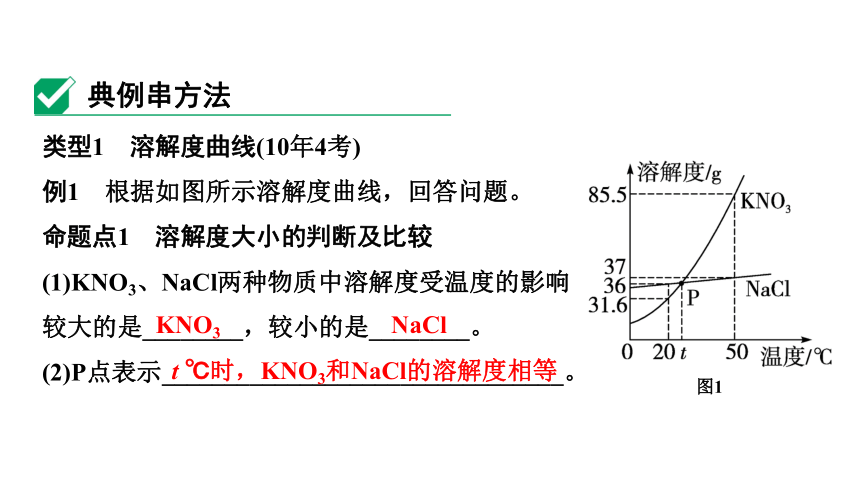
类型1 溶解度曲线(10年4考)
例1 根据如图所示溶解度曲线,回答问题。
命题点1 溶解度大小的判断及比较
(1)KNO3、NaCl两种物质中溶解度受温度的影响
较大的是________,较小的是________。
(2)P点表示________________________________。
KNO3
NaCl
t ℃时,KNO3和NaCl的溶解度相等
图1
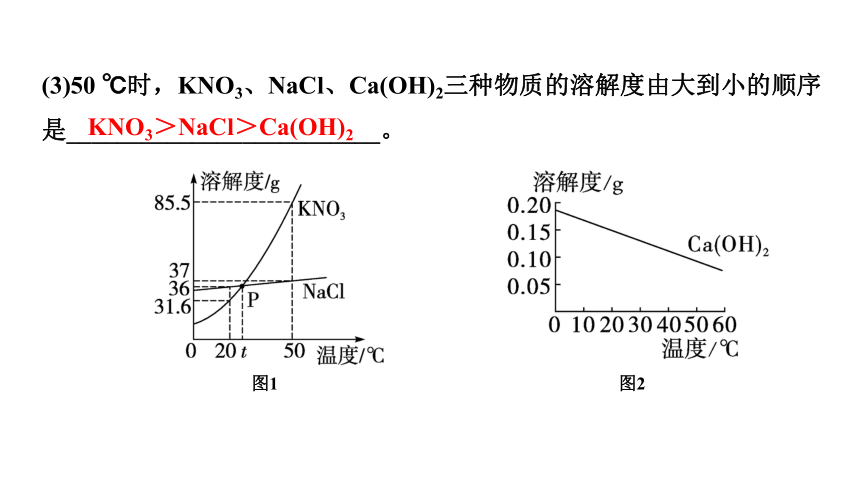
(3)50 ℃时,KNO3、NaCl、Ca(OH)2三种物质的溶解度由大到小的顺序是_________________________。
KNO3>NaCl>Ca(OH)2
图1
图2
方法指导
饱和溶液与不饱和溶液的判断
①溶剂的质量转化为100 g;
②将10 g A加入50 g水中,相当于将20 g A加入100 g水中;
③比较20 g与A在该温度下的溶解度(S)大小关系:
若20 g≥S,为________溶液;
若20 g<S,为________溶液。
不饱和
饱和
饱和溶液与不饱和溶液的转化
①改变溶质或溶剂质量(适用于所有物质)
不饱和溶液 饱和溶液
②改变温度(升温或降温取决于物质的溶解度随温度的变化趋势)
上升型:不饱和溶液 饱和溶液
下降型:不饱和溶液 饱和溶液
增加溶质或蒸发溶剂
增加溶剂
降低温度
升高温度
升高温度
降低温度
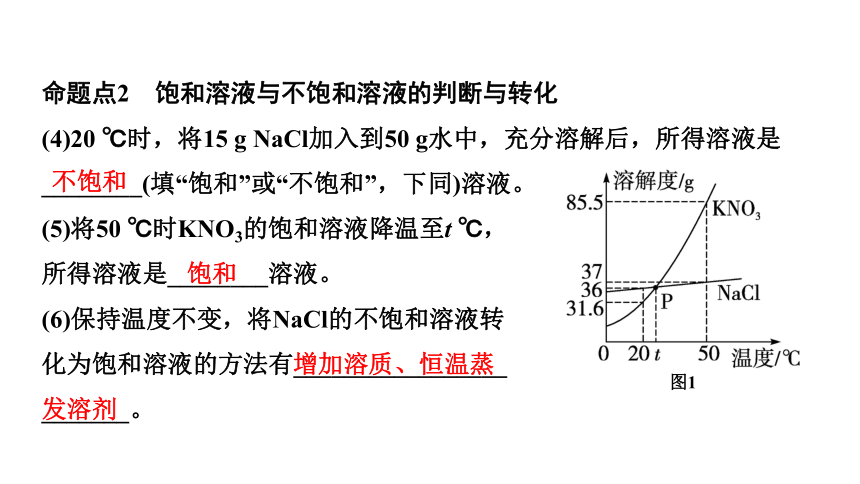
命题点2 饱和溶液与不饱和溶液的判断与转化
(4)20 ℃时,将15 g NaCl加入到50 g水中,充分溶解后,所得溶液是________(填“饱和”或“不饱和”,下同)溶液。
(5)将50 ℃时KNO3的饱和溶液降温至t ℃,
所得溶液是________溶液。
(6)保持温度不变,将NaCl的不饱和溶液转
化为饱和溶液的方法有_________________
_______。
增加溶质、恒温蒸发溶剂
不饱和
饱和
图1
增加溶质、升高温度、恒温蒸发溶剂
(7)将接近饱和的Ca(OH)2 溶液转化为饱和溶液的方法有______________
______________________。
图2
降温结晶(或冷却热饱和溶液)
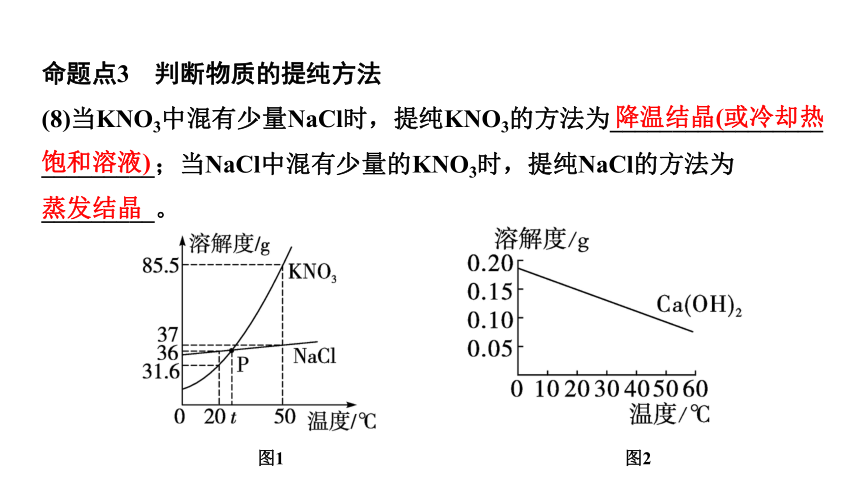
命题点3 判断物质的提纯方法
(8)当KNO3中混有少量NaCl时,提纯KNO3的方法为_________________
_________;当NaCl中混有少量的KNO3时,提纯NaCl的方法为
_________。
蒸发结晶
图1
图2
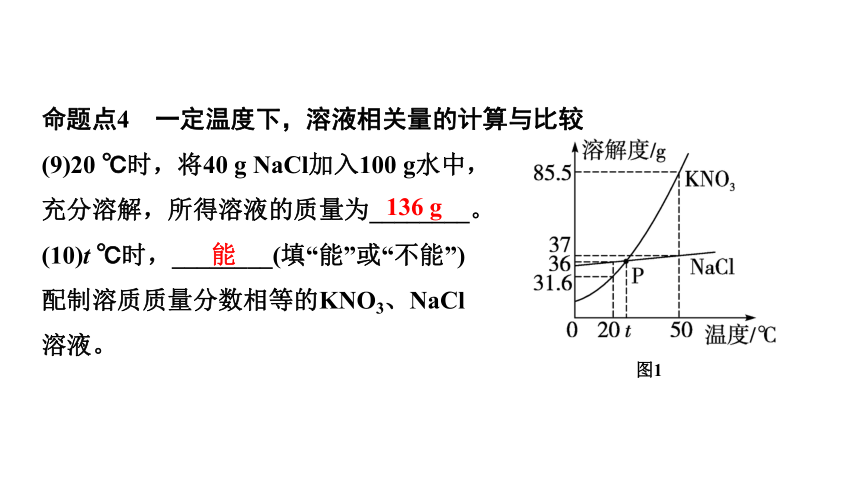
命题点4 一定温度下,溶液相关量的计算与比较
(9)20 ℃时,将40 g NaCl加入100 g水中,
充分溶解,所得溶液的质量为________。
(10)t ℃时,________(填“能”或“不能”)
配制溶质质量分数相等的KNO3、NaCl
溶液。
能
136 g
图1
(11)50 ℃时,KNO3的饱和溶液的溶质质量分数为________(结果保留至0.1%),该温度下KNO3和NaCl的饱和溶液的溶质质量分数的大小关系为____________________________。
(12)50 ℃时,_____(填“能”或“不能”)
配制溶质质量分数为37%的NaCl溶液。
(13)50 ℃时,将50 g KNO3加入100 g
水中充分溶解,所得溶液中溶质与溶
剂的质量比为________(填最简比)。
46.1%
KNO3>NaCl(或NaCl<KNO3)
不能
1∶2
图1
(14)50 ℃时,分别用100 g水配制KNO3和NaCl的饱和溶液,所需溶质质量的大小关系为____________________________。
(15)50 ℃时,将相同质量的KNO3、NaCl
配成各自的饱和溶液,所需溶剂的质量大
小关系为___________________________,
所得溶液质量的大小关系为____________
_______________。
KNO3>NaCl(或NaCl<KNO3)
KNO3<NaCl(或NaCl>KNO3)
KNO3<NaCl (或NaCl>KNO3)
图1
方法指导
判断温度改变时溶液中溶质(不含结晶水)、溶剂、溶质质量分数的变化,首先确定该溶液是否饱和。对于饱和溶液:
上升型:溶解度增大。溶质、溶剂质量、溶质质量分数均不变
下降型:溶解度减小。溶剂质量不变, 溶质质量、溶质质量分数均 减小
上升型:溶解度减小。溶剂质量不变, 溶质质量、溶质质量分数均 减小
下降型:溶解度增大。溶质质量、溶质剂量、溶质质量分数均不变
温度升高
温度降低
命题点5 改变温度时溶液中相关量的变化
(16)将Ca(OH)2的饱和溶液从20 ℃升温至40 ℃,溶质的质量________(填“增大”“减小”或“不变”,后同),溶剂的质量______,溶液的质量______,溶质质量分数________。
减小
不变
减小
减小
图1
图2
(17)将KNO3、NaCl的饱和溶液从20 ℃升温至50 ℃时,所得溶液的溶质质量分数由大到小的顺序为______________。
(18)将100 g KNO3、NaCl的饱和溶液从t ℃降温至20 ℃,析出晶体较多的是________,溶剂质量
大小关系为____________,
所得溶液的质量大小关系
为____________________
_______________。
NaCl>KNO3
KNO3
KNO3=NaCl
KNO3<NaCl (或NaCl>KNO3)
类型2 溶解度表(10年4考)
例2 下表是NaCl和KNO3在不同温度下的溶解度。
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
1. 从表中直接读取信息
(1)20 ℃时,NaCl的溶解度为____g,60 ℃时,KNO3的溶解度为____g。
(2)KNO3的溶解度随温度的升高而______(填“增大”或“减小”)。
36.0
110
增大
2. 溶解度表的应用
(3)如表所示,NaCl和KNO3的溶解度相等时的最小温度范围是_________。
(4)60 ℃时,将20 g NaCl固体加入50 g水中充分溶解,得到溶液的质量为______g。
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
20~30 ℃
68.65
类型3 实验操作图(2022.14,2019.14)
例 3 已知20 ℃时,硝酸钾的溶解度为31.6 g,40 ℃时,硝酸钾的溶解度为63.9 g。按如图所示操作后得到相应的溶液①~③。下列说法不正确的是( )
A. 只有①是饱和溶液
B. ②中溶液的质量为160 g
C. 溶质质量分数②<③
D. ③中溶质与溶剂的质量
比为63.9∶100
方法指导
1. 列表法:当溶剂为100 g水时
2. 当溶剂为m g时,最多能溶
解溶质的质量为 (S为溶
解度),计算结果与加入物质
的质量对比,然后进行分析。
① ② ③
温度/℃ 20 40 40
硝酸钾的溶解度/g 31.6 63.9 63.9
溶剂的质量/g 100 100 100
加入物质的质量/g 60 60 63.9
物质溶解的质量/g 31.6 60 63.9
状态 饱和 不饱和 饱和
【答案】A
跟踪训练
成都真题精选
1. (2014成都)Ca(OH)2在不同温度时的溶解度如下表:根据表中信息,判断下列说法正确的是( )
A. Ca(OH)2的溶解度随温度的升高而增大
B. 20 ℃时,Ca(OH)2的溶解度为0.16 g
温度/℃ 0 20 40 60 80
溶解度/g 0.18 0.16 0.14 0.11 0.09
C. 40 ℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D. 60 ℃时,向100 g水中加入0.20 g Ca(OH)2充分搅拌,固体完全溶解
【答案】B
温度/℃ 0 20 40 60 80
溶解度/g 0.18 0.16 0.14 0.11 0.09
2. (2017成都)根据下表信息,相关说法正确的是( )
A. 20 ℃时,NaCl的溶解度为36.0
B. 40 ℃时,KCl饱和溶液的溶质质量分数为40%
C. 40 ℃时,向100 g水中加入
50 g NH4Cl充分溶解,溶液质
量为145.8 g
D. 60 ℃降温到20 ℃时,KNO3
和KCl的饱和溶液析出晶体较多
的是KNO3
温度/℃ 溶解度/g NaCl KCl NH4Cl KNO3
20 36.0 34.0 37.2 31.6
40 36.6 40.0 45.8 63.9
60 37.3 45.5 55.2 110
C
3. (2021成都)60 ℃时,向100 g水中加入一定量KNO3形成溶液,再降温至20 ℃,析出固体质量的变化如图1。结合图2,下列说法正确的是
( )
A. 加入的KNO3质量为41.6 g
B. 降温过程中KNO3溶液始终为饱和溶液
C. 蒸发溶剂可将M点的溶液转化到N点
D. 20 ℃时,100 g KNO3饱和溶液中有KNO3 31.6 g
【答案】A
4. (2019成都)根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A. 无法判断a中溶液是否为饱和溶液
B. c中溶液溶质的质量分数为33.3%
氯化钠的溶解度曲线
C. b中溶液在加热过程中始终为饱和溶液
D. 常用冷却热的饱和溶液的方法获得氯化钠晶体
氯化钠的溶解度曲线
【答案】C
备考好题精选
5. (2023河北)20 ℃和60 ℃时KCl的溶解度分别为34.0 g和45.5 g,如图所示为对KCl进行的溶解实验。下列分析错误的是( )
A. ①中溶液为KCl的饱和溶液
B. ②中溶液的质量为25.0 g
C. 溶液中溶质的质量:
①<②=③
D. 溶液中溶质的质量分数:
①<②=③
D
6. (2023安徽)煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图所示。下列有关说法正确的是( )
A. 与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到
B. a1 ℃时,NaNO3的饱和溶液,溶质的
质量分数为80%
C. a2 ℃时,NaCl和Na2SO4的饱和溶液,
溶质的质量分数相等
D. 40 ℃时,Na2SO4的饱和溶液,升温到
60 ℃变为不饱和溶液
C
7. (2023锦江区二诊)为探究硝酸钾的溶解性,进行了如图实验,结合 KNO3溶解度曲线判断,下列说法正确的是( )
A. ①→②,KNO3的溶解度增大
B. ②→③,溶液中 KNO3的溶质质量分数增大
C. ③→④,析出KNO3的质量为 14.2 g
D. ②和④,溶液中KNO3的溶质质量分数是②>④
【答案】B
8. (2023成都定心卷改编)氯化钠溶解度及模拟海水晒盐的过程如下。下列说法正确的是( )
A. 60 ℃时,氯化钠饱和溶液中溶质的质量为37.3 g
B. 母液④中氯化钠的质量分数为26.4%
温度/℃ 10 20 30 40 50 60
溶解度/g 35.8 36.0 36.3 36.6 37.0 37.3
C. ①~④中③④一定是氯化钠的饱和溶液
D. 工业上常采用降温结晶的方法大规模生产食盐
温度/℃ 10 20 30 40 50 60
溶解度/g 35.8 36.0 36.3 36.6 37.0 37.3
【答案】C
9. [曲线创新](2023泰安节选)20 ℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制如图所示图像。
(1)20 ℃时,该固体物质的溶解度为______g。
(2)C点所对应的溶液是________(填“饱和”或
“不饱和”)溶液。
(3)图中A、B、C、D四点所对应的溶液溶质
质量分数大小关系为______________(用含A、
B、C、D的关系式表示)。
88
不饱和
A=B>C>D
请完成精练本习题
作业:
微专题6 溶解度的应用
跟踪训练
2
1
典例串方法
典例串方法
类型1 溶解度曲线(10年4考)
例1 根据如图所示溶解度曲线,回答问题。
命题点1 溶解度大小的判断及比较
(1)KNO3、NaCl两种物质中溶解度受温度的影响
较大的是________,较小的是________。
(2)P点表示________________________________。
KNO3
NaCl
t ℃时,KNO3和NaCl的溶解度相等
图1
(3)50 ℃时,KNO3、NaCl、Ca(OH)2三种物质的溶解度由大到小的顺序是_________________________。
KNO3>NaCl>Ca(OH)2
图1
图2
方法指导
饱和溶液与不饱和溶液的判断
①溶剂的质量转化为100 g;
②将10 g A加入50 g水中,相当于将20 g A加入100 g水中;
③比较20 g与A在该温度下的溶解度(S)大小关系:
若20 g≥S,为________溶液;
若20 g<S,为________溶液。
不饱和
饱和
饱和溶液与不饱和溶液的转化
①改变溶质或溶剂质量(适用于所有物质)
不饱和溶液 饱和溶液
②改变温度(升温或降温取决于物质的溶解度随温度的变化趋势)
上升型:不饱和溶液 饱和溶液
下降型:不饱和溶液 饱和溶液
增加溶质或蒸发溶剂
增加溶剂
降低温度
升高温度
升高温度
降低温度
命题点2 饱和溶液与不饱和溶液的判断与转化
(4)20 ℃时,将15 g NaCl加入到50 g水中,充分溶解后,所得溶液是________(填“饱和”或“不饱和”,下同)溶液。
(5)将50 ℃时KNO3的饱和溶液降温至t ℃,
所得溶液是________溶液。
(6)保持温度不变,将NaCl的不饱和溶液转
化为饱和溶液的方法有_________________
_______。
增加溶质、恒温蒸发溶剂
不饱和
饱和
图1
增加溶质、升高温度、恒温蒸发溶剂
(7)将接近饱和的Ca(OH)2 溶液转化为饱和溶液的方法有______________
______________________。
图2
降温结晶(或冷却热饱和溶液)
命题点3 判断物质的提纯方法
(8)当KNO3中混有少量NaCl时,提纯KNO3的方法为_________________
_________;当NaCl中混有少量的KNO3时,提纯NaCl的方法为
_________。
蒸发结晶
图1
图2
命题点4 一定温度下,溶液相关量的计算与比较
(9)20 ℃时,将40 g NaCl加入100 g水中,
充分溶解,所得溶液的质量为________。
(10)t ℃时,________(填“能”或“不能”)
配制溶质质量分数相等的KNO3、NaCl
溶液。
能
136 g
图1
(11)50 ℃时,KNO3的饱和溶液的溶质质量分数为________(结果保留至0.1%),该温度下KNO3和NaCl的饱和溶液的溶质质量分数的大小关系为____________________________。
(12)50 ℃时,_____(填“能”或“不能”)
配制溶质质量分数为37%的NaCl溶液。
(13)50 ℃时,将50 g KNO3加入100 g
水中充分溶解,所得溶液中溶质与溶
剂的质量比为________(填最简比)。
46.1%
KNO3>NaCl(或NaCl<KNO3)
不能
1∶2
图1
(14)50 ℃时,分别用100 g水配制KNO3和NaCl的饱和溶液,所需溶质质量的大小关系为____________________________。
(15)50 ℃时,将相同质量的KNO3、NaCl
配成各自的饱和溶液,所需溶剂的质量大
小关系为___________________________,
所得溶液质量的大小关系为____________
_______________。
KNO3>NaCl(或NaCl<KNO3)
KNO3<NaCl(或NaCl>KNO3)
KNO3<NaCl (或NaCl>KNO3)
图1
方法指导
判断温度改变时溶液中溶质(不含结晶水)、溶剂、溶质质量分数的变化,首先确定该溶液是否饱和。对于饱和溶液:
上升型:溶解度增大。溶质、溶剂质量、溶质质量分数均不变
下降型:溶解度减小。溶剂质量不变, 溶质质量、溶质质量分数均 减小
上升型:溶解度减小。溶剂质量不变, 溶质质量、溶质质量分数均 减小
下降型:溶解度增大。溶质质量、溶质剂量、溶质质量分数均不变
温度升高
温度降低
命题点5 改变温度时溶液中相关量的变化
(16)将Ca(OH)2的饱和溶液从20 ℃升温至40 ℃,溶质的质量________(填“增大”“减小”或“不变”,后同),溶剂的质量______,溶液的质量______,溶质质量分数________。
减小
不变
减小
减小
图1
图2
(17)将KNO3、NaCl的饱和溶液从20 ℃升温至50 ℃时,所得溶液的溶质质量分数由大到小的顺序为______________。
(18)将100 g KNO3、NaCl的饱和溶液从t ℃降温至20 ℃,析出晶体较多的是________,溶剂质量
大小关系为____________,
所得溶液的质量大小关系
为____________________
_______________。
NaCl>KNO3
KNO3
KNO3=NaCl
KNO3<NaCl (或NaCl>KNO3)
类型2 溶解度表(10年4考)
例2 下表是NaCl和KNO3在不同温度下的溶解度。
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
1. 从表中直接读取信息
(1)20 ℃时,NaCl的溶解度为____g,60 ℃时,KNO3的溶解度为____g。
(2)KNO3的溶解度随温度的升高而______(填“增大”或“减小”)。
36.0
110
增大
2. 溶解度表的应用
(3)如表所示,NaCl和KNO3的溶解度相等时的最小温度范围是_________。
(4)60 ℃时,将20 g NaCl固体加入50 g水中充分溶解,得到溶液的质量为______g。
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
20~30 ℃
68.65
类型3 实验操作图(2022.14,2019.14)
例 3 已知20 ℃时,硝酸钾的溶解度为31.6 g,40 ℃时,硝酸钾的溶解度为63.9 g。按如图所示操作后得到相应的溶液①~③。下列说法不正确的是( )
A. 只有①是饱和溶液
B. ②中溶液的质量为160 g
C. 溶质质量分数②<③
D. ③中溶质与溶剂的质量
比为63.9∶100
方法指导
1. 列表法:当溶剂为100 g水时
2. 当溶剂为m g时,最多能溶
解溶质的质量为 (S为溶
解度),计算结果与加入物质
的质量对比,然后进行分析。
① ② ③
温度/℃ 20 40 40
硝酸钾的溶解度/g 31.6 63.9 63.9
溶剂的质量/g 100 100 100
加入物质的质量/g 60 60 63.9
物质溶解的质量/g 31.6 60 63.9
状态 饱和 不饱和 饱和
【答案】A
跟踪训练
成都真题精选
1. (2014成都)Ca(OH)2在不同温度时的溶解度如下表:根据表中信息,判断下列说法正确的是( )
A. Ca(OH)2的溶解度随温度的升高而增大
B. 20 ℃时,Ca(OH)2的溶解度为0.16 g
温度/℃ 0 20 40 60 80
溶解度/g 0.18 0.16 0.14 0.11 0.09
C. 40 ℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D. 60 ℃时,向100 g水中加入0.20 g Ca(OH)2充分搅拌,固体完全溶解
【答案】B
温度/℃ 0 20 40 60 80
溶解度/g 0.18 0.16 0.14 0.11 0.09
2. (2017成都)根据下表信息,相关说法正确的是( )
A. 20 ℃时,NaCl的溶解度为36.0
B. 40 ℃时,KCl饱和溶液的溶质质量分数为40%
C. 40 ℃时,向100 g水中加入
50 g NH4Cl充分溶解,溶液质
量为145.8 g
D. 60 ℃降温到20 ℃时,KNO3
和KCl的饱和溶液析出晶体较多
的是KNO3
温度/℃ 溶解度/g NaCl KCl NH4Cl KNO3
20 36.0 34.0 37.2 31.6
40 36.6 40.0 45.8 63.9
60 37.3 45.5 55.2 110
C
3. (2021成都)60 ℃时,向100 g水中加入一定量KNO3形成溶液,再降温至20 ℃,析出固体质量的变化如图1。结合图2,下列说法正确的是
( )
A. 加入的KNO3质量为41.6 g
B. 降温过程中KNO3溶液始终为饱和溶液
C. 蒸发溶剂可将M点的溶液转化到N点
D. 20 ℃时,100 g KNO3饱和溶液中有KNO3 31.6 g
【答案】A
4. (2019成都)根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A. 无法判断a中溶液是否为饱和溶液
B. c中溶液溶质的质量分数为33.3%
氯化钠的溶解度曲线
C. b中溶液在加热过程中始终为饱和溶液
D. 常用冷却热的饱和溶液的方法获得氯化钠晶体
氯化钠的溶解度曲线
【答案】C
备考好题精选
5. (2023河北)20 ℃和60 ℃时KCl的溶解度分别为34.0 g和45.5 g,如图所示为对KCl进行的溶解实验。下列分析错误的是( )
A. ①中溶液为KCl的饱和溶液
B. ②中溶液的质量为25.0 g
C. 溶液中溶质的质量:
①<②=③
D. 溶液中溶质的质量分数:
①<②=③
D
6. (2023安徽)煤化工废水中含有NaCl、Na2SO4、NaNO3,这三种盐的溶解度曲线如图所示。下列有关说法正确的是( )
A. 与NaNO3相比,NaCl更适合通过饱和溶液降温结晶得到
B. a1 ℃时,NaNO3的饱和溶液,溶质的
质量分数为80%
C. a2 ℃时,NaCl和Na2SO4的饱和溶液,
溶质的质量分数相等
D. 40 ℃时,Na2SO4的饱和溶液,升温到
60 ℃变为不饱和溶液
C
7. (2023锦江区二诊)为探究硝酸钾的溶解性,进行了如图实验,结合 KNO3溶解度曲线判断,下列说法正确的是( )
A. ①→②,KNO3的溶解度增大
B. ②→③,溶液中 KNO3的溶质质量分数增大
C. ③→④,析出KNO3的质量为 14.2 g
D. ②和④,溶液中KNO3的溶质质量分数是②>④
【答案】B
8. (2023成都定心卷改编)氯化钠溶解度及模拟海水晒盐的过程如下。下列说法正确的是( )
A. 60 ℃时,氯化钠饱和溶液中溶质的质量为37.3 g
B. 母液④中氯化钠的质量分数为26.4%
温度/℃ 10 20 30 40 50 60
溶解度/g 35.8 36.0 36.3 36.6 37.0 37.3
C. ①~④中③④一定是氯化钠的饱和溶液
D. 工业上常采用降温结晶的方法大规模生产食盐
温度/℃ 10 20 30 40 50 60
溶解度/g 35.8 36.0 36.3 36.6 37.0 37.3
【答案】C
9. [曲线创新](2023泰安节选)20 ℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制如图所示图像。
(1)20 ℃时,该固体物质的溶解度为______g。
(2)C点所对应的溶液是________(填“饱和”或
“不饱和”)溶液。
(3)图中A、B、C、D四点所对应的溶液溶质
质量分数大小关系为______________(用含A、
B、C、D的关系式表示)。
88
不饱和
A=B>C>D
请完成精练本习题
作业:
同课章节目录
