2024中考化学 微专题10 探究二氧化碳与氢氧化钠溶液的反应 课件(共37张PPT)
文档属性
| 名称 | 2024中考化学 微专题10 探究二氧化碳与氢氧化钠溶液的反应 课件(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-19 21:36:50 | ||
图片预览







文档简介
(共37张PPT)
微专题10 探究二氧化碳与氢氧化钠溶液的反应
跟踪训练
2
1
典例串方法
探究一 二氧化碳与氢氧化钠溶液是否发生反应
角度1:验证新物质的生成
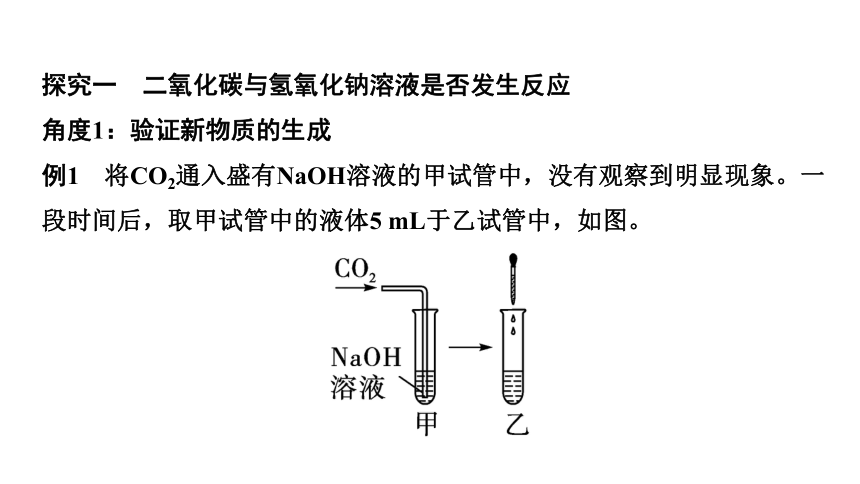
例1 将CO2通入盛有NaOH溶液的甲试管中,没有观察到明显现象。一段时间后,取甲试管中的液体5 mL于乙试管中,如图。
第1步:确定需要检验的物质
若要证明NaOH和CO2发生反应,需要检验生成物________(填化学式)是否存在。
第2步:设计方案检验生成物
向反应后的乙试管中加入稀盐酸,观察到
___________,该反应的化学方程式为
____________________________________。
Na2CO3
有气泡产生
Na2CO3+2HCl===2NaCl+H2O+CO2↑
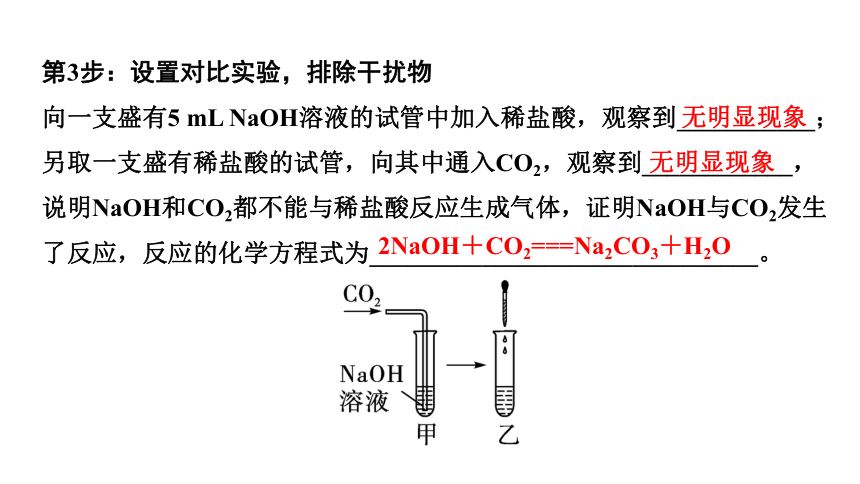
第3步:设置对比实验,排除干扰物
向一支盛有5 mL NaOH溶液的试管中加入稀盐酸,观察到___________;另取一支盛有稀盐酸的试管,向其中通入CO2,观察到____________,说明NaOH和CO2都不能与稀盐酸反应生成气体,证明NaOH与CO2发生了反应,反应的化学方程式为_______________________________。
2NaOH+CO2===Na2CO3+H2O
无明显现象
无明显现象
角度2:验证反应物的减少或消失
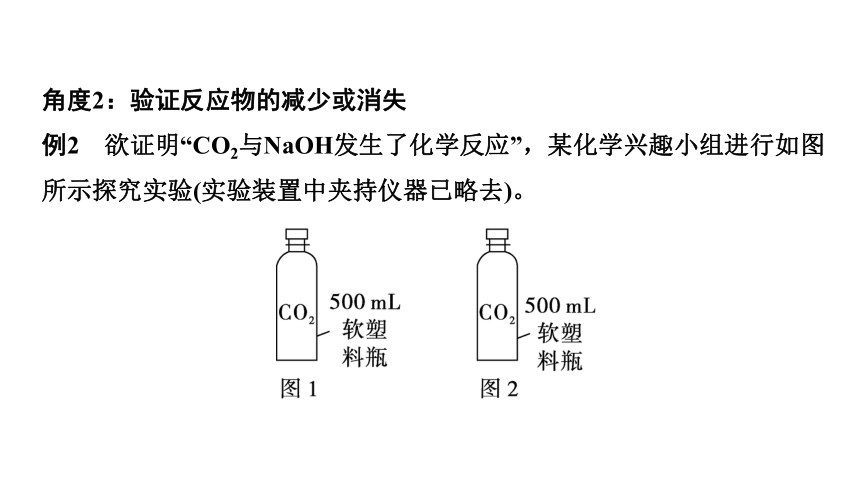
例2 欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行如图所示探究实验(实验装置中夹持仪器已略去)。
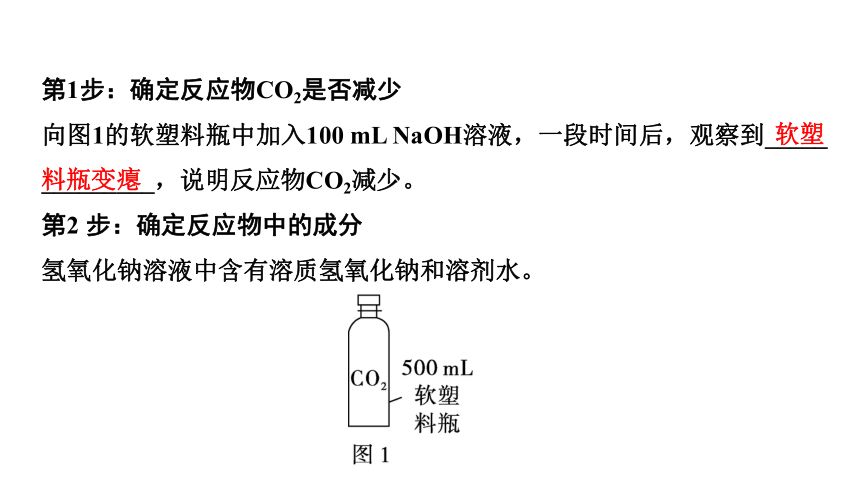
第1步:确定反应物CO2是否减少
向图1的软塑料瓶中加入100 mL NaOH溶液,一段时间后,观察到_____
_________,说明反应物CO2减少。
第2 步:确定反应物中的成分
氢氧化钠溶液中含有溶质氢氧化钠和溶剂水。
软塑料瓶变瘪
第3步:设置对比实验,排除干扰物
向图2的软塑料瓶中加入100 mL蒸馏水,观察到_____________________
______________,说明CO2与NaOH发生了化学反应。
软塑料瓶变瘪,但变瘪程度比图1中小
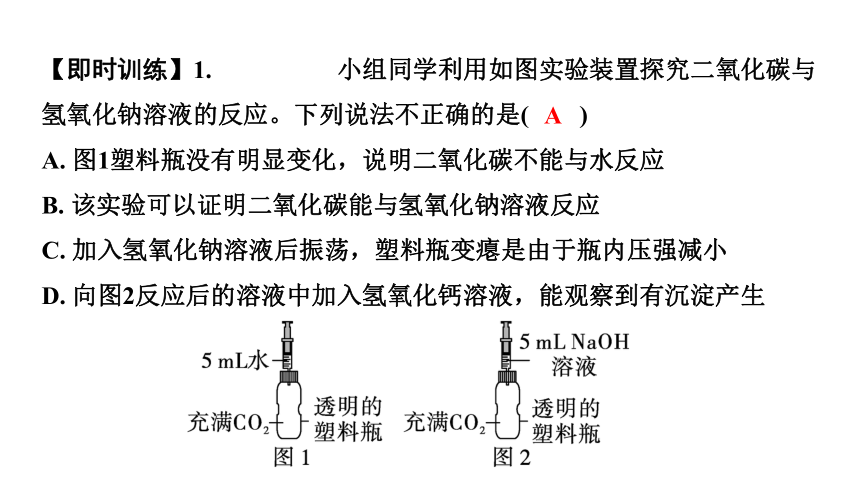
【即时训练】1. 小组同学利用如图实验装置探究二氧化碳与氢氧化钠溶液的反应。下列说法不正确的是( )
A. 图1塑料瓶没有明显变化,说明二氧化碳不能与水反应
B. 该实验可以证明二氧化碳能与氢氧化钠溶液反应
C. 加入氢氧化钠溶液后振荡,塑料瓶变瘪是由于瓶内压强减小
D. 向图2反应后的溶液中加入氢氧化钙溶液,能观察到有沉淀产生
A
探究二 二氧化碳与氢氧化钠溶液反应进行的程度
例3 实验室有一瓶忘记盖瓶盖的氢氧化钠溶液。兴趣小组同学对该瓶氢氧化钠溶液是否变质及变质的程度进行如下探究。
第1步:明确变质原因。氢氧化钠变质的化学方程式:_______________________________。
第2步:根据化学方程式猜想变质后的成分。
猜想Ⅰ:已完全变质,该固体成分中只含生成物__________________;
猜想Ⅱ:部分变质,该固体成分中含有生成物__________________和反应物__________________。
2NaOH+CO2===Na2CO3+H2O
Na2CO3(或碳酸钠)
Na2CO3(或碳酸钠)
NaOH(或氢氧化钠)
第3步:确定需要检验的物质。
比较猜想Ⅰ和猜想Ⅱ的差异,确定需要检验的物质是__________________。
第4步:设计方案
(1)判断生成物_________________是否对待检验的物质造成干扰。生成物__________________溶液显___性,因此______(填“能”或“不能”)用pH试纸、指示剂直接检验待检验的物质。
NaOH(或氢氧化钠)
不能
Na2CO3(或碳酸钠)
Na2CO3(或碳酸钠)
碱
(2)除去干扰物。
①能与Na2CO3反应的物质有________________、___________________、________________(填3种不同类别的物质)。
②结合待检验物质的化学性质,确定应选择的除杂试剂是____________
_______________。
(3)检验待检验的物质。
检验NaOH应该选择的酸碱指示剂是_________________________,观察到___________________,则为部分变质;观察到___________________
______,则为全部变质。
溶液不变色(或无明显现象)
稀盐酸(或稀硫酸)
氢氧化钙(或氢氧化钡)
氯化钡(或硝酸钡)
氯化钡溶液(或硝酸钡溶液)
无色酚酞(或紫色石蕊)溶液
溶液变红色(或蓝色)
【即时训练】2. 现有一瓶久置的氢氧化钠溶液,为探究该溶液是否变质以及变质的程度,设计了如图流程。下列说法错误的是( )
A. 由步骤①中的现象可知该氢氧化钠溶液已经变质
B. 若步骤②中的“现象Ⅰ”为“生成白色沉淀”,则该氢氧化钠溶液部分
变质
C. 若步骤②中的“现象Ⅰ”为“无明显现象”,则该氢氧化钠溶液完全变质
D. 步骤①中的氯化钡溶液也可以用氢氧化钙溶液代替
【答案】D
探究三 变质后的氢氧化钠溶液中碳酸钠含量的测定
例4 为测定某敞口久置的氢氧化钠溶液样品中碳酸钠的质量分数,进行如下探究。
第1步:明确测定原理
测定氢氧化钠溶液中碳酸钠的含量时,通过测量样品与过量稀硫酸(或稀盐酸)反应产生_________________的质量确定碳酸钠的质量,发生反应的化学方程式为______________________________________________
________________________________________。
CO2(或二氧化碳)
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
(或Na2CO3+2HCl===2NaCl+H2O+CO2↑)
第2步:组装装置
(1)装置B的作用是____________________________。
(2)装置C的作用是____________________________。
(3)若未连接装置D,可能导致结果______(填“偏大”或“偏小”)。
除去二氧化碳中混有的水蒸气
吸收反应生成的二氧化碳
偏大
第3步:测定数据进行计算
用如图装置进行实验时需要测的数据是____(填字母序号)。
a. 样品的质量
b. 实验前后装置B的质量
c. 实验前后装置C的质量
d. 实验前后装置D的质量
e. 所用稀硫酸的质量
ac
跟踪训练
1. 氢氧化钠溶液和二氧化碳的反应无明显现象,怎样证明二者发生了
反应?
(1)第一组同学按图1所示,将氢氧化钠溶液全部注入集气瓶中,过一会儿观察到气球鼓起,认为二者发生了反应。 第二组
同学认为该实验不严谨,理由是________________
____________________________________________。
于是同学们将该装置中的氢氧化钠溶液换成______
_____,做了对比实验,证明二者发生了反应。
等量的水
二氧化碳溶于水且与水反应,也能使瓶内气压减小,使气球鼓起
(2)第二组同学按图2所示,先将氢氧化钠溶液全部注入集气瓶中,过一会儿打开止水夹,观察到____________________________________,也证明二者发生了反应。
(3)第二组同学的实验中,将烧杯中的稀盐酸换为____________,也可以达到实验目的。
氯化钡溶液
稀盐酸沿导管进入瓶内,瓶内产生气泡
2. (2023丽水改编)实验室里有一个装有8克氢氧化钠固体的试剂瓶,久置未用。为检验氢氧化钠变质程度,小丽进行了定量实验。将瓶中样品全部倒入烧杯中,加水充分溶解,逐滴加入溶质质量分数为7.3%的稀盐酸充分反应,当溶液的pH恰好为7时,所加稀盐酸的质量为100克。
(1)小丽通过计算得出结论氢氧化钠完全变质(如图)。小科认为小丽的结论不正确,理由是______________________________________________
_________________________________________________;
(2)在小丽的实验方案中,要确定样品中氢氧化钠的质量,还缺少______
____________质量的测定。
CO2
(或二氧化碳)
不论氢氧化钠变质程度如何,当pH为7时,消耗盐酸的质量是一样的,所以用盐酸的质量来计算是错误的
解题关键点
第2题
解答本题的关键在于计算时已知纯净物质量的选择,氢氧化钠变质生成的碳酸钠与盐酸反应生成二氧化碳,烧杯中反应前后减少的质量即为二氧化碳的质量,故应选择二氧化碳的质量作为已知纯净物的质量,再根据化学方程式计算氢氧化钠的质量。
3. (2016成都)某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究。
【提出问题】二氧化碳是与氢氧化钠反应,还是溶解在水中?
【查阅资料】①15 ℃时,101 kPa时,二氧化碳的溶解度如下:
②15 ℃时,在酒精中,氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
溶剂 水 酒精
溶解度 1.0 0.3
【实验设计】在15 ℃、101 kPa时,制取二氧化碳并用于实验甲、实
验乙。
【分析与表达】(1)如果二氧化碳能与氢氧化钠反应,化学方程式是______________________________,那么氢氧化钠应_____保存。
2NaOH+CO2===Na2CO3+H2O
密封
(2)实验前,两套装置都进行了气密性检查。实验甲装置气密性检查的方法是__________________________________________________________
___________________________________________________________________________________________________。
在U形管中加入适量的水,用热毛巾或手紧握左边的试管,U形管内液面会出现右高左低的现象,松手一段时间后,液面回落到原位置,说明装置气密性良好,同理检验右侧试管
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是________
____________________________________________________________________________________________。
U形管内右侧液面升高,左侧液面下降,一段时间后,右侧液面缓缓下降,左侧上升,但右侧液面仍高于左侧
(4)实验乙中,将氢氧化钠溶液完全滴入锥形瓶,注射器活塞会自动向内移动并将酒精推入锥形瓶,活塞移动的速度是____。(填字母)
A. 先慢后快 B. 先快后慢 C. 先慢后快,再变慢
实验乙中,还可能观察到的现象是__________________。
B
出现白色浑浊现象
(5)实验乙中,120 mL酒精_____(填“能”或“不能”)换成水,原因是_____
______________________________________________________________。
二氧化碳在水中的溶解度大于在酒精中的,碳酸钠在酒精中微溶,现象明显
不能
【记录与处理】(6)实验乙结束时,注射器中酒精体积为20 mL,则与氢氧化钠反应的二氧化碳体积至少是____mL。
【结论与反思】 (7)由以上探究可知,二氧化碳能溶于水,也能与氢氧化钠反应。但实验乙的数据还不够准确,造成实验乙误差的原因可能有_______________。(写一条)
酒精具有挥发性
63
4. (2023成都定心卷)兴趣小组同学发现实验桌上有一瓶敞口放置的氢氧化钠溶液,为探究该氢氧化钠溶液是否变质,进行如下探究。
【探究1】这瓶氢氧化钠溶液是否变质
(1)氢氧化钠溶液敞口放置在空气中易发生变质的原因是______________________________(用化学方程式表示)。
CO2+2NaOH===Na2CO3+H2O
【设计与实验】
(2)甲、乙、丙三位同学设计如下实验。
操作 现象 结论
甲同学取少量样品于试管中,滴加无色酚酞溶液 溶液变红 该溶液没有变质
乙同学取少量样品于试管中,滴加__________________________ (填化学式)溶液 溶液变浑浊 该溶液已经变质
丙同学取少量样品于试管中,滴加稀盐酸 ____________________________________ 该溶液可能部分变质
开始无明显现象,一段时间后有气泡产生
BaCl2[或Ba(NO3)2或Ba(OH)2]
【反思与评价】
(3)请你判断甲同学的结论是否正确,并说明理由____________________
_____________________________________________。
丁同学在老师的指导下,用pH传感器进行了如图1所示的探究。
不正确,碳酸钠溶液和氢氧化钠溶液都呈碱性,都能使无色酚酞溶液变红
第1步: 用烧杯取该瓶敞口放置的氢氧化钠溶液15 mL,开启磁力搅拌器和数据采集器,运行软件,控制 3~5滴/秒的滴速,采集的pH变化曲线如图2。
第2步:取新制的氢氧化钠溶液15 mL,重复第1步操作,采集的pH变化曲线如图3。
第3步:取碳酸钠溶液15 mL,重复第1步操作,采集的pH变化曲线如
图4。
(4)图3中C点时,对应烧杯中溶液含有的溶质为_____________________
________。
HCl、NaCl(或氯化氢、氯化钠)
(5)对比曲线,证明该瓶敞口放置的氢氧化钠溶液已部分变质,依据是________________________________________________________________________________________________________________。
图2的AB段与图3开始段曲线相似,说明该溶液中含有氢氧化钠,图2的CH段与图4的AF段曲线相似,说明样品溶液中有碳酸钠
【探究2】探究该瓶氢氧化钠溶液的变质程度
第1步: 如图5(夹持仪器已略去),取20 g该瓶敞口放置的氢氧化钠溶液。第2步: 滴加质量分数为8.5%(密度为1.04 g/mL)的稀盐酸,边滴加边振荡,直到恰好没有气泡产生为止,共滴加稀盐酸15 mL,天平示数为35.06 g。
(6)该瓶溶液中溶质变质程度为________(精确到0.1%)。
【反思总结】
(7)实验要养成良好习惯,请写一条实验结束后的注意
事项___________________________________。
67.6%
及时盖上瓶塞(或将药品整理归位)
请完成精练本习题
作业:
微专题10 探究二氧化碳与氢氧化钠溶液的反应
跟踪训练
2
1
典例串方法
探究一 二氧化碳与氢氧化钠溶液是否发生反应
角度1:验证新物质的生成
例1 将CO2通入盛有NaOH溶液的甲试管中,没有观察到明显现象。一段时间后,取甲试管中的液体5 mL于乙试管中,如图。
第1步:确定需要检验的物质
若要证明NaOH和CO2发生反应,需要检验生成物________(填化学式)是否存在。
第2步:设计方案检验生成物
向反应后的乙试管中加入稀盐酸,观察到
___________,该反应的化学方程式为
____________________________________。
Na2CO3
有气泡产生
Na2CO3+2HCl===2NaCl+H2O+CO2↑
第3步:设置对比实验,排除干扰物
向一支盛有5 mL NaOH溶液的试管中加入稀盐酸,观察到___________;另取一支盛有稀盐酸的试管,向其中通入CO2,观察到____________,说明NaOH和CO2都不能与稀盐酸反应生成气体,证明NaOH与CO2发生了反应,反应的化学方程式为_______________________________。
2NaOH+CO2===Na2CO3+H2O
无明显现象
无明显现象
角度2:验证反应物的减少或消失
例2 欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行如图所示探究实验(实验装置中夹持仪器已略去)。
第1步:确定反应物CO2是否减少
向图1的软塑料瓶中加入100 mL NaOH溶液,一段时间后,观察到_____
_________,说明反应物CO2减少。
第2 步:确定反应物中的成分
氢氧化钠溶液中含有溶质氢氧化钠和溶剂水。
软塑料瓶变瘪
第3步:设置对比实验,排除干扰物
向图2的软塑料瓶中加入100 mL蒸馏水,观察到_____________________
______________,说明CO2与NaOH发生了化学反应。
软塑料瓶变瘪,但变瘪程度比图1中小
【即时训练】1. 小组同学利用如图实验装置探究二氧化碳与氢氧化钠溶液的反应。下列说法不正确的是( )
A. 图1塑料瓶没有明显变化,说明二氧化碳不能与水反应
B. 该实验可以证明二氧化碳能与氢氧化钠溶液反应
C. 加入氢氧化钠溶液后振荡,塑料瓶变瘪是由于瓶内压强减小
D. 向图2反应后的溶液中加入氢氧化钙溶液,能观察到有沉淀产生
A
探究二 二氧化碳与氢氧化钠溶液反应进行的程度
例3 实验室有一瓶忘记盖瓶盖的氢氧化钠溶液。兴趣小组同学对该瓶氢氧化钠溶液是否变质及变质的程度进行如下探究。
第1步:明确变质原因。氢氧化钠变质的化学方程式:_______________________________。
第2步:根据化学方程式猜想变质后的成分。
猜想Ⅰ:已完全变质,该固体成分中只含生成物__________________;
猜想Ⅱ:部分变质,该固体成分中含有生成物__________________和反应物__________________。
2NaOH+CO2===Na2CO3+H2O
Na2CO3(或碳酸钠)
Na2CO3(或碳酸钠)
NaOH(或氢氧化钠)
第3步:确定需要检验的物质。
比较猜想Ⅰ和猜想Ⅱ的差异,确定需要检验的物质是__________________。
第4步:设计方案
(1)判断生成物_________________是否对待检验的物质造成干扰。生成物__________________溶液显___性,因此______(填“能”或“不能”)用pH试纸、指示剂直接检验待检验的物质。
NaOH(或氢氧化钠)
不能
Na2CO3(或碳酸钠)
Na2CO3(或碳酸钠)
碱
(2)除去干扰物。
①能与Na2CO3反应的物质有________________、___________________、________________(填3种不同类别的物质)。
②结合待检验物质的化学性质,确定应选择的除杂试剂是____________
_______________。
(3)检验待检验的物质。
检验NaOH应该选择的酸碱指示剂是_________________________,观察到___________________,则为部分变质;观察到___________________
______,则为全部变质。
溶液不变色(或无明显现象)
稀盐酸(或稀硫酸)
氢氧化钙(或氢氧化钡)
氯化钡(或硝酸钡)
氯化钡溶液(或硝酸钡溶液)
无色酚酞(或紫色石蕊)溶液
溶液变红色(或蓝色)
【即时训练】2. 现有一瓶久置的氢氧化钠溶液,为探究该溶液是否变质以及变质的程度,设计了如图流程。下列说法错误的是( )
A. 由步骤①中的现象可知该氢氧化钠溶液已经变质
B. 若步骤②中的“现象Ⅰ”为“生成白色沉淀”,则该氢氧化钠溶液部分
变质
C. 若步骤②中的“现象Ⅰ”为“无明显现象”,则该氢氧化钠溶液完全变质
D. 步骤①中的氯化钡溶液也可以用氢氧化钙溶液代替
【答案】D
探究三 变质后的氢氧化钠溶液中碳酸钠含量的测定
例4 为测定某敞口久置的氢氧化钠溶液样品中碳酸钠的质量分数,进行如下探究。
第1步:明确测定原理
测定氢氧化钠溶液中碳酸钠的含量时,通过测量样品与过量稀硫酸(或稀盐酸)反应产生_________________的质量确定碳酸钠的质量,发生反应的化学方程式为______________________________________________
________________________________________。
CO2(或二氧化碳)
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
(或Na2CO3+2HCl===2NaCl+H2O+CO2↑)
第2步:组装装置
(1)装置B的作用是____________________________。
(2)装置C的作用是____________________________。
(3)若未连接装置D,可能导致结果______(填“偏大”或“偏小”)。
除去二氧化碳中混有的水蒸气
吸收反应生成的二氧化碳
偏大
第3步:测定数据进行计算
用如图装置进行实验时需要测的数据是____(填字母序号)。
a. 样品的质量
b. 实验前后装置B的质量
c. 实验前后装置C的质量
d. 实验前后装置D的质量
e. 所用稀硫酸的质量
ac
跟踪训练
1. 氢氧化钠溶液和二氧化碳的反应无明显现象,怎样证明二者发生了
反应?
(1)第一组同学按图1所示,将氢氧化钠溶液全部注入集气瓶中,过一会儿观察到气球鼓起,认为二者发生了反应。 第二组
同学认为该实验不严谨,理由是________________
____________________________________________。
于是同学们将该装置中的氢氧化钠溶液换成______
_____,做了对比实验,证明二者发生了反应。
等量的水
二氧化碳溶于水且与水反应,也能使瓶内气压减小,使气球鼓起
(2)第二组同学按图2所示,先将氢氧化钠溶液全部注入集气瓶中,过一会儿打开止水夹,观察到____________________________________,也证明二者发生了反应。
(3)第二组同学的实验中,将烧杯中的稀盐酸换为____________,也可以达到实验目的。
氯化钡溶液
稀盐酸沿导管进入瓶内,瓶内产生气泡
2. (2023丽水改编)实验室里有一个装有8克氢氧化钠固体的试剂瓶,久置未用。为检验氢氧化钠变质程度,小丽进行了定量实验。将瓶中样品全部倒入烧杯中,加水充分溶解,逐滴加入溶质质量分数为7.3%的稀盐酸充分反应,当溶液的pH恰好为7时,所加稀盐酸的质量为100克。
(1)小丽通过计算得出结论氢氧化钠完全变质(如图)。小科认为小丽的结论不正确,理由是______________________________________________
_________________________________________________;
(2)在小丽的实验方案中,要确定样品中氢氧化钠的质量,还缺少______
____________质量的测定。
CO2
(或二氧化碳)
不论氢氧化钠变质程度如何,当pH为7时,消耗盐酸的质量是一样的,所以用盐酸的质量来计算是错误的
解题关键点
第2题
解答本题的关键在于计算时已知纯净物质量的选择,氢氧化钠变质生成的碳酸钠与盐酸反应生成二氧化碳,烧杯中反应前后减少的质量即为二氧化碳的质量,故应选择二氧化碳的质量作为已知纯净物的质量,再根据化学方程式计算氢氧化钠的质量。
3. (2016成都)某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究。
【提出问题】二氧化碳是与氢氧化钠反应,还是溶解在水中?
【查阅资料】①15 ℃时,101 kPa时,二氧化碳的溶解度如下:
②15 ℃时,在酒精中,氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
溶剂 水 酒精
溶解度 1.0 0.3
【实验设计】在15 ℃、101 kPa时,制取二氧化碳并用于实验甲、实
验乙。
【分析与表达】(1)如果二氧化碳能与氢氧化钠反应,化学方程式是______________________________,那么氢氧化钠应_____保存。
2NaOH+CO2===Na2CO3+H2O
密封
(2)实验前,两套装置都进行了气密性检查。实验甲装置气密性检查的方法是__________________________________________________________
___________________________________________________________________________________________________。
在U形管中加入适量的水,用热毛巾或手紧握左边的试管,U形管内液面会出现右高左低的现象,松手一段时间后,液面回落到原位置,说明装置气密性良好,同理检验右侧试管
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是________
____________________________________________________________________________________________。
U形管内右侧液面升高,左侧液面下降,一段时间后,右侧液面缓缓下降,左侧上升,但右侧液面仍高于左侧
(4)实验乙中,将氢氧化钠溶液完全滴入锥形瓶,注射器活塞会自动向内移动并将酒精推入锥形瓶,活塞移动的速度是____。(填字母)
A. 先慢后快 B. 先快后慢 C. 先慢后快,再变慢
实验乙中,还可能观察到的现象是__________________。
B
出现白色浑浊现象
(5)实验乙中,120 mL酒精_____(填“能”或“不能”)换成水,原因是_____
______________________________________________________________。
二氧化碳在水中的溶解度大于在酒精中的,碳酸钠在酒精中微溶,现象明显
不能
【记录与处理】(6)实验乙结束时,注射器中酒精体积为20 mL,则与氢氧化钠反应的二氧化碳体积至少是____mL。
【结论与反思】 (7)由以上探究可知,二氧化碳能溶于水,也能与氢氧化钠反应。但实验乙的数据还不够准确,造成实验乙误差的原因可能有_______________。(写一条)
酒精具有挥发性
63
4. (2023成都定心卷)兴趣小组同学发现实验桌上有一瓶敞口放置的氢氧化钠溶液,为探究该氢氧化钠溶液是否变质,进行如下探究。
【探究1】这瓶氢氧化钠溶液是否变质
(1)氢氧化钠溶液敞口放置在空气中易发生变质的原因是______________________________(用化学方程式表示)。
CO2+2NaOH===Na2CO3+H2O
【设计与实验】
(2)甲、乙、丙三位同学设计如下实验。
操作 现象 结论
甲同学取少量样品于试管中,滴加无色酚酞溶液 溶液变红 该溶液没有变质
乙同学取少量样品于试管中,滴加__________________________ (填化学式)溶液 溶液变浑浊 该溶液已经变质
丙同学取少量样品于试管中,滴加稀盐酸 ____________________________________ 该溶液可能部分变质
开始无明显现象,一段时间后有气泡产生
BaCl2[或Ba(NO3)2或Ba(OH)2]
【反思与评价】
(3)请你判断甲同学的结论是否正确,并说明理由____________________
_____________________________________________。
丁同学在老师的指导下,用pH传感器进行了如图1所示的探究。
不正确,碳酸钠溶液和氢氧化钠溶液都呈碱性,都能使无色酚酞溶液变红
第1步: 用烧杯取该瓶敞口放置的氢氧化钠溶液15 mL,开启磁力搅拌器和数据采集器,运行软件,控制 3~5滴/秒的滴速,采集的pH变化曲线如图2。
第2步:取新制的氢氧化钠溶液15 mL,重复第1步操作,采集的pH变化曲线如图3。
第3步:取碳酸钠溶液15 mL,重复第1步操作,采集的pH变化曲线如
图4。
(4)图3中C点时,对应烧杯中溶液含有的溶质为_____________________
________。
HCl、NaCl(或氯化氢、氯化钠)
(5)对比曲线,证明该瓶敞口放置的氢氧化钠溶液已部分变质,依据是________________________________________________________________________________________________________________。
图2的AB段与图3开始段曲线相似,说明该溶液中含有氢氧化钠,图2的CH段与图4的AF段曲线相似,说明样品溶液中有碳酸钠
【探究2】探究该瓶氢氧化钠溶液的变质程度
第1步: 如图5(夹持仪器已略去),取20 g该瓶敞口放置的氢氧化钠溶液。第2步: 滴加质量分数为8.5%(密度为1.04 g/mL)的稀盐酸,边滴加边振荡,直到恰好没有气泡产生为止,共滴加稀盐酸15 mL,天平示数为35.06 g。
(6)该瓶溶液中溶质变质程度为________(精确到0.1%)。
【反思总结】
(7)实验要养成良好习惯,请写一条实验结束后的注意
事项___________________________________。
67.6%
及时盖上瓶塞(或将药品整理归位)
请完成精练本习题
作业:
同课章节目录
