化学人教版(2019)选择性必修1 2.2.3影响化学平衡的因素(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.3影响化学平衡的因素(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 08:47:45 | ||
图片预览







文档简介
(共27张PPT)
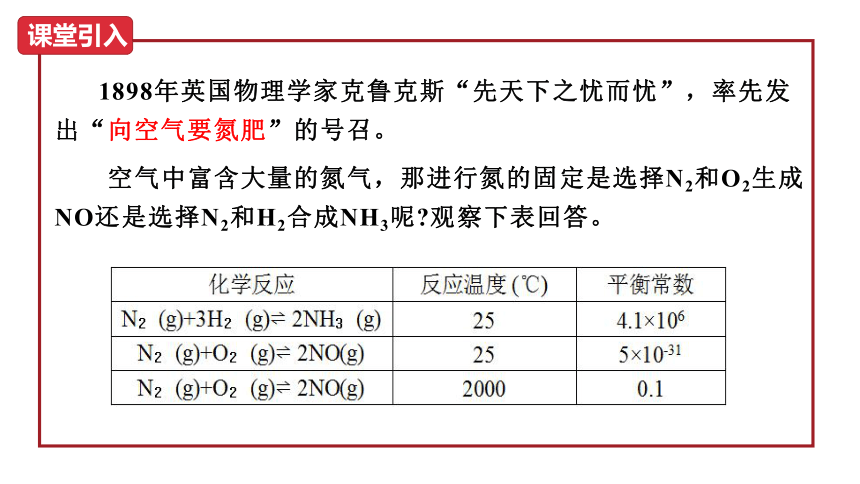
向空气要氮肥
1898年英国物理学家克鲁克斯“先天下之忧而忧”,率先发出“向空气要氮肥”的号召。
空气中富含大量的氮气,那进行氮的固定是选择N2和O2生成NO还是选择N2和H2合成NH3呢 观察下表回答。
课堂引入
在 1904-1905年间,哈伯用陶瓷管做试验,用铁做催化剂,在常压、高温(1020 ℃)达平衡时,气体混合物中含0.012%(容积)的氨。
在当时的情境下,哈伯要想提高氨气在平衡混合气中的含量,可以采取哪些措施?【N (g)+3H (g) 2NH (g)】
课堂引入
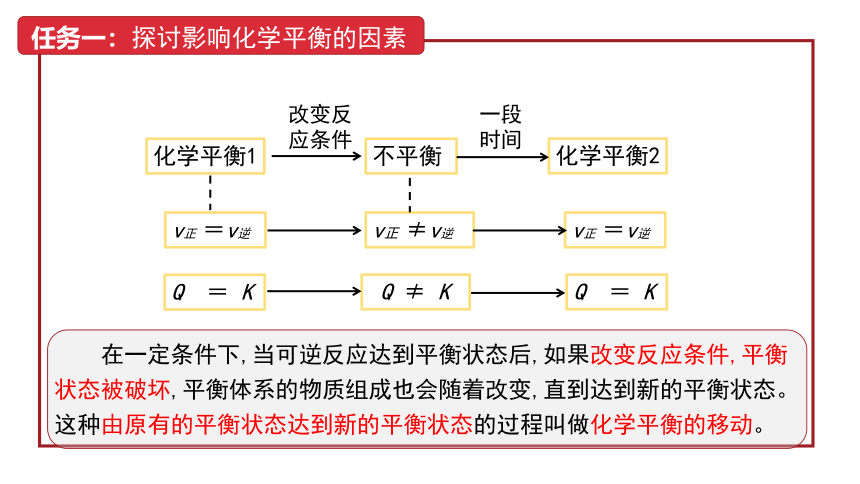
任务一:探讨影响化学平衡的因素
化学平衡1
v正 =v逆
改变反
应条件
不平衡
v正 ≠v逆
一段时间
化学平衡2
在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
Q = K
Q ≠ K
v正 =v逆
Q = K
回忆
通过改变哪些反应条件可使v正 ≠v逆,从而改变化学平衡状态?
影响化学反应速率的因素:
浓度、压强、温度、催化剂
任务二:探讨如何提高氨的百分含量
活动一
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
黄色
变量控制:温度等其他因素不变,只改变一种物质的浓度。
如何增加反应物的浓度?
如何减小反应物的浓度?
滴加饱和FeCl3溶液或
高浓度的KSCN溶液
加入铁粉降低Fe3+浓度
保持溶液总体积(基本)不变,使其他粒子浓度不变
探究浓度对化学平衡的影响
加入少量铁粉
滴入4滴 1 mol·L-1 KSCN 溶液
实验操作
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b、c三支试管中
a
b
c
对照组
溶液总体积基本不变
活动一
探究浓度对化学平衡的影响
任务二:探讨如何提高氨的百分含量
加入少量铁粉
实验现象
a
c
对照组
b
红色加深
红色变浅
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
滴入4滴 1 mol·L-1 KSCN 溶液
平衡后均分在a、b、c三支试管中
活动一
探究浓度对化学平衡的影响
请用平衡常数分析浓度对化学平衡移动的影响:
①减小c(生成物)
增大c(反应物)
平衡向 方向移动
②减小c(反应物)
增大c(生成物)
平衡向 方向移动
活动一
探究浓度对化学平衡的影响
Q ,Q K
Q ,Q K
试管编号 b c
操作 少量铁粉 4滴 1 mol·L-1 KSCN
现象 溶液红色明显变浅 溶液红色明显加深
结论
实验结论:
其他条件不变时,减小反应物的浓度,平衡向逆反应方向移动。
其他条件不变时,增大反应物的浓度,平衡向正反应方向移动
活动一
探究浓度对化学平衡的影响
结论1
其他条件不变时:
增大反应物的浓度,平衡向正反应方向移动。
减小反应物的浓度,平衡向逆反应方向移动。
思考:
增大生成物的浓度,平衡向 方向移动。
减小生成物的浓度,平衡向 方向移动。
逆反应
正反应
评价一
思考:
为了提高H2 的利用率,可采用什么措施?
N (g)+3H (g) 2NH (g)
温馨提示:在工业生产中,适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高的原料的转化率,从而降低生产成本。
任务二:探讨如何提高氨的百分含量
活动二
探究压强对化学平衡的影响
压强的改变,可能影响反应体系中多种物质的浓度。如果增大压强(缩小容积)或者减小压强(增大容积)以下反应将会向着哪个方向移动?
2NO2(g) N2O4(g)
红棕色
无色
任务二:探讨如何提高氨的百分含量
活动二
探究压强对化学平衡的影响
实验操作:用50 mL注射器抽入20 mL NO2和N2O4混合气体,将细管端用橡胶塞封闭。将针筒活塞从20mL处迅速拉至 40 mL处(压强减小),观察颜色变化。
2NO2(g) N2O4(g)
红棕色
无色
结论2
对有气体参加的可逆反应,当达到平衡时,其他条件不变的情况下:
增大压强,化学平衡向气体体积 的反应方向移动;
减小压强,化学平衡向气体体积 的反应方向移动。
其他条件不变的情况下:
增大压强,化学平衡向正反应反应方向移动;
减小压强,化学平衡向逆反应反应方向移动。
减小
增大
2NO2(g) N2O4(g)
评价二
思考:
对于工业合成氨,为了提高NH3 的百分含量,可采用低压还是高压?
N (g)+3H (g) 2NH (g)
任务二:探讨如何提高氨的百分含量
活动三
探究温度对化学平衡的影响
实验操作:把二氧化氮球(NO2和N2O4的混合气体)的一端浸泡在热水中,另一端浸泡在冷水中。观察气体颜色的变化。
结论3
其他条件不变的情况下:
升高温度,化学平衡向 反应方向移动;
降低温度,化学平衡向 反应方向移动。
其他条件不变的情况下:
升高温度,化学平衡向逆反应反应方向移动;
降低温度,化学平衡向正反应反应方向移动。
吸热
放热
2NO2(g) N2O4(g) ΔH<0
评价三
思考:
对于工业合成氨,为了提高NH3 的百分含量,可采用低温还是高温?
N (g)+3H (g) 2NH (g) ΔH=-92.4kJ/mol
任务二:探讨如何提高氨的百分含量
活动四
分析催化剂对化学平衡的影响
思考:加入催化剂会使化学平衡发生移动吗?
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
评价四
思考:
对于工业合成氨,加入催化剂能否增大NH3的百分含量?
N (g)+3H (g) 2NH (g)
整理与归纳
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度 向吸热反应方向
降低温度 向放热反应方向
向反应物浓度减少的方向
向反应物浓度增大的方向
向压强减小的方向
向压强增大的方向
向温度降低的方向
向温度升高的方向
总结
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。
这就是勒夏特列原理,也称化学平衡移动原理。
勒夏特列
勒夏特列原理
(1850—1936)
实际工业
自1784年发现氨以后,人们一直在研究如何利用化学反应由氮气和氢气合成氨,但直到1913年才实现了合成氨的工业化生产,经过研究人员的努力,几十年后建造了日产氨1000顿的大型装置。
发展
现代工艺发展之一:有两位希腊化学家发明在常压下把氢气和用氨稀释的氮气分别通人一个加热到570℃的电解池中,氢和氮在电极上就合成了氨,而且转化率达到78%
现代工艺发展之二:利用生物燃料电池原理研究室温下条件温和氨的合成法,电池工作时MW'/MV"在电极与酶之间传递电子。
现代工艺发展之三:2016年,中国科学院大连化学物理研究所的氢化物材料化学研究团队提出了一种以碱(土)金属亚氨基化合物为氮载体的低温化学合成氨技术,可在常压和 100C的条件下实现氨的合成。在 250℃下,该过程的产氨速率约大于高活性Cs-Ru/Mg0 催化过程一个数量级。这是近年来合成氨反应研究中的重要突破,为发展节能的催化剂提供了新的思路
科学发展一直在路上!
向空气要氮肥
1898年英国物理学家克鲁克斯“先天下之忧而忧”,率先发出“向空气要氮肥”的号召。
空气中富含大量的氮气,那进行氮的固定是选择N2和O2生成NO还是选择N2和H2合成NH3呢 观察下表回答。
课堂引入
在 1904-1905年间,哈伯用陶瓷管做试验,用铁做催化剂,在常压、高温(1020 ℃)达平衡时,气体混合物中含0.012%(容积)的氨。
在当时的情境下,哈伯要想提高氨气在平衡混合气中的含量,可以采取哪些措施?【N (g)+3H (g) 2NH (g)】
课堂引入
任务一:探讨影响化学平衡的因素
化学平衡1
v正 =v逆
改变反
应条件
不平衡
v正 ≠v逆
一段时间
化学平衡2
在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
Q = K
Q ≠ K
v正 =v逆
Q = K
回忆
通过改变哪些反应条件可使v正 ≠v逆,从而改变化学平衡状态?
影响化学反应速率的因素:
浓度、压强、温度、催化剂
任务二:探讨如何提高氨的百分含量
活动一
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
黄色
变量控制:温度等其他因素不变,只改变一种物质的浓度。
如何增加反应物的浓度?
如何减小反应物的浓度?
滴加饱和FeCl3溶液或
高浓度的KSCN溶液
加入铁粉降低Fe3+浓度
保持溶液总体积(基本)不变,使其他粒子浓度不变
探究浓度对化学平衡的影响
加入少量铁粉
滴入4滴 1 mol·L-1 KSCN 溶液
实验操作
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b、c三支试管中
a
b
c
对照组
溶液总体积基本不变
活动一
探究浓度对化学平衡的影响
任务二:探讨如何提高氨的百分含量
加入少量铁粉
实验现象
a
c
对照组
b
红色加深
红色变浅
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
滴入4滴 1 mol·L-1 KSCN 溶液
平衡后均分在a、b、c三支试管中
活动一
探究浓度对化学平衡的影响
请用平衡常数分析浓度对化学平衡移动的影响:
①减小c(生成物)
增大c(反应物)
平衡向 方向移动
②减小c(反应物)
增大c(生成物)
平衡向 方向移动
活动一
探究浓度对化学平衡的影响
Q ,Q K
Q ,Q K
试管编号 b c
操作 少量铁粉 4滴 1 mol·L-1 KSCN
现象 溶液红色明显变浅 溶液红色明显加深
结论
实验结论:
其他条件不变时,减小反应物的浓度,平衡向逆反应方向移动。
其他条件不变时,增大反应物的浓度,平衡向正反应方向移动
活动一
探究浓度对化学平衡的影响
结论1
其他条件不变时:
增大反应物的浓度,平衡向正反应方向移动。
减小反应物的浓度,平衡向逆反应方向移动。
思考:
增大生成物的浓度,平衡向 方向移动。
减小生成物的浓度,平衡向 方向移动。
逆反应
正反应
评价一
思考:
为了提高H2 的利用率,可采用什么措施?
N (g)+3H (g) 2NH (g)
温馨提示:在工业生产中,适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高的原料的转化率,从而降低生产成本。
任务二:探讨如何提高氨的百分含量
活动二
探究压强对化学平衡的影响
压强的改变,可能影响反应体系中多种物质的浓度。如果增大压强(缩小容积)或者减小压强(增大容积)以下反应将会向着哪个方向移动?
2NO2(g) N2O4(g)
红棕色
无色
任务二:探讨如何提高氨的百分含量
活动二
探究压强对化学平衡的影响
实验操作:用50 mL注射器抽入20 mL NO2和N2O4混合气体,将细管端用橡胶塞封闭。将针筒活塞从20mL处迅速拉至 40 mL处(压强减小),观察颜色变化。
2NO2(g) N2O4(g)
红棕色
无色
结论2
对有气体参加的可逆反应,当达到平衡时,其他条件不变的情况下:
增大压强,化学平衡向气体体积 的反应方向移动;
减小压强,化学平衡向气体体积 的反应方向移动。
其他条件不变的情况下:
增大压强,化学平衡向正反应反应方向移动;
减小压强,化学平衡向逆反应反应方向移动。
减小
增大
2NO2(g) N2O4(g)
评价二
思考:
对于工业合成氨,为了提高NH3 的百分含量,可采用低压还是高压?
N (g)+3H (g) 2NH (g)
任务二:探讨如何提高氨的百分含量
活动三
探究温度对化学平衡的影响
实验操作:把二氧化氮球(NO2和N2O4的混合气体)的一端浸泡在热水中,另一端浸泡在冷水中。观察气体颜色的变化。
结论3
其他条件不变的情况下:
升高温度,化学平衡向 反应方向移动;
降低温度,化学平衡向 反应方向移动。
其他条件不变的情况下:
升高温度,化学平衡向逆反应反应方向移动;
降低温度,化学平衡向正反应反应方向移动。
吸热
放热
2NO2(g) N2O4(g) ΔH<0
评价三
思考:
对于工业合成氨,为了提高NH3 的百分含量,可采用低温还是高温?
N (g)+3H (g) 2NH (g) ΔH=-92.4kJ/mol
任务二:探讨如何提高氨的百分含量
活动四
分析催化剂对化学平衡的影响
思考:加入催化剂会使化学平衡发生移动吗?
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
评价四
思考:
对于工业合成氨,加入催化剂能否增大NH3的百分含量?
N (g)+3H (g) 2NH (g)
整理与归纳
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度 向吸热反应方向
降低温度 向放热反应方向
向反应物浓度减少的方向
向反应物浓度增大的方向
向压强减小的方向
向压强增大的方向
向温度降低的方向
向温度升高的方向
总结
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。
这就是勒夏特列原理,也称化学平衡移动原理。
勒夏特列
勒夏特列原理
(1850—1936)
实际工业
自1784年发现氨以后,人们一直在研究如何利用化学反应由氮气和氢气合成氨,但直到1913年才实现了合成氨的工业化生产,经过研究人员的努力,几十年后建造了日产氨1000顿的大型装置。
发展
现代工艺发展之一:有两位希腊化学家发明在常压下把氢气和用氨稀释的氮气分别通人一个加热到570℃的电解池中,氢和氮在电极上就合成了氨,而且转化率达到78%
现代工艺发展之二:利用生物燃料电池原理研究室温下条件温和氨的合成法,电池工作时MW'/MV"在电极与酶之间传递电子。
现代工艺发展之三:2016年,中国科学院大连化学物理研究所的氢化物材料化学研究团队提出了一种以碱(土)金属亚氨基化合物为氮载体的低温化学合成氨技术,可在常压和 100C的条件下实现氨的合成。在 250℃下,该过程的产氨速率约大于高活性Cs-Ru/Mg0 催化过程一个数量级。这是近年来合成氨反应研究中的重要突破,为发展节能的催化剂提供了新的思路
科学发展一直在路上!
