化学人教版(2019)选择性必修1 2.4化学反应的调控(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 29.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 09:52:53 | ||
图片预览






文档简介
(共21张PPT)
巴以冲突
1898年英国物理学家克鲁克斯“先天下之忧而忧”,率先发出“向空气要氮肥”的号召,从此从此科学家们前仆后继展开了向空气要氮肥的研究…………
重走固氮路 共圆科学梦
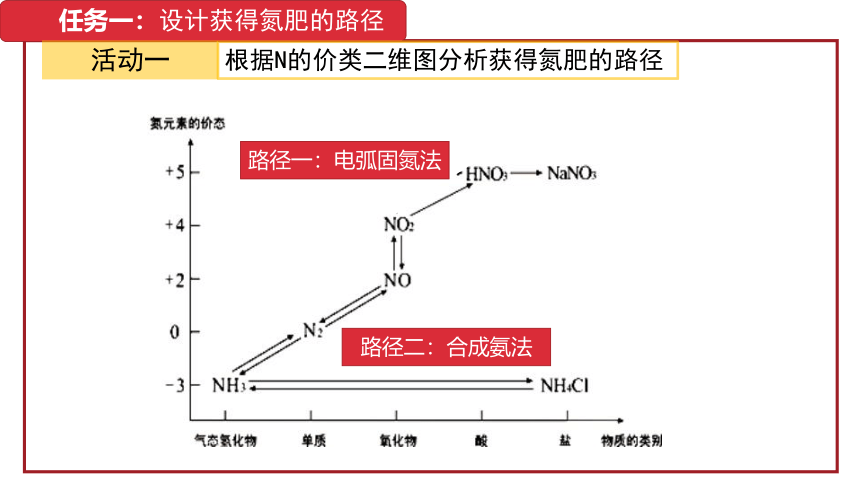
任务一:设计获得氮肥的路径
路径一:电弧固氮法
路径二:合成氨法
活动一
根据N的价类二维图分析获得氮肥的路径
途径一:N2(g)+O2(g)==2NO(g)
△H= +180.5KJ·mol-1 △S =+247.7J·K-1·mol-1
途径二:N2(g)+3H2(g) 2NH3(g)
△H= -92.4KJ·mol-1 △S = -198.2J·K-1·mol-1
任务一:设计获得氮肥的路径
活动二
利用已知知识分析两种固氮的自发性
高温自发
低温自发
资料一
卡文迪许已经发现用电火花可以让空气中的氧气和氮气化合成一氧化氮,但在那个只有直流电的世界里,这种电化学的投入与产出不成正比。
当时的化学理论已经发现了可逆反应,有了勒夏特列定律做指导。哈伯开始想,如果氨可以在高温下分解,那么氢气和氮气也可以在高温下生成氨气。
任务一:设计获得氮肥的路径
活动三
分析获得氮肥的最佳路径
途径一:N2(g)+O2(g)==2NO(g) K=5×10-31
途径二:N2(g)+3H2(g) 2NH3(g) K=4.1×108
资料二
在理论知识武装下,1904年德国化学家哈伯向合成氨发起冲击。期间,因为实验比较困难,从氮和氢中生成的氨比较少,哈伯对这项研究逐渐没有了希望,便打算放弃。
科学家在研究中遭遇失败与当时物理化学理论不成熟、缺乏理论指导有很大的关系。当后来热力学中关于活化能、化学平衡常数等理论建立起来的时候,人们重新计算这两个反应的化学平衡常数,有了新发现。
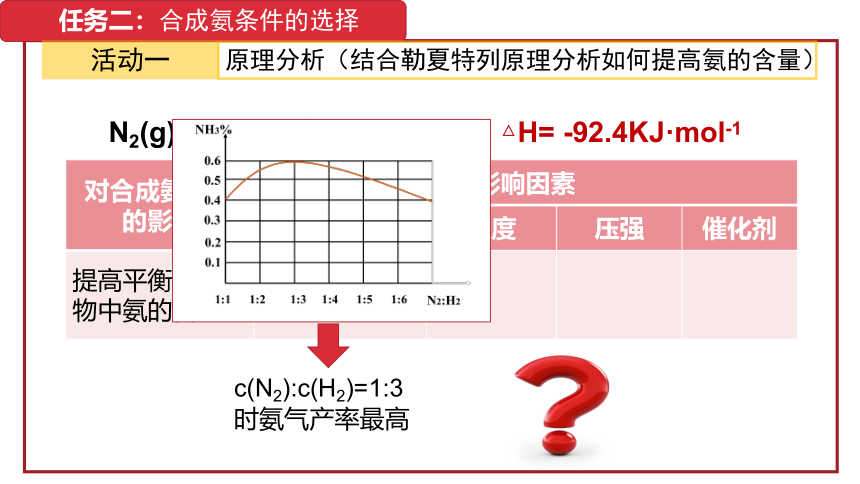
任务二:合成氨条件的选择
活动一
原理分析(结合勒夏特列原理分析如何提高氨的含量)
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
提高平衡混合物中氨的含量 增大反应物浓度、减小生成物浓度 低温 高压 无影响
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ·mol-1
c(N2):c(H2)=1:3时氨气产率最高
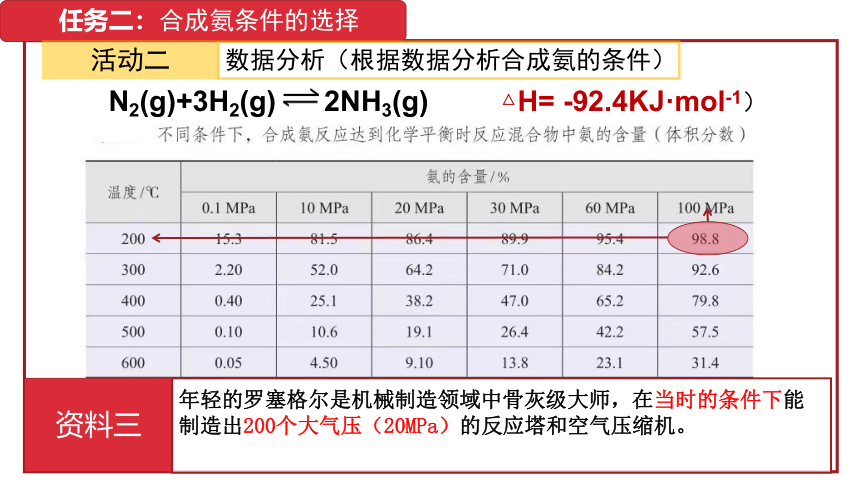
任务二:合成氨条件的选择
活动二
数据分析(根据数据分析合成氨的条件)
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ·mol-1)
资料三
年轻的罗塞格尔是机械制造领域中骨灰级大师,在当时的条件下能制造出200个大气压(20MPa)的反应塔和空气压缩机。
压强的选择必须要考虑设备的抗压能力。
任务二:合成氨条件的选择
活动三
从速率角度考虑合成氨选择的条件
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
资料四
计算表明:温度每升高10℃,速率加快2—4倍。(若在500℃下年产氨量30万吨的工厂,将温度降为200℃,年产量最多为300克。)
速率和限度是工业生产需要考虑的两大核心因素,我们需要统筹兼顾,当二者发生矛盾时,优先调控反应速率。
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率 增大反应物 浓度 高温 高压 加入催化剂
任务二:合成氨条件的选择
活动四
确定合成氨条件,投入生产
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
资料五
哈伯通过理论计算后,表明让氢和氮在600℃和20MPa大气压力下进行反应,大约可以生成8%的氨,提出了提高氨产率的三项措施:
(1)高压条件;(2)不断把产品氨从反应器中分离出去;(3)选择高效催化剂加快反应速率。
为了寻找合适的催化剂,哈伯和助手们试验了数百种金属及其化合物,发现金属锇的活性最好。
1908年,哈伯在175—200个大气压力下和500—600℃时,利用金属锇作催化剂,氢和氮反应能产生6%左右的氨。
任务三:工业合成氨条件的控制
活动一
如何降低反应成本
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
降低原料成本
提高原料转化率
加快反应速率
锦囊妙计1:
采用水煤气(主要成分为H2和CO)作为氢气的来源
氮气由液化空气分离法提供
锦囊妙计2:
将氮气和氢气循环利用
将生成的氨气及时分离出去
锦囊妙计3:
实验表明,在特定条件下,合成氨反应的速率与参与反应的物质的浓度的关系式为ν =κc(N2)c1.5(H2)c-1(NH3),精囊妙计2中的措施能否加快反应速率。
任务三:工业合成氨条件的控制
活动二
寻找高效稳定的催化剂
资料六
粉末状的锇是一种贵金属,储量较少,常温下会逐渐氧化成四氧化锇。锇蒸气有剧毒,强烈刺激人眼黏膜,严重时会造成失明。
试验了2500种配方,进行了6500次实验
铁触媒做催化剂
哈伯
奥斯特瓦尔德
博施
博施
用金属锇做催化剂
用铁丝做催化剂
用铁直接催化N2和H2不产生氨
条件 Ea /kJ/mol k(催)/k(无)
无催化剂 335 3.4×1012(700k)
使用铁催化剂 167 铁触媒催化能力
200
400
600
800
铁触媒催化能力
200
400
600
800
任务三:工业合成氨条件的控制
活动三
开发适合高温、高压的合成设备
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
资料七
高温、高压条件下,氢气使钢脱碳,导致“氢腐蚀”。“氢腐蚀”有两种形式:
(1)氢气与钢表面的碳结合,引起表面脱碳,使机械性能恶化;
(2)氢气渗透到钢材内部,与碳化合生成甲烷,在刚才内部造成裂纹。
博施发明“双层反应塔”
在当时的情况下,博施对反应塔内壁进行了改良
(1)采用含碳量极低的熟铁作为反应塔的衬里,但高压的情况还是不能避免H2从熟铁衬里逸出
(2)在熟铁衬里和钢壁上开出许多小孔,让氢气逸出——双层塔终于诞生
任务三:工业合成氨条件的控制
活动四
分析科技的发展对合成氨的影响
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
合成氨反应并不是简单和直观的,埃尔特根据实验绘制了如上反应过程能量图。根据如上图像,分析哪一步是决速步?如何加快决速步的反应速率。
合成氨反应是在催化剂表面进行的。根据埃特尔的研究,这一过程主要经历了以下几个步骤:
扩散
吸附
断键解离
表面反应
脱附
工业生产通过提高N2的含量来提高N2的吸附速率,使反应速率增大,所以实际生产时N2、H2物质的量之比为
1 : 2.8。
归纳总结
外部条件 工业合成氨的适宜条件
压强
温度
催化剂
浓度
根据反应器可使用的钢材质量及综合指标来选择压强
适宜温度
700K左右
使用铁触媒作催化剂
N2和H2的物质的量比为1:2.8的投料比, 氨及时从混合气中分离出去
实际工业简要流程
造气、净化、合成氨
防催化剂中毒
净化
压缩
合成
分离
H2 : N2
(2.8:1)
造气
液氨
N2和H2循环利用
冷凝
总结
“合成氨”中的诺贝尔奖
迄今为止,Nobel奖曾3次颁发给合成氨相关领域的科学家。
1918
Fritz Haber
弗里茨·哈伯
1931
Carl Bosch
卡尔·博施
2007
Gerhard Ertl
格哈德·埃特尔
“合成氨”中的中国人:
2016年,中国科学院大连化学物理研究所的研究团队研制了一种新型催化剂,将合成氨的温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破,为发展节能的催化剂提供了新的思路。
时代需要我们
气候变化是当今人类面临的重大全球性挑战。我国为了积极应对气候变化于2020年9月提出碳达峰、碳中和。作为一名化学人,我们又能怎么做呢?
巴以冲突
1898年英国物理学家克鲁克斯“先天下之忧而忧”,率先发出“向空气要氮肥”的号召,从此从此科学家们前仆后继展开了向空气要氮肥的研究…………
重走固氮路 共圆科学梦
任务一:设计获得氮肥的路径
路径一:电弧固氮法
路径二:合成氨法
活动一
根据N的价类二维图分析获得氮肥的路径
途径一:N2(g)+O2(g)==2NO(g)
△H= +180.5KJ·mol-1 △S =+247.7J·K-1·mol-1
途径二:N2(g)+3H2(g) 2NH3(g)
△H= -92.4KJ·mol-1 △S = -198.2J·K-1·mol-1
任务一:设计获得氮肥的路径
活动二
利用已知知识分析两种固氮的自发性
高温自发
低温自发
资料一
卡文迪许已经发现用电火花可以让空气中的氧气和氮气化合成一氧化氮,但在那个只有直流电的世界里,这种电化学的投入与产出不成正比。
当时的化学理论已经发现了可逆反应,有了勒夏特列定律做指导。哈伯开始想,如果氨可以在高温下分解,那么氢气和氮气也可以在高温下生成氨气。
任务一:设计获得氮肥的路径
活动三
分析获得氮肥的最佳路径
途径一:N2(g)+O2(g)==2NO(g) K=5×10-31
途径二:N2(g)+3H2(g) 2NH3(g) K=4.1×108
资料二
在理论知识武装下,1904年德国化学家哈伯向合成氨发起冲击。期间,因为实验比较困难,从氮和氢中生成的氨比较少,哈伯对这项研究逐渐没有了希望,便打算放弃。
科学家在研究中遭遇失败与当时物理化学理论不成熟、缺乏理论指导有很大的关系。当后来热力学中关于活化能、化学平衡常数等理论建立起来的时候,人们重新计算这两个反应的化学平衡常数,有了新发现。
任务二:合成氨条件的选择
活动一
原理分析(结合勒夏特列原理分析如何提高氨的含量)
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
提高平衡混合物中氨的含量 增大反应物浓度、减小生成物浓度 低温 高压 无影响
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ·mol-1
c(N2):c(H2)=1:3时氨气产率最高
任务二:合成氨条件的选择
活动二
数据分析(根据数据分析合成氨的条件)
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ·mol-1)
资料三
年轻的罗塞格尔是机械制造领域中骨灰级大师,在当时的条件下能制造出200个大气压(20MPa)的反应塔和空气压缩机。
压强的选择必须要考虑设备的抗压能力。
任务二:合成氨条件的选择
活动三
从速率角度考虑合成氨选择的条件
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
资料四
计算表明:温度每升高10℃,速率加快2—4倍。(若在500℃下年产氨量30万吨的工厂,将温度降为200℃,年产量最多为300克。)
速率和限度是工业生产需要考虑的两大核心因素,我们需要统筹兼顾,当二者发生矛盾时,优先调控反应速率。
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率 增大反应物 浓度 高温 高压 加入催化剂
任务二:合成氨条件的选择
活动四
确定合成氨条件,投入生产
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
资料五
哈伯通过理论计算后,表明让氢和氮在600℃和20MPa大气压力下进行反应,大约可以生成8%的氨,提出了提高氨产率的三项措施:
(1)高压条件;(2)不断把产品氨从反应器中分离出去;(3)选择高效催化剂加快反应速率。
为了寻找合适的催化剂,哈伯和助手们试验了数百种金属及其化合物,发现金属锇的活性最好。
1908年,哈伯在175—200个大气压力下和500—600℃时,利用金属锇作催化剂,氢和氮反应能产生6%左右的氨。
任务三:工业合成氨条件的控制
活动一
如何降低反应成本
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
降低原料成本
提高原料转化率
加快反应速率
锦囊妙计1:
采用水煤气(主要成分为H2和CO)作为氢气的来源
氮气由液化空气分离法提供
锦囊妙计2:
将氮气和氢气循环利用
将生成的氨气及时分离出去
锦囊妙计3:
实验表明,在特定条件下,合成氨反应的速率与参与反应的物质的浓度的关系式为ν =κc(N2)c1.5(H2)c-1(NH3),精囊妙计2中的措施能否加快反应速率。
任务三:工业合成氨条件的控制
活动二
寻找高效稳定的催化剂
资料六
粉末状的锇是一种贵金属,储量较少,常温下会逐渐氧化成四氧化锇。锇蒸气有剧毒,强烈刺激人眼黏膜,严重时会造成失明。
试验了2500种配方,进行了6500次实验
铁触媒做催化剂
哈伯
奥斯特瓦尔德
博施
博施
用金属锇做催化剂
用铁丝做催化剂
用铁直接催化N2和H2不产生氨
条件 Ea /kJ/mol k(催)/k(无)
无催化剂 335 3.4×1012(700k)
使用铁催化剂 167 铁触媒催化能力
200
400
600
800
铁触媒催化能力
200
400
600
800
任务三:工业合成氨条件的控制
活动三
开发适合高温、高压的合成设备
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
资料七
高温、高压条件下,氢气使钢脱碳,导致“氢腐蚀”。“氢腐蚀”有两种形式:
(1)氢气与钢表面的碳结合,引起表面脱碳,使机械性能恶化;
(2)氢气渗透到钢材内部,与碳化合生成甲烷,在刚才内部造成裂纹。
博施发明“双层反应塔”
在当时的情况下,博施对反应塔内壁进行了改良
(1)采用含碳量极低的熟铁作为反应塔的衬里,但高压的情况还是不能避免H2从熟铁衬里逸出
(2)在熟铁衬里和钢壁上开出许多小孔,让氢气逸出——双层塔终于诞生
任务三:工业合成氨条件的控制
活动四
分析科技的发展对合成氨的影响
N2(g)+3H2(g) 2NH3(g) △H= -92.2KJ·mol-1)
合成氨反应并不是简单和直观的,埃尔特根据实验绘制了如上反应过程能量图。根据如上图像,分析哪一步是决速步?如何加快决速步的反应速率。
合成氨反应是在催化剂表面进行的。根据埃特尔的研究,这一过程主要经历了以下几个步骤:
扩散
吸附
断键解离
表面反应
脱附
工业生产通过提高N2的含量来提高N2的吸附速率,使反应速率增大,所以实际生产时N2、H2物质的量之比为
1 : 2.8。
归纳总结
外部条件 工业合成氨的适宜条件
压强
温度
催化剂
浓度
根据反应器可使用的钢材质量及综合指标来选择压强
适宜温度
700K左右
使用铁触媒作催化剂
N2和H2的物质的量比为1:2.8的投料比, 氨及时从混合气中分离出去
实际工业简要流程
造气、净化、合成氨
防催化剂中毒
净化
压缩
合成
分离
H2 : N2
(2.8:1)
造气
液氨
N2和H2循环利用
冷凝
总结
“合成氨”中的诺贝尔奖
迄今为止,Nobel奖曾3次颁发给合成氨相关领域的科学家。
1918
Fritz Haber
弗里茨·哈伯
1931
Carl Bosch
卡尔·博施
2007
Gerhard Ertl
格哈德·埃特尔
“合成氨”中的中国人:
2016年,中国科学院大连化学物理研究所的研究团队研制了一种新型催化剂,将合成氨的温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破,为发展节能的催化剂提供了新的思路。
时代需要我们
气候变化是当今人类面临的重大全球性挑战。我国为了积极应对气候变化于2020年9月提出碳达峰、碳中和。作为一名化学人,我们又能怎么做呢?
