1.1原子结构第一课时课件(共25张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1原子结构第一课时课件(共25张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 08:48:47 | ||
图片预览







文档简介
(共25张PPT)
第一节 原子结构
第1课时:能层与能级
基态与激发态 原子光谱
第一章 原子结构与性质
学习目标
1.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2.知道电子运动的能量状态,具有量子化的特征。能从电子跃迁角度初步解释原子光谱的形成,强化“结构决定性质”的观念。电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
新课导入
比尔盖茨的实体版元素周期表
推荐观看纪录片
BBC 《化学史》三集
BBC 《原子》 三集
推荐阅读书籍
《上帝掷骰子吗》
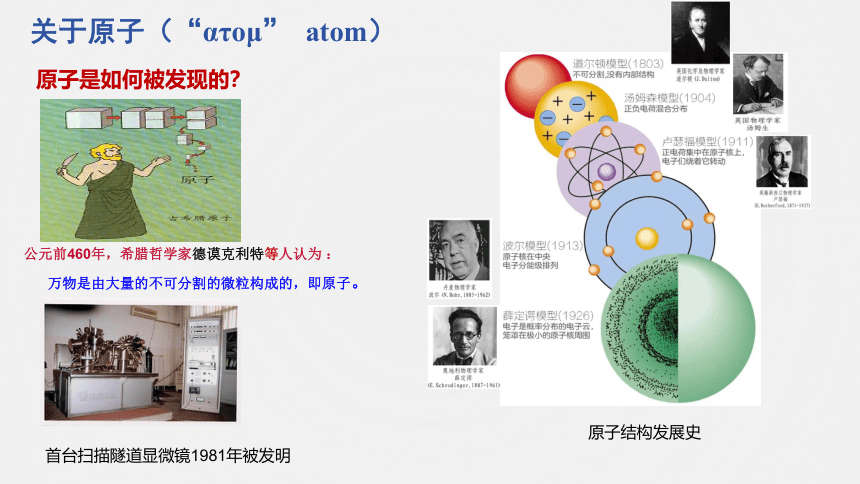
关于原子(“ατομ” atom)
原子是如何被发现的?
公元前460年,希腊哲学家德谟克利特等人认为 :
万物是由大量的不可分割的微粒构成的,即原子。
原子结构发展史
首台扫描隧道显微镜1981年被发明
原子看不见,道尔顿是怎么知道的?
证据+推理
证据一:质量守恒定律
联想
在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。
质量守恒定律是俄国科学家罗蒙诺索夫于1756年最早发现的。
积木不变
房屋在变
表明物质在化学反应时以某种方式重组,得到了具有新的性质的新的物质
证据二:定比定律:化合物都有确定的组成,又称为定组成定律。
屋顶上的铜绿
实验室制取的碱式碳酸铜
天然矿石
57.48%Cu
5.43%C
0.91%H
36.18%O
不管来源是什么,碱式碳酸铜都有相同的组成
一种纯净的化合物,无论它的来源如何,无论用何种方法测定,他的组分元素的质量都有一定的比例
确定的质量比意味着?
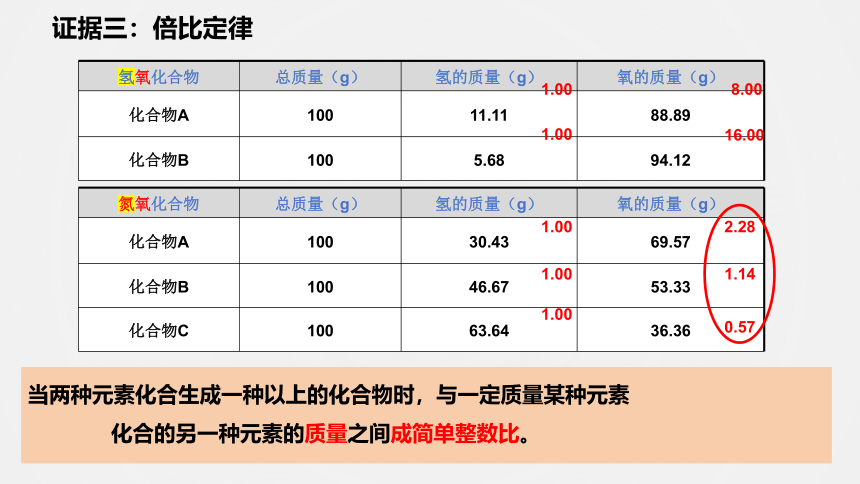
当两种元素化合生成一种以上的化合物时,与一定质量某种元素
化合的另一种元素的质量之间成简单整数比。
氢氧化合物 总质量(g) 氢的质量(g) 氧的质量(g)
化合物A 100 11.11 88.89
化合物B 100 5.68 94.12
氮氧化合物 总质量(g) 氢的质量(g) 氧的质量(g)
化合物A 100 30.43 69.57
化合物B 100 46.67 53.33
化合物C 100 63.64 36.36
1.00
1.00
8.00
16.00
1.00
1.00
1.00
2.28
1.14
0.57
证据三:倍比定律
原子看不见,是怎么知道的?
整数 :用来数“物体”的数目。
“物体”:拥有确定且相同质量的各微粒。
“微粒”:可称为原子
早期原子分子论
1. 每种元素都是由微小的、相同的粒子组成,称为原子。
2. 单一元素的所有原子都有相同的特征质量。
3. 这些原子的质量在化学反应中不会发生变化。
4. 每种化合物都是由相同的分子构成,即由原子间通过简单整数比形成的相同的微粒。
哲学思辨
基于实证,科学理论
葡萄干面包模型
1897年,汤姆生通过阴极射线的偏转实验在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
1911年,卢瑟福通过精密的
α粒子轰击金箔实验证明在原子中心有一个极小的核,电子绕核做高速旋转。
核式(行星太阳)模型
1904年
1911年
原子模型的发展
卢瑟福的核式结构“困境”
1. 原子的稳定性
经典物理学中指出,任何带电粒子在做加速运动的过程中都要以发射电磁波的方式放出能量,以致轨道半径越来越小,最后消失在原子核中,并导致原子坍缩。
事实上原子的结构十分稳定
2. 原子的线性光谱
*光是一种电磁波。光是能量的一种形式。
氢原子的光谱不是连续的,而是线性的,在可见光区有4条谱线
1913年
电子分层排布模型
丹麦科学家
玻尔
研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型基本假设
玻尔的原子模型
能量的量子化
位置和能量是连续的
位置和能量是不连续的
氢原子的能级图
Hδ
Hγ
Hβ
Hα
H
可见光光子的能量范围为:1.62eV~3.11eV
原子光谱
通常,电子处在能量最低的轨道(基态)上运动;
电子在高能量轨道(激发态)上运动
吸收
能量
释放能量
每一次跃迁(辐射或吸收)的能量以光的形式产生一条分立的谱线,被记录下来,
就形成了光谱。
跃迁
吸收光谱
发射光谱
暗色背景,亮谱线
亮色背景,暗谱线
激发态
K
L
M
N
能量
基态
原子光谱
通常,电子处在能量最低的轨道(基态)上运动;
电子在高能量轨道(激发态)上运动
吸收
能量
释放能量
焰火
霓虹灯光
激光
LED灯光
学生活动:阅读教材P8第一自然段和图1-4,回答以下问题:
2.原子光谱的应用:
3.光谱分析的定义:
鉴定元素,发现新元素
例如:铯(1860年)和铷(1861年),其光谱图中有特征的蓝光和红光,它们的拉丁文名称由此得名。又如,稀有气体氦的原意是“太阳元素”,是1868年分析太阳光谱发现的,最初人们以为它只存在于太阳,后来才在地球上发现。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
1.电子跃迁属于物理变化还是化学变化?
电子的跃迁是物理变化(未发生电子转移)
1913年
电子分层排布模型
丹麦科学家
玻尔
研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型基本假设
(1)原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。
核外电子在原子轨道上运动时,既不辐射能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。能量最低的
状态叫做基态,其他状态叫激发态。
(3)电子在能量不同的轨道上发生跃迁时,才会辐射或吸收能量,形成光谱。
玻尔获得了1922年的诺贝尔物理学奖
玻尔的原子模型
玻尔原子模型只限于解释氢原子或类氢原子(单电子)的光谱
无法较好解释多电子原子的光谱。
电子云模型
(1927~1935年)
现代物质结构学说。 [电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道]
氢原子电子云图
(量子力学模型)
人类认识原子的历史是漫长的,也是无止境的。
对应训练
【典例1】下列现象和应用与电子跃迁无关的是( )
A.激光 B.焰色试验 C.缓慢氧化放热 D.霓虹灯
【解析】 电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化,如激光、焰色试验、霓虹灯都与电子跃迁有关。激光与电子跃迁有关,故A错误;当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故B错误;缓慢氧化放热是化学能转化为热能,与电子跃迁无关,故C正确;霓虹灯的各色的光是原子核外电子发生能级跃迁的结果,与电子跃迁有关,故D错误。答案:C
对应训练
【典例2】对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一
现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
【解析】在电流作用下,基态氖原子的电子吸收能量跃迁到较高能级,变为激发态原子,这一过程要吸收能量,不会发出红色光;而电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,从而产生红光,A项正确。答案:A
给原子核外空间分区—能层
能量规律:
原子核外电子总是尽可能先排布在能量较低的能层上,然后由内向外依次排布在能量逐渐升高的电子层。
一般情况下能层越高,电子的能量越高。
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
2×12
2×22
2×32
2×42
2×52
2×62
2×72
2n2
数量规律: 第n层最多可容纳的电子数为2n2
给原子核外空间分区—能层—能级
在多电子原子中,同一能层的电子,能量可能不同,还可以把能层分成不同的能级。
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
s、p、d、f…排序的各能级可容纳的最多电子数依次为 ;
英文字母相同的不同能级中所能容纳的最多电子数 ;
相同
1、3、5、7…的2倍
同一能层,各能级的能量顺序: ;
ns各能级最多容纳的电子数:
用能层能级描述你的位置
幼儿园
小学
初中
高中
大学
高中
二年级
能层——
能级——
【典例】电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取( )
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
【解析】能量E(3d)
第一节 原子结构
第1课时:能层与能级
基态与激发态 原子光谱
第一章 原子结构与性质
学习目标
1.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2.知道电子运动的能量状态,具有量子化的特征。能从电子跃迁角度初步解释原子光谱的形成,强化“结构决定性质”的观念。电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
新课导入
比尔盖茨的实体版元素周期表
推荐观看纪录片
BBC 《化学史》三集
BBC 《原子》 三集
推荐阅读书籍
《上帝掷骰子吗》
关于原子(“ατομ” atom)
原子是如何被发现的?
公元前460年,希腊哲学家德谟克利特等人认为 :
万物是由大量的不可分割的微粒构成的,即原子。
原子结构发展史
首台扫描隧道显微镜1981年被发明
原子看不见,道尔顿是怎么知道的?
证据+推理
证据一:质量守恒定律
联想
在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。
质量守恒定律是俄国科学家罗蒙诺索夫于1756年最早发现的。
积木不变
房屋在变
表明物质在化学反应时以某种方式重组,得到了具有新的性质的新的物质
证据二:定比定律:化合物都有确定的组成,又称为定组成定律。
屋顶上的铜绿
实验室制取的碱式碳酸铜
天然矿石
57.48%Cu
5.43%C
0.91%H
36.18%O
不管来源是什么,碱式碳酸铜都有相同的组成
一种纯净的化合物,无论它的来源如何,无论用何种方法测定,他的组分元素的质量都有一定的比例
确定的质量比意味着?
当两种元素化合生成一种以上的化合物时,与一定质量某种元素
化合的另一种元素的质量之间成简单整数比。
氢氧化合物 总质量(g) 氢的质量(g) 氧的质量(g)
化合物A 100 11.11 88.89
化合物B 100 5.68 94.12
氮氧化合物 总质量(g) 氢的质量(g) 氧的质量(g)
化合物A 100 30.43 69.57
化合物B 100 46.67 53.33
化合物C 100 63.64 36.36
1.00
1.00
8.00
16.00
1.00
1.00
1.00
2.28
1.14
0.57
证据三:倍比定律
原子看不见,是怎么知道的?
整数 :用来数“物体”的数目。
“物体”:拥有确定且相同质量的各微粒。
“微粒”:可称为原子
早期原子分子论
1. 每种元素都是由微小的、相同的粒子组成,称为原子。
2. 单一元素的所有原子都有相同的特征质量。
3. 这些原子的质量在化学反应中不会发生变化。
4. 每种化合物都是由相同的分子构成,即由原子间通过简单整数比形成的相同的微粒。
哲学思辨
基于实证,科学理论
葡萄干面包模型
1897年,汤姆生通过阴极射线的偏转实验在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
1911年,卢瑟福通过精密的
α粒子轰击金箔实验证明在原子中心有一个极小的核,电子绕核做高速旋转。
核式(行星太阳)模型
1904年
1911年
原子模型的发展
卢瑟福的核式结构“困境”
1. 原子的稳定性
经典物理学中指出,任何带电粒子在做加速运动的过程中都要以发射电磁波的方式放出能量,以致轨道半径越来越小,最后消失在原子核中,并导致原子坍缩。
事实上原子的结构十分稳定
2. 原子的线性光谱
*光是一种电磁波。光是能量的一种形式。
氢原子的光谱不是连续的,而是线性的,在可见光区有4条谱线
1913年
电子分层排布模型
丹麦科学家
玻尔
研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型基本假设
玻尔的原子模型
能量的量子化
位置和能量是连续的
位置和能量是不连续的
氢原子的能级图
Hδ
Hγ
Hβ
Hα
H
可见光光子的能量范围为:1.62eV~3.11eV
原子光谱
通常,电子处在能量最低的轨道(基态)上运动;
电子在高能量轨道(激发态)上运动
吸收
能量
释放能量
每一次跃迁(辐射或吸收)的能量以光的形式产生一条分立的谱线,被记录下来,
就形成了光谱。
跃迁
吸收光谱
发射光谱
暗色背景,亮谱线
亮色背景,暗谱线
激发态
K
L
M
N
能量
基态
原子光谱
通常,电子处在能量最低的轨道(基态)上运动;
电子在高能量轨道(激发态)上运动
吸收
能量
释放能量
焰火
霓虹灯光
激光
LED灯光
学生活动:阅读教材P8第一自然段和图1-4,回答以下问题:
2.原子光谱的应用:
3.光谱分析的定义:
鉴定元素,发现新元素
例如:铯(1860年)和铷(1861年),其光谱图中有特征的蓝光和红光,它们的拉丁文名称由此得名。又如,稀有气体氦的原意是“太阳元素”,是1868年分析太阳光谱发现的,最初人们以为它只存在于太阳,后来才在地球上发现。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
1.电子跃迁属于物理变化还是化学变化?
电子的跃迁是物理变化(未发生电子转移)
1913年
电子分层排布模型
丹麦科学家
玻尔
研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型基本假设
(1)原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。
核外电子在原子轨道上运动时,既不辐射能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。能量最低的
状态叫做基态,其他状态叫激发态。
(3)电子在能量不同的轨道上发生跃迁时,才会辐射或吸收能量,形成光谱。
玻尔获得了1922年的诺贝尔物理学奖
玻尔的原子模型
玻尔原子模型只限于解释氢原子或类氢原子(单电子)的光谱
无法较好解释多电子原子的光谱。
电子云模型
(1927~1935年)
现代物质结构学说。 [电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道]
氢原子电子云图
(量子力学模型)
人类认识原子的历史是漫长的,也是无止境的。
对应训练
【典例1】下列现象和应用与电子跃迁无关的是( )
A.激光 B.焰色试验 C.缓慢氧化放热 D.霓虹灯
【解析】 电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化,如激光、焰色试验、霓虹灯都与电子跃迁有关。激光与电子跃迁有关,故A错误;当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故B错误;缓慢氧化放热是化学能转化为热能,与电子跃迁无关,故C正确;霓虹灯的各色的光是原子核外电子发生能级跃迁的结果,与电子跃迁有关,故D错误。答案:C
对应训练
【典例2】对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一
现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
【解析】在电流作用下,基态氖原子的电子吸收能量跃迁到较高能级,变为激发态原子,这一过程要吸收能量,不会发出红色光;而电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量,从而产生红光,A项正确。答案:A
给原子核外空间分区—能层
能量规律:
原子核外电子总是尽可能先排布在能量较低的能层上,然后由内向外依次排布在能量逐渐升高的电子层。
一般情况下能层越高,电子的能量越高。
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
2×12
2×22
2×32
2×42
2×52
2×62
2×72
2n2
数量规律: 第n层最多可容纳的电子数为2n2
给原子核外空间分区—能层—能级
在多电子原子中,同一能层的电子,能量可能不同,还可以把能层分成不同的能级。
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
s、p、d、f…排序的各能级可容纳的最多电子数依次为 ;
英文字母相同的不同能级中所能容纳的最多电子数 ;
相同
1、3、5、7…的2倍
同一能层,各能级的能量顺序: ;
ns
用能层能级描述你的位置
幼儿园
小学
初中
高中
大学
高中
二年级
能层——
能级——
【典例】电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取( )
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
【解析】能量E(3d)
