专题3《水溶液中的离子反应》单元检测题(含解析)2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题3《水溶液中的离子反应》单元检测题(含解析)2023-2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 16:02:16 | ||
图片预览



文档简介
专题3《水溶液中的离子反应》
一、单选题(共13题)
1.常温下,用NaOH溶液滴定某二元弱酸H2A溶液,溶液中-lg[]和-lgc(HA-)或-lg[]和-lgc(A2-)关系如图所示,下列说法正确的是
A.N线是-lg[]和-lgc(A2-)的关系
B.Na2A溶液中:2c(Na+)= c(HA-)+ c(A2-)+ c(H2A)
C.水的电离程度:M点大于N点
D.NaHA溶液中:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
2.已知短周期主族元素R、W、X、Y、Z,其中R元素所在的周期数是其族序数的一半,且对应的两种常见氧化物均为酸性氧化物,W元素与Z元素在同一主族,X与其同主族另一元素单质构成原子反应堆导热剂,Y元素原子最外层电子数为m,次外层电子数为n,Z元素原子L层电子数为m+n,M层电子数为m-n,下列叙述中错误的是
A.R、X、Y对应的简单离子半径:r(X)<r(Y)<r(R)
B.相同温度相同浓度的W、R的最高价含氧酸的正盐溶液的碱性:W>R
C.将WY2与RY2分别通入Ba(NO3)2溶液中,现象不同
D.因氢化物的稳定性:Y>R,故氢化物的沸点:Y>R
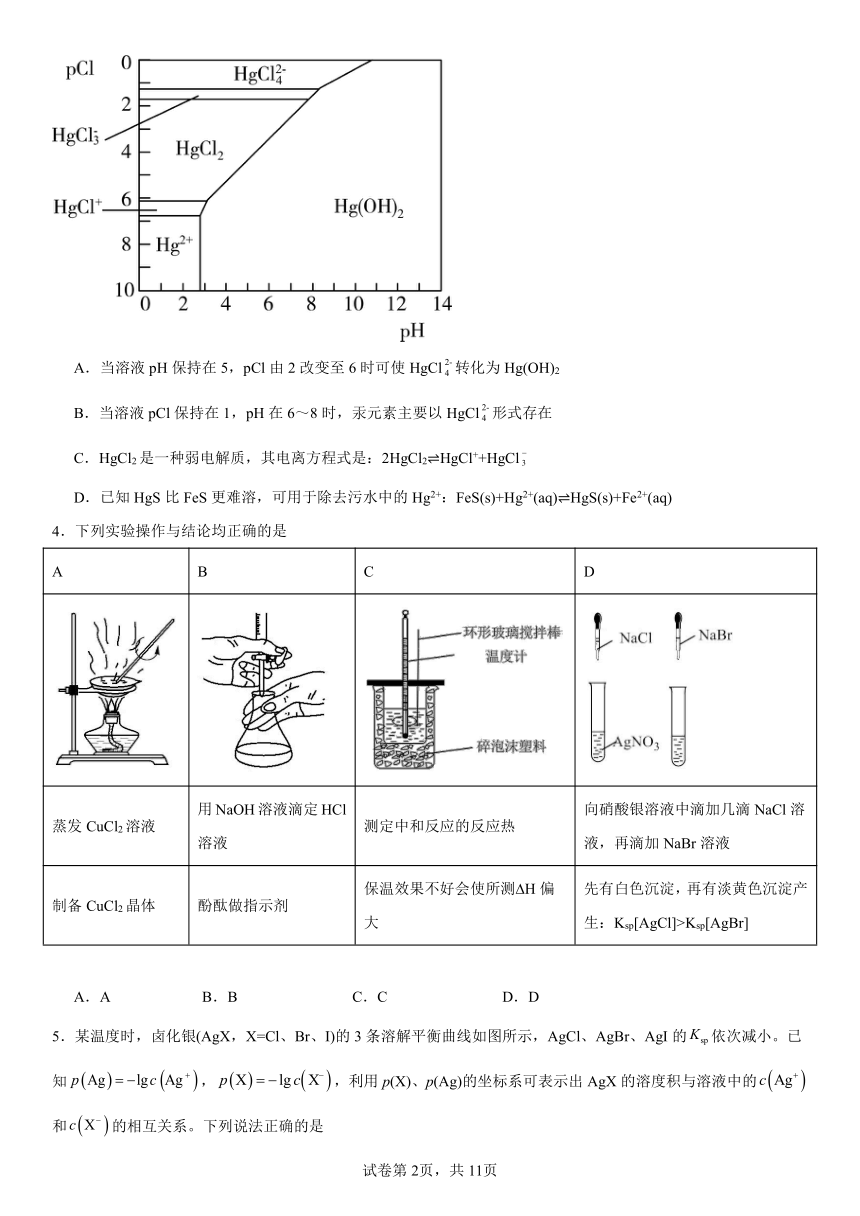
3.Hg是水体污染的重金属元素之一、水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
A.当溶液pH保持在5,pCl由2改变至6时可使HgCl转化为Hg(OH)2
B.当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl形式存在
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2 HgCl++HgCl
D.已知HgS比FeS更难溶,可用于除去污水中的Hg2+:FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq)
4.下列实验操作与结论均正确的是
A B C D
蒸发CuCl2溶液 用NaOH溶液滴定HCl溶液 测定中和反应的反应热 向硝酸银溶液中滴加几滴NaCl溶液,再滴加NaBr溶液
制备CuCl2晶体 酚酞做指示剂 保温效果不好会使所测 H偏大 先有白色沉淀,再有淡黄色沉淀产生:Ksp[AgCl]>Ksp[AgBr]
A.A B.B C.C D.D
5.某温度时,卤化银(AgX,X=Cl、Br、I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的依次减小。已知,,利用p(X)、p(Ag)的坐标系可表示出AgX的溶度积与溶液中的和的相互关系。下列说法正确的是
A.G线是AgCl的溶解平衡曲线
B.坐标点p形成的溶液中AgCl已经达到过饱和状态
C.m点是在水中加入AgBr形成的饱和溶液
D.n点表示由过量的KI与反应产生AgI沉淀
6.乙二酸(H2C2O4 )俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。25°C时,向10mL、0.1mol/LH2C2O4溶液中逐滴加入0.1mol/L的NaOH溶液,溶液中含碳微粒的物 质的量分数随溶液pH 的变化如图所示。下列叙述错误的是
A.曲线Ⅱ表示溶液中的物质的量分数随溶液 pH 的变化
B.25°C 时,H2C2O4的电离平衡常数分别是Ka1、Ka2,则=1000
C.pH为2.5~5.5过程中主要发生反应的离子方程式是OH-+=+H2O
D.当加入20mlNaOH 溶液时,溶液中阴离子浓度由大到小的顺序为:c()>c( )> c(OH-)
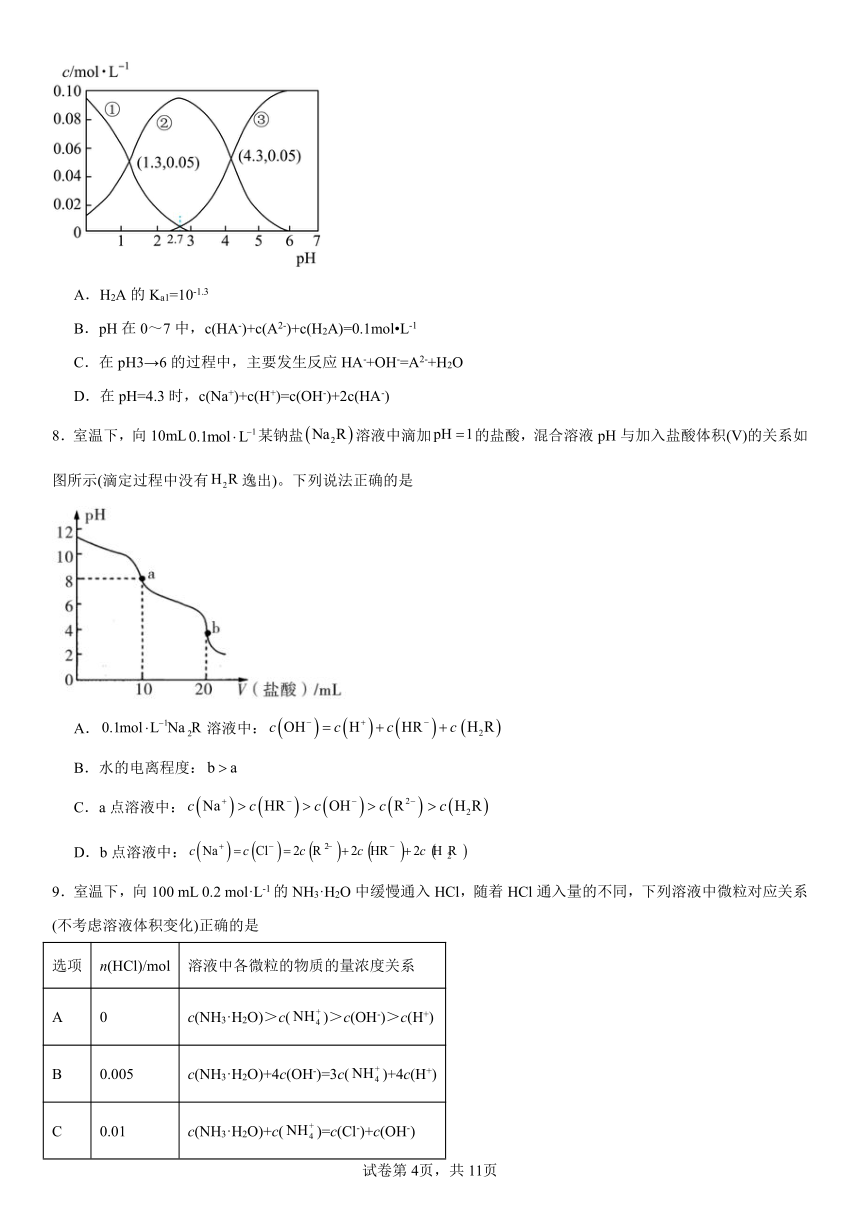
7.已知:H2A为二元弱酸,25℃时,在0.1mol L-150mL的H2A溶液中,H2A、HA-、A2-的物质的量浓度随溶液pH变化的关系如图所示。下列说法不正确的是
A.H2A的Ka1=10-1.3
B.pH在0~7中,c(HA-)+c(A2-)+c(H2A)=0.1mol L-1
C.在pH3→6的过程中,主要发生反应HA-+OH-=A2-+H2O
D.在pH=4.3时,c(Na+)+c(H+)=c(OH-)+2c(HA-)
8.室温下,向10mL某钠盐溶液中滴加的盐酸,混合溶液pH与加入盐酸体积(V)的关系如图所示(滴定过程中没有逸出)。下列说法正确的是
A.溶液中:
B.水的电离程度:
C.a点溶液中:
D.b点溶液中:
9.室温下,向100 mL 0.2 mol·L-1的NH3·H2O中缓慢通入HCl,随着HCl通入量的不同,下列溶液中微粒对应关系(不考虑溶液体积变化)正确的是
选项 n(HCl)/mol 溶液中各微粒的物质的量浓度关系
A 0 c(NH3·H2O)>c()>c(OH-)>c(H+)
B 0.005 c(NH3·H2O)+4c(OH-)=3c()+4c(H+)
C 0.01 c(NH3·H2O)+c()=c(Cl-)+c(OH-)
D 0.02 c(Cl-)>c(NH3·H2O)>c()>c(OH-)
A.A B.B C.C D.D
10.室温下,用的溶液滴定溶液,测得混合溶液的pH与的关系如图所示。下列说法错误的是
A.HA为弱酸,的数量级为(室温下)
B.b点消耗溶液的体积小于
C.当消耗时,溶液中存在
D.c点坐标中,
11.KOH标准溶液的配制和标定,需经过KOH溶液配制,基准物质的称量以及用KOH溶液滴定等操作。下列有关说法正确的是
A.用经水湿润的pH试纸测量KOH溶液的pH
B.中和滴定时,锥形瓶用所盛装的反应液润洗2~3次
C.用图甲所示操作检查碱式滴定管是否漏液
D.用图乙所示装置以KOH待测液滴定溶液
12.下列解释事实的离子方程式不正确的是( )
A.在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色:Cr2O+2OH-=2CrO+H2O
B.硫酸铜溶液显酸性:Cu2++2H2O Cu(OH)2+2H+
C.草酸使酸性高锰酸钾溶液褪色:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O
D.“84”消毒液与洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O
13.下列装置能达到实验目的的是
A.装置甲:制备少量“84”消毒液
B.装置乙:除去胶体中的
C.装置丙:电解饱和食盐水并检验气体产物
D.装置丁:测定草酸溶液的浓度
二、填空题(共8题)
14.化学在生产生活中有着广泛的应用,请回答下列问题:
(1)工业生产和生活中常见有以下10种物质:
①干冰;②氯化钠固体;③液氯;④稀硫酸;⑤溶液;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧食醋;⑨液态氯化氢;⑩氨水
其中能导电的是 (填写符号,下同);属于强电解质的是 ;属于非电解质的是 。
(2)长期烧水的壶里有水垢,其中含有,难用酸除去,可先用纯碱溶液浸泡处理后转化为疏松,易溶于酸的,再用醋酸处理。用醋酸溶液浸泡处理的反应为 (用离子方程式表示),
(3)(亚硫酰氯)可用作农药杀虫剂、杀菌剂和除草剂等,将溶液蒸干并灼烧得不到无水,而将与混合加热可制得无水,结合化学方程式解释其原因: 。
(4)泡沫灭火器喷出的泡沫可以覆盖在燃烧物的表面,同时产生二氧化碳,阻止空气进入,请用一个离子方程式解释泡沫灭火器的工作原理: 。
(5)牙齿表面有一层坚硬的(羟基磷灰石)物质保护着,它在唾液中存在下列平衡:
当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是: 。
15.现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 。
(2)将六份溶液同等稀释10倍后,溶液的pH:
① ②,③ ④,⑤ ⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。
①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
16.自然界是各类物质相互依存的复杂体系,水溶液的离子平衡是一个重要方面。
(1)时,在的溶液中,有的电离成离子,则该温度下的电离平衡常数为 。
(2)在时,将的溶液与的溶液混合,若所得溶液为中性,则 。
(3)常温下将的溶液与的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为 。
(4)已知常温下部分弱电解质的电离平衡常数如下表:
化学式
电离常数
常温下,相同的三种溶液①溶液;②溶液;③溶液,其物质的量浓度由大到小的顺序是 (填序号)。
(5)已知时,的溶度积常数。则使恰好完全沉淀,即溶液中时,应调节的最小值a为多少 。
(6)查阅资料获得时部分弱酸的数据:、、。
①已知溶液呈弱碱性,试用离子反应方程式解释原因 。
②常温下,氢氟酸溶液加水稀释过程中,下列表达式数据变大的是 (填序号)。
A.B.C.D.
(7)已知在时,将浓度相等的与溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因 。
(8)同浓度的溶液和溶液相比:(选填“<”、“=”或“>”)后者溶液中: 前者溶液中
(9)已加溶液为中性,又知溶液加到溶液中有无色无味气体放出,现有时等浓度的5种溶液:请回答下列问题:
a.b.c.d.e.
问题1:试推断溶液的 7(填“>”、“<”或=)
问题2:将5种溶液按浓度由大到小的顺序排列是: (填序号)。
(10)已知常温下,相同物质的量浓度的溶液和溶液相比,溶液的较小。现将溶液和溶液等体积混合,各离子浓度关系正确的是________(填序号)。
A.
B.
C.
D.
17.在室温下,下列三种溶液:①溶液②溶液③溶液,请根据要求填写下列空白:
(1)溶液①呈 (填“酸”“碱”或“中”)性,其原因是 (用离子方程式表示)。
(2)溶液②③中的大小关系是② ③(填“>”“<”或“=”)。
(3)某温度时,测得的NaOH溶液的pH为11。在此温度下,将pH=a的NaOH溶液与pH=b的硫酸混合。
①若所得混合液为中性,且a=12,b=2,则 。
②若所得混合液的pH=10,且a=12,b=2,则 。
(4)常温下,某盐溶液M中存在的离子有、、、,存在的分子有、HA。
①写出的水解离子方程式: 。
②该溶液M中离子浓度由大到小关系为 。
18.在室温下,下列五种溶液:① 0.1mol/LNH4Cl溶液② 0.1mol/LCH3COONH4溶液
③ 0.1mol/LNH4HSO4溶液④ 0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液⑤ 0.1mol/L氨水,请根据要求填写下列空白:
(1)溶液①呈 (填“酸”、“碱”或“中”)性,其原因是 (用离子方程式表示)。
(2)溶液② ③中的大小关系是② ③。(填“>”、“<”或“=”)
(3)在溶液④ 中 (离子)的浓度为0.1mol/L;NH3·H2O和 (离子)的浓度之和为0.2mol/L。
(4)室温下,测得溶液② 的pH=7,CH3COO-与浓度的大小关系是 (填“>”、“<”或“=”)
19.(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法 (填“正确”或“不正确”),并说明理由: 。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是 。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)= 。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式)。
20.Ⅰ、H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。
(1)以酚酞为指示剂(变色范围pH8.0 ~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。
(2)pH=11时,图中H3AsO3水溶液中三种微粒浓度由大到小顺序为 ;
(3)H3AsO4第一步电离方程式为 ;
(4)若pKa2=-1gHKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2= 。
Ⅱ、用0.1000mol L-1AgNO3滴定50.00mL L-3Cl-溶液的滴定曲线如图所示
(5)根据曲线数据计算可知Ksp(AgCl)数量级为 ;
(6)相同实验条件下,若改为0.0400mol L-1Cl-,反应终点c移到 ;(填“a”、“b”或“d”)
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若给为0.0500mol L-1Br-,反应终点c向 方向移动(填“a”、“b”或“d”)。
21.(1)常温下在20mLpH=12的Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO、CO (填“能”或“不能”)大量共存;
②当pH=8时,溶液中含碳元素的主要微粒为 ;
③已知在25℃时,HCO的电离平衡常数:K=5.0×10-11,当溶液中处于交叉点a时,溶液的pH= 。(保留1位小数,已知:lg2=0.3、lg3=0.5、lg5=0.7)
(2)CrO和Cr2O在溶液中可相互转化。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
若加水稀释,则将 (填:“变大”、“变小”、“不变”)。
②+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O还原成Cr3+,反应的离子方程式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.Ka1=,Ka2=,由于Ka1>Ka2,即>,所以[lg+lgc(HA-)]>[lg+lgc(A2-)],则[-lg-lgc(HA-)]<[-lg-+lgc(A2-)],据图可知曲线M上各点横纵坐标之和小于曲线N,所以曲线N代表-lg[]和-lgc(A2-)的关系,A正确;
B.Na2A溶液中存在物料守恒c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),B错误;
C.曲线N代表-lg[]和-lgc(A2-)的关系,所以曲线N代表的溶液中以HA-的电离为主,曲线M代表的溶液中以H2A的电离为主,H2A的电离程度更大,对水的电离抑制作用更强,所以水的电离程度:M点小于N点,C错误;
D.溶液中存在电荷守恒c(Na+)+ c(H+)=c(OH-)+c(HA-)+2c(A2-),D错误;
综上所述答案为A。
2.D
【分析】已知短周期主族元素R、W、X、Y、Z,其中R元素所在的周期数是其族序数的一半,且对应的两种常见氧化物均为酸性氧化物,则为S元素, X与其同主族另一元素单质构成原子反应堆导热剂,则X为Na元素,Y元素原子最外层电子数为m,次外层电子数为n,Z元素原子L层电子数为m+n,M层电子数为m-n,则n=2,m=6,故Z为Si,Y为O,W元素与Z元素在同一主族,W为C。由题意可推知 R、W、X、Y、Z五种元素分别是S、C、Na、O、Si。
【详解】A.R、X、Y 对应的简单离子半径:r(Na+)B.相同温度相同浓度的 R、W的最高价含氧酸的正盐溶液分别为Na2SO4(中性)、Na2CO3(碱性),则pH: Na2CO3>Na2SO4,选项B正确;
C.将CO2与SO2分别通入Ba(NO3)2溶液中,通入CO2时无明显现象,通入SO2时有白色沉淀,现象不同,选项C正确;
D.H2O的熔、沸点比 H2S的熔、沸点高,是因为水分子间存在氢键,不是因为H2O比H2S稳定,选项D错误;
答案选D。
3.A
【详解】A.由图可知,当溶液pH保持在5,pCl为2、6时,汞分别为HgCl2、Hg(OH)2形式存在,故pCl由2改变至6时可使HgCl2转化为Hg(OH)2,A错误;
B.由图可知,当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl形式存在,B正确;
C.HgCl2是一种弱电解质,由图可知,汞会以HgCl+、离子形式存在,则其电离方程式是:2HgCl2 HgCl++,C正确;
D.已知HgS比FeS更难溶,可用于除去污水中的Hg2+可以加入FeS将Hg2+转化为更难溶的HgS沉淀,反应为FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq),D正确;
故选A。
4.C
【详解】A.蒸发CuCl溶液不能得到CuCl2晶体,本题中我们要考虑CuCl2的水解和HCl的挥发性,CuCl2水解方程式可以写为:CuCl2+2H2O=Cu(OH)2+2HCl,在加热蒸发条件下,HCl挥发,促进正向水解的进行,因此蒸发CuCl2溶液不能得到CuCl2晶体,A错误;
B.用NaOH溶液滴定HCl溶液,可以用酚酞作为指示剂,滴定终点即溶液呈现淡粉色,本题中,由图可知,NaOH溶液装于酸式滴定管中,滴定时,NaOH溶液应该装于碱式滴定管,B错误;
C.中和热的计算公式为:,装置的保温效果不好,会使得公式中T2-T1的差值减小,最后计算得出来的中和热的数值也会减小,但考虑到该反应是放热,最后的中和热是负值,故最后所测得的△H会偏大,C正确;
D.比较Ksp[AgCl]、Ksp[AgBr]的大小,应该于过量的NaCl溶液中滴加AgNO3溶液,使得Ag+全部转换为AgCl沉淀,后滴加NaBr溶液,观察是否有淡黄色沉淀产生,D错误;
故选C。
5.C
【分析】已知p(Ag)=-lgc(Ag+),p(X)=-lgc(X-),Ag+、Cl-浓度越大,浓度的负对数得到的数值越小,依据图像分析可知,溶解度:AgCl>AgBr>AgI,溶液中的离子浓度也是AgCl>AgBr>AgI,所以E线表示的是AgCl,F线表示的是AgBr,G线表示的是AgI;
【详解】A.由分析可知,G线是AgI的溶解平衡曲线,A错误;
B.坐标点p不在曲线上,在曲线E之上,形成的溶液是AgCl的不饱和溶液,B错误;
C.m点是沉淀溶解平衡线上的一点,说明是沉淀溶解平衡状态下的饱和溶液,C正确;
D.因为n点在曲线上,即处于沉淀溶解平衡状态,不存在净生成沉淀或有部分沉淀溶解的问题,表示的是AgI沉淀的沉淀溶解平衡状态,D错误;
故选C。
6.D
【分析】草酸属于二元素弱酸,应分步电离H2C2O4HC2O+H+、HC2OC2O+H+,草酸溶液中加入NaOH溶液,H2C2O4物质的量浓度逐渐减小,HC2O逐渐增大,后逐渐减小,C2O逐渐增大,因此Ⅰ代表H2C2O4,Ⅱ代表HC2O,Ⅲ代表C2O,据此分析;
【详解】A.根据上述分析,Ⅱ代表HC2O物质的量分数随pH变化,故A说法正确;
B.Ka1=,电离平衡常数只受温度的影响,取(1.2,0.5)点,c(HC2O)= c(H2C2O4),因此Ka1=c(H+)=10-1.2,同理Ka2=c(H+)=10-4.2,因此=103=1000,故B说法正确;
C.pH在2.5~5.5之间,HC2O物质的量分数逐渐减少,C2O物质的量分数逐渐增大,因此该阶段发生离子方程式为HC2O+OH-=C2O+H2O,故C说法正确;
D.当加入20mL等浓度NaOH溶液,充分反应后,溶质为Na2C2O4,C2O发生水解,其水解方程式为C2O+H2O HC2O+OH-,水也要电离出OH-,因此c(OH-)>c(HC2O),水解程度微弱,c(C2O)最大,即c(C2O)>c(OH-)>c(HC2O),故D说法错误;
答案为D。
7.D
【分析】H2A为二元弱酸,电离方程式为H2A HA-+ H+,HA- A2-+ H+,根据图象,随着溶液pH的增大,H2A的浓度逐渐减小,HA-的浓度逐渐增大,即①为H2A的浓度的变化曲线,②为HA-的浓度的变化曲线,随着溶液pH的进一步增大, HA-的浓度逐渐减小,A2-逐渐增大,则③为A2-浓度的变化曲线,据此分析解答。
【详解】A.H2A的第一步电离方程式为H2A HA-+ H+,根据图象,当pH=1.3时,H2A、HA-的浓度相等,即c(HA-)=c(H2A)则Ka1== c(H+)=10-1.3,故A正确;
B.根据物料守恒,pH在0~7中,c(HA-)+c(A2-)+c(H2A)=0.1mol L-1,故B正确;
C.根据图象,在pH3→6的过程中,HA-的浓度逐渐减小,A2-逐渐增大,主要发生反应HA-+OH-=A2-+H2O,故C正确;
D.根据图象,在pH=4.3时,c(HA-)=c(A2-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+ +c(HA-)+2c(A2-)= c(OH-)+ 3c(HA-),故D错误;
故选D。
8.D
【详解】A.溶液中,根据质子守恒得到,故A错误;
B.a点溶质为NaHR,溶液显碱性,说明HR-水解成都大于电离程度,促进水的电离,b点溶质为NaCl、H2R,抑制水的电离,因此水的电离程度:,故B错误;
C.a点溶质为NaHR,溶液显碱性,说明HR-水解成都大于电离程度,则a点溶液中:,故C错误;
D.b点溶质为NaCl、H2R且两者浓度之比为2:1,根据物料守恒得到b点溶液中:,故D正确。
综上所述,答案为D。
9.B
【分析】在100 mL 0.2 mol·L-1的NH3·H2O中含有溶质的物质的量n(NH3·H2O)=0.2 mol/L×0.1 L=0.02 mol,通入HCl气体时发生反应:NH3·H2O+HCl=NH4Cl+H2O,然后根据通入的HCl的物质的量,结合反应消耗关系,确定混合溶液的成分,发现溶液中各种微粒的浓度大小关系。
【详解】A.通入HCl的物质的量是0 mol时,溶液的溶质为NH3·H2O,由于NH3·H2O是弱电解质,主要以电解质分子存在,电离产生的、OH-的浓度远小于电解质分子的浓度,溶液中除NH3·H2O电离产生OH-外,还存在H2O电离产生OH-,故溶液中离子浓度大小关系为:c(NH3·H2O)>c(OH-)>c()>c(H+),A错误;
B.溶液中n(NH3·H2O)=0.2 mol/L×0.1 L=0.02 mol,当通入HCl的物质的量n(HCl)=0.005 mol<0.02 mol,二者发生反应:NH3·H2O+HCl=NH4Cl+H2O,二者反应的物质的量的比是1:1,n(NH3·H2O)过量=0.02 mol-0.005 mol=0.015 mol,反应后混合溶液中n(NH3·H2O):n(NH4Cl)=0.015 mol:0.005 mol=3:1,根据电荷守恒可得:c()+c(H+)=c(OH-)+c(Cl-),根据物料守恒可得c(NH3·H2O)+c()=4c(Cl-),将两个式子联立可得c(NH3·H2O)+4c(OH-)=3c()+4c(H+),B正确;
C.当通入HCl的物质的量是0.01 mol时,反应产生NH4Cl的物质的量是0.01 mol,剩余NH3·H2O的物质的量是0.01 mol,溶液为等物质的量的NH4Cl、NH3·H2O的混合溶液,根据电荷守恒可得c()+c(H+)=c(OH-)+c(Cl-),根据电荷守恒可知c(NH3·H2O)+c()=2c(Cl-),将两式联立可得c()+2c(H+)=c(NH3·H2O)+2c(OH-),C错误;
D.当通入HCl的物质的量是0.02 mol时,二者恰好反应产生NH4Cl,其物质的量是0.02 mol。该盐是强酸弱碱盐,发生水解反应产生NH3·H2O、H+,导致的物质的量比Cl-小,所以c(Cl-)>c(),但盐水解程度是微弱的,盐电离产生的离子浓度远大于弱电解质产生的离子浓度,盐水解产生的NH3·H2O的浓度远小于的浓度,因此c()>c(NH3·H2O),D错误;
故合理选项是B。
10.C
【详解】A.由a点,可计算出,其数量级为,A项正确;
B.HA为弱酸,若b点时消耗溶液的体积等于,则刚好生成,溶液显碱性,而b点显中性,则HA稍过量,所以b点时消耗溶液的体积小于,B项正确;
C.当消耗时,恰好完全反应,溶质为,根据电荷守恒和物料守恒可知,溶液中存在,C项错误;
D.根据,c点,可知,D项正确。
故选C。
11.D
【详解】A.测量溶液的pH不能用经水湿润的pH试纸,选项A错误;
B.锥形瓶在用水洗后,不能用待装液润洗2~3次,选项B错误;
C.将碱式滴定管的尖嘴向上是为了排出碱式滴定管中的气泡,而不是检查是否漏液,选项C错误;
D.氢氧化钾溶液放在碱式滴定管中滴定溶液,选项D正确;
答案选D。
12.C
【详解】A.在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色,橙色的Cr2O转化为黄色的CrO,故A正确;
B.铜离子水解消耗水中的氢氧根离子,促进水的电解,氢离子浓度增加,所以显酸性;离子方程式为Cu2++2H2O Cu(OH)2+2H+,故B正确;
C.草酸使酸性高锰酸钾溶液褪色,草酸为弱酸,离子方程式中应该以化学式形式存在,故C错误;
D.“84”消毒液的主要成分为次氯酸钠,洁厕灵主要成分为盐酸,消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O,故D正确;
故答案为C。
13.D
【详解】A.和浓盐酸反应需要加热,A项错误;
B.胶体粒子和、都能透过滤纸,B项错误;
C.电解饱和食盐水时,阳极生成,用淀粉溶液检验,阴极生成,用向下排空气法收集,C项错误;
D.酸性溶液有强氧化性,用酸式滴定管盛装,且酸性溶液呈紫色,可指示滴定终点,D项正确;
答案选D。
14.(1) ④⑤⑥⑦⑩ ②⑧⑨ ①
(2)
(3)能与水反应,而脱去中水
(4)
(5)当人进食后被细菌分解产生的有机酸与氢氧根离子反应,使平衡向右移动,牙齿表面的减少
【详解】(1)(1)干冰属于非电解质;氯化钠固体、碳酸钠固体、液态氯化氢为强电解质;液氯既不是电解质也不是非电解质;稀硫酸、溶液、氢氧化钡溶液、食醋、氨水均为电解质溶液,能导电,故填④⑤⑥⑦⑩、②⑧⑨、①;
(2)(2)与醋酸反应的离子方程式为:,故填;
(3)(3)能与水反应达到脱去中水的目的,其反应为,故填能与水反应,而脱去中水;
(4)(4)泡沫灭火器的主要成分为碳酸氢钠溶液和硫酸钠溶液,两者混合后发生完全双水解,其反应的离子方程式为,故填;
(5)(5)根据,当人进食后被细菌分解产生的有机酸与氢氧根离子反应,使平衡向右移动,牙齿表面的减少,故填当人进食后被细菌分解产生的有机酸与氢氧根离子反应,使平衡向右移动,牙齿表面的减少;
15.(1) ⑥ ②③④
(2) > > >
(3) > >
(4) 否 AB c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
【详解】(1)① ② ③ ④ 是酸或碱对水的电离起抑制作用,⑤ NH3·H2O是弱碱,CH3COOH是弱酸,反应后溶液中溶质:CH3COONH4、NH3·H2O,对水的电离抑制,⑥ 两者恰好完全反应,生成NaCl,对水的电离无影响,所以⑥ 的水的电离程度最大,② ③ ④ 溶液中c(H+)或c(OH-)相等,对水的电离影响相同,故答案为:⑥;②③④。
(2)①CH3COOH是弱酸,②HCl是强酸,稀释相同倍数,醋酸中的c(H+)小于盐酸中c(H+),pH:①>②;pH=12时,NH3·H2O是弱碱在稀释过程还要电离出一部分OH-,c(OH-)大于氢氧化钠溶液中c(OH-),③>④;⑤反应后溶液显碱性,⑥反应后溶液显中性,⑤>⑥,故答案为:>;>;>。
(3)混合溶液中c(Na+)>c(CN-),说明CN-的水解大HCN的电离,溶液显碱性,①c(OH-)>c(H+),②c(HCN)>c(CN-),故答案为:>;>。
(4)①醋酸是弱酸,氢氧化钠是强碱,两者恰好完全反应生成的CH3COONa是强碱弱酸盐,水溶液显碱性,因此这种看法不正确,填写:否,二者恰好完全反应的点在AB区间内;② 在C点溶液显酸性,此时的溶质是:CH3COOH、CH3COONa,CH3COOH的电离大于CH3COO-的水解,因此离子浓度由大到小的顺序:c(CH3COO-)> c(Na+)> c(H+)> c(OH-),故答案为:否;AB;c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
16.(1)1×10 5
(2)10:1
(3)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(4)①>②>③
(5)5
(6) ABD
(7),说明HF的电离程度大于氟离子的水解程度,所以溶液显酸性
(8)>
(9) > e>a>c>b>d
(10)AB
【详解】(1)时,在的溶液中,有的电离成离子,则电离出的氢离子浓度为,则该温度下的电离平衡常数为;故答案为:1×10 5。
(2)在时,将的溶液与的溶液混合,若所得溶液为中性,,则10:1;故答案为:10:1。
(3)常温下将的溶液与的醋酸溶液混合后溶液显酸性,溶质是醋酸和醋酸钠且两者物质的量浓度相等,由于溶液显酸性,说明醋酸电离程度大于醋酸根水解程度,则混合后溶液中各离子浓度的大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
(4)根据“越弱越水解”,得到碳酸钠水解程度最大,次氯酸钠水解程度次之,氟化钠水解程度最小,由于三者水解出的氢氧根浓度相同,则水解程度越大,说明其物质的量浓度越小,因此常温下,相同的三种溶液①溶液;②溶液;③溶液,其物质的量浓度由大到小的顺序是①>②>③;故答案为:①>②>③。
(5)已知时,的溶度积常数。则使恰好完全沉淀,即溶液中时,根据,则,即pH=5,因此应调节的最小值a为5;故答案为:5。
(6)①已知溶液呈弱碱性,硫氰根水解显碱性,其离子反应方程式解释原因;故答案为:。
②A.氢氟酸溶液加水稀释过程中,氢离子浓度增大,离子积常数不变,因此变大,故A符合题意;B.在加水过程中氢离子物质的量和氟离子物质的量都增大,但由于在加水过程中水电离出的氢离子成增大趋势,因此变大,故B符合题意;C.氢氟酸溶液加水稀释过程中,减小,故C不符合题意;D.氢氟酸溶液加水稀释过程中,氟离子浓度减小,因此增大,故D符合题意;综上所述,答案为ABD。
(7)已知在时,将浓度相等的与溶液等体积混合,溶液呈酸性,其溶液呈酸性的原因,说明HF的电离程度大于氟离子的水解程度,所以溶液显酸性;故答案为:,说明HF的电离程度大于氟离子的水解程度,所以溶液显酸性。
(8)同浓度的溶液和溶液相比,两溶液中钾离子浓度和钠离子浓度相等,由于醋酸根水解程度大于氟离子水解程度,因此溶液中醋酸根离子浓度小于氟离子浓度,则溶液中:>;故答案为:>。
(9)问题1:已加溶液为中性,说明氨水的电离平衡常数等于醋酸的电离平衡常数,又知溶液加到溶液中有无色无味气体放出,说明氨水的电离平衡常数大于碳酸的电离平衡常数,根据“谁强显谁性”即谁相对强显谁的性质,则溶液的>7;故答案为:>。
问题2:是电离出的氢离子抑制铵根水解,则铵根离子浓度最大;是单一水解,铵根离子浓度次之;、、是相互促进的双水解,根据“越弱越水解”,则碳酸氢根水解程度>醋酸根水解程度>硫氰根水解程度,酸根水解程度越大,促进铵根水解程度越大,铵根离子浓度越小,因此5种溶液按浓度由大到小的顺序排列是:e>a>c>b>d;故答案为:e>a>c>b>d。
(10)已知常温下,相同物质的量浓度的溶液和溶液相比,溶液的较小,说明次氯酸跟水解程度小于碳酸根水解程度,说明次氯酸的电离平衡常数大于碳酸氢根的电离平衡常数,现将溶液和溶液等体积混合,A.碳酸根水解程度大于次氯酸跟水解程度,水解是微弱的,因此,故A正确;B.根据物料守恒得到,故B正确;C.根据质子守恒得到,故C错误;D.根据物料守恒得到,故D错误;综上所述,答案为:AB。
17.(1) 酸
(2)<
(3) 1:10 1:9
(4) >>>
【详解】(1)NH4Cl是强酸弱碱盐,NH发生水解反应,所以溶液呈酸性;
(2)溶液②中NH、CH3COO-水解相互促进;是强酸的酸式盐,电离出的H+抑制NH的水解,的大小关系是②<③;
(3)某温度时,测得的NaOH溶液的pH为11,、,在此温度下,; pH=12的NaOH溶液中, pH=2的硫酸中:
①若所得混合液为中性,则,1:10;
②若所得混合液的pH=10,,则1:9;
(4)①溶液中同时存在、HA,说明HA是弱酸,的水解离子方程式为;
②溶液中同时存在、HA,说明HA是弱酸,水解,溶液呈碱性,该溶液M中离子浓度由大到小关系为>>>。
18.(1) 酸 +H2O NH3·H2O+H+
(2)<
(3) Cl-
(4)=
【详解】(1)氯化铵为强酸弱碱盐,铵根离子能发生水解:+H2O NH3·H2O+H+,导致溶液中的氢离子浓度大于氢氧根离子浓度,溶液显酸性,故答案为:酸;+H2O NH3·H2O+H+;
(2)② 0.1mol/LCH3COONH4溶液中醋酸根离子水解促进了铵根离子水解,使铵根水解程度增大,③ 0.1mol/LNH4HSO4溶液中电离出的氢离子抑制铵根离子的水解,使铵根水解程度减小,因此③中铵根离子浓度大于②,故答案为:<;
(3)④0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液中氯离子不发生水解,其离子浓度为0.1mol/L,根据物料守恒可知NH3·H2O和的浓度和为0.1mol/L+0.1mol/L=0.2mol/L,故答案为:Cl-;;
(4)②0.1mol/LCH3COONH4溶液的pH值等于7,说明铵根离子和醋酸根离子的水解程度相同,则溶液中的等于,故答案为:=。
19. 正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 a-2<b<a 1×10-8 mol·L-1 中 碱 NH
【详解】(I)①假设现有0.010 mol·L-1氢氧化钠溶液,c(OH-)=0.01 mol·L-1, c(H+)=10-12 mol·L-1,用pH试纸测出pH为12,现用pH试纸测出0.010 mol·L-1氨水的pH为10,所以NH3·H2O是弱电解质,正确;正确答案: 正确; 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 。
②假设氨水为强碱,0.010 mol·L-1氨水pH=a,用蒸馏水稀释至100倍,其pH=b=a-2,现确认NH3·H2O是弱电解质,存在电离平衡,所以a-2<b<a ;正确选项:a-2<b<a。
(II) (1)在pH=6的CH3COOH与CH3COONa的混合溶液中,c(H+)=10-6 mol/L,c(OH-)=10-14/10-6= 1×10-8 mol·L-1,正确答案:1×10-8 mol·L-1。
(2)醋酸和NH3·H2O的电离平衡常数均为1.74×10-5,电离能力相同,所以CH3COONH4溶液中两种离子水解能力相同,溶液呈中性;由CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O反应可知醋酸的酸性大于碳酸的酸性,NH4HCO3溶液中,HCO3-水解能力大于NH4+水解能力,所以溶液显碱性,离子浓度最大为NH4+;正确答案:中; 碱 ; NH。
20. OH-+H3AsO3=H2AsO3-+H2O c(H2AsO3-)>c(HAsO32-)>c(H3AsO3) H3AsO4 H2AsO4-+H+ 10-7 10-10 b d
【分析】Ⅰ、(1)根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应;
(2)图象中分析判断pH=11时,图中H3AsO3水溶液中三种微粒浓度;
(3)多元弱酸分步电离,H3AsO4第一步电离方程式H3AsO4 H2AsO4-+H+;
(4)H3AsO4第二步电离的电离常数为Ka2=,pH=7时c(H2AsO4-)=c(HAsO42-);
Ⅱ、(5)沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lgc(Cl-)=5,据此计算;
(6)曲线上的点是达到沉淀溶解平衡的平衡点,满足c(Ag+) c(Cl-)=Ksp(AgCl);溶度积常数只随温度改变而改变,改变滴定反应液浓度不改变溶度积常数;
(7)AgBr比AgCl更难溶,达到沉淀溶解平衡时Br-的浓度更低。
【详解】Ⅰ、(1)根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应,同时还生成水,离子方程式为:OH-+H3AsO3=H2AsO3-+H2O,
故答案为OH-+H3AsO3=H2AsO3-+H2O;
(2)图象中分析判断pH=11时,图中H3AsO3水溶液中三种微粒浓度为:c(H2AsO3-)>c(HAsO32-)>c(H3AsO3),
故答案为c(H2AsO3-)>c(HAsO32-)>c(H3AsO3);
(3)多元弱酸分步电离,H3AsO4第一步电离方程式为:H3AsO4 H2AsO4-+H+,
故答案为H3AsO4 H2AsO4-+H+;
(4)H3AsO4第二步电离的电离常数为Ka2=,PH=7时c(H2AsO4-)=c(HAsO42-),Ka2=c(H+)=10-7,
故答案为10-7;
Ⅱ、(5)沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lgc(Cl-)=5,达到沉淀溶解平衡时,c(Ag+)=c(Cl-)=10-5mol/L,所以根据曲线数据计算可知Ksp(AgCl)的数量级为10-10,
故答案为b;
(6)溶度积常数只随温度改变而改变,改变滴定反应液浓度不改变溶度积常数,所以相同实验条件下,若改为0.0400mol L-1Cl-,则所需AgNO3溶液体积就变为mL=20mL,反应终点c移到b点,
故答案为b;
(7)AgBr比AgCl更难溶,达到沉淀溶解平衡时Br-的浓度更低,则-lgc(Br-)值更大,消耗AgNO3溶液的体积不变,反应终点c向d点,
故答案为d。
【点睛】本题考查沉淀溶解平衡相关知识,明确达到沉淀溶解平衡时的关系式,把握图象反应的信息,掌握基础是解题关键。
21. 不能 HCO 10.3 2CrO+2H+ Cr2O+H2O 变大 Cr2O+3HSO+5H+=2Cr3++3SO+4H2O
【分析】(1)根据图象分析判断溶液中的微粒关系;当溶液中处于交叉点a时,c(CO)= c(HCO),结合HCO的电离平衡常数:K=5.0×10-11计算判断;
(2)①CrO在酸性条件下可转化为Cr2O,用离子反应方程式表示为:2CrO+2H+ Cr2O+H2O;若加水稀释,溶液的酸性减弱,c(H+)减小,平衡逆向移动,据此分析;
②用NaHSO3将废液中的Cr2O还原成Cr3+,Cr元素的化合价降低,则S元素的化合价升高,生成硫酸根离子,并结合电荷、电子守恒配平。
【详解】(1)①由图象可知,pH>8时,溶液中只含有HCO、CO,pH<8时,溶液中只含有HCO、H2CO3,则在同一溶液中, H2CO3、HCO、CO不能大量共存;
②由图象可知,当pH=8时,溶液中含碳元素的主要微粒为HCO;
③已知在25℃时,HCO的电离平衡常数:K=5.0×10-11,当溶液中处于交叉点a时,溶液的c(CO)= c(HCO),HCO的电离平衡常数:K==c(H+)=5.0×10-11,则pH=11- lg5=11-0.7=10.3;
(2)①CrO在酸性条件下可转化为Cr2O,用离子反应方程式表示为:2CrO+2H+ Cr2O+H2O;若加水稀释,溶液的酸性减弱,c(H+)减小,平衡逆向移动,c(CrO)增大,c(Cr2O)浓度减小,则将变大;
②用NaHSO3将废液中的Cr2O还原成Cr3+,Cr元素的化合价降低,则S元素的化合价升高,生成硫酸根离子,由电荷、电子守恒及原子守恒可知离子反应为Cr2O+3HSO+5H+=2Cr3++3SO+4H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13题)
1.常温下,用NaOH溶液滴定某二元弱酸H2A溶液,溶液中-lg[]和-lgc(HA-)或-lg[]和-lgc(A2-)关系如图所示,下列说法正确的是
A.N线是-lg[]和-lgc(A2-)的关系
B.Na2A溶液中:2c(Na+)= c(HA-)+ c(A2-)+ c(H2A)
C.水的电离程度:M点大于N点
D.NaHA溶液中:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
2.已知短周期主族元素R、W、X、Y、Z,其中R元素所在的周期数是其族序数的一半,且对应的两种常见氧化物均为酸性氧化物,W元素与Z元素在同一主族,X与其同主族另一元素单质构成原子反应堆导热剂,Y元素原子最外层电子数为m,次外层电子数为n,Z元素原子L层电子数为m+n,M层电子数为m-n,下列叙述中错误的是
A.R、X、Y对应的简单离子半径:r(X)<r(Y)<r(R)
B.相同温度相同浓度的W、R的最高价含氧酸的正盐溶液的碱性:W>R
C.将WY2与RY2分别通入Ba(NO3)2溶液中,现象不同
D.因氢化物的稳定性:Y>R,故氢化物的沸点:Y>R
3.Hg是水体污染的重金属元素之一、水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
A.当溶液pH保持在5,pCl由2改变至6时可使HgCl转化为Hg(OH)2
B.当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl形式存在
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2 HgCl++HgCl
D.已知HgS比FeS更难溶,可用于除去污水中的Hg2+:FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq)
4.下列实验操作与结论均正确的是
A B C D
蒸发CuCl2溶液 用NaOH溶液滴定HCl溶液 测定中和反应的反应热 向硝酸银溶液中滴加几滴NaCl溶液,再滴加NaBr溶液
制备CuCl2晶体 酚酞做指示剂 保温效果不好会使所测 H偏大 先有白色沉淀,再有淡黄色沉淀产生:Ksp[AgCl]>Ksp[AgBr]
A.A B.B C.C D.D
5.某温度时,卤化银(AgX,X=Cl、Br、I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的依次减小。已知,,利用p(X)、p(Ag)的坐标系可表示出AgX的溶度积与溶液中的和的相互关系。下列说法正确的是
A.G线是AgCl的溶解平衡曲线
B.坐标点p形成的溶液中AgCl已经达到过饱和状态
C.m点是在水中加入AgBr形成的饱和溶液
D.n点表示由过量的KI与反应产生AgI沉淀
6.乙二酸(H2C2O4 )俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。25°C时,向10mL、0.1mol/LH2C2O4溶液中逐滴加入0.1mol/L的NaOH溶液,溶液中含碳微粒的物 质的量分数随溶液pH 的变化如图所示。下列叙述错误的是
A.曲线Ⅱ表示溶液中的物质的量分数随溶液 pH 的变化
B.25°C 时,H2C2O4的电离平衡常数分别是Ka1、Ka2,则=1000
C.pH为2.5~5.5过程中主要发生反应的离子方程式是OH-+=+H2O
D.当加入20mlNaOH 溶液时,溶液中阴离子浓度由大到小的顺序为:c()>c( )> c(OH-)
7.已知:H2A为二元弱酸,25℃时,在0.1mol L-150mL的H2A溶液中,H2A、HA-、A2-的物质的量浓度随溶液pH变化的关系如图所示。下列说法不正确的是
A.H2A的Ka1=10-1.3
B.pH在0~7中,c(HA-)+c(A2-)+c(H2A)=0.1mol L-1
C.在pH3→6的过程中,主要发生反应HA-+OH-=A2-+H2O
D.在pH=4.3时,c(Na+)+c(H+)=c(OH-)+2c(HA-)
8.室温下,向10mL某钠盐溶液中滴加的盐酸,混合溶液pH与加入盐酸体积(V)的关系如图所示(滴定过程中没有逸出)。下列说法正确的是
A.溶液中:
B.水的电离程度:
C.a点溶液中:
D.b点溶液中:
9.室温下,向100 mL 0.2 mol·L-1的NH3·H2O中缓慢通入HCl,随着HCl通入量的不同,下列溶液中微粒对应关系(不考虑溶液体积变化)正确的是
选项 n(HCl)/mol 溶液中各微粒的物质的量浓度关系
A 0 c(NH3·H2O)>c()>c(OH-)>c(H+)
B 0.005 c(NH3·H2O)+4c(OH-)=3c()+4c(H+)
C 0.01 c(NH3·H2O)+c()=c(Cl-)+c(OH-)
D 0.02 c(Cl-)>c(NH3·H2O)>c()>c(OH-)
A.A B.B C.C D.D
10.室温下,用的溶液滴定溶液,测得混合溶液的pH与的关系如图所示。下列说法错误的是
A.HA为弱酸,的数量级为(室温下)
B.b点消耗溶液的体积小于
C.当消耗时,溶液中存在
D.c点坐标中,
11.KOH标准溶液的配制和标定,需经过KOH溶液配制,基准物质的称量以及用KOH溶液滴定等操作。下列有关说法正确的是
A.用经水湿润的pH试纸测量KOH溶液的pH
B.中和滴定时,锥形瓶用所盛装的反应液润洗2~3次
C.用图甲所示操作检查碱式滴定管是否漏液
D.用图乙所示装置以KOH待测液滴定溶液
12.下列解释事实的离子方程式不正确的是( )
A.在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色:Cr2O+2OH-=2CrO+H2O
B.硫酸铜溶液显酸性:Cu2++2H2O Cu(OH)2+2H+
C.草酸使酸性高锰酸钾溶液褪色:2MnO+5C2O+16H+=2Mn2++10CO2↑+8H2O
D.“84”消毒液与洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O
13.下列装置能达到实验目的的是
A.装置甲:制备少量“84”消毒液
B.装置乙:除去胶体中的
C.装置丙:电解饱和食盐水并检验气体产物
D.装置丁:测定草酸溶液的浓度
二、填空题(共8题)
14.化学在生产生活中有着广泛的应用,请回答下列问题:
(1)工业生产和生活中常见有以下10种物质:
①干冰;②氯化钠固体;③液氯;④稀硫酸;⑤溶液;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧食醋;⑨液态氯化氢;⑩氨水
其中能导电的是 (填写符号,下同);属于强电解质的是 ;属于非电解质的是 。
(2)长期烧水的壶里有水垢,其中含有,难用酸除去,可先用纯碱溶液浸泡处理后转化为疏松,易溶于酸的,再用醋酸处理。用醋酸溶液浸泡处理的反应为 (用离子方程式表示),
(3)(亚硫酰氯)可用作农药杀虫剂、杀菌剂和除草剂等,将溶液蒸干并灼烧得不到无水,而将与混合加热可制得无水,结合化学方程式解释其原因: 。
(4)泡沫灭火器喷出的泡沫可以覆盖在燃烧物的表面,同时产生二氧化碳,阻止空气进入,请用一个离子方程式解释泡沫灭火器的工作原理: 。
(5)牙齿表面有一层坚硬的(羟基磷灰石)物质保护着,它在唾液中存在下列平衡:
当人进食后,口腔中的细菌在分解食物的过程中会产生有机酸,这时牙齿就会受到腐蚀,其原因是: 。
15.现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 。
(2)将六份溶液同等稀释10倍后,溶液的pH:
① ②,③ ④,⑤ ⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。
①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
16.自然界是各类物质相互依存的复杂体系,水溶液的离子平衡是一个重要方面。
(1)时,在的溶液中,有的电离成离子,则该温度下的电离平衡常数为 。
(2)在时,将的溶液与的溶液混合,若所得溶液为中性,则 。
(3)常温下将的溶液与的醋酸溶液混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为 。
(4)已知常温下部分弱电解质的电离平衡常数如下表:
化学式
电离常数
常温下,相同的三种溶液①溶液;②溶液;③溶液,其物质的量浓度由大到小的顺序是 (填序号)。
(5)已知时,的溶度积常数。则使恰好完全沉淀,即溶液中时,应调节的最小值a为多少 。
(6)查阅资料获得时部分弱酸的数据:、、。
①已知溶液呈弱碱性,试用离子反应方程式解释原因 。
②常温下,氢氟酸溶液加水稀释过程中,下列表达式数据变大的是 (填序号)。
A.B.C.D.
(7)已知在时,将浓度相等的与溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因 。
(8)同浓度的溶液和溶液相比:(选填“<”、“=”或“>”)后者溶液中: 前者溶液中
(9)已加溶液为中性,又知溶液加到溶液中有无色无味气体放出,现有时等浓度的5种溶液:请回答下列问题:
a.b.c.d.e.
问题1:试推断溶液的 7(填“>”、“<”或=)
问题2:将5种溶液按浓度由大到小的顺序排列是: (填序号)。
(10)已知常温下,相同物质的量浓度的溶液和溶液相比,溶液的较小。现将溶液和溶液等体积混合,各离子浓度关系正确的是________(填序号)。
A.
B.
C.
D.
17.在室温下,下列三种溶液:①溶液②溶液③溶液,请根据要求填写下列空白:
(1)溶液①呈 (填“酸”“碱”或“中”)性,其原因是 (用离子方程式表示)。
(2)溶液②③中的大小关系是② ③(填“>”“<”或“=”)。
(3)某温度时,测得的NaOH溶液的pH为11。在此温度下,将pH=a的NaOH溶液与pH=b的硫酸混合。
①若所得混合液为中性,且a=12,b=2,则 。
②若所得混合液的pH=10,且a=12,b=2,则 。
(4)常温下,某盐溶液M中存在的离子有、、、,存在的分子有、HA。
①写出的水解离子方程式: 。
②该溶液M中离子浓度由大到小关系为 。
18.在室温下,下列五种溶液:① 0.1mol/LNH4Cl溶液② 0.1mol/LCH3COONH4溶液
③ 0.1mol/LNH4HSO4溶液④ 0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液⑤ 0.1mol/L氨水,请根据要求填写下列空白:
(1)溶液①呈 (填“酸”、“碱”或“中”)性,其原因是 (用离子方程式表示)。
(2)溶液② ③中的大小关系是② ③。(填“>”、“<”或“=”)
(3)在溶液④ 中 (离子)的浓度为0.1mol/L;NH3·H2O和 (离子)的浓度之和为0.2mol/L。
(4)室温下,测得溶液② 的pH=7,CH3COO-与浓度的大小关系是 (填“>”、“<”或“=”)
19.(I)为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010mol·L-1氨水、0.1mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法 (填“正确”或“不正确”),并说明理由: 。
②乙取出10mL0.010mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是 。
(II)(1)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)= 。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性,NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式)。
20.Ⅰ、H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。
(1)以酚酞为指示剂(变色范围pH8.0 ~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。
(2)pH=11时,图中H3AsO3水溶液中三种微粒浓度由大到小顺序为 ;
(3)H3AsO4第一步电离方程式为 ;
(4)若pKa2=-1gHKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2= 。
Ⅱ、用0.1000mol L-1AgNO3滴定50.00mL L-3Cl-溶液的滴定曲线如图所示
(5)根据曲线数据计算可知Ksp(AgCl)数量级为 ;
(6)相同实验条件下,若改为0.0400mol L-1Cl-,反应终点c移到 ;(填“a”、“b”或“d”)
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若给为0.0500mol L-1Br-,反应终点c向 方向移动(填“a”、“b”或“d”)。
21.(1)常温下在20mLpH=12的Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO、CO (填“能”或“不能”)大量共存;
②当pH=8时,溶液中含碳元素的主要微粒为 ;
③已知在25℃时,HCO的电离平衡常数:K=5.0×10-11,当溶液中处于交叉点a时,溶液的pH= 。(保留1位小数,已知:lg2=0.3、lg3=0.5、lg5=0.7)
(2)CrO和Cr2O在溶液中可相互转化。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
若加水稀释,则将 (填:“变大”、“变小”、“不变”)。
②+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O还原成Cr3+,反应的离子方程式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.Ka1=,Ka2=,由于Ka1>Ka2,即>,所以[lg+lgc(HA-)]>[lg+lgc(A2-)],则[-lg-lgc(HA-)]<[-lg-+lgc(A2-)],据图可知曲线M上各点横纵坐标之和小于曲线N,所以曲线N代表-lg[]和-lgc(A2-)的关系,A正确;
B.Na2A溶液中存在物料守恒c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),B错误;
C.曲线N代表-lg[]和-lgc(A2-)的关系,所以曲线N代表的溶液中以HA-的电离为主,曲线M代表的溶液中以H2A的电离为主,H2A的电离程度更大,对水的电离抑制作用更强,所以水的电离程度:M点小于N点,C错误;
D.溶液中存在电荷守恒c(Na+)+ c(H+)=c(OH-)+c(HA-)+2c(A2-),D错误;
综上所述答案为A。
2.D
【分析】已知短周期主族元素R、W、X、Y、Z,其中R元素所在的周期数是其族序数的一半,且对应的两种常见氧化物均为酸性氧化物,则为S元素, X与其同主族另一元素单质构成原子反应堆导热剂,则X为Na元素,Y元素原子最外层电子数为m,次外层电子数为n,Z元素原子L层电子数为m+n,M层电子数为m-n,则n=2,m=6,故Z为Si,Y为O,W元素与Z元素在同一主族,W为C。由题意可推知 R、W、X、Y、Z五种元素分别是S、C、Na、O、Si。
【详解】A.R、X、Y 对应的简单离子半径:r(Na+)
C.将CO2与SO2分别通入Ba(NO3)2溶液中,通入CO2时无明显现象,通入SO2时有白色沉淀,现象不同,选项C正确;
D.H2O的熔、沸点比 H2S的熔、沸点高,是因为水分子间存在氢键,不是因为H2O比H2S稳定,选项D错误;
答案选D。
3.A
【详解】A.由图可知,当溶液pH保持在5,pCl为2、6时,汞分别为HgCl2、Hg(OH)2形式存在,故pCl由2改变至6时可使HgCl2转化为Hg(OH)2,A错误;
B.由图可知,当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl形式存在,B正确;
C.HgCl2是一种弱电解质,由图可知,汞会以HgCl+、离子形式存在,则其电离方程式是:2HgCl2 HgCl++,C正确;
D.已知HgS比FeS更难溶,可用于除去污水中的Hg2+可以加入FeS将Hg2+转化为更难溶的HgS沉淀,反应为FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq),D正确;
故选A。
4.C
【详解】A.蒸发CuCl溶液不能得到CuCl2晶体,本题中我们要考虑CuCl2的水解和HCl的挥发性,CuCl2水解方程式可以写为:CuCl2+2H2O=Cu(OH)2+2HCl,在加热蒸发条件下,HCl挥发,促进正向水解的进行,因此蒸发CuCl2溶液不能得到CuCl2晶体,A错误;
B.用NaOH溶液滴定HCl溶液,可以用酚酞作为指示剂,滴定终点即溶液呈现淡粉色,本题中,由图可知,NaOH溶液装于酸式滴定管中,滴定时,NaOH溶液应该装于碱式滴定管,B错误;
C.中和热的计算公式为:,装置的保温效果不好,会使得公式中T2-T1的差值减小,最后计算得出来的中和热的数值也会减小,但考虑到该反应是放热,最后的中和热是负值,故最后所测得的△H会偏大,C正确;
D.比较Ksp[AgCl]、Ksp[AgBr]的大小,应该于过量的NaCl溶液中滴加AgNO3溶液,使得Ag+全部转换为AgCl沉淀,后滴加NaBr溶液,观察是否有淡黄色沉淀产生,D错误;
故选C。
5.C
【分析】已知p(Ag)=-lgc(Ag+),p(X)=-lgc(X-),Ag+、Cl-浓度越大,浓度的负对数得到的数值越小,依据图像分析可知,溶解度:AgCl>AgBr>AgI,溶液中的离子浓度也是AgCl>AgBr>AgI,所以E线表示的是AgCl,F线表示的是AgBr,G线表示的是AgI;
【详解】A.由分析可知,G线是AgI的溶解平衡曲线,A错误;
B.坐标点p不在曲线上,在曲线E之上,形成的溶液是AgCl的不饱和溶液,B错误;
C.m点是沉淀溶解平衡线上的一点,说明是沉淀溶解平衡状态下的饱和溶液,C正确;
D.因为n点在曲线上,即处于沉淀溶解平衡状态,不存在净生成沉淀或有部分沉淀溶解的问题,表示的是AgI沉淀的沉淀溶解平衡状态,D错误;
故选C。
6.D
【分析】草酸属于二元素弱酸,应分步电离H2C2O4HC2O+H+、HC2OC2O+H+,草酸溶液中加入NaOH溶液,H2C2O4物质的量浓度逐渐减小,HC2O逐渐增大,后逐渐减小,C2O逐渐增大,因此Ⅰ代表H2C2O4,Ⅱ代表HC2O,Ⅲ代表C2O,据此分析;
【详解】A.根据上述分析,Ⅱ代表HC2O物质的量分数随pH变化,故A说法正确;
B.Ka1=,电离平衡常数只受温度的影响,取(1.2,0.5)点,c(HC2O)= c(H2C2O4),因此Ka1=c(H+)=10-1.2,同理Ka2=c(H+)=10-4.2,因此=103=1000,故B说法正确;
C.pH在2.5~5.5之间,HC2O物质的量分数逐渐减少,C2O物质的量分数逐渐增大,因此该阶段发生离子方程式为HC2O+OH-=C2O+H2O,故C说法正确;
D.当加入20mL等浓度NaOH溶液,充分反应后,溶质为Na2C2O4,C2O发生水解,其水解方程式为C2O+H2O HC2O+OH-,水也要电离出OH-,因此c(OH-)>c(HC2O),水解程度微弱,c(C2O)最大,即c(C2O)>c(OH-)>c(HC2O),故D说法错误;
答案为D。
7.D
【分析】H2A为二元弱酸,电离方程式为H2A HA-+ H+,HA- A2-+ H+,根据图象,随着溶液pH的增大,H2A的浓度逐渐减小,HA-的浓度逐渐增大,即①为H2A的浓度的变化曲线,②为HA-的浓度的变化曲线,随着溶液pH的进一步增大, HA-的浓度逐渐减小,A2-逐渐增大,则③为A2-浓度的变化曲线,据此分析解答。
【详解】A.H2A的第一步电离方程式为H2A HA-+ H+,根据图象,当pH=1.3时,H2A、HA-的浓度相等,即c(HA-)=c(H2A)则Ka1== c(H+)=10-1.3,故A正确;
B.根据物料守恒,pH在0~7中,c(HA-)+c(A2-)+c(H2A)=0.1mol L-1,故B正确;
C.根据图象,在pH3→6的过程中,HA-的浓度逐渐减小,A2-逐渐增大,主要发生反应HA-+OH-=A2-+H2O,故C正确;
D.根据图象,在pH=4.3时,c(HA-)=c(A2-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+ +c(HA-)+2c(A2-)= c(OH-)+ 3c(HA-),故D错误;
故选D。
8.D
【详解】A.溶液中,根据质子守恒得到,故A错误;
B.a点溶质为NaHR,溶液显碱性,说明HR-水解成都大于电离程度,促进水的电离,b点溶质为NaCl、H2R,抑制水的电离,因此水的电离程度:,故B错误;
C.a点溶质为NaHR,溶液显碱性,说明HR-水解成都大于电离程度,则a点溶液中:,故C错误;
D.b点溶质为NaCl、H2R且两者浓度之比为2:1,根据物料守恒得到b点溶液中:,故D正确。
综上所述,答案为D。
9.B
【分析】在100 mL 0.2 mol·L-1的NH3·H2O中含有溶质的物质的量n(NH3·H2O)=0.2 mol/L×0.1 L=0.02 mol,通入HCl气体时发生反应:NH3·H2O+HCl=NH4Cl+H2O,然后根据通入的HCl的物质的量,结合反应消耗关系,确定混合溶液的成分,发现溶液中各种微粒的浓度大小关系。
【详解】A.通入HCl的物质的量是0 mol时,溶液的溶质为NH3·H2O,由于NH3·H2O是弱电解质,主要以电解质分子存在,电离产生的、OH-的浓度远小于电解质分子的浓度,溶液中除NH3·H2O电离产生OH-外,还存在H2O电离产生OH-,故溶液中离子浓度大小关系为:c(NH3·H2O)>c(OH-)>c()>c(H+),A错误;
B.溶液中n(NH3·H2O)=0.2 mol/L×0.1 L=0.02 mol,当通入HCl的物质的量n(HCl)=0.005 mol<0.02 mol,二者发生反应:NH3·H2O+HCl=NH4Cl+H2O,二者反应的物质的量的比是1:1,n(NH3·H2O)过量=0.02 mol-0.005 mol=0.015 mol,反应后混合溶液中n(NH3·H2O):n(NH4Cl)=0.015 mol:0.005 mol=3:1,根据电荷守恒可得:c()+c(H+)=c(OH-)+c(Cl-),根据物料守恒可得c(NH3·H2O)+c()=4c(Cl-),将两个式子联立可得c(NH3·H2O)+4c(OH-)=3c()+4c(H+),B正确;
C.当通入HCl的物质的量是0.01 mol时,反应产生NH4Cl的物质的量是0.01 mol,剩余NH3·H2O的物质的量是0.01 mol,溶液为等物质的量的NH4Cl、NH3·H2O的混合溶液,根据电荷守恒可得c()+c(H+)=c(OH-)+c(Cl-),根据电荷守恒可知c(NH3·H2O)+c()=2c(Cl-),将两式联立可得c()+2c(H+)=c(NH3·H2O)+2c(OH-),C错误;
D.当通入HCl的物质的量是0.02 mol时,二者恰好反应产生NH4Cl,其物质的量是0.02 mol。该盐是强酸弱碱盐,发生水解反应产生NH3·H2O、H+,导致的物质的量比Cl-小,所以c(Cl-)>c(),但盐水解程度是微弱的,盐电离产生的离子浓度远大于弱电解质产生的离子浓度,盐水解产生的NH3·H2O的浓度远小于的浓度,因此c()>c(NH3·H2O),D错误;
故合理选项是B。
10.C
【详解】A.由a点,可计算出,其数量级为,A项正确;
B.HA为弱酸,若b点时消耗溶液的体积等于,则刚好生成,溶液显碱性,而b点显中性,则HA稍过量,所以b点时消耗溶液的体积小于,B项正确;
C.当消耗时,恰好完全反应,溶质为,根据电荷守恒和物料守恒可知,溶液中存在,C项错误;
D.根据,c点,可知,D项正确。
故选C。
11.D
【详解】A.测量溶液的pH不能用经水湿润的pH试纸,选项A错误;
B.锥形瓶在用水洗后,不能用待装液润洗2~3次,选项B错误;
C.将碱式滴定管的尖嘴向上是为了排出碱式滴定管中的气泡,而不是检查是否漏液,选项C错误;
D.氢氧化钾溶液放在碱式滴定管中滴定溶液,选项D正确;
答案选D。
12.C
【详解】A.在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色,橙色的Cr2O转化为黄色的CrO,故A正确;
B.铜离子水解消耗水中的氢氧根离子,促进水的电解,氢离子浓度增加,所以显酸性;离子方程式为Cu2++2H2O Cu(OH)2+2H+,故B正确;
C.草酸使酸性高锰酸钾溶液褪色,草酸为弱酸,离子方程式中应该以化学式形式存在,故C错误;
D.“84”消毒液的主要成分为次氯酸钠,洁厕灵主要成分为盐酸,消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O,故D正确;
故答案为C。
13.D
【详解】A.和浓盐酸反应需要加热,A项错误;
B.胶体粒子和、都能透过滤纸,B项错误;
C.电解饱和食盐水时,阳极生成,用淀粉溶液检验,阴极生成,用向下排空气法收集,C项错误;
D.酸性溶液有强氧化性,用酸式滴定管盛装,且酸性溶液呈紫色,可指示滴定终点,D项正确;
答案选D。
14.(1) ④⑤⑥⑦⑩ ②⑧⑨ ①
(2)
(3)能与水反应,而脱去中水
(4)
(5)当人进食后被细菌分解产生的有机酸与氢氧根离子反应,使平衡向右移动,牙齿表面的减少
【详解】(1)(1)干冰属于非电解质;氯化钠固体、碳酸钠固体、液态氯化氢为强电解质;液氯既不是电解质也不是非电解质;稀硫酸、溶液、氢氧化钡溶液、食醋、氨水均为电解质溶液,能导电,故填④⑤⑥⑦⑩、②⑧⑨、①;
(2)(2)与醋酸反应的离子方程式为:,故填;
(3)(3)能与水反应达到脱去中水的目的,其反应为,故填能与水反应,而脱去中水;
(4)(4)泡沫灭火器的主要成分为碳酸氢钠溶液和硫酸钠溶液,两者混合后发生完全双水解,其反应的离子方程式为,故填;
(5)(5)根据,当人进食后被细菌分解产生的有机酸与氢氧根离子反应,使平衡向右移动,牙齿表面的减少,故填当人进食后被细菌分解产生的有机酸与氢氧根离子反应,使平衡向右移动,牙齿表面的减少;
15.(1) ⑥ ②③④
(2) > > >
(3) > >
(4) 否 AB c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
【详解】(1)① ② ③ ④ 是酸或碱对水的电离起抑制作用,⑤ NH3·H2O是弱碱,CH3COOH是弱酸,反应后溶液中溶质:CH3COONH4、NH3·H2O,对水的电离抑制,⑥ 两者恰好完全反应,生成NaCl,对水的电离无影响,所以⑥ 的水的电离程度最大,② ③ ④ 溶液中c(H+)或c(OH-)相等,对水的电离影响相同,故答案为:⑥;②③④。
(2)①CH3COOH是弱酸,②HCl是强酸,稀释相同倍数,醋酸中的c(H+)小于盐酸中c(H+),pH:①>②;pH=12时,NH3·H2O是弱碱在稀释过程还要电离出一部分OH-,c(OH-)大于氢氧化钠溶液中c(OH-),③>④;⑤反应后溶液显碱性,⑥反应后溶液显中性,⑤>⑥,故答案为:>;>;>。
(3)混合溶液中c(Na+)>c(CN-),说明CN-的水解大HCN的电离,溶液显碱性,①c(OH-)>c(H+),②c(HCN)>c(CN-),故答案为:>;>。
(4)①醋酸是弱酸,氢氧化钠是强碱,两者恰好完全反应生成的CH3COONa是强碱弱酸盐,水溶液显碱性,因此这种看法不正确,填写:否,二者恰好完全反应的点在AB区间内;② 在C点溶液显酸性,此时的溶质是:CH3COOH、CH3COONa,CH3COOH的电离大于CH3COO-的水解,因此离子浓度由大到小的顺序:c(CH3COO-)> c(Na+)> c(H+)> c(OH-),故答案为:否;AB;c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
16.(1)1×10 5
(2)10:1
(3)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(4)①>②>③
(5)5
(6) ABD
(7),说明HF的电离程度大于氟离子的水解程度,所以溶液显酸性
(8)>
(9) > e>a>c>b>d
(10)AB
【详解】(1)时,在的溶液中,有的电离成离子,则电离出的氢离子浓度为,则该温度下的电离平衡常数为;故答案为:1×10 5。
(2)在时,将的溶液与的溶液混合,若所得溶液为中性,,则10:1;故答案为:10:1。
(3)常温下将的溶液与的醋酸溶液混合后溶液显酸性,溶质是醋酸和醋酸钠且两者物质的量浓度相等,由于溶液显酸性,说明醋酸电离程度大于醋酸根水解程度,则混合后溶液中各离子浓度的大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
(4)根据“越弱越水解”,得到碳酸钠水解程度最大,次氯酸钠水解程度次之,氟化钠水解程度最小,由于三者水解出的氢氧根浓度相同,则水解程度越大,说明其物质的量浓度越小,因此常温下,相同的三种溶液①溶液;②溶液;③溶液,其物质的量浓度由大到小的顺序是①>②>③;故答案为:①>②>③。
(5)已知时,的溶度积常数。则使恰好完全沉淀,即溶液中时,根据,则,即pH=5,因此应调节的最小值a为5;故答案为:5。
(6)①已知溶液呈弱碱性,硫氰根水解显碱性,其离子反应方程式解释原因;故答案为:。
②A.氢氟酸溶液加水稀释过程中,氢离子浓度增大,离子积常数不变,因此变大,故A符合题意;B.在加水过程中氢离子物质的量和氟离子物质的量都增大,但由于在加水过程中水电离出的氢离子成增大趋势,因此变大,故B符合题意;C.氢氟酸溶液加水稀释过程中,减小,故C不符合题意;D.氢氟酸溶液加水稀释过程中,氟离子浓度减小,因此增大,故D符合题意;综上所述,答案为ABD。
(7)已知在时,将浓度相等的与溶液等体积混合,溶液呈酸性,其溶液呈酸性的原因,说明HF的电离程度大于氟离子的水解程度,所以溶液显酸性;故答案为:,说明HF的电离程度大于氟离子的水解程度,所以溶液显酸性。
(8)同浓度的溶液和溶液相比,两溶液中钾离子浓度和钠离子浓度相等,由于醋酸根水解程度大于氟离子水解程度,因此溶液中醋酸根离子浓度小于氟离子浓度,则溶液中:>;故答案为:>。
(9)问题1:已加溶液为中性,说明氨水的电离平衡常数等于醋酸的电离平衡常数,又知溶液加到溶液中有无色无味气体放出,说明氨水的电离平衡常数大于碳酸的电离平衡常数,根据“谁强显谁性”即谁相对强显谁的性质,则溶液的>7;故答案为:>。
问题2:是电离出的氢离子抑制铵根水解,则铵根离子浓度最大;是单一水解,铵根离子浓度次之;、、是相互促进的双水解,根据“越弱越水解”,则碳酸氢根水解程度>醋酸根水解程度>硫氰根水解程度,酸根水解程度越大,促进铵根水解程度越大,铵根离子浓度越小,因此5种溶液按浓度由大到小的顺序排列是:e>a>c>b>d;故答案为:e>a>c>b>d。
(10)已知常温下,相同物质的量浓度的溶液和溶液相比,溶液的较小,说明次氯酸跟水解程度小于碳酸根水解程度,说明次氯酸的电离平衡常数大于碳酸氢根的电离平衡常数,现将溶液和溶液等体积混合,A.碳酸根水解程度大于次氯酸跟水解程度,水解是微弱的,因此,故A正确;B.根据物料守恒得到,故B正确;C.根据质子守恒得到,故C错误;D.根据物料守恒得到,故D错误;综上所述,答案为:AB。
17.(1) 酸
(2)<
(3) 1:10 1:9
(4) >>>
【详解】(1)NH4Cl是强酸弱碱盐,NH发生水解反应,所以溶液呈酸性;
(2)溶液②中NH、CH3COO-水解相互促进;是强酸的酸式盐,电离出的H+抑制NH的水解,的大小关系是②<③;
(3)某温度时,测得的NaOH溶液的pH为11,、,在此温度下,; pH=12的NaOH溶液中, pH=2的硫酸中:
①若所得混合液为中性,则,1:10;
②若所得混合液的pH=10,,则1:9;
(4)①溶液中同时存在、HA,说明HA是弱酸,的水解离子方程式为;
②溶液中同时存在、HA,说明HA是弱酸,水解,溶液呈碱性,该溶液M中离子浓度由大到小关系为>>>。
18.(1) 酸 +H2O NH3·H2O+H+
(2)<
(3) Cl-
(4)=
【详解】(1)氯化铵为强酸弱碱盐,铵根离子能发生水解:+H2O NH3·H2O+H+,导致溶液中的氢离子浓度大于氢氧根离子浓度,溶液显酸性,故答案为:酸;+H2O NH3·H2O+H+;
(2)② 0.1mol/LCH3COONH4溶液中醋酸根离子水解促进了铵根离子水解,使铵根水解程度增大,③ 0.1mol/LNH4HSO4溶液中电离出的氢离子抑制铵根离子的水解,使铵根水解程度减小,因此③中铵根离子浓度大于②,故答案为:<;
(3)④0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液中氯离子不发生水解,其离子浓度为0.1mol/L,根据物料守恒可知NH3·H2O和的浓度和为0.1mol/L+0.1mol/L=0.2mol/L,故答案为:Cl-;;
(4)②0.1mol/LCH3COONH4溶液的pH值等于7,说明铵根离子和醋酸根离子的水解程度相同,则溶液中的等于,故答案为:=。
19. 正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 a-2<b<a 1×10-8 mol·L-1 中 碱 NH
【详解】(I)①假设现有0.010 mol·L-1氢氧化钠溶液,c(OH-)=0.01 mol·L-1, c(H+)=10-12 mol·L-1,用pH试纸测出pH为12,现用pH试纸测出0.010 mol·L-1氨水的pH为10,所以NH3·H2O是弱电解质,正确;正确答案: 正确; 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 。
②假设氨水为强碱,0.010 mol·L-1氨水pH=a,用蒸馏水稀释至100倍,其pH=b=a-2,现确认NH3·H2O是弱电解质,存在电离平衡,所以a-2<b<a ;正确选项:a-2<b<a。
(II) (1)在pH=6的CH3COOH与CH3COONa的混合溶液中,c(H+)=10-6 mol/L,c(OH-)=10-14/10-6= 1×10-8 mol·L-1,正确答案:1×10-8 mol·L-1。
(2)醋酸和NH3·H2O的电离平衡常数均为1.74×10-5,电离能力相同,所以CH3COONH4溶液中两种离子水解能力相同,溶液呈中性;由CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O反应可知醋酸的酸性大于碳酸的酸性,NH4HCO3溶液中,HCO3-水解能力大于NH4+水解能力,所以溶液显碱性,离子浓度最大为NH4+;正确答案:中; 碱 ; NH。
20. OH-+H3AsO3=H2AsO3-+H2O c(H2AsO3-)>c(HAsO32-)>c(H3AsO3) H3AsO4 H2AsO4-+H+ 10-7 10-10 b d
【分析】Ⅰ、(1)根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应;
(2)图象中分析判断pH=11时,图中H3AsO3水溶液中三种微粒浓度;
(3)多元弱酸分步电离,H3AsO4第一步电离方程式H3AsO4 H2AsO4-+H+;
(4)H3AsO4第二步电离的电离常数为Ka2=,pH=7时c(H2AsO4-)=c(HAsO42-);
Ⅱ、(5)沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lgc(Cl-)=5,据此计算;
(6)曲线上的点是达到沉淀溶解平衡的平衡点,满足c(Ag+) c(Cl-)=Ksp(AgCl);溶度积常数只随温度改变而改变,改变滴定反应液浓度不改变溶度积常数;
(7)AgBr比AgCl更难溶,达到沉淀溶解平衡时Br-的浓度更低。
【详解】Ⅰ、(1)根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应,同时还生成水,离子方程式为:OH-+H3AsO3=H2AsO3-+H2O,
故答案为OH-+H3AsO3=H2AsO3-+H2O;
(2)图象中分析判断pH=11时,图中H3AsO3水溶液中三种微粒浓度为:c(H2AsO3-)>c(HAsO32-)>c(H3AsO3),
故答案为c(H2AsO3-)>c(HAsO32-)>c(H3AsO3);
(3)多元弱酸分步电离,H3AsO4第一步电离方程式为:H3AsO4 H2AsO4-+H+,
故答案为H3AsO4 H2AsO4-+H+;
(4)H3AsO4第二步电离的电离常数为Ka2=,PH=7时c(H2AsO4-)=c(HAsO42-),Ka2=c(H+)=10-7,
故答案为10-7;
Ⅱ、(5)沉淀滴定时到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lgc(Cl-)=5,达到沉淀溶解平衡时,c(Ag+)=c(Cl-)=10-5mol/L,所以根据曲线数据计算可知Ksp(AgCl)的数量级为10-10,
故答案为b;
(6)溶度积常数只随温度改变而改变,改变滴定反应液浓度不改变溶度积常数,所以相同实验条件下,若改为0.0400mol L-1Cl-,则所需AgNO3溶液体积就变为mL=20mL,反应终点c移到b点,
故答案为b;
(7)AgBr比AgCl更难溶,达到沉淀溶解平衡时Br-的浓度更低,则-lgc(Br-)值更大,消耗AgNO3溶液的体积不变,反应终点c向d点,
故答案为d。
【点睛】本题考查沉淀溶解平衡相关知识,明确达到沉淀溶解平衡时的关系式,把握图象反应的信息,掌握基础是解题关键。
21. 不能 HCO 10.3 2CrO+2H+ Cr2O+H2O 变大 Cr2O+3HSO+5H+=2Cr3++3SO+4H2O
【分析】(1)根据图象分析判断溶液中的微粒关系;当溶液中处于交叉点a时,c(CO)= c(HCO),结合HCO的电离平衡常数:K=5.0×10-11计算判断;
(2)①CrO在酸性条件下可转化为Cr2O,用离子反应方程式表示为:2CrO+2H+ Cr2O+H2O;若加水稀释,溶液的酸性减弱,c(H+)减小,平衡逆向移动,据此分析;
②用NaHSO3将废液中的Cr2O还原成Cr3+,Cr元素的化合价降低,则S元素的化合价升高,生成硫酸根离子,并结合电荷、电子守恒配平。
【详解】(1)①由图象可知,pH>8时,溶液中只含有HCO、CO,pH<8时,溶液中只含有HCO、H2CO3,则在同一溶液中, H2CO3、HCO、CO不能大量共存;
②由图象可知,当pH=8时,溶液中含碳元素的主要微粒为HCO;
③已知在25℃时,HCO的电离平衡常数:K=5.0×10-11,当溶液中处于交叉点a时,溶液的c(CO)= c(HCO),HCO的电离平衡常数:K==c(H+)=5.0×10-11,则pH=11- lg5=11-0.7=10.3;
(2)①CrO在酸性条件下可转化为Cr2O,用离子反应方程式表示为:2CrO+2H+ Cr2O+H2O;若加水稀释,溶液的酸性减弱,c(H+)减小,平衡逆向移动,c(CrO)增大,c(Cr2O)浓度减小,则将变大;
②用NaHSO3将废液中的Cr2O还原成Cr3+,Cr元素的化合价降低,则S元素的化合价升高,生成硫酸根离子,由电荷、电子守恒及原子守恒可知离子反应为Cr2O+3HSO+5H+=2Cr3++3SO+4H2O。
答案第1页,共2页
答案第1页,共2页
