浙江省宁波市地区2023-2024学年高二上学期12月月考化学试卷(PDF含答案)
文档属性
| 名称 | 浙江省宁波市地区2023-2024学年高二上学期12月月考化学试卷(PDF含答案) |  | |
| 格式 | |||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 16:11:34 | ||
图片预览



文档简介
宁波地区高二化学学科 12 月月考试卷
考生须知:1、本卷共 24小题,满分 100 分,时间 80 分钟, 2、试题答案填涂在答题卡上
2.本试题可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Fe-56
一、单选题(只有一个正确答案,1-15 题每题每题 2 分,16-20 题每题 3 分,共 45 分)
1. 发明创造为人类文明进步做出了巨大贡献。下列装置工作时,涉及的能量转化主要是化学能与电能之间
的转化的是
A.新型太阳能路灯 B.“长征五号”遥四运火箭发射 C.铅蓄电池 D.煤气灶载
2. 下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的 S<0
C.使用催化剂可降低反应的 H和反应的活化能,从而提高化学反应速率
D.升高温度,可使单位体积内活化分子数增多,反应速率加快
3. 化学与社会、生产、生活密切相关,下列说法正确的是
A. BaCO3可用于胃肠 X射线造影检查
B. 明矾常用作净水剂,是因为它能够消毒杀菌
C. 钢铁制品和纯铜制品均既能发生吸氧腐蚀又能发生析氢腐蚀
D. 使用Na 2S做沉淀剂去除工业废水中Cu2
4. 化学与生活关系密切,下列说法正确的是
A. 合成氨工业采用金属镍催化,这样做是为了提高平衡转化率
B. 钢管表面镀锌可以防止钢管被腐蚀,镀层破损后,钢管反而会加速腐蚀
C. 打印机黑色的墨粉中含有铁的氧化物,这种氧化物是氧化铁
D. 水垢中的CaSO4,可先用Na 2CO3溶液处理,而后用酸除去
5. 下列说法或有关化学用语的表达正确的是
A. 能级能量大小关系:4f 5d
B. 基态铜原子( 929Cu )的价层电子排布式:3d 4s2
C. Ca处于激发态的电子排布式可能为:1s22s22p63p64p2
D. 基态Na 的轨道表示式:
高二化学学科 1
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
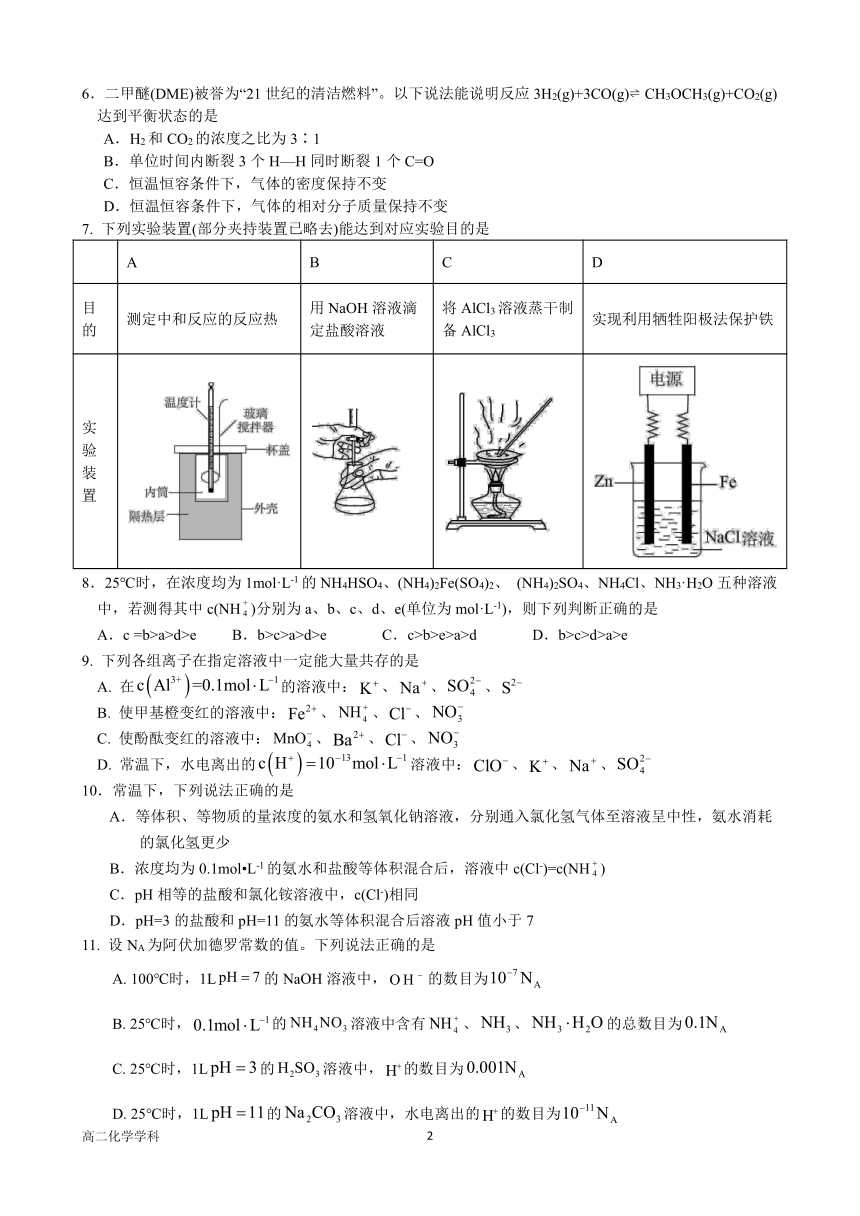
6.二甲醚(DME)被誉为“21世纪的清洁燃料”。以下说法能说明反应 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
达到平衡状态的是
A.H2和 CO2的浓度之比为 3∶1
B.单位时间内断裂 3个 H—H同时断裂 1个 C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒容条件下,气体的相对分子质量保持不变
7. 下列实验装置(部分夹持装置已略去)能达到对应实验目的是
A B C D
目 用 NaOH溶液滴 将 AlCl3溶液蒸干制
测定中和反应的反应热 实现利用牺牲阳极法保护铁
的 定盐酸溶液 备 AlCl3
实
验
装
置
8.25℃时,在浓度均为 1mol·L-1的 NH4HSO4、(NH4)2Fe(SO4)2、 (NH4)2SO4、NH4Cl、NH3·H2O五种溶液
中,若测得其中 c(NH +4 )分别为 a、b、c、d、e(单位为 mol·L-1),则下列判断正确的是
A.c =b>a>d>e B.b>c>a>d>e C.c>b>e>a>d D.b>c>d>a>e
9. 下列各组离子在指定溶液中一定能大量共存的是
A. c Al3+在 =0.1mol L 1 2 的溶液中:K 、Na 、SO 、S2 4
B. 使甲基橙变红的溶液中:Fe2 、NH 4 、Cl 、NO3
C. 使酚酞变红的溶液中:MnO 、Ba2 、Cl 4 、NO
3
D. 常温下,水电离出的 c H 10 13mol L 1溶液中:ClO 、K 、Na 、SO2 4
10.常温下,下列说法正确的是
A.等体积、等物质的量浓度的氨水和氢氧化钠溶液,分别通入氯化氢气体至溶液呈中性,氨水消耗
的氯化氢更少
B .浓度均为 0.1mol L-1的氨水和盐酸等体积混合后,溶液中 c(Cl-)=c(NH 4 )
C.pH相等的盐酸和氯化铵溶液中,c(Cl-)相同
D.pH=3的盐酸和 pH=11的氨水等体积混合后溶液 pH值小于 7
11. 设 NA为阿伏加德罗常数的值。下列说法正确的是
A. 100℃时,1L pH 7 7的 NaOH溶液中,OH 的数目为10 NA
B. 25℃时,0.1mol L 1的NH4NO 3溶液中含有NH 4 、NH3、NH3 H2O的总数目为0.1NA
C. 25℃时,1L pH 3的H 2SO3溶液中,H 的数目为0.001NA
D. 25℃时,1L pH 11 11的Na 2CO3溶液中,水电离出的H 的数目为10 NA
高二化学学科 2
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
12. 下列说法正确的是
A. 错误,违反了泡利不相容原理
B. 各能级最多容纳的电子数是该能级原子轨道数的二倍,支持这一结论的理论是构造原理
C. 6C的电子排布式1s
22s22p2x 违反了洪特规则
D. 电子排布式 22Ti 1s22s22p63s23p63d4违反了泡利不相容原理
13. 向含HCN的废水中加入铁粉和K2CO3 可制备K4 Fe CN 6 ,发生反应:
6HCN Fe 2K 2CO3 K 4 Fe CN H 2 2CO6 2 2H 2O ,下列说法错误的是
A. 依据反应可知:Ka HCN >Ka1 H2CO3 ;还原性:Fe H2
B. 基态碳原子和基态氮原子的未成对电子之比为 2∶3
C. Fe位于周期表中第 VIII族;反应中 Fe失去 4s2电子
D. 离子半径大小:N3->O2-
14. 常温时,下列关于溶液的 pH或微粒的物质的量浓度的说法不.正.确.的是
A. pH 3的二元弱酸H2R溶液与 pH=11的 NaOH溶液混合后,混合液的 pH等于 7,则反应后的
2- -
混合液中: 2c R +c HR =c Na+
B. 某溶液中只存在Cl 、OH NH 、 4 、H 四种离子,则一定不存在下列关系:
c NH+4 >c Cl- >c H+ >c OH-
C. 向NH4HSO4溶液中加入等物质的量的 NaOH形成的溶液中:
c Na+ =c SO2-4 >c NH+ -4 >c OH >c H+
D. 将0.2mol L 1的某一元酸 HA溶液和0.1mol L 1NaOH 溶液等体积混合后溶液 pH大于 7,
-
则反应后的混合液中: 2c OH +c A- =2c H+ +c HA
15. 下列实验操作、现象及结论均正确是
选
操作和现象 结论
项
1
常温下,用 pH计分别测定等体积1mol L CH3COONH4 溶液和 两种CH3COONHA 4溶液中水
0.1mol L 1CH3COONH4溶液的 pH,pH均为 7 的电离程度相同
向 2mL1mol L 1的KI溶液中滴加 2mL0.1mol L 1的FeCl3 溶液,
B 充分反应后加入 2mLCCl4 ,取上层溶液滴加 KSCN溶液,溶液变 FeCl3 与 KI的反应存在限度
红色
C 向溶有SO2 的BaCl2的溶液中通入气体 X,出现白色沉淀 X具有强氧化性
向 2mL0.1mol L 1 MgCl2 溶液中滴入 3滴 2mol L 1NaOH溶液,
同温度下的Ksp:
D
再滴入 4滴0.1mol L 1 FeCl3 溶液,先产生白色沉淀,后产生红 Mg OH 2 Fe OH 3
褐色沉淀
高二化学学科 3
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
16. 如图(Ea表示活化能)是 CH4与 Cl2生成 CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列
说法正确的是( )
A. Cl·可由 Cl2在高温条件下生成,是 CH4与 Cl2反应
的催化剂
B. 升高温度,Ea1、Ea2均减小,反应速率加快
C. 增大 Cl2的浓度,可提高反应速率,但不影响△H
的大小
D. 第一步反应的速率大于第二步反应
17. 电化学降解NO3 的原理如图所示,下列说法正确
的是
A. N为电源的正极
B. 电池工作时,阴极区的溶液 pH逐渐变大
C. Pt 电极上的反应式为 2H2O 4e O2 4H
D. 每生成 5.6gN2,左右两侧溶液质量变化差 10.4g
18. 下列叙述及对应图示错误的是
A. 图甲是某温度下 c CH3COOH c CH3COO 0.100mol L 1的醋酸与醋酸钠混合溶液中
c CH3COOH 、 c CH 3COO 与 pH的关系曲线, pH 3的溶液中: Ka 10 4.75
B. 图乙是恒温密闭容器中发生反应CaCO3 s CaO s CO2 g 时, c CO2 随反应时间变化的
曲线, t1时刻改变的条件可能是缩小容器的体积
C. 图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线, t1时刻溶液的温度最高
D. 图丁是在0.1mol L 1的Na2CO3溶液中加水稀释,随着加入水的体积的增大,溶液中 c HCO 3 的
变化曲线,Na2CO3的水解程度:A点小于 B点
高二化学学科 4
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
19. 常温时,AgCl、AgSCN、Ag2CrO4的沉淀溶解平衡曲线如图所示。
+ n-
已知:Ksp AgCl >Ksp AgSCN , pAg=-lgc Ag , pX=-lgc X 。下列说法正确的是
A. 图中 x代表AgCl曲线,z代表AgSCN曲线
B. 常温时,AgCl s SCN aq AgSCN s Cl aq 的平衡常数K 2
C. 常温时,若增大 p点的阴离子浓度,则 y上的点沿曲线向上移动
D. 2 相同温度下,在Cl 和CrO4 的物质的量浓度均为 0.1mol L 的溶液中,
滴入少量 0.1mol / LAgNO3溶液,先产生AgCl沉淀
20.25℃时,以 NaOH溶液调节 0.1mol·L-1二元弱酸 H2A溶液的 pH,溶液中的 H2A、HA-、A2-的物质的
c(X)
量分数δ(X)随 pH的变化如图所示[已知δ(X) c(H A)+c(HA- )+c(A2- ) ]。下列说法不.正.确.的是2
A.二元弱酸 H2A的 pKa1=1.2(已知:pKa=-lgKa)
B.20.0mL0.1mol·L-1的H2A溶液与 30.0mL0.1mol·L-1NaOH
溶液混合,混合液的 pH=4.2
C.往 H2A溶液中滴加 NaOH 溶液的过程中,一定存在:
c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.在 0.1mol·L-1NaHA溶液中,各离子浓度大小关系:
c(Na+)>c(HA-)>c(A2-)>c(OH-)
二、填空题(本题包括 4小题,共 55分)
21. (12 分)回答下列问题。
(1)现有常温下 pH 2 的盐酸(甲)和 pH 2的醋酸溶液
(乙),请根据下列操作回答:
①常温下,0.1mol L 1 CH3COOH 溶液加水稀释,下列数值一定变小的是___________(填字母)。
c H
+ c OH-
A c H+ B C c H . . . c OH D.
c CH3COOH c H+
高二化学学科 5
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
②取 10mL乙溶液,加入少量无水CH3COONa 固体(假设加入固体前后,溶液体积保持不变),待固体溶解
c H+
后,溶液中 的值将___________(填“增大”“减小”或“无法确定”)。
c CH3COOH
③相同条件下,取等体积的甲、乙两溶液,分别与 0.1mol/LNaOH溶液反应,消耗 NaOH溶液的体积
(甲)___________(乙)(填“>”“<”或“=”)。
2 0.001mol L 1 HCl c H+ 1.0 10 9mol L 1( )某温度下,测得 的 溶液中,水电离出的 ,此温度下,
将VaLpH 4 HCl溶液和VbLpH 9的Ba OH 2 溶液混合均匀(忽略混合后溶液体积的变化),测得溶液的
pH 7则Va : Vb ___________。
(3)已知:在 25℃,有关弱电解质的电离平衡常数如下表有下表:
弱电解质 NH3 H2O HClO H2CO3 H2SO3
Ka1 4.2 10
7 K 2a1 1.54 10
5 8
电离常数 Kb 1.8 10 Ka 4.7 10
K 5.6 10 11 K 1.02 10 7a2 a2
c SO2-
①将SO - 32 通入该氨水中,当 c OH 降至1.0 10 7mol L 1时,溶液中的 =c ___________。HSO -3
②下列微粒在溶液中不能大量共存的是___________。
a SO2 HCO b ClO HCO c HSO CO2 . 3 、 3 . 、 3 . 3 、 3 d.HClO、HCO
-
3
22.(12 分) 前四周期元素 A、B、C、D、E原子序数依次增大,其相关性质如表所示:
A 2p能级电子半充满
B 与 A同周期,且原子核外有 2个未成对电子
C 基态原子核外有 6个原子轨道排有电子,且只有 1个未成对电子
D 其基态原子外围电子排布式为 nsn-1npn+1
E 前四周期元素中,E元素基态原子未成对电子数最多
请根据以上情况,回答下列问题:
(1)A元素在周期表中的位置为______________,其基态原子的价电子排布图为______________。
(2)A、B、D三种元素第一电离能由大到小的顺序为_______(用元素符号表示)。B、C、D三种元素的简
单离子的半径由大到小的顺序为_______(用离子符号表示)。
(3)E元素基态原子核外有_______种空间运动状态不同的电子,该元素的价层电子排布式为_______。
高二化学学科 6
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
23.(15分)探究 CH3OH合成反应化学平衡的影响因素,有利于提高 CH3OH的产率。
以 CO2、H2为原料合成 CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1<0
Ⅱ.CO(g)+2H2(g) CH3OH(g)△H2
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g)△H3>0
已知 CO(g)、H2(g)、CH3OH(g)的标准燃烧热分别为 285.8kJ mol-1,283.0kJ mol-1,761.0kJ mol-1回答下列
问题:
(1)△H2=_______kJ mol-1。
(2)一定条件下,向体积一定的恒容密闭容器中通入 1mol CO2和 3mol H2发生上述反应,达到平衡时,
容器中 CH3OH(g)为 amol,CO为 bmol,此时 H2O(g)的物质的量为_______mol(用含 a,b的代数式表示,
下同),反应Ⅲ的平衡常数为_______
(3)不同压强下,按照 n(CO2):n(H2)=1:3投料,实验测定 CH3OH的平衡产率(图 1)和 CO2的平衡转化
率(图 2)随温度的变化关系如图所示。
n CO2 n CO 初始 2 平衡
已知:CO2的平衡转化率= ×100%n CO2 初始
n CH3OH
CH3OH的平衡产率= 平衡 ×100%n CO2 初始
① 图 1 中 , 一 定 压 强 下 , CH3OH 的 平 衡 产 率 随 温 度 升 高 而 下 降 的 原 因 是
___________________________________。
② 图 1中,压强 p1、p2、p3由大到小的顺序为__________ 。
③ 图 2 中 T1 温 度 时 , 三 条 曲 线 几 乎 交 于 一 点 的 原 因 是
____________________________________________________。
(4)为同时提高 CO2的平衡转化率和 CH3OH的平衡产率,应选择的反应条件为___ 。
A. 低温、高压 B. 高温、低压
C. 低温、低压 D. 高温、高压
高二化学学科 7
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
24. (16分)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于 0.035g/mL。
某研究小组用 0.1000mol L 1NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。
Ⅰ.实验步骤
A.冷却至室温后,在___________(填仪器名称)中定容配成 100mL白醋溶液。
B.量取 20.00mL待测白醋溶液于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为0.1000mol L 1标准 NaOH溶液装入碱式滴定管,调节液面记下读数。如果液面位
置如右图所示,则此时的读数为___________mL
E.继续滴定至终点,记下最终读数。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入 NaOH标准溶液,边滴边摇动锥形瓶。
G.用干燥的___________(填仪器名称)量取食用白醋样品 10.00mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
(1)以上步骤的正确顺序为 G→A→_____→______→D→____→_____→H(用编号字母填写)
(2)A中的仪器为___________,G中的仪器为___________。
(3)D中的读数为___________mL。
Ⅱ.实验记录
滴定次数
实验数据
1 2 3 4
V(样品)/mL 20.00 20.00 20.00 20.00
滴定前 V(NaOH)/mL 0.00 0.10 0.20 1.00
滴定后 V(NaOH)/mL 15.95 15.10 15.25 15.95
Ⅲ.数据处理与讨论
(4)按数据处理,市售白醋中醋酸的含量=___________g 100mL 1 (保留四位有效数字)。
(5)若测定结果偏低,其原因可能是___________
A. 滴定过程中振摇时有液滴溅出
B. 滴定前仰视读数,滴定后读数正确
C. 盛装待测液的锥形瓶用蒸馏水洗过后未干燥
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
Ⅳ.实验讨论:
(6)某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶
c CH3COOH 1
液中 c CH COO 1.8 103 ,则此时溶液中的 pH ___________。(已知室温下醋酸的3
Ka 1.8 10
5 ),滴定终点的现象为____________________________________________。
高二化学学科 8
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
宁波地区高二化学学科 12 月月考试卷答案
1-5CDDDC 6-10DABCA 11-15CCACB 16-20 CBCDB
21(12 分,每空 2 分)(1) ①. A ②. 减小 ③. <
(2)9:1
(3) ① 1.02 ②. c
22(12 分,每空 2 分)(1) ①. 第二周期ⅤA族; ②. ;
(2) ①. N>O>S; ②. S2->O2->Na+;
(3) ①15; ②3d54s1;
23(15 分,第(1)题 3 分,其余每空 2 分)(1)-90.8
(2) ① a+b ②. b a b
1 a b 3 3a b
(3) ①. 生成 CH3OH的反应正方向放热,温度升高,平衡逆向移动,甲醇的产率下降
② p1>p2>p3 ③T1时以反应 III为主,反应 III前后气体分子数相等,压强改变对平衡没有影响
(4) A
24(16 分)(1) G→A→_C_→__B__→D→_F__→__E__→H(2) ① 100m容量瓶 ②. 酸式滴
定管
(3)0.60 (4)4.500 (5)AB
(6) ①8 滴入最后半滴 NaOH溶液,溶液会由无色变为浅红色,且半分钟内不褪色
高二化学学科 9
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
考生须知:1、本卷共 24小题,满分 100 分,时间 80 分钟, 2、试题答案填涂在答题卡上
2.本试题可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Fe-56
一、单选题(只有一个正确答案,1-15 题每题每题 2 分,16-20 题每题 3 分,共 45 分)
1. 发明创造为人类文明进步做出了巨大贡献。下列装置工作时,涉及的能量转化主要是化学能与电能之间
的转化的是
A.新型太阳能路灯 B.“长征五号”遥四运火箭发射 C.铅蓄电池 D.煤气灶载
2. 下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的 S<0
C.使用催化剂可降低反应的 H和反应的活化能,从而提高化学反应速率
D.升高温度,可使单位体积内活化分子数增多,反应速率加快
3. 化学与社会、生产、生活密切相关,下列说法正确的是
A. BaCO3可用于胃肠 X射线造影检查
B. 明矾常用作净水剂,是因为它能够消毒杀菌
C. 钢铁制品和纯铜制品均既能发生吸氧腐蚀又能发生析氢腐蚀
D. 使用Na 2S做沉淀剂去除工业废水中Cu2
4. 化学与生活关系密切,下列说法正确的是
A. 合成氨工业采用金属镍催化,这样做是为了提高平衡转化率
B. 钢管表面镀锌可以防止钢管被腐蚀,镀层破损后,钢管反而会加速腐蚀
C. 打印机黑色的墨粉中含有铁的氧化物,这种氧化物是氧化铁
D. 水垢中的CaSO4,可先用Na 2CO3溶液处理,而后用酸除去
5. 下列说法或有关化学用语的表达正确的是
A. 能级能量大小关系:4f 5d
B. 基态铜原子( 929Cu )的价层电子排布式:3d 4s2
C. Ca处于激发态的电子排布式可能为:1s22s22p63p64p2
D. 基态Na 的轨道表示式:
高二化学学科 1
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
6.二甲醚(DME)被誉为“21世纪的清洁燃料”。以下说法能说明反应 3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
达到平衡状态的是
A.H2和 CO2的浓度之比为 3∶1
B.单位时间内断裂 3个 H—H同时断裂 1个 C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒容条件下,气体的相对分子质量保持不变
7. 下列实验装置(部分夹持装置已略去)能达到对应实验目的是
A B C D
目 用 NaOH溶液滴 将 AlCl3溶液蒸干制
测定中和反应的反应热 实现利用牺牲阳极法保护铁
的 定盐酸溶液 备 AlCl3
实
验
装
置
8.25℃时,在浓度均为 1mol·L-1的 NH4HSO4、(NH4)2Fe(SO4)2、 (NH4)2SO4、NH4Cl、NH3·H2O五种溶液
中,若测得其中 c(NH +4 )分别为 a、b、c、d、e(单位为 mol·L-1),则下列判断正确的是
A.c =b>a>d>e B.b>c>a>d>e C.c>b>e>a>d D.b>c>d>a>e
9. 下列各组离子在指定溶液中一定能大量共存的是
A. c Al3+在 =0.1mol L 1 2 的溶液中:K 、Na 、SO 、S2 4
B. 使甲基橙变红的溶液中:Fe2 、NH 4 、Cl 、NO3
C. 使酚酞变红的溶液中:MnO 、Ba2 、Cl 4 、NO
3
D. 常温下,水电离出的 c H 10 13mol L 1溶液中:ClO 、K 、Na 、SO2 4
10.常温下,下列说法正确的是
A.等体积、等物质的量浓度的氨水和氢氧化钠溶液,分别通入氯化氢气体至溶液呈中性,氨水消耗
的氯化氢更少
B .浓度均为 0.1mol L-1的氨水和盐酸等体积混合后,溶液中 c(Cl-)=c(NH 4 )
C.pH相等的盐酸和氯化铵溶液中,c(Cl-)相同
D.pH=3的盐酸和 pH=11的氨水等体积混合后溶液 pH值小于 7
11. 设 NA为阿伏加德罗常数的值。下列说法正确的是
A. 100℃时,1L pH 7 7的 NaOH溶液中,OH 的数目为10 NA
B. 25℃时,0.1mol L 1的NH4NO 3溶液中含有NH 4 、NH3、NH3 H2O的总数目为0.1NA
C. 25℃时,1L pH 3的H 2SO3溶液中,H 的数目为0.001NA
D. 25℃时,1L pH 11 11的Na 2CO3溶液中,水电离出的H 的数目为10 NA
高二化学学科 2
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
12. 下列说法正确的是
A. 错误,违反了泡利不相容原理
B. 各能级最多容纳的电子数是该能级原子轨道数的二倍,支持这一结论的理论是构造原理
C. 6C的电子排布式1s
22s22p2x 违反了洪特规则
D. 电子排布式 22Ti 1s22s22p63s23p63d4违反了泡利不相容原理
13. 向含HCN的废水中加入铁粉和K2CO3 可制备K4 Fe CN 6 ,发生反应:
6HCN Fe 2K 2CO3 K 4 Fe CN H 2 2CO6 2 2H 2O ,下列说法错误的是
A. 依据反应可知:Ka HCN >Ka1 H2CO3 ;还原性:Fe H2
B. 基态碳原子和基态氮原子的未成对电子之比为 2∶3
C. Fe位于周期表中第 VIII族;反应中 Fe失去 4s2电子
D. 离子半径大小:N3->O2-
14. 常温时,下列关于溶液的 pH或微粒的物质的量浓度的说法不.正.确.的是
A. pH 3的二元弱酸H2R溶液与 pH=11的 NaOH溶液混合后,混合液的 pH等于 7,则反应后的
2- -
混合液中: 2c R +c HR =c Na+
B. 某溶液中只存在Cl 、OH NH 、 4 、H 四种离子,则一定不存在下列关系:
c NH+4 >c Cl- >c H+ >c OH-
C. 向NH4HSO4溶液中加入等物质的量的 NaOH形成的溶液中:
c Na+ =c SO2-4 >c NH+ -4 >c OH >c H+
D. 将0.2mol L 1的某一元酸 HA溶液和0.1mol L 1NaOH 溶液等体积混合后溶液 pH大于 7,
-
则反应后的混合液中: 2c OH +c A- =2c H+ +c HA
15. 下列实验操作、现象及结论均正确是
选
操作和现象 结论
项
1
常温下,用 pH计分别测定等体积1mol L CH3COONH4 溶液和 两种CH3COONHA 4溶液中水
0.1mol L 1CH3COONH4溶液的 pH,pH均为 7 的电离程度相同
向 2mL1mol L 1的KI溶液中滴加 2mL0.1mol L 1的FeCl3 溶液,
B 充分反应后加入 2mLCCl4 ,取上层溶液滴加 KSCN溶液,溶液变 FeCl3 与 KI的反应存在限度
红色
C 向溶有SO2 的BaCl2的溶液中通入气体 X,出现白色沉淀 X具有强氧化性
向 2mL0.1mol L 1 MgCl2 溶液中滴入 3滴 2mol L 1NaOH溶液,
同温度下的Ksp:
D
再滴入 4滴0.1mol L 1 FeCl3 溶液,先产生白色沉淀,后产生红 Mg OH 2 Fe OH 3
褐色沉淀
高二化学学科 3
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
16. 如图(Ea表示活化能)是 CH4与 Cl2生成 CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列
说法正确的是( )
A. Cl·可由 Cl2在高温条件下生成,是 CH4与 Cl2反应
的催化剂
B. 升高温度,Ea1、Ea2均减小,反应速率加快
C. 增大 Cl2的浓度,可提高反应速率,但不影响△H
的大小
D. 第一步反应的速率大于第二步反应
17. 电化学降解NO3 的原理如图所示,下列说法正确
的是
A. N为电源的正极
B. 电池工作时,阴极区的溶液 pH逐渐变大
C. Pt 电极上的反应式为 2H2O 4e O2 4H
D. 每生成 5.6gN2,左右两侧溶液质量变化差 10.4g
18. 下列叙述及对应图示错误的是
A. 图甲是某温度下 c CH3COOH c CH3COO 0.100mol L 1的醋酸与醋酸钠混合溶液中
c CH3COOH 、 c CH 3COO 与 pH的关系曲线, pH 3的溶液中: Ka 10 4.75
B. 图乙是恒温密闭容器中发生反应CaCO3 s CaO s CO2 g 时, c CO2 随反应时间变化的
曲线, t1时刻改变的条件可能是缩小容器的体积
C. 图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线, t1时刻溶液的温度最高
D. 图丁是在0.1mol L 1的Na2CO3溶液中加水稀释,随着加入水的体积的增大,溶液中 c HCO 3 的
变化曲线,Na2CO3的水解程度:A点小于 B点
高二化学学科 4
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
19. 常温时,AgCl、AgSCN、Ag2CrO4的沉淀溶解平衡曲线如图所示。
+ n-
已知:Ksp AgCl >Ksp AgSCN , pAg=-lgc Ag , pX=-lgc X 。下列说法正确的是
A. 图中 x代表AgCl曲线,z代表AgSCN曲线
B. 常温时,AgCl s SCN aq AgSCN s Cl aq 的平衡常数K 2
C. 常温时,若增大 p点的阴离子浓度,则 y上的点沿曲线向上移动
D. 2 相同温度下,在Cl 和CrO4 的物质的量浓度均为 0.1mol L 的溶液中,
滴入少量 0.1mol / LAgNO3溶液,先产生AgCl沉淀
20.25℃时,以 NaOH溶液调节 0.1mol·L-1二元弱酸 H2A溶液的 pH,溶液中的 H2A、HA-、A2-的物质的
c(X)
量分数δ(X)随 pH的变化如图所示[已知δ(X) c(H A)+c(HA- )+c(A2- ) ]。下列说法不.正.确.的是2
A.二元弱酸 H2A的 pKa1=1.2(已知:pKa=-lgKa)
B.20.0mL0.1mol·L-1的H2A溶液与 30.0mL0.1mol·L-1NaOH
溶液混合,混合液的 pH=4.2
C.往 H2A溶液中滴加 NaOH 溶液的过程中,一定存在:
c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.在 0.1mol·L-1NaHA溶液中,各离子浓度大小关系:
c(Na+)>c(HA-)>c(A2-)>c(OH-)
二、填空题(本题包括 4小题,共 55分)
21. (12 分)回答下列问题。
(1)现有常温下 pH 2 的盐酸(甲)和 pH 2的醋酸溶液
(乙),请根据下列操作回答:
①常温下,0.1mol L 1 CH3COOH 溶液加水稀释,下列数值一定变小的是___________(填字母)。
c H
+ c OH-
A c H+ B C c H . . . c OH D.
c CH3COOH c H+
高二化学学科 5
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
②取 10mL乙溶液,加入少量无水CH3COONa 固体(假设加入固体前后,溶液体积保持不变),待固体溶解
c H+
后,溶液中 的值将___________(填“增大”“减小”或“无法确定”)。
c CH3COOH
③相同条件下,取等体积的甲、乙两溶液,分别与 0.1mol/LNaOH溶液反应,消耗 NaOH溶液的体积
(甲)___________(乙)(填“>”“<”或“=”)。
2 0.001mol L 1 HCl c H+ 1.0 10 9mol L 1( )某温度下,测得 的 溶液中,水电离出的 ,此温度下,
将VaLpH 4 HCl溶液和VbLpH 9的Ba OH 2 溶液混合均匀(忽略混合后溶液体积的变化),测得溶液的
pH 7则Va : Vb ___________。
(3)已知:在 25℃,有关弱电解质的电离平衡常数如下表有下表:
弱电解质 NH3 H2O HClO H2CO3 H2SO3
Ka1 4.2 10
7 K 2a1 1.54 10
5 8
电离常数 Kb 1.8 10 Ka 4.7 10
K 5.6 10 11 K 1.02 10 7a2 a2
c SO2-
①将SO - 32 通入该氨水中,当 c OH 降至1.0 10 7mol L 1时,溶液中的 =c ___________。HSO -3
②下列微粒在溶液中不能大量共存的是___________。
a SO2 HCO b ClO HCO c HSO CO2 . 3 、 3 . 、 3 . 3 、 3 d.HClO、HCO
-
3
22.(12 分) 前四周期元素 A、B、C、D、E原子序数依次增大,其相关性质如表所示:
A 2p能级电子半充满
B 与 A同周期,且原子核外有 2个未成对电子
C 基态原子核外有 6个原子轨道排有电子,且只有 1个未成对电子
D 其基态原子外围电子排布式为 nsn-1npn+1
E 前四周期元素中,E元素基态原子未成对电子数最多
请根据以上情况,回答下列问题:
(1)A元素在周期表中的位置为______________,其基态原子的价电子排布图为______________。
(2)A、B、D三种元素第一电离能由大到小的顺序为_______(用元素符号表示)。B、C、D三种元素的简
单离子的半径由大到小的顺序为_______(用离子符号表示)。
(3)E元素基态原子核外有_______种空间运动状态不同的电子,该元素的价层电子排布式为_______。
高二化学学科 6
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
23.(15分)探究 CH3OH合成反应化学平衡的影响因素,有利于提高 CH3OH的产率。
以 CO2、H2为原料合成 CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1<0
Ⅱ.CO(g)+2H2(g) CH3OH(g)△H2
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g)△H3>0
已知 CO(g)、H2(g)、CH3OH(g)的标准燃烧热分别为 285.8kJ mol-1,283.0kJ mol-1,761.0kJ mol-1回答下列
问题:
(1)△H2=_______kJ mol-1。
(2)一定条件下,向体积一定的恒容密闭容器中通入 1mol CO2和 3mol H2发生上述反应,达到平衡时,
容器中 CH3OH(g)为 amol,CO为 bmol,此时 H2O(g)的物质的量为_______mol(用含 a,b的代数式表示,
下同),反应Ⅲ的平衡常数为_______
(3)不同压强下,按照 n(CO2):n(H2)=1:3投料,实验测定 CH3OH的平衡产率(图 1)和 CO2的平衡转化
率(图 2)随温度的变化关系如图所示。
n CO2 n CO 初始 2 平衡
已知:CO2的平衡转化率= ×100%n CO2 初始
n CH3OH
CH3OH的平衡产率= 平衡 ×100%n CO2 初始
① 图 1 中 , 一 定 压 强 下 , CH3OH 的 平 衡 产 率 随 温 度 升 高 而 下 降 的 原 因 是
___________________________________。
② 图 1中,压强 p1、p2、p3由大到小的顺序为__________ 。
③ 图 2 中 T1 温 度 时 , 三 条 曲 线 几 乎 交 于 一 点 的 原 因 是
____________________________________________________。
(4)为同时提高 CO2的平衡转化率和 CH3OH的平衡产率,应选择的反应条件为___ 。
A. 低温、高压 B. 高温、低压
C. 低温、低压 D. 高温、高压
高二化学学科 7
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
24. (16分)食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于 0.035g/mL。
某研究小组用 0.1000mol L 1NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。
Ⅰ.实验步骤
A.冷却至室温后,在___________(填仪器名称)中定容配成 100mL白醋溶液。
B.量取 20.00mL待测白醋溶液于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为0.1000mol L 1标准 NaOH溶液装入碱式滴定管,调节液面记下读数。如果液面位
置如右图所示,则此时的读数为___________mL
E.继续滴定至终点,记下最终读数。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入 NaOH标准溶液,边滴边摇动锥形瓶。
G.用干燥的___________(填仪器名称)量取食用白醋样品 10.00mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
(1)以上步骤的正确顺序为 G→A→_____→______→D→____→_____→H(用编号字母填写)
(2)A中的仪器为___________,G中的仪器为___________。
(3)D中的读数为___________mL。
Ⅱ.实验记录
滴定次数
实验数据
1 2 3 4
V(样品)/mL 20.00 20.00 20.00 20.00
滴定前 V(NaOH)/mL 0.00 0.10 0.20 1.00
滴定后 V(NaOH)/mL 15.95 15.10 15.25 15.95
Ⅲ.数据处理与讨论
(4)按数据处理,市售白醋中醋酸的含量=___________g 100mL 1 (保留四位有效数字)。
(5)若测定结果偏低,其原因可能是___________
A. 滴定过程中振摇时有液滴溅出
B. 滴定前仰视读数,滴定后读数正确
C. 盛装待测液的锥形瓶用蒸馏水洗过后未干燥
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
Ⅳ.实验讨论:
(6)某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶
c CH3COOH 1
液中 c CH COO 1.8 103 ,则此时溶液中的 pH ___________。(已知室温下醋酸的3
Ka 1.8 10
5 ),滴定终点的现象为____________________________________________。
高二化学学科 8
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
宁波地区高二化学学科 12 月月考试卷答案
1-5CDDDC 6-10DABCA 11-15CCACB 16-20 CBCDB
21(12 分,每空 2 分)(1) ①. A ②. 减小 ③. <
(2)9:1
(3) ① 1.02 ②. c
22(12 分,每空 2 分)(1) ①. 第二周期ⅤA族; ②. ;
(2) ①. N>O>S; ②. S2->O2->Na+;
(3) ①15; ②3d54s1;
23(15 分,第(1)题 3 分,其余每空 2 分)(1)-90.8
(2) ① a+b ②. b a b
1 a b 3 3a b
(3) ①. 生成 CH3OH的反应正方向放热,温度升高,平衡逆向移动,甲醇的产率下降
② p1>p2>p3 ③T1时以反应 III为主,反应 III前后气体分子数相等,压强改变对平衡没有影响
(4) A
24(16 分)(1) G→A→_C_→__B__→D→_F__→__E__→H(2) ① 100m容量瓶 ②. 酸式滴
定管
(3)0.60 (4)4.500 (5)AB
(6) ①8 滴入最后半滴 NaOH溶液,溶液会由无色变为浅红色,且半分钟内不褪色
高二化学学科 9
{#{QQABbYCAggCgABAAARhCAQVKCgMQkBGAACoGxAAMMAABgAFABAA=}#}
同课章节目录
