4.1 原电池 同步练习(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1 原电池 同步练习(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 894.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 14:50:36 | ||
图片预览

文档简介
4.1原电池同步练习题
一、选择题
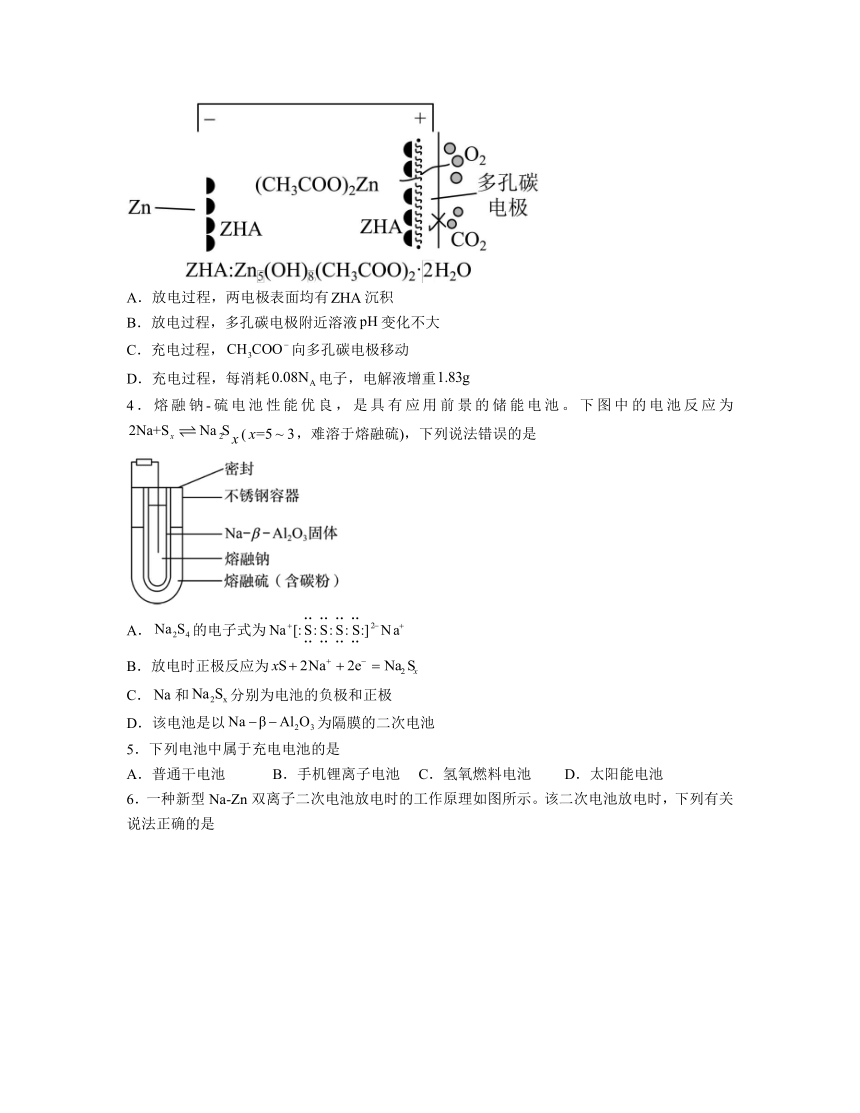
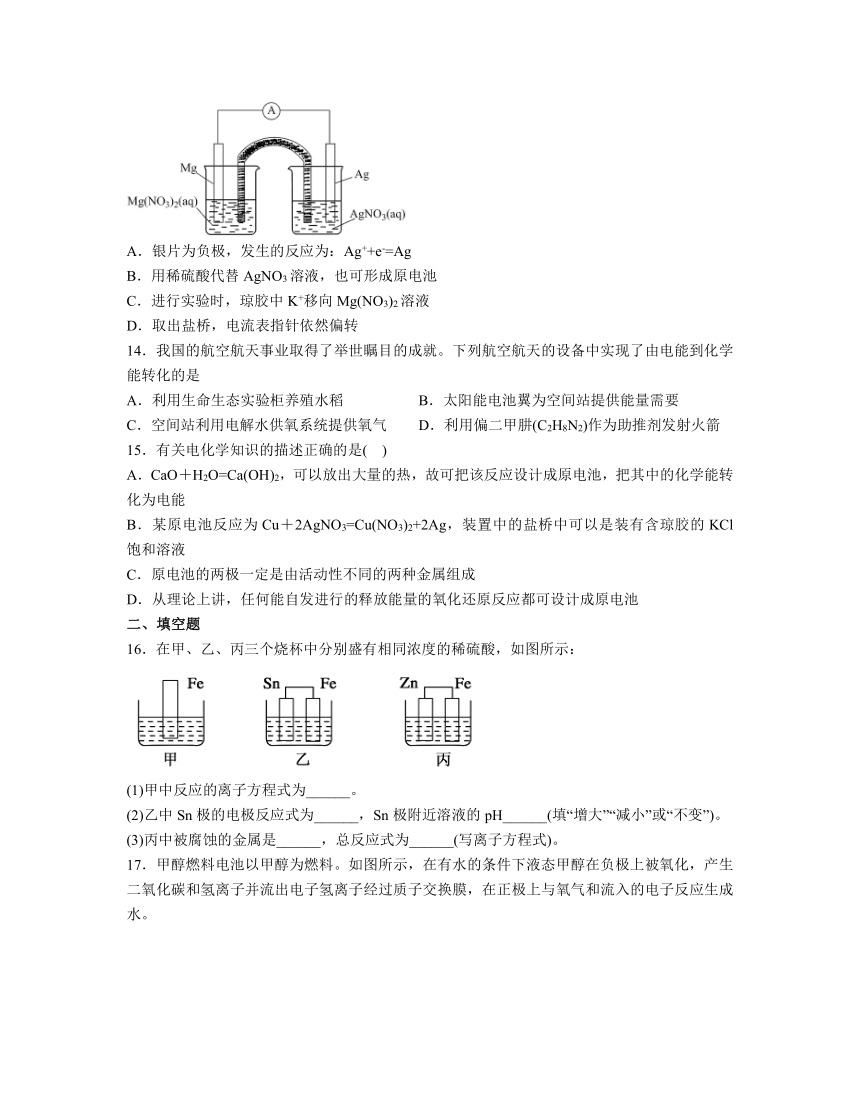
1.金属-空气电池的结构如图所示,常见的金属电极材料包括锌、铝等,下列说法中错误的是
A.放电时,空气电极为正极
B.金属电极材料为Zn、溶液为碱性环境时,电极反应式为
C.放电时,电子由金属电极经外电路移向空气电极
D.金属电极材料为Al时,电池的比能量低于Zn作金属电极
2.2020年中科院研究所报道了一种高压可充电碱-酸混合电池,电池采用阴、阳双隔膜完成离子循环(如下图),该电池良好的电化学性能为解决传统水性电池的关键问题提供了很好的机会。下列说法不正确的是
A.充电时,d极发生氧化反应
B.离子交换膜b、c分别为阳离子交换膜和阴离子交换膜
C.放电时a极的电极反应为:
D.放电时,每转移2mol电子,中间溶液中溶质减少1mol
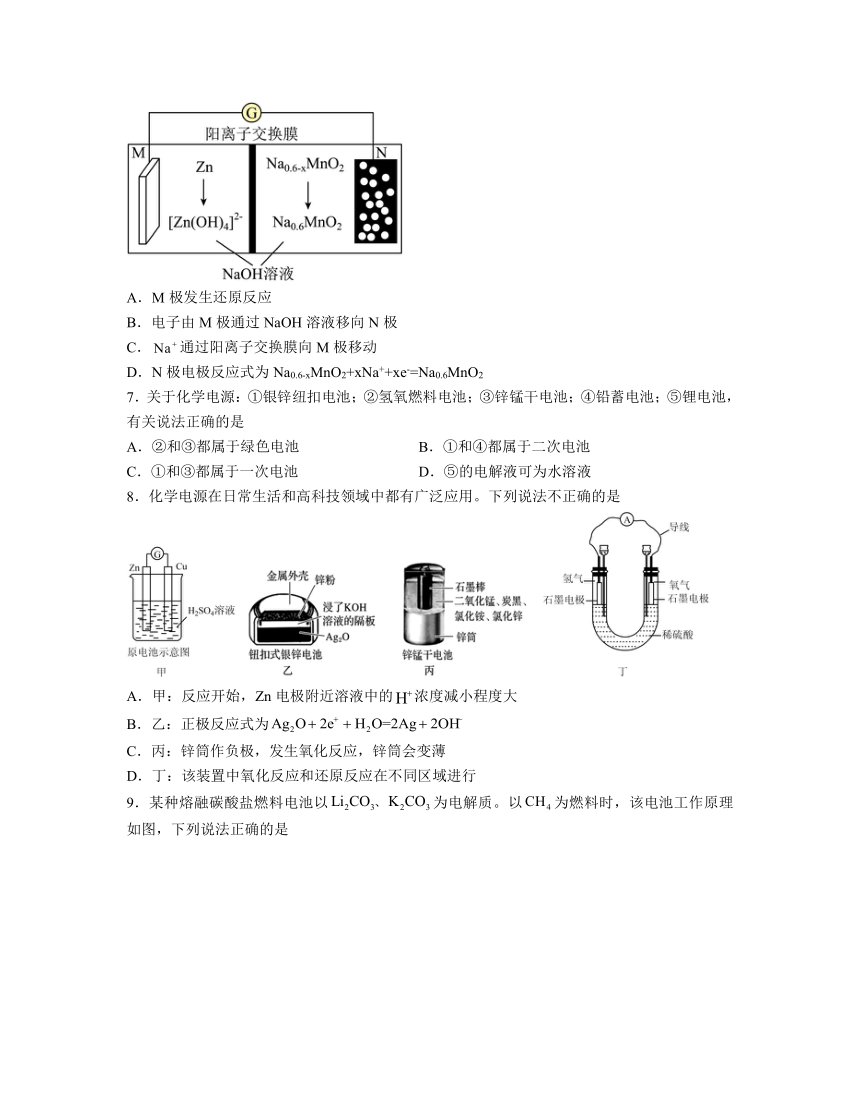
3.使用弱酸性电解液解决锌-空气二次电池中的干扰,其装置如图所示。电池反应为。下列说法错误的是
A.放电过程,两电极表面均有沉积
B.放电过程,多孔碳电极附近溶液变化不大
C.充电过程,向多孔碳电极移动
D.充电过程,每消耗电子,电解液增重
4.熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(,难溶于熔融硫),下列说法错误的是
A.的电子式为
B.放电时正极反应为
C.和分别为电池的负极和正极
D.该电池是以为隔膜的二次电池
5.下列电池中属于充电电池的是
A.普通干电池 B.手机锂离子电池 C.氢氧燃料电池 D.太阳能电池
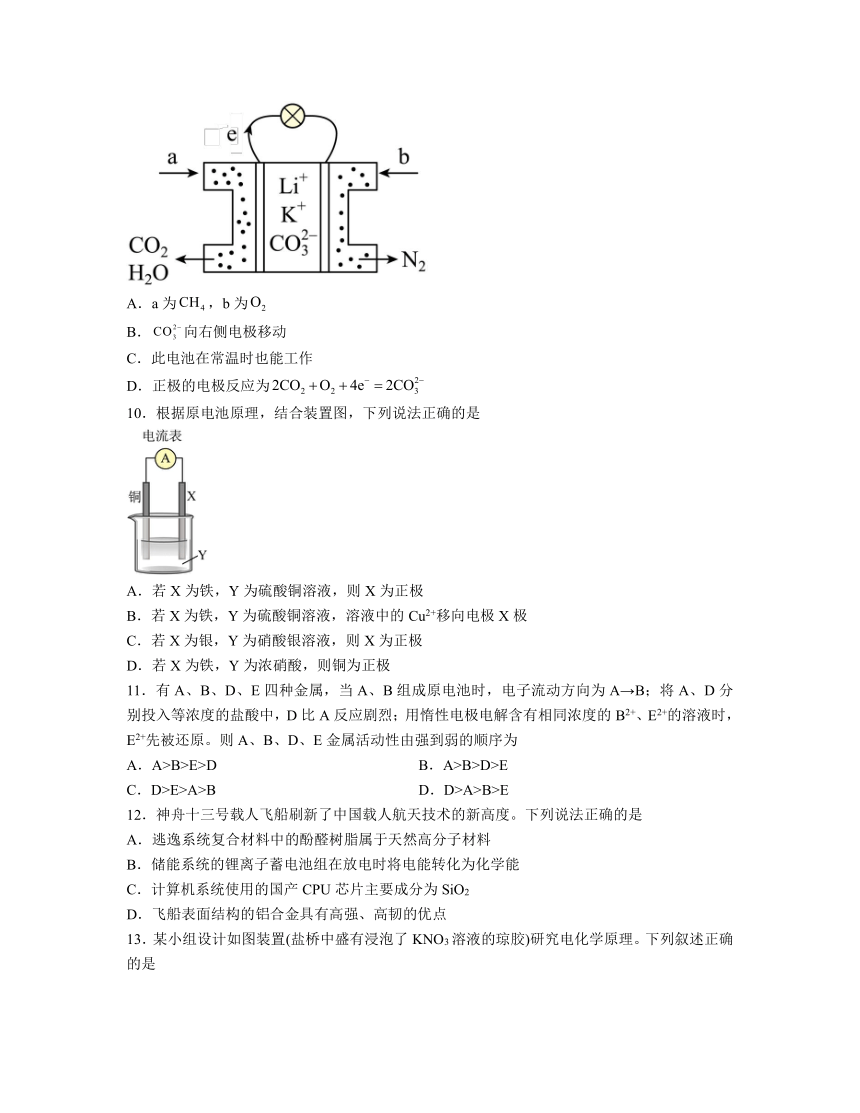
6.一种新型Na-Zn双离子二次电池放电时的工作原理如图所示。该二次电池放电时,下列有关说法正确的是
A.M极发生还原反应
B.电子由M极通过NaOH溶液移向N极
C.通过阳离子交换膜向M极移动
D.N极电极反应式为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2
7.关于化学电源:①银锌纽扣电池;②氢氧燃料电池;③锌锰干电池;④铅蓄电池;⑤锂电池,有关说法正确的是
A.②和③都属于绿色电池 B.①和④都属于二次电池
C.①和③都属于一次电池 D.⑤的电解液可为水溶液
8.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.甲:反应开始,Zn电极附近溶液中的浓度减小程度大
B.乙:正极反应式为
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:该装置中氧化反应和还原反应在不同区域进行
9.某种熔融碳酸盐燃料电池以为电解质。以为燃料时,该电池工作原理如图,下列说法正确的是
A.a为,b为
B.向右侧电极移动
C.此电池在常温时也能工作
D.正极的电极反应为
10.根据原电池原理,结合装置图,下列说法正确的是
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
11.有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原。则A、B、D、E金属活动性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E
C.D>E>A>B D.D>A>B>E
12.神舟十三号载人飞船刷新了中国载人航天技术的新高度。下列说法正确的是
A.逃逸系统复合材料中的酚醛树脂属于天然高分子材料
B.储能系统的锂离子蓄电池组在放电时将电能转化为化学能
C.计算机系统使用的国产CPU芯片主要成分为SiO2
D.飞船表面结构的铝合金具有高强、高韧的优点
13.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼胶)研究电化学原理。下列叙述正确的是
A.银片为负极,发生的反应为:Ag++e-=Ag
B.用稀硫酸代替AgNO3溶液,也可形成原电池
C.进行实验时,琼胶中K+移向Mg(NO3)2溶液
D.取出盐桥,电流表指针依然偏转
14.我国的航空航天事业取得了举世瞩目的成就。下列航空航天的设备中实现了由电能到化学能转化的是
A.利用生命生态实验柜养殖水稻 B.太阳能电池翼为空间站提供能量需要
C.空间站利用电解水供氧系统提供氧气 D.利用偏二甲肼(C2H8N2)作为助推剂发射火箭
15.有关电化学知识的描述正确的是( )
A.CaO+H2O=Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.原电池的两极一定是由活动性不同的两种金属组成
D.从理论上讲,任何能自发进行的释放能量的氧化还原反应都可设计成原电池
二、填空题
16.在甲、乙、丙三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
(1)甲中反应的离子方程式为______。
(2)乙中Sn极的电极反应式为______,Sn极附近溶液的pH______(填“增大”“减小”或“不变”)。
(3)丙中被腐蚀的金属是______,总反应式为______(写离子方程式)。
17.甲醇燃料电池以甲醇为燃料。如图所示,在有水的条件下液态甲醇在负极上被氧化,产生二氧化碳和氢离子并流出电子氢离子经过质子交换膜,在正极上与氧气和流入的电子反应生成水。
甲醇燃料电池的工作原理示意图
写出上述过程中电极上发生的半反应及总反应。
(1)半反应:___________
(2)总反应:___________
18.铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。
(2)FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 _______;与MnO2 -Zn电池类似,K2FeO4 -Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________________________;
19.常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)石墨中化学键类型为______________,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________。
(5)操作A的名称为______________。
(6)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)
20.利用电极反应可探究物质氧化性、还原性的变化规律。
已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
电对(氧化型/还原型)
电极电势/V 0.771 1.776 0.695 1.224 0.536
回答下列问题:
I.探究的分解反应
催化分解反应过程包括i、ii两步:
反应i:___________(未配平)
反应ii:
(1)反应i的离子方程式为___________。
(2)验证生成:反应过程中,加入___________溶液,产生蓝色沉淀,证明有生成。
(3)酸性条件下也可催化分解。结合表中数据判断,上述条件下、、的氧化性由强到弱的顺序为___________。
Ⅱ.探究物质氧化性变化对电化学反应方向的影响
用可逆反应设计电池,按图a装置进行实验,测得电压E()随时间t的变化如图b所示:
(4)电池初始工作时,正极的电极反应式为___________。
(5)某小组从还原型物质浓度、氧化性变化的角度分析图b,提出以下猜想:
猜想1:增大,的氧化性减弱,正极的电极电势降低。
猜想2:减小,的氧化性增强,负极的电极电势升高。
①时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
实验 实验操作 电压E/V 结论
i 往烧杯A中加入适量Fe E___________0 猜想1成立
ii 往烧杯B中加入适量___________ E<0 猜想2成立
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由___________。
③为进一步验证猜想1,进行实验Ⅱi,完成表中填空。
实验 实验操作 电压E/V 结论
iii 往烧杯A中加入适量___________ E<0 猜想1成立
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。
【参考答案】
一、选择题
1.D
解析:A.放电时,氧气得电子发生还原反应,空气电极为正极,故A正确;
B.金属电极材料为Zn、溶液为碱性环境时,锌失电子发生氧化反应,电极反应式为,故B正确;
C.放电时,金属电极为负极、空气电极为正极,电子由金属电极经外电路移向空气电极,故C正确;
D.1gAl失电子 ,1gZn失电子,金属电极材料为Al时,电池的比能量大于Zn作金属电极,故D错误;
选D。
2.D
【分析】由图可知,放电时,a极为负极,电极反应式为,d极为正极,电极反应式为PbO2+2e +SO+4H+=PbSO4+2H2O,充电时,a极为阴极,d极为阳极,据此作答。
解析:A.充电时,d极为阳极,发生氧化反应,故A正确;
B.放电时,负极区氢氧根离子被消耗,钾离子透过b膜向右迁移,故b膜为阳离子交换膜,正极区氢离子消耗量大于硫酸根离子,硫酸根离子透过c膜向左迁移,故c膜为阴离子交换膜,故B正确;
C.放电时,a极为负极,电极反应式为,故C正确;
D.放电时,每转移2mol电子,中间K2SO4溶液中溶质增加1mol,故D错误;
故答案选D。
【点睛】本题考查可充电电池,题目难度中等,能依据图像和题目信息准确判断正负极和阴阳极是解题的关键,难点是电极反应式的书写。
3.D
解析:A.由图可知,放电时Zn为负极,多孔电极为正极,负极Zn生成ZHA,正极反应生成ZHA,两极均有ZHA沉积,故A正确;
B.放电时多孔电极上发生反应:,原溶于中存在,微弱水解使溶液显碱性,生成的醋酸为弱酸,微弱电离使溶液呈酸性,因为水解电离程度都很小,因此溶液的pH值变化不大,故B正确;
C.充电时为电解池,阴离子移向阳极,则向多孔碳电极移动,故C正确;
D.根据反应:,消耗电子即0.08mol电子时,n(Zn)=0.04mol,同时有0.01mol和0.06mol进入电解质溶液中,质量为0.01mol×183g/mol+0.06 mol×18g/mol=2.91g,故D错误;
故选:D。
4.C
【分析】由总反应可知,钠较活泼,放电时钠失去电子发生氧化反应,故放电时钠为负极、熔融硫为正极;
解析:A.中硫原子间以共价键相结合且均达到8电子稳定结构,电子式为,故A正确;
B.放电时钠为负极、熔融硫为正极,正极得到电子发生还原反应,,故B正确;
C.由分析可知,和熔融硫分别为电池的负极和正极,故C错误;
D.由图可知,该电池是以为隔膜的二次电池,故D正确;
故选C。
5.B
解析:A. 普通干电池不能充电,完全放电后不能再使用,是一次电池,A不符合题意;
B. 铅蓄电池、镍镉电池、锂电池等可以反复充电放电,属于可充电电池,是二次电池,B符合题意;
C. 通常所说的二次电池是指可充电电池,而氢氧燃烧电池可以反复使用,只要源源不断地提供燃料氢气,但性质上仍属于一次电池,因为燃料氢气没了,就不能再用了,C不符合题意;
D. 太阳能电池是太阳能转化为电能的装置,太阳能电池不属于化学电池,D不符合题意;故答案为:B。
6.D
【分析】由图可知,原电池中M为负极,电极反应为Zn-2e-+4OH-=[Zn(OH)4]2-,N为正极,电极反应为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2。
解析:A.根据分析,M为原电池的负极,发生氧化反应,A错误;
B.电子不能在电解质溶液中移动,B错误;
C.原电池中,阳离子向正极移动,因此Na+向N电极移动,C错误;
D.根据分析,N为正极,电极反应为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2,D正确;
故选D。
7.C
解析:A.②氢氧燃料电池属于绿色电池,③锌锰干电池不属于绿色电池,故A错误;
B.①银锌纽扣电池属于不可充电电池,完全放电后不能再使用,属于一次电池,④铅蓄电池可以重复充电,属于二次电池,故B错误;
C.①银锌纽扣电池、③锌锰干电池都属于不可充电电池,完全放电后不能再使用,属于一次电池,故C正确;
D.金属锂可以水溶液反应,⑤锂电池电解液不可为水溶液,故D错误;
故选C。
8.A
解析:A.甲装置为Zn、Cu原电池,Zn做负极,失去电子变成Zn2+,Cu做正极,氢离子得电子生成氢气,所以反应开始,Cu电极附近溶液中的浓度减小程度大,故A错误;
B.乙装置中Ag2O做正极,反应式为,故B正确;
C.丙装置中锌筒作负极,发生氧化反应,锌筒由于发生反应会变薄,故C正确;
D.丁装置中氧化反应和还原反应分别在U型管的左侧区域和右侧区域进行,故D正确;
故答案选A。
9.D
【分析】该装置为甲烷的燃料电池,通甲烷一极为负极,电解质为熔融碳酸盐,因此通空气一极为正极,然后根据原电池工作原理进行分析;
解析:A.通入甲烷一极为负极,电极反应式为CH4+4CO-8e-=5CO2+2H2O,通入空气一极为正极,电极反应式为O2+2CO2+4e-=2CO,根据装置图可知,a为CH4,b为空气,故A错误;
B.根据原电池工作原理,CO向负极移动,即向左侧电极移动,故B错误;
C.因为该电池是在熔融状态进行,因此常温时,该电池不能工作,故C错误;
D.根据A选项分析,正极反应式为O2+2CO2+4e-=2CO,故D正确;
答案为D。
10.C
解析:A.铁的活泼性比铜强,正极为铜,A错误;
B.若X为铁,铁不铜活泼,铁作负极,铜作正极,溶液中的Cu2+移向正极铜,B错误;
C.若X为银,铜比银活泼,铜作负极,Ag作正极,故C正确;
D.若X为铁,Y为浓硝酸,铁与浓硝酸发生钝化,铜与浓硝酸反应,则铜为负极,D错误;
故选:C。
11.D
【分析】一般来说,较活泼金属作原电池负极。
解析:有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B,则A作负极,即金属活动性:A>B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈,则证明金属活动性:D>A;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原,则说明氧化性:E2+>B2+,即还原性:B>E,综上所述,金属活动性由强到弱的顺序是:D>A>B>E;
故答案为:D。
12.D
解析:A.酚醛树脂是苯酚与甲醛的缩聚产物,属于人工合成的高分子材料,故A错误;
B.锂离子蓄电池组在放电时将化学能转化成电能,故B错误;
C.CPU芯片主要成分为Si,故C错误;
D.铝合金具有高强度、高韧性的优点,故D正确;
故选:D。
13.B
解析:A.该装置为MgAg原电池,镁的活泼性大于银,镁作负极,失电子形成镁离子,故A错误;
B.若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,可以构成原电池,故B正确;
C.MgAg原电池,镁的活泼性大于银,镁作负极、银为正极,原电池中阳离子移向正极,所以盐桥中的阳离子往右侧硝酸银溶液迁移,故C错误;
D.取出盐桥,由于无法构成闭合回路,不能形成原电池,所以电流表不发生偏转,D错误;
选B。
14.C
解析:A.利用生命生态实验柜养殖水稻没有利用电能,故A不选;
B.太阳能电池翼为空间站提供能量需要是电能转化为其它形式的能量,故B不选;
C.空间站利用电解水供氧系统提供氧气是电能转化为化学能,故C选;
D.利用偏二甲肼(C2H8N2)作为助推剂发射火箭是化学能转化为动能,故D不选;
故选C。
15.D
解析:A. CaO+H2O═Ca(OH)2不是氧化还原反应,没有电子的转移,所以不能设计为原电池,故A错误;
B. 电解质溶液为AgNO3,与氯离子反应生成沉淀,所以不能用装有含琼胶的KCl饱和溶液作盐桥,故B错误;
C. 原电池的两极可以是由活动性不同的两种金属组成,也可以是非金属,如氢氧燃料电池中石墨棒用作电极,故C错误;
D. 理论上,任何能自发进行的氧化还原反应都可被设计成原电池,故D正确;
故选D。
二、填空题
16. Fe+2H+=Fe2++H2↑ 2H++2e-=H2↑ 增大 Zn Zn+2H+=Zn2++H2↑
解析:(1)甲中发生氢离子和Fe的置换反应,离子方程式为Fe+2H+=Fe2++H2↑;
(2)Sn、Fe和稀硫酸溶液形成原电池,Fe比Sn活泼,所以Fe为负极,Sn为正极,氢离子在Sn电极上放电生成氢气,电极反应时式为2H++2e-=H2↑,由于氢离子浓度减小,所以Sn电极附近pH增大;
(3)Zn比Fe活泼,所以形成原电池时,Zn为负极,被腐蚀,总反应为Zn和稀硫酸溶液的反应,离子方程式为Zn+2H+=Zn2++H2↑。
17.(1)负极:CH3OH+H2O-6e-=CO2+6H+;正极:4H++O2+4e-=2H2O。
(2)2CH3OH+3O2=2CO2+4H2O
解析:(1)根据图示可知,电池负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+;正极上氢离子得电子与氧气反应生成水,电极反应式为4H++O2+4e-=2H2O。
(2)根据题意可知,电池总反应为2CH3OH+3O2=2CO2+4H2O。
18.(1)10%
(2) 2Fe(OH)3+3ClO-+ 4OH-=2+3Cl-+5H2O +3e-+4H2O=Fe(OH)3+5OH-
解析:(1)设FeCl2和FeCl3的物质的量分别为a、b,则(a+b):(2a+3b)=1:2.1,a:b=9:1,则该样品中FeCl3的物质的量分数为;
(2)铁离子再强碱环境下为氢氧化铁,FeCl3与KClO在强碱性条件下反应可制取K2FeO4,铁元素化合价升高、氯元素化合价降低变为-1,其反应的离子方程式为2Fe(OH)3+3ClO-+ 4OH-=2+3Cl-+5H2O; K2FeO4在电池中作为正极材料,得到电子,发生还原反应生成氢氧化铁,其电极反应式为+3e-+4H2O=Fe(OH)3+5OH-。
19. 共价键(非极性共价键), 导电 Zn-2e-=Zn2+ MnO2+e-+H2O=MnOOH+OH- 加快溶解速率 过滤 Cu+H2O2+H2SO4=CuSO4+2H2O
【分析】废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌,据此解答。
解析:(1) 石墨晶体为混合晶型,是层状结构。在每一层内,每个碳原子与其他3个碳原子以共价键结合形成六边形网状结构;石墨具有导电性,在电池中作电极,起导电作用,
故答案为共价键(非极性共价键);导电;
(2) 酸性锌锰干电池的负极为锌,负极反应为Zn-2e-=Zn2+,
故答案为Zn-2e-=Zn2+;
(3) 在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O=MnOOH+OH-,
故答案为MnO2+e-+H2O=MnOOH+OH-;
(4) 加热适当升高温度,可促进溶解,
故答案为加快溶解速率;
(5) 分离不溶性固体和溶液采用过滤的方法,所以操作A的名称是过滤,
故答案为过滤;
(6) 酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为Cu+H2O2+H2SO4=CuSO4+2H2O。
20.(1)
(2)
(3)>>
(4)
(5) < AgNO3固体 加入铁粉后,同时造成增大,减小,都能使平衡逆移,使E<0 FeCl2固体
【分析】已知:酸性介质中,1mol/L不同电对的电极电势越高,其氧化型物质的氧化性越强,结合表中数据判断,上述条件下氧化性由强到弱的顺序为>>Fe3+>>I2,还原性顺序为:I->>Fe2+>>H2O;
要通过反应探究对电化学反应方向的影响,从某还原型物质浓度、氧化性变化的角度分析图b,对于2个猜想,只能通过改变一个变量观察是否使E<0来探究——猜想1:增大,的氧化性减弱,正极的电极电势降低,故只能通过A烧杯加适量氯化亚铁固体,增加亚铁离子浓度,猜想2:减小,的氧化性增强,负极的电极电势升高,只能通过B烧杯加适量硝酸银固体减少碘离子浓度来实现。
解析:(1)结合分析可知,反应i中铁离子把双氧水氧化了,生成亚铁离子、氧气和水,离子方程式为。
(2)遇发生反应:,生成深蓝色沉淀,则反应过程中,加入溶液,产生蓝色沉淀,证明有生成。
(3)据分析,上述条件下、、的氧化性由强到弱的顺序为>>。
(4)电池初始工作时,由可知,铁离子得电子发生还原反应转变为亚铁离子,为正极,则正极的电极反应式为。
(5)①i.t1时,若往烧杯A中加入适量Fe,则铁与铁离子反应,结合猜想1,增大,的氧化性减弱,正极的电极电势降低,则E<0;
ii.②t1时,若往烧杯B中加入适量AgNO3固体,可使碘离子产生沉淀,使减小,的氧化性增强,负极的电极电势升高,使E<0,猜想2成立。
③iii.t1时,若往烧杯A中加入适量FeCl2固体, 增大,的氧化性减弱,正极的电极电势降低,使E<0,猜想1成立
一、选择题
1.金属-空气电池的结构如图所示,常见的金属电极材料包括锌、铝等,下列说法中错误的是
A.放电时,空气电极为正极
B.金属电极材料为Zn、溶液为碱性环境时,电极反应式为
C.放电时,电子由金属电极经外电路移向空气电极
D.金属电极材料为Al时,电池的比能量低于Zn作金属电极
2.2020年中科院研究所报道了一种高压可充电碱-酸混合电池,电池采用阴、阳双隔膜完成离子循环(如下图),该电池良好的电化学性能为解决传统水性电池的关键问题提供了很好的机会。下列说法不正确的是
A.充电时,d极发生氧化反应
B.离子交换膜b、c分别为阳离子交换膜和阴离子交换膜
C.放电时a极的电极反应为:
D.放电时,每转移2mol电子,中间溶液中溶质减少1mol
3.使用弱酸性电解液解决锌-空气二次电池中的干扰,其装置如图所示。电池反应为。下列说法错误的是
A.放电过程,两电极表面均有沉积
B.放电过程,多孔碳电极附近溶液变化不大
C.充电过程,向多孔碳电极移动
D.充电过程,每消耗电子,电解液增重
4.熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为(,难溶于熔融硫),下列说法错误的是
A.的电子式为
B.放电时正极反应为
C.和分别为电池的负极和正极
D.该电池是以为隔膜的二次电池
5.下列电池中属于充电电池的是
A.普通干电池 B.手机锂离子电池 C.氢氧燃料电池 D.太阳能电池
6.一种新型Na-Zn双离子二次电池放电时的工作原理如图所示。该二次电池放电时,下列有关说法正确的是
A.M极发生还原反应
B.电子由M极通过NaOH溶液移向N极
C.通过阳离子交换膜向M极移动
D.N极电极反应式为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2
7.关于化学电源:①银锌纽扣电池;②氢氧燃料电池;③锌锰干电池;④铅蓄电池;⑤锂电池,有关说法正确的是
A.②和③都属于绿色电池 B.①和④都属于二次电池
C.①和③都属于一次电池 D.⑤的电解液可为水溶液
8.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.甲:反应开始,Zn电极附近溶液中的浓度减小程度大
B.乙:正极反应式为
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:该装置中氧化反应和还原反应在不同区域进行
9.某种熔融碳酸盐燃料电池以为电解质。以为燃料时,该电池工作原理如图,下列说法正确的是
A.a为,b为
B.向右侧电极移动
C.此电池在常温时也能工作
D.正极的电极反应为
10.根据原电池原理,结合装置图,下列说法正确的是
A.若X为铁,Y为硫酸铜溶液,则X为正极
B.若X为铁,Y为硫酸铜溶液,溶液中的Cu2+移向电极X极
C.若X为银,Y为硝酸银溶液,则X为正极
D.若X为铁,Y为浓硝酸,则铜为正极
11.有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原。则A、B、D、E金属活动性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E
C.D>E>A>B D.D>A>B>E
12.神舟十三号载人飞船刷新了中国载人航天技术的新高度。下列说法正确的是
A.逃逸系统复合材料中的酚醛树脂属于天然高分子材料
B.储能系统的锂离子蓄电池组在放电时将电能转化为化学能
C.计算机系统使用的国产CPU芯片主要成分为SiO2
D.飞船表面结构的铝合金具有高强、高韧的优点
13.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼胶)研究电化学原理。下列叙述正确的是
A.银片为负极,发生的反应为:Ag++e-=Ag
B.用稀硫酸代替AgNO3溶液,也可形成原电池
C.进行实验时,琼胶中K+移向Mg(NO3)2溶液
D.取出盐桥,电流表指针依然偏转
14.我国的航空航天事业取得了举世瞩目的成就。下列航空航天的设备中实现了由电能到化学能转化的是
A.利用生命生态实验柜养殖水稻 B.太阳能电池翼为空间站提供能量需要
C.空间站利用电解水供氧系统提供氧气 D.利用偏二甲肼(C2H8N2)作为助推剂发射火箭
15.有关电化学知识的描述正确的是( )
A.CaO+H2O=Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.原电池的两极一定是由活动性不同的两种金属组成
D.从理论上讲,任何能自发进行的释放能量的氧化还原反应都可设计成原电池
二、填空题
16.在甲、乙、丙三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:
(1)甲中反应的离子方程式为______。
(2)乙中Sn极的电极反应式为______,Sn极附近溶液的pH______(填“增大”“减小”或“不变”)。
(3)丙中被腐蚀的金属是______,总反应式为______(写离子方程式)。
17.甲醇燃料电池以甲醇为燃料。如图所示,在有水的条件下液态甲醇在负极上被氧化,产生二氧化碳和氢离子并流出电子氢离子经过质子交换膜,在正极上与氧气和流入的电子反应生成水。
甲醇燃料电池的工作原理示意图
写出上述过程中电极上发生的半反应及总反应。
(1)半反应:___________
(2)总反应:___________
18.铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)现有一含有FeCl2和FeCl3的混合物样品;采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。
(2)FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 _______;与MnO2 -Zn电池类似,K2FeO4 -Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________________________;
19.常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)石墨中化学键类型为______________,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________。
(5)操作A的名称为______________。
(6)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)
20.利用电极反应可探究物质氧化性、还原性的变化规律。
已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
电对(氧化型/还原型)
电极电势/V 0.771 1.776 0.695 1.224 0.536
回答下列问题:
I.探究的分解反应
催化分解反应过程包括i、ii两步:
反应i:___________(未配平)
反应ii:
(1)反应i的离子方程式为___________。
(2)验证生成:反应过程中,加入___________溶液,产生蓝色沉淀,证明有生成。
(3)酸性条件下也可催化分解。结合表中数据判断,上述条件下、、的氧化性由强到弱的顺序为___________。
Ⅱ.探究物质氧化性变化对电化学反应方向的影响
用可逆反应设计电池,按图a装置进行实验,测得电压E()随时间t的变化如图b所示:
(4)电池初始工作时,正极的电极反应式为___________。
(5)某小组从还原型物质浓度、氧化性变化的角度分析图b,提出以下猜想:
猜想1:增大,的氧化性减弱,正极的电极电势降低。
猜想2:减小,的氧化性增强,负极的电极电势升高。
①时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
实验 实验操作 电压E/V 结论
i 往烧杯A中加入适量Fe E___________0 猜想1成立
ii 往烧杯B中加入适量___________ E<0 猜想2成立
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由___________。
③为进一步验证猜想1,进行实验Ⅱi,完成表中填空。
实验 实验操作 电压E/V 结论
iii 往烧杯A中加入适量___________ E<0 猜想1成立
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。
【参考答案】
一、选择题
1.D
解析:A.放电时,氧气得电子发生还原反应,空气电极为正极,故A正确;
B.金属电极材料为Zn、溶液为碱性环境时,锌失电子发生氧化反应,电极反应式为,故B正确;
C.放电时,金属电极为负极、空气电极为正极,电子由金属电极经外电路移向空气电极,故C正确;
D.1gAl失电子 ,1gZn失电子,金属电极材料为Al时,电池的比能量大于Zn作金属电极,故D错误;
选D。
2.D
【分析】由图可知,放电时,a极为负极,电极反应式为,d极为正极,电极反应式为PbO2+2e +SO+4H+=PbSO4+2H2O,充电时,a极为阴极,d极为阳极,据此作答。
解析:A.充电时,d极为阳极,发生氧化反应,故A正确;
B.放电时,负极区氢氧根离子被消耗,钾离子透过b膜向右迁移,故b膜为阳离子交换膜,正极区氢离子消耗量大于硫酸根离子,硫酸根离子透过c膜向左迁移,故c膜为阴离子交换膜,故B正确;
C.放电时,a极为负极,电极反应式为,故C正确;
D.放电时,每转移2mol电子,中间K2SO4溶液中溶质增加1mol,故D错误;
故答案选D。
【点睛】本题考查可充电电池,题目难度中等,能依据图像和题目信息准确判断正负极和阴阳极是解题的关键,难点是电极反应式的书写。
3.D
解析:A.由图可知,放电时Zn为负极,多孔电极为正极,负极Zn生成ZHA,正极反应生成ZHA,两极均有ZHA沉积,故A正确;
B.放电时多孔电极上发生反应:,原溶于中存在,微弱水解使溶液显碱性,生成的醋酸为弱酸,微弱电离使溶液呈酸性,因为水解电离程度都很小,因此溶液的pH值变化不大,故B正确;
C.充电时为电解池,阴离子移向阳极,则向多孔碳电极移动,故C正确;
D.根据反应:,消耗电子即0.08mol电子时,n(Zn)=0.04mol,同时有0.01mol和0.06mol进入电解质溶液中,质量为0.01mol×183g/mol+0.06 mol×18g/mol=2.91g,故D错误;
故选:D。
4.C
【分析】由总反应可知,钠较活泼,放电时钠失去电子发生氧化反应,故放电时钠为负极、熔融硫为正极;
解析:A.中硫原子间以共价键相结合且均达到8电子稳定结构,电子式为,故A正确;
B.放电时钠为负极、熔融硫为正极,正极得到电子发生还原反应,,故B正确;
C.由分析可知,和熔融硫分别为电池的负极和正极,故C错误;
D.由图可知,该电池是以为隔膜的二次电池,故D正确;
故选C。
5.B
解析:A. 普通干电池不能充电,完全放电后不能再使用,是一次电池,A不符合题意;
B. 铅蓄电池、镍镉电池、锂电池等可以反复充电放电,属于可充电电池,是二次电池,B符合题意;
C. 通常所说的二次电池是指可充电电池,而氢氧燃烧电池可以反复使用,只要源源不断地提供燃料氢气,但性质上仍属于一次电池,因为燃料氢气没了,就不能再用了,C不符合题意;
D. 太阳能电池是太阳能转化为电能的装置,太阳能电池不属于化学电池,D不符合题意;故答案为:B。
6.D
【分析】由图可知,原电池中M为负极,电极反应为Zn-2e-+4OH-=[Zn(OH)4]2-,N为正极,电极反应为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2。
解析:A.根据分析,M为原电池的负极,发生氧化反应,A错误;
B.电子不能在电解质溶液中移动,B错误;
C.原电池中,阳离子向正极移动,因此Na+向N电极移动,C错误;
D.根据分析,N为正极,电极反应为Na0.6-xMnO2+xNa++xe-=Na0.6MnO2,D正确;
故选D。
7.C
解析:A.②氢氧燃料电池属于绿色电池,③锌锰干电池不属于绿色电池,故A错误;
B.①银锌纽扣电池属于不可充电电池,完全放电后不能再使用,属于一次电池,④铅蓄电池可以重复充电,属于二次电池,故B错误;
C.①银锌纽扣电池、③锌锰干电池都属于不可充电电池,完全放电后不能再使用,属于一次电池,故C正确;
D.金属锂可以水溶液反应,⑤锂电池电解液不可为水溶液,故D错误;
故选C。
8.A
解析:A.甲装置为Zn、Cu原电池,Zn做负极,失去电子变成Zn2+,Cu做正极,氢离子得电子生成氢气,所以反应开始,Cu电极附近溶液中的浓度减小程度大,故A错误;
B.乙装置中Ag2O做正极,反应式为,故B正确;
C.丙装置中锌筒作负极,发生氧化反应,锌筒由于发生反应会变薄,故C正确;
D.丁装置中氧化反应和还原反应分别在U型管的左侧区域和右侧区域进行,故D正确;
故答案选A。
9.D
【分析】该装置为甲烷的燃料电池,通甲烷一极为负极,电解质为熔融碳酸盐,因此通空气一极为正极,然后根据原电池工作原理进行分析;
解析:A.通入甲烷一极为负极,电极反应式为CH4+4CO-8e-=5CO2+2H2O,通入空气一极为正极,电极反应式为O2+2CO2+4e-=2CO,根据装置图可知,a为CH4,b为空气,故A错误;
B.根据原电池工作原理,CO向负极移动,即向左侧电极移动,故B错误;
C.因为该电池是在熔融状态进行,因此常温时,该电池不能工作,故C错误;
D.根据A选项分析,正极反应式为O2+2CO2+4e-=2CO,故D正确;
答案为D。
10.C
解析:A.铁的活泼性比铜强,正极为铜,A错误;
B.若X为铁,铁不铜活泼,铁作负极,铜作正极,溶液中的Cu2+移向正极铜,B错误;
C.若X为银,铜比银活泼,铜作负极,Ag作正极,故C正确;
D.若X为铁,Y为浓硝酸,铁与浓硝酸发生钝化,铜与浓硝酸反应,则铜为负极,D错误;
故选:C。
11.D
【分析】一般来说,较活泼金属作原电池负极。
解析:有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B,则A作负极,即金属活动性:A>B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈,则证明金属活动性:D>A;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原,则说明氧化性:E2+>B2+,即还原性:B>E,综上所述,金属活动性由强到弱的顺序是:D>A>B>E;
故答案为:D。
12.D
解析:A.酚醛树脂是苯酚与甲醛的缩聚产物,属于人工合成的高分子材料,故A错误;
B.锂离子蓄电池组在放电时将化学能转化成电能,故B错误;
C.CPU芯片主要成分为Si,故C错误;
D.铝合金具有高强度、高韧性的优点,故D正确;
故选:D。
13.B
解析:A.该装置为MgAg原电池,镁的活泼性大于银,镁作负极,失电子形成镁离子,故A错误;
B.若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,可以构成原电池,故B正确;
C.MgAg原电池,镁的活泼性大于银,镁作负极、银为正极,原电池中阳离子移向正极,所以盐桥中的阳离子往右侧硝酸银溶液迁移,故C错误;
D.取出盐桥,由于无法构成闭合回路,不能形成原电池,所以电流表不发生偏转,D错误;
选B。
14.C
解析:A.利用生命生态实验柜养殖水稻没有利用电能,故A不选;
B.太阳能电池翼为空间站提供能量需要是电能转化为其它形式的能量,故B不选;
C.空间站利用电解水供氧系统提供氧气是电能转化为化学能,故C选;
D.利用偏二甲肼(C2H8N2)作为助推剂发射火箭是化学能转化为动能,故D不选;
故选C。
15.D
解析:A. CaO+H2O═Ca(OH)2不是氧化还原反应,没有电子的转移,所以不能设计为原电池,故A错误;
B. 电解质溶液为AgNO3,与氯离子反应生成沉淀,所以不能用装有含琼胶的KCl饱和溶液作盐桥,故B错误;
C. 原电池的两极可以是由活动性不同的两种金属组成,也可以是非金属,如氢氧燃料电池中石墨棒用作电极,故C错误;
D. 理论上,任何能自发进行的氧化还原反应都可被设计成原电池,故D正确;
故选D。
二、填空题
16. Fe+2H+=Fe2++H2↑ 2H++2e-=H2↑ 增大 Zn Zn+2H+=Zn2++H2↑
解析:(1)甲中发生氢离子和Fe的置换反应,离子方程式为Fe+2H+=Fe2++H2↑;
(2)Sn、Fe和稀硫酸溶液形成原电池,Fe比Sn活泼,所以Fe为负极,Sn为正极,氢离子在Sn电极上放电生成氢气,电极反应时式为2H++2e-=H2↑,由于氢离子浓度减小,所以Sn电极附近pH增大;
(3)Zn比Fe活泼,所以形成原电池时,Zn为负极,被腐蚀,总反应为Zn和稀硫酸溶液的反应,离子方程式为Zn+2H+=Zn2++H2↑。
17.(1)负极:CH3OH+H2O-6e-=CO2+6H+;正极:4H++O2+4e-=2H2O。
(2)2CH3OH+3O2=2CO2+4H2O
解析:(1)根据图示可知,电池负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+;正极上氢离子得电子与氧气反应生成水,电极反应式为4H++O2+4e-=2H2O。
(2)根据题意可知,电池总反应为2CH3OH+3O2=2CO2+4H2O。
18.(1)10%
(2) 2Fe(OH)3+3ClO-+ 4OH-=2+3Cl-+5H2O +3e-+4H2O=Fe(OH)3+5OH-
解析:(1)设FeCl2和FeCl3的物质的量分别为a、b,则(a+b):(2a+3b)=1:2.1,a:b=9:1,则该样品中FeCl3的物质的量分数为;
(2)铁离子再强碱环境下为氢氧化铁,FeCl3与KClO在强碱性条件下反应可制取K2FeO4,铁元素化合价升高、氯元素化合价降低变为-1,其反应的离子方程式为2Fe(OH)3+3ClO-+ 4OH-=2+3Cl-+5H2O; K2FeO4在电池中作为正极材料,得到电子,发生还原反应生成氢氧化铁,其电极反应式为+3e-+4H2O=Fe(OH)3+5OH-。
19. 共价键(非极性共价键), 导电 Zn-2e-=Zn2+ MnO2+e-+H2O=MnOOH+OH- 加快溶解速率 过滤 Cu+H2O2+H2SO4=CuSO4+2H2O
【分析】废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌,据此解答。
解析:(1) 石墨晶体为混合晶型,是层状结构。在每一层内,每个碳原子与其他3个碳原子以共价键结合形成六边形网状结构;石墨具有导电性,在电池中作电极,起导电作用,
故答案为共价键(非极性共价键);导电;
(2) 酸性锌锰干电池的负极为锌,负极反应为Zn-2e-=Zn2+,
故答案为Zn-2e-=Zn2+;
(3) 在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O=MnOOH+OH-,
故答案为MnO2+e-+H2O=MnOOH+OH-;
(4) 加热适当升高温度,可促进溶解,
故答案为加快溶解速率;
(5) 分离不溶性固体和溶液采用过滤的方法,所以操作A的名称是过滤,
故答案为过滤;
(6) 酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为Cu+H2O2+H2SO4=CuSO4+2H2O。
20.(1)
(2)
(3)>>
(4)
(5) < AgNO3固体 加入铁粉后,同时造成增大,减小,都能使平衡逆移,使E<0 FeCl2固体
【分析】已知:酸性介质中,1mol/L不同电对的电极电势越高,其氧化型物质的氧化性越强,结合表中数据判断,上述条件下氧化性由强到弱的顺序为>>Fe3+>>I2,还原性顺序为:I->>Fe2+>>H2O;
要通过反应探究对电化学反应方向的影响,从某还原型物质浓度、氧化性变化的角度分析图b,对于2个猜想,只能通过改变一个变量观察是否使E<0来探究——猜想1:增大,的氧化性减弱,正极的电极电势降低,故只能通过A烧杯加适量氯化亚铁固体,增加亚铁离子浓度,猜想2:减小,的氧化性增强,负极的电极电势升高,只能通过B烧杯加适量硝酸银固体减少碘离子浓度来实现。
解析:(1)结合分析可知,反应i中铁离子把双氧水氧化了,生成亚铁离子、氧气和水,离子方程式为。
(2)遇发生反应:,生成深蓝色沉淀,则反应过程中,加入溶液,产生蓝色沉淀,证明有生成。
(3)据分析,上述条件下、、的氧化性由强到弱的顺序为>>。
(4)电池初始工作时,由可知,铁离子得电子发生还原反应转变为亚铁离子,为正极,则正极的电极反应式为。
(5)①i.t1时,若往烧杯A中加入适量Fe,则铁与铁离子反应,结合猜想1,增大,的氧化性减弱,正极的电极电势降低,则E<0;
ii.②t1时,若往烧杯B中加入适量AgNO3固体,可使碘离子产生沉淀,使减小,的氧化性增强,负极的电极电势升高,使E<0,猜想2成立。
③iii.t1时,若往烧杯A中加入适量FeCl2固体, 增大,的氧化性减弱,正极的电极电势降低,使E<0,猜想1成立
