3.1.3铁盐和亚铁盐课件(共37张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.3铁盐和亚铁盐课件(共37张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 42.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 19:06:22 | ||
图片预览








文档简介
(共37张PPT)
第三章 铁金属材料
第一节 铁及其化合物
第3课时 铁盐、亚铁盐
目
录
1、铁盐和亚铁盐
2、Fe2+与Fe3+的相互转化
3、常见题型训练
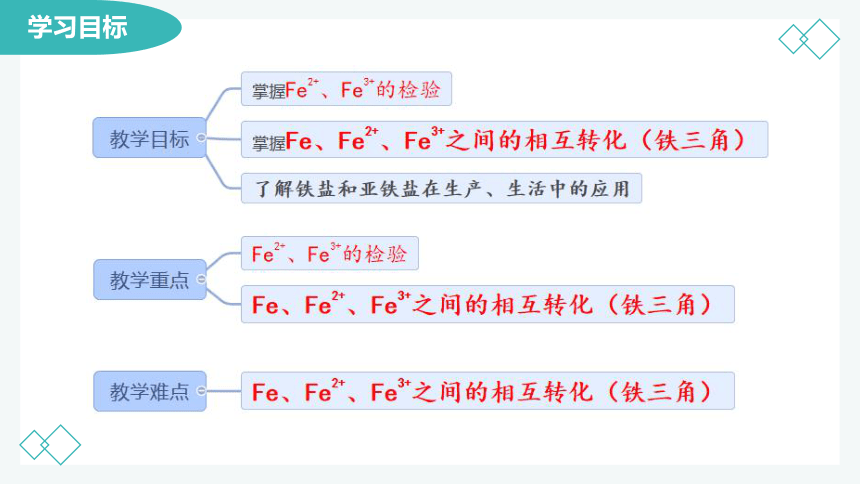
学习目标
你贫血吗?
紧压指甲盖数秒,然后放开,如果马上变红表明你是很健康的;由白色慢慢变红,表明你可能存在贫血。
高低导入一下
铁是人体必需的微量元素中含量最多的一种。食用富含铁元素的食品,可以补充人体所需的铁元素。那你知道为什么人体需要补铁吗?补的几价铁?
菠菜
木耳
瘦肉
生活中的铁元素
缺铁会导致缺铁性贫血,造成人的记忆能力、免疫能力等生理功能下降。亚铁盐可以用来治疗缺铁性贫血。某补铁药物如图所示,其主要成分是琥珀酸亚铁。
生活中的铁元素
一、铁盐和亚铁盐
久置氯化亚铁
新置氯化亚铁
久置
观察体验
【思考】久置的FeSO4溶液,颜色有些发黄,你觉得发黄的原因是什么
Fe3+、Fe2+的检验
【假设猜想】亚铁离子氧化变质,生成了Fe3+
【思考】如何检验Fe3+的存在
检验方法 Fe3+ Fe2+
观察法
棕黄色
浅绿色
加入NaOH
红褐色沉淀
白色沉淀迅速变为灰绿色最后变为红褐色
加入酸性KMnO4
加入酸性KMnO4溶液,无明显现象
加入酸性KMnO4溶液,溶液紫色褪去
1.如何检验某溶液只含有Fe2+而不含有Fe3+?
2.如何检验某溶液既含有Fe2+又含有Fe3+?
3.如何检验FeCl2溶液中是否含有FeCl3?
4.如何检验FeCl3溶液中是否含有FeCl2?
资料卡片:
硫氰化钾(KSCN)溶液,是一种无色溶液,遇Fe3+变为血红色,遇Fe2+硫氰化钾(KSCN)溶液无明显现象
思考与交流
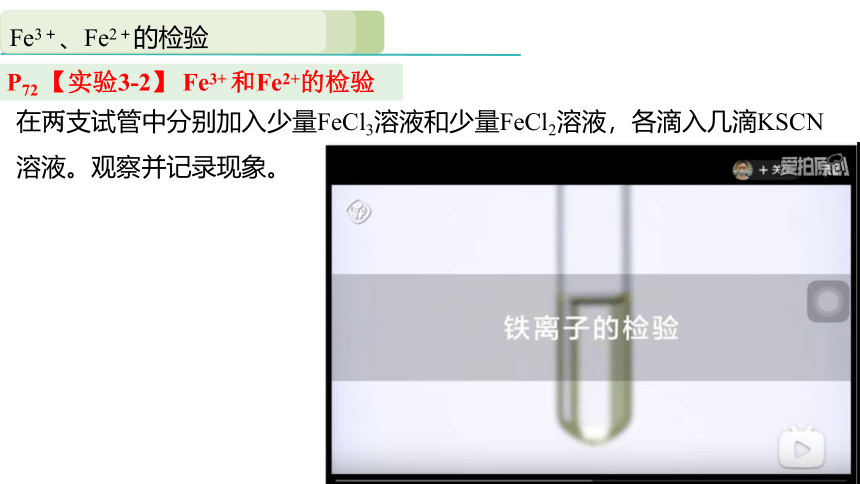
在两支试管中分别加入少量FeCl3溶液和少量FeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。
P72 【实验3-2】 Fe3+ 和Fe2+的检验
Fe3+、Fe2+的检验
1、与KSCN溶液的反应——Fe3+的检验
滴入KSCN
滴入KSCN
FeCl2溶液
Fe3+、Fe2+的检验
Fe3+ Fe2+
溶液的颜色 色 色
滴加KSCN溶液
反应原理
应用 在含有Fe3+的盐溶液中滴加 ,检验Fe3+的存在
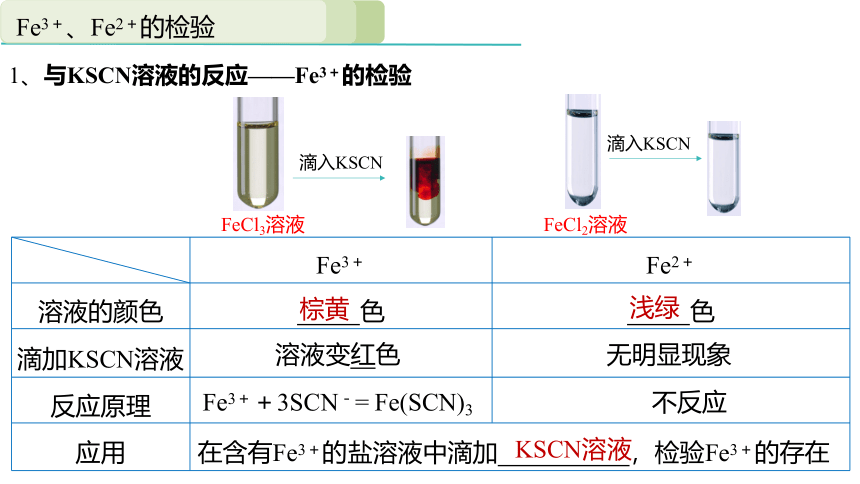
浅绿
棕黄
KSCN溶液
无明显现象
溶液变红色
不反应
Fe3++3SCN-= Fe(SCN)3
FeCl3溶液
请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质。
待测液
KSCN溶液
变红色
酸性高锰酸钾溶液
含Fe3+
褪色
含Fe2+
部分变质
问题回顾
Fe2+、Fe3+的检验归纳
混合溶液中Fe2+、Fe3+的检验
(1)Fe2+和Fe3+的混合溶液中检验Fe2+的方法
①通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去,
说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+的检验有干扰)。
②向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,说明含有Fe2+。
(2)Fe2+和Fe3+的混合溶液中检验Fe3+,可用KSCN试剂,现象为溶液变红。
【例1】.下列离子的检验方法合理的是
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含
有Fe2+
C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为
红褐色,说明原溶液中含有Fe2+,不含有Mg2+
C
二、Fe2+与Fe3+的相互转化
在盛有 2 mL FeCl3溶液的试管中加入过量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又发生了什么变化
P73【实验3-3】
振荡
现象
离子方程式
结论
溶液变为浅绿色
溶液无明显变化
溶液变红色
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
2Fe3++Fe=3Fe2+
a.Fe3+具有氧化性,能被还原剂(如Fe)还原为Fe2+;
b.Fe2+具有还原性,能被氧化剂(如氯气、过氧化氢等)氧化为Fe3+。
Fe2++Zn = Fe+Zn2+
2Fe2++Cl2 = 2Fe3++2Cl-
2Fe3++Fe = 3Fe2+
2Fe3++Cu = 2Fe2++Cu2+
①Fe2+
氧化性
还原性
Cl2
酸性KMnO4褪色
5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O
②Fe3+
氧化性
Fe
Cu
I-
印刷电路板
2Fe3++2I- = I2 +2Fe2+
从价态角度归纳Fe2+和Fe3+的性质
Fe3+ Fe2+
还原剂(Fe、Cu等)
氧化剂(Cl2、KMnO4(H+)、HNO3、H2O2等)
结合Fe,建立“铁三角”
1、Fe3+与Fe2+的转化
Fe3+与Fe2+的相互转化
Fe3+与Fe2+的相互转化
“铁 三 角”
Fe3+与Fe2+转化关系的应用
(1)含Fe2+、Fe3+的分离、除杂
序号 混合物 除杂方法 离子方程式
1 除去FeCl2溶液中的少量FeCl3
2 除去FeCl3溶液中的少量FeCl2
3 除去FeCl2溶液中的少量CuCl2
2Fe3++Fe=3Fe2+
2Fe2++Cl2 =2Fe3++2Cl-
Cu2++Fe=Fe2++Cu
加入足量铁粉
通入少量氯气
加入足量铁粉
(2)与Fe2+、Fe3+在水溶液中不能大量共存的离子总结
③Fe3+与SCN-发生反应生成难电离的Fe(SCN)3,不能大量共存。
②Fe3+与S2-、I-、HS-、SO32-,Fe2+与ClO-、MnO4-(H+)在溶液中因发
生氧化还原反应而不能大量共存。
①Fe2+、Fe3+与OH-因反应生成沉淀而不能大量共存。
Fe3+与Fe2+转化关系的应用
C
①实验原理:
(3)利用覆铜板制作图案
学生自主阅读课本P74【探究】
利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀
取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案
②实验操作:
用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的图案。
③实验现象:
④反应方程式:
⑤实验结论:
2FeCl3+Cu=2FeCl2+CuCl2
铜可被FeCl3溶液腐蚀
如何处理腐蚀液回收得到Cu和FeCl3 设计回收转化流程。
2Fe3++Cu = 2Fe2++Cu2+
【例3】.(2022广东东莞七校联考)电子工业上使用的印刷电路板,是在覆有铜膜的塑料板上以涂层保护所要的线路,然后用FeCl3浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3作为腐蚀液原料循环使用,准备采用图示步骤:
(1)写出FeCl3溶液与铜膜发生反应的离子方程式: 。
(2)检验腐蚀废液中含有Fe3+所需试剂名称: ,实验现象: 。
(3)向滤液②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:
,
此转化的化学方程式为 、 。
(4)已知通入的⑥是一种黄绿色气体,写出通入⑥发生反应的离子方程式: 。
2Fe3++Cu == 2Fe2++Cu2+
硫氰化钾溶液
溶液变为红色
反应生成白色沉淀,迅速变为灰绿色,最后变为红褐色
FeCl2+2NaOH = Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
2Fe2++Cl2 = 2Fe3++2Cl-
总结
铁的价类二维图
物质类别
化合价
单质
氧化物
碱
盐
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
+2
+3
三、常见题型训练
C
2.(2022·烟台高一质检)下列物质反应后,加入KSCN溶液一定变红的是( )
A.过量的Fe与Cl2反应 B.Fe与稀硫酸反应
C.FeCl2溶液中通入少量Cl2 D.Fe和Fe2O3的混合物溶于盐酸
C
3.(2022·北京清华附中高一期末)下列方程式与所给事实不相符的是
A.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu = 2Fe2++Cu2+
B.盐酸除铁锈:Fe2O3 + 6H+ = 2Fe3++3H2O
C.将H2O2溶液滴加到酸性FeCl2溶液中:2Fe2++H2O2+2H+ =2H2O+2Fe3+
D.红热的Fe粉和水蒸气反应生成黑色固体:2Fe+3H2O Fe2O3+3H2
D
4.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为:2Fe2++Cl2 ===2Fe3++2Cl-
D. 用酸性KMnO4溶液可检验溶液中是否还有Fe2+
C
5.(2022河北辛集一中月考)已知氧化性:Fe3+>Cu2+。向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在。下列判断中正确的是 ( )
A.剩余固体中可能没有铜 B.反应后的溶液中可能含有Fe3+
C.反应后的溶液中一定含有Cu2+ D.反应后的溶液中一定含有Fe2+
D
6.(2023浙江温州联考)已知:Br2++2Fe2+ = 2Fe3++2Br-,2Fe3++2I- = 2Fe2++I2。则以下说法中错误的是 ( )
A.氧化性:Br2>Fe3+>I2
B.Br-和Fe2+在溶液中能大量共存
C.FeI2溶液中通足量氯气的离子方程式:2Fe2++2I-+2Cl2 = 2Fe3++4Cl-+I2
D.FeBr2溶液中通少量氯气的离子方程式:2Fe2++Cl2 = 2Fe3++2Cl-
D
7.(2023江苏南京五中期末)证明某溶液只含有Fe2+而不含有Fe3+的实验方法最好的是 ( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,立即产生红褐色沉淀
D.只需滴加KSCN溶液
B
8.(教材习题改编)下列除杂的操作不正确的是 ( )
A.FeCl3溶液中混有少量FeCl2:通入过量Cl2后加热
B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤
C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤
D.FeCl2溶液中混有少量CuCl2:加入过量铁粉充分反应后过滤
D
9.(2023广东东莞期末)部分含铁物质的类别与相应化合价关系如图所示(f、g可溶于水)。下列推断不合理的是 ( )
A.a与H2O(g)高温下反应可实现a转化为c
B.g与Cu反应或b与H+反应,均可得到f中的阳离子
C.可实现f→d→e→g→f的循环转化
D.由图可预测:Na2FeO4具有强氧化性,可用于消毒
D
10.(2022浙江杭州重点中学期中联考)如图所示物质之间的转化:
请回答下列问题:
(1)A的化学式为 ;C的化学式为 。
(2)F转化为G的离子方程式为 。
(3)有同学向盛有H2O2溶液的试管中加入几滴酸化的B溶液,溶液变为棕黄色,发生反应的离子方程式为 。
(4)为了检验A在氯气中燃烧的产物(产物为纯净物)中的阳离子,可将产物溶解于水配成溶液,则可选用进行检验的试剂是 ,现象是 。
Fe
KOH
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
H2O2 + 2Fe2+ + 2H+ = 2Fe3+ + 2H2O
KSCN溶液
溶液变为红色
第三章 铁金属材料
第一节 铁及其化合物
第3课时 铁盐、亚铁盐
目
录
1、铁盐和亚铁盐
2、Fe2+与Fe3+的相互转化
3、常见题型训练
学习目标
你贫血吗?
紧压指甲盖数秒,然后放开,如果马上变红表明你是很健康的;由白色慢慢变红,表明你可能存在贫血。
高低导入一下
铁是人体必需的微量元素中含量最多的一种。食用富含铁元素的食品,可以补充人体所需的铁元素。那你知道为什么人体需要补铁吗?补的几价铁?
菠菜
木耳
瘦肉
生活中的铁元素
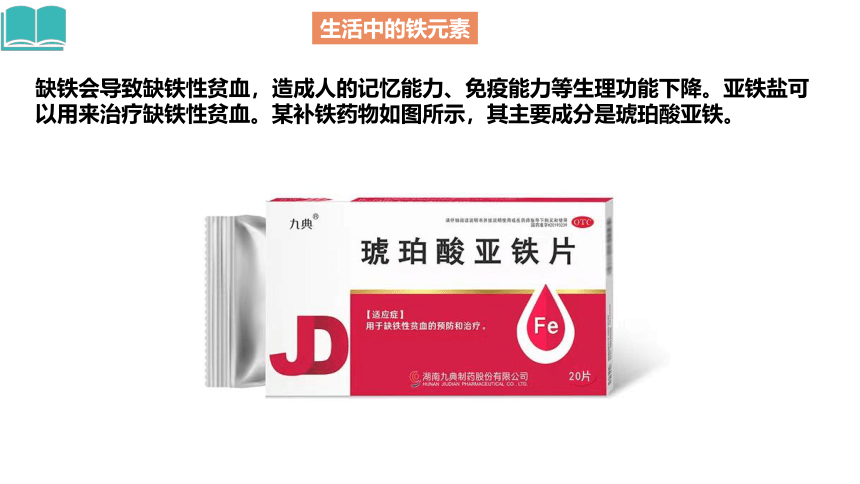
缺铁会导致缺铁性贫血,造成人的记忆能力、免疫能力等生理功能下降。亚铁盐可以用来治疗缺铁性贫血。某补铁药物如图所示,其主要成分是琥珀酸亚铁。
生活中的铁元素
一、铁盐和亚铁盐
久置氯化亚铁
新置氯化亚铁
久置
观察体验
【思考】久置的FeSO4溶液,颜色有些发黄,你觉得发黄的原因是什么
Fe3+、Fe2+的检验
【假设猜想】亚铁离子氧化变质,生成了Fe3+
【思考】如何检验Fe3+的存在
检验方法 Fe3+ Fe2+
观察法
棕黄色
浅绿色
加入NaOH
红褐色沉淀
白色沉淀迅速变为灰绿色最后变为红褐色
加入酸性KMnO4
加入酸性KMnO4溶液,无明显现象
加入酸性KMnO4溶液,溶液紫色褪去
1.如何检验某溶液只含有Fe2+而不含有Fe3+?
2.如何检验某溶液既含有Fe2+又含有Fe3+?
3.如何检验FeCl2溶液中是否含有FeCl3?
4.如何检验FeCl3溶液中是否含有FeCl2?
资料卡片:
硫氰化钾(KSCN)溶液,是一种无色溶液,遇Fe3+变为血红色,遇Fe2+硫氰化钾(KSCN)溶液无明显现象
思考与交流
在两支试管中分别加入少量FeCl3溶液和少量FeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。
P72 【实验3-2】 Fe3+ 和Fe2+的检验
Fe3+、Fe2+的检验
1、与KSCN溶液的反应——Fe3+的检验
滴入KSCN
滴入KSCN
FeCl2溶液
Fe3+、Fe2+的检验
Fe3+ Fe2+
溶液的颜色 色 色
滴加KSCN溶液
反应原理
应用 在含有Fe3+的盐溶液中滴加 ,检验Fe3+的存在
浅绿
棕黄
KSCN溶液
无明显现象
溶液变红色
不反应
Fe3++3SCN-= Fe(SCN)3
FeCl3溶液
请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质。
待测液
KSCN溶液
变红色
酸性高锰酸钾溶液
含Fe3+
褪色
含Fe2+
部分变质
问题回顾
Fe2+、Fe3+的检验归纳
混合溶液中Fe2+、Fe3+的检验
(1)Fe2+和Fe3+的混合溶液中检验Fe2+的方法
①通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去,
说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+的检验有干扰)。
②向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,说明含有Fe2+。
(2)Fe2+和Fe3+的混合溶液中检验Fe3+,可用KSCN试剂,现象为溶液变红。
【例1】.下列离子的检验方法合理的是
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含
有Fe2+
C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为
红褐色,说明原溶液中含有Fe2+,不含有Mg2+
C
二、Fe2+与Fe3+的相互转化
在盛有 2 mL FeCl3溶液的试管中加入过量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又发生了什么变化
P73【实验3-3】
振荡
现象
离子方程式
结论
溶液变为浅绿色
溶液无明显变化
溶液变红色
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
2Fe3++Fe=3Fe2+
a.Fe3+具有氧化性,能被还原剂(如Fe)还原为Fe2+;
b.Fe2+具有还原性,能被氧化剂(如氯气、过氧化氢等)氧化为Fe3+。
Fe2++Zn = Fe+Zn2+
2Fe2++Cl2 = 2Fe3++2Cl-
2Fe3++Fe = 3Fe2+
2Fe3++Cu = 2Fe2++Cu2+
①Fe2+
氧化性
还原性
Cl2
酸性KMnO4褪色
5Fe2++MnO4-+8H+ = 5Fe3++Mn2++4H2O
②Fe3+
氧化性
Fe
Cu
I-
印刷电路板
2Fe3++2I- = I2 +2Fe2+
从价态角度归纳Fe2+和Fe3+的性质
Fe3+ Fe2+
还原剂(Fe、Cu等)
氧化剂(Cl2、KMnO4(H+)、HNO3、H2O2等)
结合Fe,建立“铁三角”
1、Fe3+与Fe2+的转化
Fe3+与Fe2+的相互转化
Fe3+与Fe2+的相互转化
“铁 三 角”
Fe3+与Fe2+转化关系的应用
(1)含Fe2+、Fe3+的分离、除杂
序号 混合物 除杂方法 离子方程式
1 除去FeCl2溶液中的少量FeCl3
2 除去FeCl3溶液中的少量FeCl2
3 除去FeCl2溶液中的少量CuCl2
2Fe3++Fe=3Fe2+
2Fe2++Cl2 =2Fe3++2Cl-
Cu2++Fe=Fe2++Cu
加入足量铁粉
通入少量氯气
加入足量铁粉
(2)与Fe2+、Fe3+在水溶液中不能大量共存的离子总结
③Fe3+与SCN-发生反应生成难电离的Fe(SCN)3,不能大量共存。
②Fe3+与S2-、I-、HS-、SO32-,Fe2+与ClO-、MnO4-(H+)在溶液中因发
生氧化还原反应而不能大量共存。
①Fe2+、Fe3+与OH-因反应生成沉淀而不能大量共存。
Fe3+与Fe2+转化关系的应用
C
①实验原理:
(3)利用覆铜板制作图案
学生自主阅读课本P74【探究】
利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀
取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案
②实验操作:
用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的图案。
③实验现象:
④反应方程式:
⑤实验结论:
2FeCl3+Cu=2FeCl2+CuCl2
铜可被FeCl3溶液腐蚀
如何处理腐蚀液回收得到Cu和FeCl3 设计回收转化流程。
2Fe3++Cu = 2Fe2++Cu2+
【例3】.(2022广东东莞七校联考)电子工业上使用的印刷电路板,是在覆有铜膜的塑料板上以涂层保护所要的线路,然后用FeCl3浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3作为腐蚀液原料循环使用,准备采用图示步骤:
(1)写出FeCl3溶液与铜膜发生反应的离子方程式: 。
(2)检验腐蚀废液中含有Fe3+所需试剂名称: ,实验现象: 。
(3)向滤液②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:
,
此转化的化学方程式为 、 。
(4)已知通入的⑥是一种黄绿色气体,写出通入⑥发生反应的离子方程式: 。
2Fe3++Cu == 2Fe2++Cu2+
硫氰化钾溶液
溶液变为红色
反应生成白色沉淀,迅速变为灰绿色,最后变为红褐色
FeCl2+2NaOH = Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
2Fe2++Cl2 = 2Fe3++2Cl-
总结
铁的价类二维图
物质类别
化合价
单质
氧化物
碱
盐
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
+2
+3
三、常见题型训练
C
2.(2022·烟台高一质检)下列物质反应后,加入KSCN溶液一定变红的是( )
A.过量的Fe与Cl2反应 B.Fe与稀硫酸反应
C.FeCl2溶液中通入少量Cl2 D.Fe和Fe2O3的混合物溶于盐酸
C
3.(2022·北京清华附中高一期末)下列方程式与所给事实不相符的是
A.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu = 2Fe2++Cu2+
B.盐酸除铁锈:Fe2O3 + 6H+ = 2Fe3++3H2O
C.将H2O2溶液滴加到酸性FeCl2溶液中:2Fe2++H2O2+2H+ =2H2O+2Fe3+
D.红热的Fe粉和水蒸气反应生成黑色固体:2Fe+3H2O Fe2O3+3H2
D
4.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为:2Fe2++Cl2 ===2Fe3++2Cl-
D. 用酸性KMnO4溶液可检验溶液中是否还有Fe2+
C
5.(2022河北辛集一中月考)已知氧化性:Fe3+>Cu2+。向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在。下列判断中正确的是 ( )
A.剩余固体中可能没有铜 B.反应后的溶液中可能含有Fe3+
C.反应后的溶液中一定含有Cu2+ D.反应后的溶液中一定含有Fe2+
D
6.(2023浙江温州联考)已知:Br2++2Fe2+ = 2Fe3++2Br-,2Fe3++2I- = 2Fe2++I2。则以下说法中错误的是 ( )
A.氧化性:Br2>Fe3+>I2
B.Br-和Fe2+在溶液中能大量共存
C.FeI2溶液中通足量氯气的离子方程式:2Fe2++2I-+2Cl2 = 2Fe3++4Cl-+I2
D.FeBr2溶液中通少量氯气的离子方程式:2Fe2++Cl2 = 2Fe3++2Cl-
D
7.(2023江苏南京五中期末)证明某溶液只含有Fe2+而不含有Fe3+的实验方法最好的是 ( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,立即产生红褐色沉淀
D.只需滴加KSCN溶液
B
8.(教材习题改编)下列除杂的操作不正确的是 ( )
A.FeCl3溶液中混有少量FeCl2:通入过量Cl2后加热
B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤
C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤
D.FeCl2溶液中混有少量CuCl2:加入过量铁粉充分反应后过滤
D
9.(2023广东东莞期末)部分含铁物质的类别与相应化合价关系如图所示(f、g可溶于水)。下列推断不合理的是 ( )
A.a与H2O(g)高温下反应可实现a转化为c
B.g与Cu反应或b与H+反应,均可得到f中的阳离子
C.可实现f→d→e→g→f的循环转化
D.由图可预测:Na2FeO4具有强氧化性,可用于消毒
D
10.(2022浙江杭州重点中学期中联考)如图所示物质之间的转化:
请回答下列问题:
(1)A的化学式为 ;C的化学式为 。
(2)F转化为G的离子方程式为 。
(3)有同学向盛有H2O2溶液的试管中加入几滴酸化的B溶液,溶液变为棕黄色,发生反应的离子方程式为 。
(4)为了检验A在氯气中燃烧的产物(产物为纯净物)中的阳离子,可将产物溶解于水配成溶液,则可选用进行检验的试剂是 ,现象是 。
Fe
KOH
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
H2O2 + 2Fe2+ + 2H+ = 2Fe3+ + 2H2O
KSCN溶液
溶液变为红色
