1.1化学方程式3--华师大版初中科学九上同步课件
文档属性
| 名称 | 1.1化学方程式3--华师大版初中科学九上同步课件 |
|
|
| 格式 | pptx | ||
| 文件大小 | 748.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-12-25 09:44:18 | ||
图片预览




文档简介
(共19张PPT)
化学方程式
第三课时
第一章 化学反应
化学方程式是怎样体现质量守恒定律的?
2 H2 + O2
点燃
2 H2O
2×1×2
=4
16×2
=32
2×(1×2+16)
=36
2 H2 + O2
点燃
2 H2O
每4份质量的氢气和32份质量的氧气完全反应生成36份质量的水;
H原子数目:
4
2
2
4
O原子数目:
反应前后,原子的种类和数目不变!
1、我国用“长征”二号F捆绑式火箭将“神舟号” 载人飞船成功送上太空。火箭用联氨(N2H4)作燃料,一氧化氮作氧化剂。反应的化学方程式是:N2H4+2NO == 2X+2H2O,求X的化学式( )
点燃
A.N2 B.NO2 C.NH3 D.N2O
A
归纳方法:从化学式全部已知的一边入手。
N原子数目: 4
H原子数目: 4 O原子数目: 2
4 2
N2H4 + 2NO == 2X + 2H2O
点燃
课中小练
课中小练
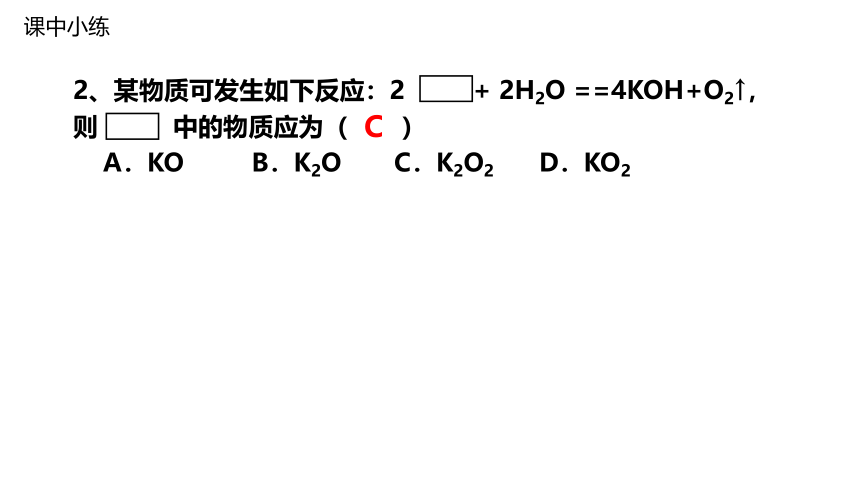
2、某物质可发生如下反应:2 + 2H2O ==4KOH+O2↑,则 中的物质应为( )
A.KO B.K2O C.K2O2 D.KO2
C
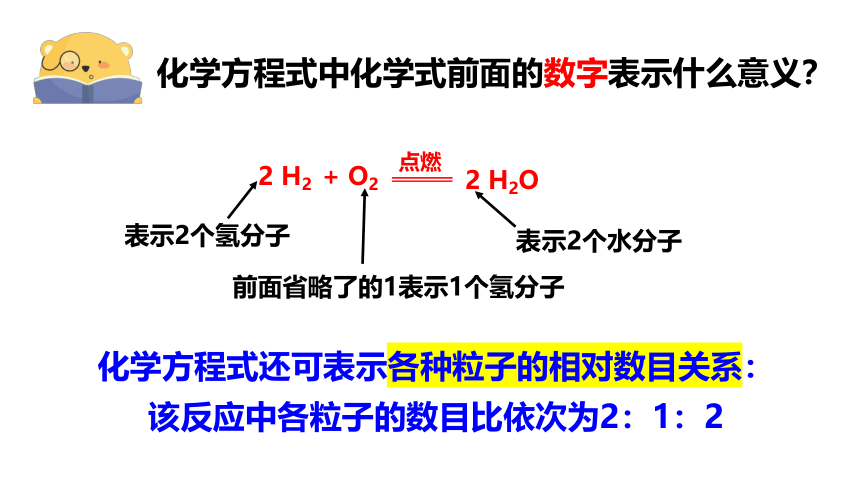
化学方程式中化学式前面的数字表示什么意义?
2 H2 + O2
点燃
2 H2O
化学方程式还可表示各种粒子的相对数目关系:
该反应中各粒子的数目比依次为2:1:2
表示2个氢分子
前面省略了的1表示1个氢分子
表示2个水分子
课中小练
1、下图是某个化学反应前后的微观模拟图,请根据图示判断参加反应的 和 与反应后生成物的分子个数比是 。
用图示表示这一化学反应为:
反应前
反应后
2:1:2
+
→
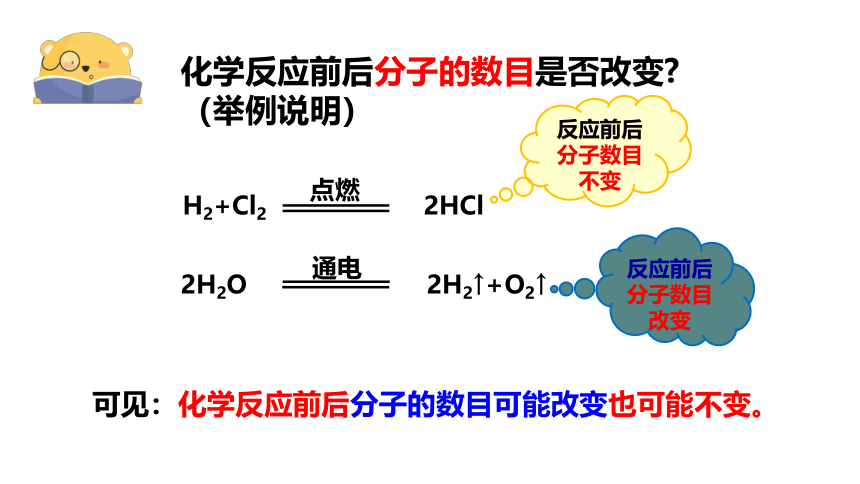
化学反应前后分子的数目是否改变 (举例说明)
反应前后分子数目不变
反应前后分子数目改变
H2+Cl2 2HCl
点燃
2H2O 2H2↑+O2↑
通电
可见:化学反应前后分子的数目可能改变也可能不变。
归纳:化学方程式的意义
C
O2
点燃
CO2
+
1
1
16×2
44
1
12
1.宏观意义:表示反应物,生成物和反应条件
2.微观意义:表示参加反应的各物质间的数量关系,即粒子个数比。
粒子个数比=化学计量数之比
3.质量意义:表示各物质之间的质量关系,即各物质之间的质量比。
质量比=相对分子质量与化学计量数乘积之比
粒子个数比:
各物质的质量比:
如何读出化学方程式?
1.宏观读法:碳和氧气在点燃的条件下生成二氧化碳。
2.微观读法:每1个碳原子和1个氧分子反应生成1个二氧化碳分子。
3.质量读法:每12份质量的碳和32份质量的氧气反应生成44份质量的二氧化碳。
C
O2
点燃
CO2
+
学会正确表达化学方程式的意义!
1、读出下列化学反应的化学方程式
CO2+Ca(OH)2=CaCO3↓+H2O
1.宏观读法:
2.微观读法:
3.质量读法:
二氧化碳和氢氧化钙反应生成碳酸钙和水
每1个二氧化碳分子和1个氢氧化钙反应生成1个碳酸钙和1个水分子
每44份质量的二氧化碳和74份质量的氢氧化钙反应生成100份质量的碳酸钙和18份质量的水。
课中小练
2、书写和读出下列化学反应的化学方程式
二氧化碳+水→碳酸
CO2+H2O=H2CO3
CaCO3 CO2↑+CaO
高温
课中小练
小结
1. 化学方程式的意义
2. 化学方程式的读法
(1)表示反应物,生成物和反应条件
(2)表示反应过程中微粒的个数比
(3)表示反应过程中各微粒的质量比
(1)宏观读法
(2)微观读法
(3)质量读法
1.化学方程式可以反映( )
①质量守恒定律②反应物和生成物的质量比
③反应物和生成物的种类④反应物和生成物间分子的个数关系
A.①②③ B.①③④
C.①②④ D.①②③④
练一练
C
练一练
A
D
A
练一练
A
练一练
B
练一练
B
练一练
总结:
化学方程式
1、定义:
2、意义:
(1)表示反应物,生成物和反应条件
(2)表示反应过程中微粒的个数比
3、读法:
4、书写原则:
以客观事实为基础
遵守质量守恒定律
5、书写步骤:
写:左反右生中间一短线
配:配平
注:注明反应条件、生成物的状态 (↑↓)
等:短线改等号
查:检查化学方程式是否书写完整
用化学式表示化学反应的式子。
(3)表示反应过程中各微粒的质量比
化学方程式
第三课时
第一章 化学反应
化学方程式是怎样体现质量守恒定律的?
2 H2 + O2
点燃
2 H2O
2×1×2
=4
16×2
=32
2×(1×2+16)
=36
2 H2 + O2
点燃
2 H2O
每4份质量的氢气和32份质量的氧气完全反应生成36份质量的水;
H原子数目:
4
2
2
4
O原子数目:
反应前后,原子的种类和数目不变!
1、我国用“长征”二号F捆绑式火箭将“神舟号” 载人飞船成功送上太空。火箭用联氨(N2H4)作燃料,一氧化氮作氧化剂。反应的化学方程式是:N2H4+2NO == 2X+2H2O,求X的化学式( )
点燃
A.N2 B.NO2 C.NH3 D.N2O
A
归纳方法:从化学式全部已知的一边入手。
N原子数目: 4
H原子数目: 4 O原子数目: 2
4 2
N2H4 + 2NO == 2X + 2H2O
点燃
课中小练
课中小练
2、某物质可发生如下反应:2 + 2H2O ==4KOH+O2↑,则 中的物质应为( )
A.KO B.K2O C.K2O2 D.KO2
C
化学方程式中化学式前面的数字表示什么意义?
2 H2 + O2
点燃
2 H2O
化学方程式还可表示各种粒子的相对数目关系:
该反应中各粒子的数目比依次为2:1:2
表示2个氢分子
前面省略了的1表示1个氢分子
表示2个水分子
课中小练
1、下图是某个化学反应前后的微观模拟图,请根据图示判断参加反应的 和 与反应后生成物的分子个数比是 。
用图示表示这一化学反应为:
反应前
反应后
2:1:2
+
→
化学反应前后分子的数目是否改变 (举例说明)
反应前后分子数目不变
反应前后分子数目改变
H2+Cl2 2HCl
点燃
2H2O 2H2↑+O2↑
通电
可见:化学反应前后分子的数目可能改变也可能不变。
归纳:化学方程式的意义
C
O2
点燃
CO2
+
1
1
16×2
44
1
12
1.宏观意义:表示反应物,生成物和反应条件
2.微观意义:表示参加反应的各物质间的数量关系,即粒子个数比。
粒子个数比=化学计量数之比
3.质量意义:表示各物质之间的质量关系,即各物质之间的质量比。
质量比=相对分子质量与化学计量数乘积之比
粒子个数比:
各物质的质量比:
如何读出化学方程式?
1.宏观读法:碳和氧气在点燃的条件下生成二氧化碳。
2.微观读法:每1个碳原子和1个氧分子反应生成1个二氧化碳分子。
3.质量读法:每12份质量的碳和32份质量的氧气反应生成44份质量的二氧化碳。
C
O2
点燃
CO2
+
学会正确表达化学方程式的意义!
1、读出下列化学反应的化学方程式
CO2+Ca(OH)2=CaCO3↓+H2O
1.宏观读法:
2.微观读法:
3.质量读法:
二氧化碳和氢氧化钙反应生成碳酸钙和水
每1个二氧化碳分子和1个氢氧化钙反应生成1个碳酸钙和1个水分子
每44份质量的二氧化碳和74份质量的氢氧化钙反应生成100份质量的碳酸钙和18份质量的水。
课中小练
2、书写和读出下列化学反应的化学方程式
二氧化碳+水→碳酸
CO2+H2O=H2CO3
CaCO3 CO2↑+CaO
高温
课中小练
小结
1. 化学方程式的意义
2. 化学方程式的读法
(1)表示反应物,生成物和反应条件
(2)表示反应过程中微粒的个数比
(3)表示反应过程中各微粒的质量比
(1)宏观读法
(2)微观读法
(3)质量读法
1.化学方程式可以反映( )
①质量守恒定律②反应物和生成物的质量比
③反应物和生成物的种类④反应物和生成物间分子的个数关系
A.①②③ B.①③④
C.①②④ D.①②③④
练一练
C
练一练
A
D
A
练一练
A
练一练
B
练一练
B
练一练
总结:
化学方程式
1、定义:
2、意义:
(1)表示反应物,生成物和反应条件
(2)表示反应过程中微粒的个数比
3、读法:
4、书写原则:
以客观事实为基础
遵守质量守恒定律
5、书写步骤:
写:左反右生中间一短线
配:配平
注:注明反应条件、生成物的状态 (↑↓)
等:短线改等号
查:检查化学方程式是否书写完整
用化学式表示化学反应的式子。
(3)表示反应过程中各微粒的质量比
