1.4根据化学方程式的简单计算--华师大版初中科学九上同步课件
文档属性
| 名称 | 1.4根据化学方程式的简单计算--华师大版初中科学九上同步课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 632.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-12-25 09:49:39 | ||
图片预览






文档简介
(共22张PPT)
根据化学方程式的简单计算
第一章 化学反应
预热
1、根据相对原子质量求式量:
H2O
H2SO4
Ca(OH)2
NaOH
KClO3
H-1,O-16,Na-23,S-32,Cl-35.5,K-39,Ca-40
1×2+16×1=18
1×2+32×1+16×4= 98
40×1+(16×1+1×1)×2=74
23×1+16×1+1×1=40
39×1+35.5×1+16×3=122.5
式量的求法:
化学式中各原子相对原子质量与原子个数乘积的总和。
预热
2、说出下列化学方程式的意义:
2H2O 2H2↑+O2↑
通直流电
(1)水通直流电反应生成氢气和氧气
(2)2个水分子通直流电反应生成2个氢分子和1个氧分子
(3)36份质量的水通直流电反应生成4份质量的氢气和32份质量的氧气
反应物和生成物的微粒个数比为2:2:1
反应物和生成物的质量比分别为36:4:32
9:1:8
提问
举例:电解18吨水,理论上可分解获得多少质量的氢气?
2H2O 2H2↑+O2↑
通电
质量比
思路
2×18 2×2 32
:
:
化学方程式的质量意义中反应物和生成物之间存在确定的质量比,
则实际参加反应的反应物质量和生成物的质量也满足该比值关系。
9 : 1 : 8
若: 9g ( )g ( )g
若: ( ) g ( )g 16 g
1
8
18
2
知道化学反应中各物质的质量比,有什么实际应用?
1.可以根据反应前物质质量,知道能生成多少产物
2.可以根据反应产物质量,知道要准备多少反应物
3.可以根据一种反应物质量,知道需要配多少其他反应物
4.可以根据一种产物质量,知道会产生多少其他物质
提问
知道化学反应中各物质的质量比,有什么实际应用?
解题过程
电解18吨水,理论上可分解获得多少质量的氢气?
解:设生成氢气的质量为x。
36 4
18t x
36 4
18t x
=
解得x=2t
答:理论上可得到2t的氢气。
解题步骤:
①设未知数
②写方程式
③找质量比
④列比例式
⑤解未知数
⑥作答
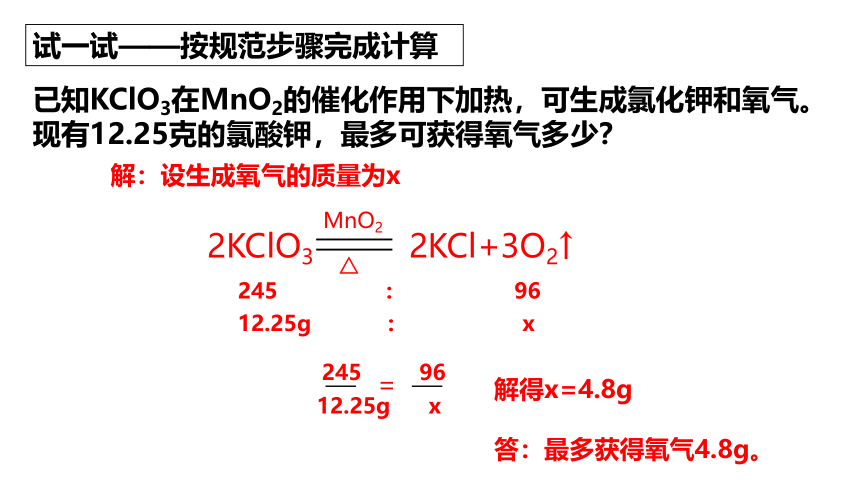
试一试——按规范步骤完成计算
已知KClO3在MnO2的催化作用下加热,可生成氯化钾和氧气。
现有12.25克的氯酸钾,最多可获得氧气多少?
2KClO3 2KCl+3O2↑
MnO2
△
245 : 96
12.25g : x
解:设生成氧气的质量为x
245 96
12.25g x
=
解得x=4.8g
答:最多获得氧气4.8g。
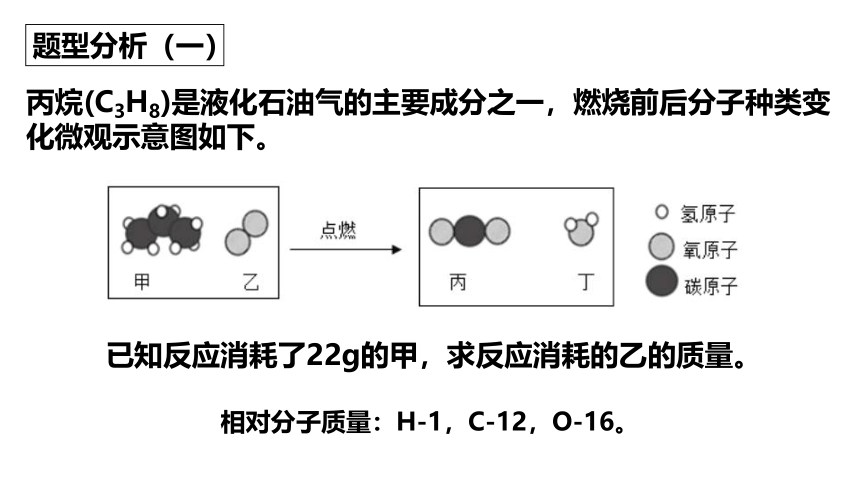
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化微观示意图如下。
题型分析(一)
已知反应消耗了22g的甲,求反应消耗的乙的质量。
相对分子质量:H-1,C-12,O-16。
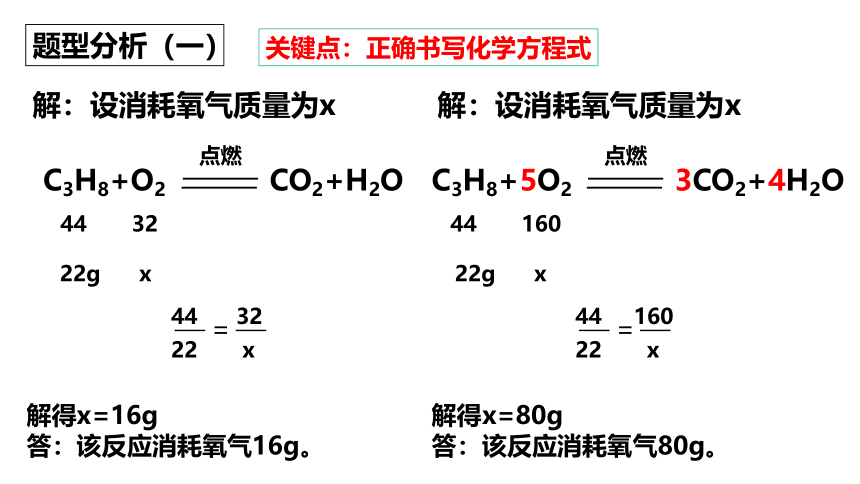
题型分析(一)
C3H8+O2
CO2+H2O
点燃
解:设消耗氧气质量为x
44 32
22g x
44 32
22 x
=
解得x=16g
答:该反应消耗氧气16g。
关键点:正确书写化学方程式
C3H8+5O2
3CO2+4H2O
点燃
解:设消耗氧气质量为x
44 160
22g x
44 160
22 x
=
解得x=80g
答:该反应消耗氧气80g。
题型分析(二)
若火箭升空时携带了100kg液氢,燃料舱中填充有1000kg液氧。待二者充分反应后,生成的水的质量是多少?
题型分析(二)
2H2+O2 2H2O
点燃
4 32 36
由分析可知,液氢全部消耗完而液氧有剩余,设最终生成水的质量为x
100kg x
... ...
解得x=900kg
关键点:判断清楚完全反应的对象
方法一:根据质量比进行求解
题型分析(二)
由分析可知,液氢全部消耗完而液氧有剩余,而生成的水中所含氢元素全部来自于液氢,设水的质量为x,有
关键点:判断清楚完全反应的对象
方法二:根据元素质量守恒
题型分析(三)
高温分解质量分数为90%的碳酸钙固体100g,已知生成的二氧化碳全部来自于碳酸钙分解,求二氧化碳的质量?
CaCO3
CaO+CO2↑
高温
解:设二氧化碳质量为x
100 44
100×90% x
... ...
解得x=39.6g
关键点:取用纯净物的质量来计算
题型分析(四)
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。求反应消耗了多少过氧化氢?
没有可以直接利用的质量数据,怎么办?
2H2O2
2H2O+O2↑
MnO2
解:设消耗的过氧化氢质量为x
题型分析(四)
关键点:反应前后物质总质量不变
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。求反应消耗了多少过氧化氢?
2H2O2
2H2O+O2↑
MnO2
由题可知,实验中产生的氧气质量为20g+0.5g-19.7g=0.8g
34
x
差量法
32
0.8g
... ...
解得x=0.85g
解:设可生成五氧化二磷的质量为x
点燃
P + O2 P2O5
试一试:找出下列解答过程中的错误
15.5g红磷在氧气中充分燃烧,求生成五氧化二磷的质量
31 142
15.5 x
142×15.5
31
= 71
答:可生成五氧化二磷71克
31 142
15.5g x
=
x=
未配平
质量比错误
未标单位
计算过程
未标单位
计算结果错
误且无单位
化学方程式计算小结
【格式要求】
①步骤要完整,格式要规范
(设、写、标、列、答);
②得数要准确
(除不尽的默认保留1位小数)。
【三个关键】
①准确书写化学方程式,准确计算相对分子质量;
②代入量均指纯净物的质量(单位要代入计算过程);
③若涉及完全反应,分析清楚谁消耗完了,谁还有剩余。
【三个方法】
①根据质量比;
②元素质量守恒;
③反应前后物质总质量守恒(差量法);
1、 A+3B=C+2D反应中,8gA和9gB恰好完全反应生成7gC,同时生成 gD;若要得到30gD,则参加反应的B为 g。
A + 3B = C + 2D
根据质量守恒定律:
9g
8g
7g
?
17g
17g
解:设生成D的质量为x
X
X+7g=17g
X=10g
10
∴ 生成的D为10g
10g
30g
解:设生成B的质量为y
y
9g
y
10g
30g
y=27g
∴ 参加反应的B为27g
27
练习
2、已知在反应3A+2B=2C+D中,反应物A、B的质量比为3:4。
当反应生成C和D的质量共140g时,B消耗的质量为_____g。
80
3A + 2B 2C+D
140g
140g
根据质量守恒定律:
解:设A的质量为ma,B的质量为mb
ma
mb
3
4
ma+mb=140g
∴ ma=60g, mb=80g
答:B消耗的质量为80g
练习
3、写出碳在高温下还原氧化铜的化学方程式。并计算要得到256g铜,至少需要碳单质多少克?需要氧化铜多少克?
解:需要至少碳的质量是x、需要氧化铜的质量是y
C + 2CuO 2Cu+ CO
高温
12 160 128
x y 256g
12 160 128
x y 256g
解得:x= 24g, y=320g
答:至少需要碳单质24克,需要氧化铜320克
练习
4、10克含H2O234%的双氧水在二氧化锰的催化条件下
能产生多少克氧气?
解:设可以得到氧气的质量为x
2H2O2 2H2O + O2↑
MnO2
10g×34%
x
68
32
X=1.6g
答:得到氧气的质量为1.6克。
68 32
=
3.4g X
练习
称量次数 第一次 第二次 第三次 第四次 第五次
物品 坩埚 坩埚+试剂 坩埚+试剂 坩埚+试剂 坩埚+试剂
质量/g 19.13 21.61 20.98 20.72 20.72
A.坩埚质量为19.13g B.硫酸铜晶体的质量为2.48g
C.无水硫酸铜的质量为1.59g D.结晶水的质量为0.63g
5、为了测定硫酸铜晶体(CuSO4·xH2O)中的x值,将一定质量的这种硫酸铜晶体放入坩埚中,称量、加热、称量、再加热、再称量直至不含结晶水。
(化学反应为:CuSO4·xH2O CuSO4+xH2O)实验中得到如下数据:根据表中数据判断,下列结论不正确的是( )
最后两次质量不变,说明已经完全分解。mCuSO4·xH2O=21.61g-19.13g=2.48g; mCuSO4=20.72g-19.13g=1.59g;mH2O=2.48g-1.59g=0.89g。D错误。
D
练习
根据化学方程式的简单计算
第一章 化学反应
预热
1、根据相对原子质量求式量:
H2O
H2SO4
Ca(OH)2
NaOH
KClO3
H-1,O-16,Na-23,S-32,Cl-35.5,K-39,Ca-40
1×2+16×1=18
1×2+32×1+16×4= 98
40×1+(16×1+1×1)×2=74
23×1+16×1+1×1=40
39×1+35.5×1+16×3=122.5
式量的求法:
化学式中各原子相对原子质量与原子个数乘积的总和。
预热
2、说出下列化学方程式的意义:
2H2O 2H2↑+O2↑
通直流电
(1)水通直流电反应生成氢气和氧气
(2)2个水分子通直流电反应生成2个氢分子和1个氧分子
(3)36份质量的水通直流电反应生成4份质量的氢气和32份质量的氧气
反应物和生成物的微粒个数比为2:2:1
反应物和生成物的质量比分别为36:4:32
9:1:8
提问
举例:电解18吨水,理论上可分解获得多少质量的氢气?
2H2O 2H2↑+O2↑
通电
质量比
思路
2×18 2×2 32
:
:
化学方程式的质量意义中反应物和生成物之间存在确定的质量比,
则实际参加反应的反应物质量和生成物的质量也满足该比值关系。
9 : 1 : 8
若: 9g ( )g ( )g
若: ( ) g ( )g 16 g
1
8
18
2
知道化学反应中各物质的质量比,有什么实际应用?
1.可以根据反应前物质质量,知道能生成多少产物
2.可以根据反应产物质量,知道要准备多少反应物
3.可以根据一种反应物质量,知道需要配多少其他反应物
4.可以根据一种产物质量,知道会产生多少其他物质
提问
知道化学反应中各物质的质量比,有什么实际应用?
解题过程
电解18吨水,理论上可分解获得多少质量的氢气?
解:设生成氢气的质量为x。
36 4
18t x
36 4
18t x
=
解得x=2t
答:理论上可得到2t的氢气。
解题步骤:
①设未知数
②写方程式
③找质量比
④列比例式
⑤解未知数
⑥作答
试一试——按规范步骤完成计算
已知KClO3在MnO2的催化作用下加热,可生成氯化钾和氧气。
现有12.25克的氯酸钾,最多可获得氧气多少?
2KClO3 2KCl+3O2↑
MnO2
△
245 : 96
12.25g : x
解:设生成氧气的质量为x
245 96
12.25g x
=
解得x=4.8g
答:最多获得氧气4.8g。
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化微观示意图如下。
题型分析(一)
已知反应消耗了22g的甲,求反应消耗的乙的质量。
相对分子质量:H-1,C-12,O-16。
题型分析(一)
C3H8+O2
CO2+H2O
点燃
解:设消耗氧气质量为x
44 32
22g x
44 32
22 x
=
解得x=16g
答:该反应消耗氧气16g。
关键点:正确书写化学方程式
C3H8+5O2
3CO2+4H2O
点燃
解:设消耗氧气质量为x
44 160
22g x
44 160
22 x
=
解得x=80g
答:该反应消耗氧气80g。
题型分析(二)
若火箭升空时携带了100kg液氢,燃料舱中填充有1000kg液氧。待二者充分反应后,生成的水的质量是多少?
题型分析(二)
2H2+O2 2H2O
点燃
4 32 36
由分析可知,液氢全部消耗完而液氧有剩余,设最终生成水的质量为x
100kg x
... ...
解得x=900kg
关键点:判断清楚完全反应的对象
方法一:根据质量比进行求解
题型分析(二)
由分析可知,液氢全部消耗完而液氧有剩余,而生成的水中所含氢元素全部来自于液氢,设水的质量为x,有
关键点:判断清楚完全反应的对象
方法二:根据元素质量守恒
题型分析(三)
高温分解质量分数为90%的碳酸钙固体100g,已知生成的二氧化碳全部来自于碳酸钙分解,求二氧化碳的质量?
CaCO3
CaO+CO2↑
高温
解:设二氧化碳质量为x
100 44
100×90% x
... ...
解得x=39.6g
关键点:取用纯净物的质量来计算
题型分析(四)
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。求反应消耗了多少过氧化氢?
没有可以直接利用的质量数据,怎么办?
2H2O2
2H2O+O2↑
MnO2
解:设消耗的过氧化氢质量为x
题型分析(四)
关键点:反应前后物质总质量不变
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。求反应消耗了多少过氧化氢?
2H2O2
2H2O+O2↑
MnO2
由题可知,实验中产生的氧气质量为20g+0.5g-19.7g=0.8g
34
x
差量法
32
0.8g
... ...
解得x=0.85g
解:设可生成五氧化二磷的质量为x
点燃
P + O2 P2O5
试一试:找出下列解答过程中的错误
15.5g红磷在氧气中充分燃烧,求生成五氧化二磷的质量
31 142
15.5 x
142×15.5
31
= 71
答:可生成五氧化二磷71克
31 142
15.5g x
=
x=
未配平
质量比错误
未标单位
计算过程
未标单位
计算结果错
误且无单位
化学方程式计算小结
【格式要求】
①步骤要完整,格式要规范
(设、写、标、列、答);
②得数要准确
(除不尽的默认保留1位小数)。
【三个关键】
①准确书写化学方程式,准确计算相对分子质量;
②代入量均指纯净物的质量(单位要代入计算过程);
③若涉及完全反应,分析清楚谁消耗完了,谁还有剩余。
【三个方法】
①根据质量比;
②元素质量守恒;
③反应前后物质总质量守恒(差量法);
1、 A+3B=C+2D反应中,8gA和9gB恰好完全反应生成7gC,同时生成 gD;若要得到30gD,则参加反应的B为 g。
A + 3B = C + 2D
根据质量守恒定律:
9g
8g
7g
?
17g
17g
解:设生成D的质量为x
X
X+7g=17g
X=10g
10
∴ 生成的D为10g
10g
30g
解:设生成B的质量为y
y
9g
y
10g
30g
y=27g
∴ 参加反应的B为27g
27
练习
2、已知在反应3A+2B=2C+D中,反应物A、B的质量比为3:4。
当反应生成C和D的质量共140g时,B消耗的质量为_____g。
80
3A + 2B 2C+D
140g
140g
根据质量守恒定律:
解:设A的质量为ma,B的质量为mb
ma
mb
3
4
ma+mb=140g
∴ ma=60g, mb=80g
答:B消耗的质量为80g
练习
3、写出碳在高温下还原氧化铜的化学方程式。并计算要得到256g铜,至少需要碳单质多少克?需要氧化铜多少克?
解:需要至少碳的质量是x、需要氧化铜的质量是y
C + 2CuO 2Cu+ CO
高温
12 160 128
x y 256g
12 160 128
x y 256g
解得:x= 24g, y=320g
答:至少需要碳单质24克,需要氧化铜320克
练习
4、10克含H2O234%的双氧水在二氧化锰的催化条件下
能产生多少克氧气?
解:设可以得到氧气的质量为x
2H2O2 2H2O + O2↑
MnO2
10g×34%
x
68
32
X=1.6g
答:得到氧气的质量为1.6克。
68 32
=
3.4g X
练习
称量次数 第一次 第二次 第三次 第四次 第五次
物品 坩埚 坩埚+试剂 坩埚+试剂 坩埚+试剂 坩埚+试剂
质量/g 19.13 21.61 20.98 20.72 20.72
A.坩埚质量为19.13g B.硫酸铜晶体的质量为2.48g
C.无水硫酸铜的质量为1.59g D.结晶水的质量为0.63g
5、为了测定硫酸铜晶体(CuSO4·xH2O)中的x值,将一定质量的这种硫酸铜晶体放入坩埚中,称量、加热、称量、再加热、再称量直至不含结晶水。
(化学反应为:CuSO4·xH2O CuSO4+xH2O)实验中得到如下数据:根据表中数据判断,下列结论不正确的是( )
最后两次质量不变,说明已经完全分解。mCuSO4·xH2O=21.61g-19.13g=2.48g; mCuSO4=20.72g-19.13g=1.59g;mH2O=2.48g-1.59g=0.89g。D错误。
D
练习
