1.1 化学反应的热效应同步训练(含解析) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.1 化学反应的热效应同步训练(含解析) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 637.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-20 21:20:57 | ||
图片预览



文档简介
1.1 化学反应的热效应同步训练
一、单选题
1.能源是当今社会发展的三大支柱之一。有专家提出:如果对燃料燃烧产物如二氧化碳、水、氮气等能够实现利用太阳能让它们重新组合(如下图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为()
A.化学能 B.热能 C.生物能 D.电能
2.下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是( )
物质 CH4 C2H2 H2
燃烧热/kJ/mol 890.3 1299.6 285.8
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
3.下列关于燃烧热的说法中正确的是( )
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而改变
4.下列装置或过程能实现电能转化为化学能的是( )
A B C D
锌锰干电池 燃气燃烧 电池充电 火力发电
A.A B.B C.C D.D
5.2020年12月17日,嫦娥五号返回着陆成功,标志着我国探月计划取得突破进展。下列有关嫦娥五号的说法正确的是( )
A.使用的钛铝合金材料外壳,其硬度高于各成分金属
B.采用的锂离子电池和光电池均能将化学能转化为电能
C.取回的月壤中含有的玻璃质,是一种新的化合物
D.展示的国旗材料为聚酰胺,是一种无机非金属材料
6.下列过程中吸热的是( )
A.生石灰溶于水 B.乙醇燃烧
C.Ba(OH)2·8H2O与NH4Cl晶体混合 D.盐酸与氢氧化钠混合
7.如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ· mol-1,下列说法或热化学方程式正确的是( )
A.C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ· mol-1
B.拆开1mol金刚石和1mol O2中的化学键需要吸收395.4kJ的热量
C.金刚石的稳定性强于石墨
D.石墨的总键能比金刚石的总键能小1.9 kJ
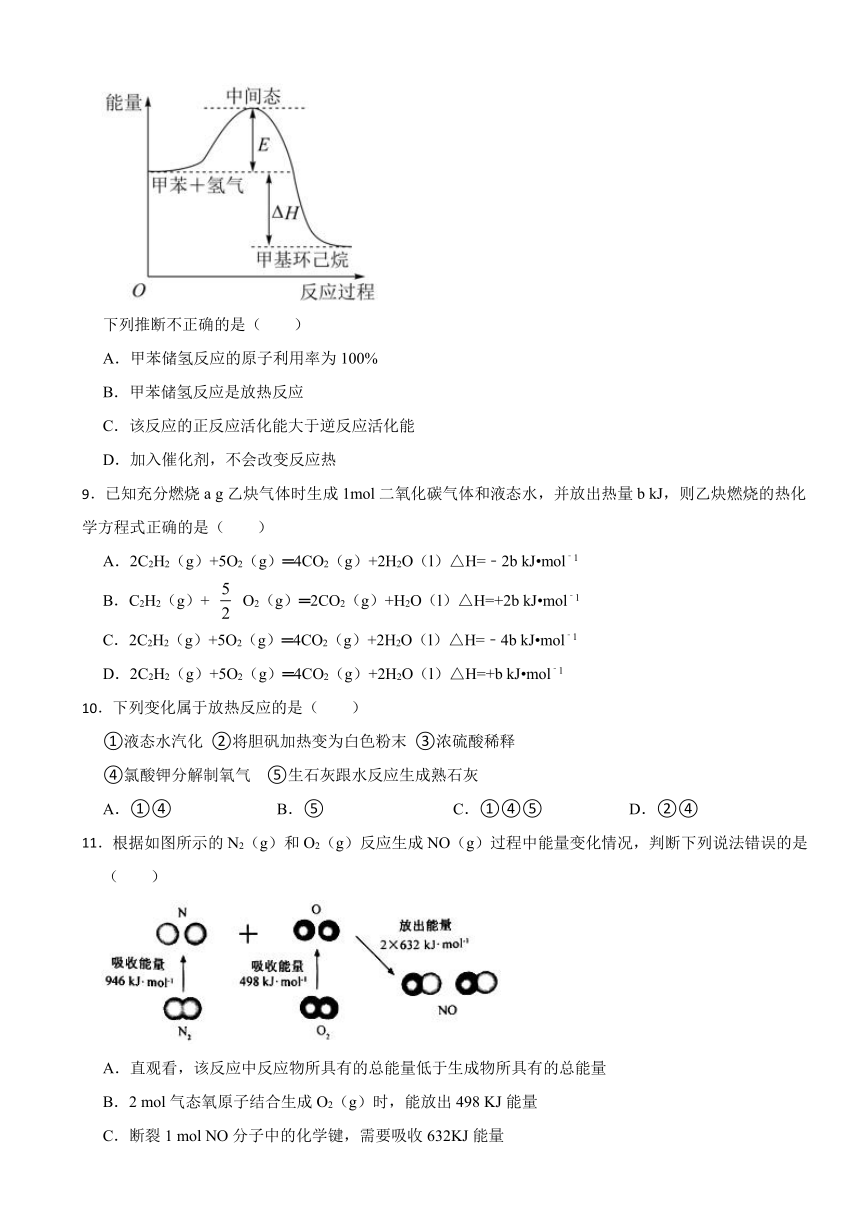
8.研究发现液态有机物是比较理想的储氢材料。甲苯储氢反应(+3H2→)的能量变化如图所示。
下列推断不正确的是( )
A.甲苯储氢反应的原子利用率为100%
B.甲苯储氢反应是放热反应
C.该反应的正反应活化能大于逆反应活化能
D.加入催化剂,不会改变反应热
9.已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ mol﹣1
B.C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=+2b kJ mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ mol﹣1
10.下列变化属于放热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.⑤ C.①④⑤ D.②④
11.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
( )
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632KJ能量
D.该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.
12.下列热化学方程式中,正确的是( )
A.乙烯的燃烧热为△H=akJ·mol-1,则乙烯燃烧热的热化学方程式可表示为:C2H4(g)+2O2(g)=2CO(g)+2H2O(g)△H=akJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ·mol-1
D.如图所示,N2O(g)和NO(g)反应生成N2(g)和NO2(g)的逆向活化能为348kJ·mol-1
13.已知N2(g)+3H2(g)=2NH3(g) ΔH=-92.3 kJ mol 1,则NH3(g) = N2(g)+ H2(g)的焓变为( )
A.+46.1 kJ/mol B.-46.1 kJ/mol
C.+ 92.3 kJ/mol D.-92.3 kJ/mol
14.下列有关说法正确的是( )
A.最好同时改变两个或多个变量来研究反应速率的变化规律
B.对于一个化学反应,它的焓变与其逆反应的焓变相同
C.可以根据重要化合物性质的递变规律,推出同周期元素性质的递变规律
D.HF、HCl、HBr、HI四种溶液中,酸性最强的是HF
15.若物质的量均为1 mol的A、B、C所具有的能量分别用Ea、Eb、Ec表示,则对于放热反应A=2B+C,下列关系错误的是( )
A.2Eb+Ec>Ea B.Ea>Ec C.Ea>Eb+Ec D.Ea>2Eb
16.下列说法中错误的是( )
A.在海底高压、低温下形成的晶体CH4·nH2O,俗称“可燃冰”,有可能成为人类未来的重要能源
B.向包有过氧化钠的脱脂棉吹气后脱脂棉燃烧,说明二氧化碳、水与过氧化钠反应是放热反应
C.有的物质即使充分燃烧,其产物也会污染环境污染
D.核电厂发电时,是将核燃料的化学能转变为电能
二、综合题
17.煤的气化和液化可实现煤的综合利用,提高煤的利用价值。煤的间接液化是指以煤为原料,先气化(主要以水作气化剂)制成合成气,然后再通过一系列作用将合成气转化成烃类燃料、醇类燃料和化学品的过程。
(1)Ⅰ.煤的气化
煤与水蒸气发生反应生成水煤气的反应为:C(s)+H2O(g) CO(g)+H2(g)。
一定温度下,在一个恒容的密闭容器中,加入足量的炭粉(体积忽略不计)与10 mol的水蒸气发生上述反应,下列叙述能说明该反应一定达到化学平衡状态的是______(填字母序号)。
A.v(H2O)=v(H2)时
B.容器内气体的密度不再随时间改变而变化
C.形成1 mol H-O键的同时,形成1 mol H-H键
D.容器内气体的平均摩尔质量不再随时间改变而变化
(2)Ⅱ.合成气的液化
将产生的CO与H2的混合气体,通过反应CO(g)+H2(g)→X(未配平,该反应为放热反应)合成X,是煤的液化的常用方法。
图中能够正确表示上述反应的能量变化的图像是 (填“A”或“B”)。
(3)将等物质的量的CO和H2分别充入一个2 L的密闭容器内,在一定条件下发生上述反应,反应过程中各物质的转化关如图。
①该反应的方程式为 (注:X要用具体的分子式或结构简式表示)。
②该反应前5 min内用H2表示的平均反应速率v(H2)= mol/(L·min)。
18.已知:Na2CO3 10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.4KJ mol﹣1
Na2CO3 10H2O(s)=Na2CO3 2H2O(s)+8H2O(g)△H2=+373.6KJ mol﹣1
H2O(g)═H2O(1)△H3=﹣44KJ mol﹣1
(1)写出Na2CO3 2H2O脱水分解后生成碳酸钠固体和液态水的热化学方程式 .
(2)已知1g乙醇(C2H5OH)完全燃烧生成CO2气体和液态水时,放出29.7KJ的热量,写出乙醇燃烧热的热化学方程式为 .
19.向某密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
(1)若t1=15
s,则t0~t1阶段的反应速率为v(C)= 。
(2)t4时刻改变的条件为 ,B的起始物质的量为 。
(3)t5时刻改变的条件为 。
(4)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式 。
20.根据有关知识回答下列问题。
(1)(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式 。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式 。
(3)(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。
A是石墨棒,B是一种金属,该金属是 (填名称)。
(4)B应接电源的 极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式 。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式 ,当放出标况下112mL氢气时,该溶液的pH= (室温下)。
(7)(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。
若X为铜,为减缓铁的腐蚀,开关K应置于 处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为 。
21.甲烷在化工领域中应用广泛,是一种重要能源。
(1)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分 步进行,其中,第 步的正反应活化能最大。
(2)用甲烷催化还原氮氧化物可以消除氮氧化物污染,发生的主反应如下:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0 kJ·mol 1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH1=-1160.0 kJ·mol 1
③CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH3
则:ΔH3= kJ·mol 1
(3)如图所示,装置甲为甲烷-空气燃料电池(电解质溶液为KOH溶液),通过装置乙实现铁棒上镀铜。
①电镀结束后,装置甲溶液中的阴离子除了OH-以外还含有 (忽略水解),装置乙中Cu电极的质量将 (填“变大”“变小”或“不变” )。
②在此过程中每消耗2.24L(标准状况下)甲烷,理论上装置乙中阴极质量变化 g。
(4)模拟工业上离子交换膜法制烧碱的方法,可以用甲烷-空气燃料电池作为电源,用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阴极反应式为 。此时通过阳离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阴离子交换膜的离子数。
②制得的硫酸溶液从出口 (填“A”“B”“C”或“D”)导出。
答案解析部分
1.【答案】B
【解析】【解答】根据图示是利用太阳能把燃烧产物转化为燃料CH4、CH3OH、NH3等,所以太阳能最终转化为热能。
故答案为;B
【分析】燃料最终转化为热能释放出来。
2.【答案】A
【解析】【解答】根据键能与反应热的关系,结合热化学方程式2CH4(g)=C2H2(g) +3H2(g) △H=+376.4 kJ/mol可得8×413.4-2×413.4-C≡C-3×436.0=376.4,解得C≡C的键能为796.0,选项A正确。由于C原子半径比H大,所以C—H键键长大于H—H键,B项错误; H2燃烧热285.8 kJ/mol是指1mol H2完全燃烧产生稳定的化合物时放出的热量,H2O的稳定状态为液态,正确的应该为2H2(g) +O2(g)= 2H2O(l) △H=﹣571.6 kJ/mol,C项错误;假设反应2CH4(g)= C2H2(g) +3H2(g) 的反应热为△H,则根据盖斯定律可得-2×890.3=△H-1299.6-3×285.8。解得△H=+376.4 kJ/mo。所以2CH4(g)=C2H2(g) +3H2(g) △H=+376.4 kJ/mol,D项错误。
故答案为:A
【分析】注意原子半径越小,键长越短,键能越大,物质越稳定。
3.【答案】C
【解析】【解答】紧扣燃烧热的定义可得正确答案为C。
故答案为:C
【分析】强酸与强碱的稀溶液反应生成可溶性盐和1mol水时放出的热量,通过实验测定为57.3KJ。而燃烧热是1mol可燃物完全燃烧生成稳定的化合物时放出的热量。
4.【答案】C
【解析】【解答】A.锌锰干电池是将化学能转化为电能,A不符合题意;
B.燃气燃烧是将化学能转化为热能,B不符合题意;
C.电池充电是将电能转化为化学能,C符合题意;
D. 火力发电是将机械能转化为电能,D不符合题意;
故答案为:C。
【分析】A.原电池是将化学能转化为电能;
B.燃烧是将化学能转化为热能;
C.电解将电能转化为化学能;
D. 火力发电是热能转化为机械能、机械能再转化为电能。
5.【答案】A
【解析】【解答】A.合金的硬度高于成分金属,钛铝合金的硬度高于各成分金属,故A符合题意;
B.锂离子电池能将化学能转化为电能,光电池将光能转化为电能,故B不符合题意;
C.玻璃中含有硅酸钠、硅酸钙、二氧化硅等,玻璃是混合物,故C不符合题意;
D.聚酰胺是有机合成材料,故D不符合题意;
故答案为:A。
【分析】B.锂离子电池将化学能转化为电能,光电池将光能转化为电能;
C.玻璃是混合物;
D.聚酰胺属于有机高分子材料。
6.【答案】C
【解析】【解答】解:A. 生石灰溶于水生成氢氧化钙,属于放热反应,A不符合题意;
B. 乙醇燃烧一定是放热反应,B不符合题意;
C. Ba(OH)2·8H2O与NH4Cl晶体混合属于吸热反应,C符合题意;
D. 盐酸与氢氧化钠混合发生中和反应,一定是放热反应,D不符合题意;
故答案为:C
【分析】A.生石灰与水反应放热;
B.燃烧反应都是放热反应;
C.Ba(OH)2·8H2O与NH4Cl的反应为吸热反应;
D.中和反应为放热反应;
7.【答案】A
【解析】【解答】A.由图得:①C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H=-395.4kJ mol-1,根据盖斯定律,将①-②可得:C(s,石墨)=C(s,金刚石) △H=+1.9kJ mol-1,故A符合题意;
B.由图得:C(s,金刚石)+O2(g)=CO2(g) △H=-395.4kJ mol-1,则拆开1mol金刚石和1mol O2中的化学键需要吸收的能量比形成2molC=O键放出的能量少395.4kJ,故B不符合题意;
C.根据图示,金刚石能量大于石墨的总能量,物质的能量越大,越不稳定,则石墨比金刚石稳定,故C不符合题意;
D.依据热化学方程式 C(s,石墨)=C(s,金刚石) △H=+1.9kJ mol-1,所以1mol石墨本身具有的总能量比1mol金刚石本身具有的总能量小1.9 kJ,故D不符合题意;
故答案为:A。
【分析】先根据图示写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,最后结合物质的能量越低越稳定以及△H=生成物的总能量-反应物的总能量分析解答。
8.【答案】C
【解析】【解答】A.甲苯储氢反应( +3H2→ ),该反应属于加成反应,反应物全部转化为生成物,原子利用率为100%,故A不符合题意;
B.根据能量变化图可知,反应物总能量大于生成物总能量,该反应为放热反应,故B不符合题意;
C.根据能量变化图可知,该反应的正反应活化能为E,从中间态到甲基环己烷为逆反应活化能,正反应活化能小于逆反应活化能,故C符合题意;
D.加入催化剂,可以改变正逆反应活化能,但不能改变反应的始态和终态,即不会改变反应热,故D不符合题意;
故答案为:C。
【分析】A.甲苯储氢反应为加成反应,加成反应的原子利用率为100%;
B.反应物的总能量高于生成物的总能量,反应放热;
C.因为反应物的总能量高于生成物的总能量,所以正反应的活化能低于逆反应的活化能;
D.催化剂降低了反应的活化能,始末状态不变,反应热不变。
9.【答案】C
【解析】【解答】解:充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和液态水,并放出热量2bkJ,或生成4mol二氧化碳气体和液态水,并放出热量4bkJ,则乙炔燃烧的热化学方程式为C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=﹣2b kJ/mol
或2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=﹣4bkJ/mol;
故选C.
【分析】由物质的物质的量与反应放出的热量成正比可知以及热化学方程式的书写方法写出热化学方程式.
10.【答案】B
【解析】【解答】①液态水汽化属于物理变化,故①不符合题意;
②将胆矾加热变为白色粉末为分解反应,属于吸热反应,故②不符合题意;
③浓硫酸稀释属于物理变化,故③不符合题意;
④氯酸钾分解制氧气为分解反应,属于吸热反应,故④不符合题意;
⑤生石灰跟水反应生成熟石灰为化合反应,属于放热反应,故⑤符合题意;
故答案为B。
【分析】放热反应主要是酸和金属、酸碱中和、大部分化合反应
11.【答案】D
【解析】【解答】解:A.焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol﹣2×632kJ/mol=+180kJ/mol,反应是吸热反应,反应中反应物所具有的总能量低于生成物所具有的总能量,故A正确;
B.1mol O2(g)吸收498kJ能量形成2mol O原子,原子结合形成分子的过程是化学键形成过程,是放热过程,2mol O原子结合生成1mol O2(g)时需要放出498kJ能量,故B正确;
C.形成2molNO放热2×632KJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量,故C正确;
D.焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol﹣2×632kJ/mol=+180kJ/mol,热化学方程式无论反应物还是生成物必须标明聚集状态,焓变的数值和方程式的系数相对应,注明焓变的单位是kJ/mol,所以该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180KJ/mol,故D错误;
故选D.
【分析】A.依据焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,计算分析,反应中反应物所具有的总能量高于生成物所具有的总能量是放热反应,反之是吸热反应;
B.原子结合形成分子的过程是化学键形成过程,是放热过程;
C.依据图示可知形成2molNO放热2×632KJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量;
D.反应焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,并需注明物质的聚集状态.
12.【答案】D
【解析】【解答】A.乙烯的燃烧热为△H=akJ·mol-1,燃烧热表示可燃物完全燃烧生成稳定的氧化物,产物水为液体水,则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=akJ·mol-1,A项不符合题意;
B.将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,合成氨为可逆反应,0.5molN2不能完全反应生成,则1molN2(g)充分反应生成NH3(g)放热大于38.6kJ,放热反应的焓变为负值,则N2(g)+3H2(g) 2NH3(g)△H< 38.6kJ mol 1,B项不符合题意;
C.中和反应为放热反应,焓变为负值,生成硫酸钙放热,由HCl和NaOH反应的中和热△H= 57.3kJ mol 1可知,H2SO4和Ca(OH)2反应的△H<2×( 57.3)kJ mol 1,C项不符合题意;
D.由图可知,N2O(g)和NO(g)反应生成N2(g)和NO2(g)的逆向活化能为348kJ·mol-1,D项符合题意;
故答案为:D。
【分析】A、燃烧热的热化学方程式中,水的状态为液态;
B、合成氨气的反应为可逆反应,反应无法进行到底;
C、中和热以生产1mol H2O所放出的热量进行计算;
D、逆向活化能即看生成的键能。
13.【答案】A
【解析】【解答】正反应是放热反应,则逆反应是吸热反应,吸热和放热的数字相同,N2(g)+3H2(g)=2NH3(g) ΔH=-92.3 kJ mol 1,则2NH3(g) = N2(g)+3H2(g) ΔH=+92.3 kJ mol 1,由于焓变与计量系数有关,所以NH3(g) = N2(g)+ H2(g)的焓变为+46.1 kJ mol 1,故A符合题意。
故答案为A。
【分析】考查的是可逆反应的逆反应焓变问题,正逆反应热量数值相等,符号相反
14.【答案】C
【解析】【解答】A.要采用控制变量法研究反应速率的影响因素,必须只有一个变量,不能同时改变两个变量,A不符合题意;
B.可逆反应中,正反应和逆反应的焓变数值相同,但符号相反,B不符合题意;
C.根据重要化合物性质的递变规律,可推出同周期元素性质的递变规律,如:同一周期元素从左向右,简单氢化物的稳定性逐渐增强,元素非金属性逐渐增强,C符合题意;
D.元素的非金属性:F>Cl>Br>I,元素的非金属性越强,其与H形成的化学键就越强,越不容易断裂,电离产生H+的能力就越弱,所以相应的HF、HCl、HBr、HI四种溶液的酸性逐渐增强,则酸性最强的是HI,D不符合题意;
故答案为:C。
【分析】A.研究速率的影响因素时,需要进行控制变量法,控制一个条件改变,其他条件不变的方法。
B.焓变有正负号
C.主要是对元素周期律的运用
D.氢氟酸是弱酸,酸性最弱
15.【答案】A
【解析】【解答】A.反应A=2B+C是放热反应,则Ea-(2Eb+Ec)>0,所以2Eb+Ec<Ea,A符合题意;
B.反应A=2B+C是放热反应,则Ea>2Eb+Ec,所以Ea>Ec,B不符合题意;
C.反应A=2B+C是放热反应,则Ea>2Eb+Ec,因此Ea>Eb+Ec,C不符合题意;
D.反应A=2B+C是放热反应,则Ea>2Eb+Ec,因此Ea>2Eb,D不符合题意;
故答案为:A。
【分析】根据放热反应中反应物具有的总能量大于生成物具有的总能量;反应热等于断裂反应物化学键吸收的总能量与形成生成物化学键释放的总能量的差。
16.【答案】D
【解析】【解答】解:A.在海底形成的晶体CH4·nH2O,俗称“可燃冰”,有可能成为人类未来的重要能源,A不符合题意;
B.由题目给出的信息可知,脱脂棉燃烧起来,说明达到了着火点,因此为放热反应,B不符合题意;
C.有的物质即使充分燃烧其产物也会环境污染,如含硫或氮的物质,C不符合题意;
D.核电厂发电时将核能转化为电能,D符合题意。
故答案为:D
【分析】A、天然气水合物,有机化合物,即可燃冰,是分布于深海沉积物或陆域的永久冻土中,由天然气与水在高压低温条件下形成的类冰状的结晶物质;
B、反应放热,达到了脱脂棉的着火点,使其燃烧;
C、S和N的化合物即使充分燃烧,其产物也会对环境造成危害,形成酸雨等;
D、了解核电的发电原理;
17.【答案】(1)B;D
(2)A
(3)CO(g)+2H2(g) CH3OH(l);0.4
【解析】【解答】(1) A.未指明反应速率是正反应速率还是逆反应速率,无法判断正反应速率是否等于逆反应速率,因此不能确定是否为平衡状态,A不正确;
B.反应物C是固体,反应发生使气体的质量增加,容器的容积不变,若容器内气体的密度不再随时间改变而变化,说明反应达到了平衡状态,B正确;
C.形成2 mol H-O键的同时会断裂1 mol H-H键,形成1 mol H-O键的同时会消耗0.5 mol H-H键,而同时又形成1 mol H-H键,说明正反应速率不等于逆反应速率,反应未达到平衡,C不正确;
D.若容器内气体的平均摩尔质量不再随时间改变而变化,说明气体的质量不变,气体的物质的量不变,反应达到平衡状态,D正确;
故答案为:BD;
(2)由于CO与H2反应生成X的反应是放热反应,说明反应物CO与H2的能量比生成物X的能量高,则能够表示该反应的能量变化的图示是A;
(3)①在5 min内CO变化的物质的量是2 mol,H2变化的物质的量是4 mol,X变化的物质的量为2 mol,△n(CO):△n(H2):△n(X)=1:2:1,由于物质反应的物质的量的比等于方程式中相应物质的化学计量数的比,根据质量守恒定律,可知X分子式是CH3OH或CH4O,5 min后各种物质都存在,且它们的物质的量不变,说明反应为可逆反应,故该反应方程式为:CO(g)+2H2(g) CH3OH(l);
②该反应前5 min内用H2表示的平均反应速率v(H2)= =0.4 mol/(L·min)。
【分析】(1)判断平衡可以从速率是否相等,浓度是否发生改变,质量分数是否发生改变、以及气体的质量是否改变考虑
(2)放热反应,反应物的能量高于生成物的能量
(3)根据物质的变化量之比等于化学计量系数之比即可写出方程式,利用公式v= 进行计算即可
18.【答案】(1)Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol
(2)C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.2kJ mol﹣1
【解析】【解答】解:(1)①Na2CO3 10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ mol﹣1②Na2CO3 10H2O(s)═Na2CO3 H2O(s)+9H2O(g)△H2=+373.6kJ mol﹣1③H2O(g)=H2O(l)△H3=﹣44kJ mol﹣1由盖斯定律①﹣②+③得到:Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol,故答案为:Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol;(2)燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为46×29.7kJ=1366.2kJ,其燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.2kJ mol﹣1,故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.2kJ mol﹣1.
【分析】(1)①Na2CO3 10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ mol﹣1②Na2CO3 10H2O(s)═Na2CO3 H2O(s)+9H2O(g)△H2=+373.6kJ mol﹣1③H2O(g)=H2O(l)△H3=﹣44kJ mol﹣1由盖斯定律①﹣②+③得到:Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l),据此进行分析;(2)表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式.
19.【答案】(1)0.02 mol·L-1·s-1
(2)减小压强;2 mol
(3)升高温度
(4)2A(g)+B(g) 3C(g) ΔH=+2.5Q kJ·mol-1
【解析】【解答】(1)若t1=15s,生成物C在t0~t1时间段的平均反应速率为:v= = =0.02mol L-1 s-1,故答案为:0.02mol L-1 s-1;(2)t4~t5阶段改变条件后,正逆反应速率都减小且相等,所以不可能是降低温度,应该为减小压强;反应中A的浓度变化为:1mol/L-0.8mol/L=0.2mol/L,C的浓度变化为:0.6mol/L-0.3mol/L=0.3mol/L,反应中A与C的化学计量数之比为0.2:0.3=2:3,根据t4~t5阶段改变压强平衡不移动可知,该反应的方程式为2A(g)+B(g) 3C(g);由方程式可知反应过程中消耗的B的物质的量浓度为:(1mol/L-0.8mol/L)× =0.1mol/L,所以B的起始浓度为0.4mol/L+0.1mol/L=0.5mol/L,向某密闭容器中加入4mol A、1.2mol C和一定量的B三种气体,A的起始浓度为1.0mol/L,体积= =4L,物质的量=0.5mol/L×4L=2mol,
故答案为:减小压强; 2mol;(3)该反应是体积不变的反应,而t5~t6阶段正逆反应速率都增大,说明是升高了温度;升高温度后正反应速率大于逆反应速率,说明该反应为吸热反应,逆反应为放热反应,
故答案为:升高温度;(4)依据(2)的计算得到A的物质的量共变化物质的量=(1mol/L-0.8mol/L)×4L=0.8mol/L,而此过程中容器与外界的热交换总量为QkJ,所以2molA反应热量变化为2.5QkJ,所以反应的热化学方程式为:2A(g)+B(g) 3C(g)△H=+2.5QkJ/mol,故答案为:2A(g)+B(g) 3C(g)△H=+2.5QkJ/mol。
【分析】(1)根据v=计算t0~t1阶段以C物质的浓度变化表示的反应速率;
(2)t4~t5阶段正逆反应速率减小且相等,如是降低温度,平衡移动发生移动,则正逆反应速率不相等,所以是减小了压强;根据A、C浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式,然后根据化学方程式计算;
(3)根据t5~t6阶段正逆反应速率变化可知,t5时升高了温度.
(4)根据反应中A和C的浓度变化量之比,得到反应中A与C的化学计量数之比,再根据t4~t5阶段改变压强平衡不移动可知化学反应方程式,再求得容器与外界的热交换总量为QkJ,进而解答该题。
20.【答案】(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-27kJ/mol
(2)O2 + 4H+ + 4e-= 2H2O
(3)铜
(4)通入O2
(5)2H++2e-=H2↑
(6)2Cl-+2H2O 2OH-+H2↑+Cl2↑;13
(7)N 处
(8)牺牲阳极的阴极保护法
【解析】【解答】(1)已知:a、Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ mol-1,B、C(石墨)+CO2(g)=2CO(g)△H2=+172kJ mol-1,依据盖斯定律a-b×3得到:Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g)△H=489-172×3=-27kJ/mol,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-27kJ/mol;
(2)CO-O2燃料电池(以H2SO4溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳,原电池负极电极反应为:CO+H2O-2e-=CO2+2H+,正极电极反应为氧气得到电子发生还原反应,在酸性溶液中的电极反应为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
(3)要实现铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4,只能利用电解原理,A是石墨棒,B是一种金属,只能是铜,故答案为:铜;
(4)根据反应方程式,铜被氧化,因此B应接电源的正极,即通入O2的一极,故答案为:通入O2;
(5)该装置,溶液中的氢离子在阴极发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(6)用石墨作电极电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成,电池反应式为2Cl-+2H2O H2↑+Cl2↑+2OH-;设生成氢氧根离子的物质的量为x,
2Cl-+2H2O H2↑+Cl2↑+ 2OH-
22.4L 2mol
0.112L x
22.4L:2mol=0.112L:x,解得:x= =0.01mol,c(OH-)= =0.1mol/L,则溶液的pH=13,故答案为:2Cl-+2H2O 2OH-+H2↑+Cl2↑,13;
(7)若X为铜,为减缓铁的腐蚀,铁比铜活泼,所以要采用外加电流的阴极保护法,所以为延缓铁腐蚀,K应置于N处,故答案为:N处;
(8)若X为锌,开关K置于M处,该方法为牺牲阳极的阴极保护法,故答案为:牺牲阳极的阴极保护法。
【分析】(1)由盖斯定律计算反应热,从而得出反应的热化学方程式;
(2)该燃料电池中,O2在正极发生得电子的还原反应;
(3)由电池总反应,确定该金属为Cu;
(4)在该电解池中,Cu做阳极,与电源的正极相连;
(5)在该电解池中,H+在阴极发生得电子的还原反应;
(6)电解饱和食盐水的总反应为: 2Cl-+2H2O 2OH-+H2↑+Cl2↑ ;根据公式计算产生H2的物质的脸,进而求出产生n(OH-),根据公式c(H+)×c(OH-)=Kw,求溶液中c(H+),进而求出溶液的pH;
(7)缓解铜的腐蚀,铜应作为原电池的正极,或电解池的阴极;
开关置于M处时,为原电池,铁做正极,锌做负极,为牺牲阳极的阴极保护法;
21.【答案】(1)4;4
(2)-867
(3)CO;变小;25.6
(4)2H2O+2e =H2↑+2OH ;大于;A
【解析】【解答】(1)由图可知,反应过程中能量变化出现了4个峰,即吸收了4次活化能,经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,即正反应方向第4步吸收的能量最多,对应的正反应活化能最大;
(2)由热化学方程式可知,③式可由由×(①+②)得到,根据盖斯定律,ΔH3=×(-1160-574)=-867kJ/mol;
(3)①a是燃料电池的负极,负极发生氧化反应, a极的电极反应是CH4-8e - + 10OH- = CO+ 7H2O,因此溶液中存在CO;乙装置中Cu电极为阳极,阳极反应Cu-2e-=Cu2+,故Cu电极质量变小;
②CH4的物质的量为=0.1mol,转移电子的物质的量为0.8mol,乙装置中阴极反应为Cu2++2e-=Cu,生成Cu的物质的量为0.4mol,质量为0.4mol×64g/mol=25.6g;
(4)①若用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,阴极是水得到电子生成OH-和H2,2H2O+2e =H2↑+2OH ;阳极是水失去电子生成H+、O2,2H2O-4e =O2↑+4H+,K+穿过阳离子交换膜进入阴极区形成KOH,穿过阴离子交换膜进入阳极区形成H2SO4,根据电荷守恒,K+的穿过的数目应是的2倍,即阳离子数目大于阴离子数目;
②H2SO4在阳极区形成,B出的是气体,即O2,H2SO4从A口出。
【分析】(1)有多少组峰则有多少步反应,活化能越大则上升的峰值越高;
(2)盖斯定律的应用要注意,判断列出的热化学方程式的对应关系,左右两边相同的物质互相抵消则相加,在同一边相同的物质互相抵消则相减;
(3) ① 甲烷燃料电池在碱性条件下不会生成二氧化碳而是生成碳酸根;
② 结合公式n=V/Vm和化学计量数之比等于物质的量之比判断;
(4) ① 阴极为氢离子放电,其电极反应式为水得到电子生成氢气和氢氧根离子;
② 硫酸根离子为阴离子,移向阳极,同时氢氧根离子在阳极放电,氢离子浓度增加,形成硫酸。
一、单选题
1.能源是当今社会发展的三大支柱之一。有专家提出:如果对燃料燃烧产物如二氧化碳、水、氮气等能够实现利用太阳能让它们重新组合(如下图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为()
A.化学能 B.热能 C.生物能 D.电能
2.下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是( )
物质 CH4 C2H2 H2
燃烧热/kJ/mol 890.3 1299.6 285.8
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
3.下列关于燃烧热的说法中正确的是( )
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而改变
4.下列装置或过程能实现电能转化为化学能的是( )
A B C D
锌锰干电池 燃气燃烧 电池充电 火力发电
A.A B.B C.C D.D
5.2020年12月17日,嫦娥五号返回着陆成功,标志着我国探月计划取得突破进展。下列有关嫦娥五号的说法正确的是( )
A.使用的钛铝合金材料外壳,其硬度高于各成分金属
B.采用的锂离子电池和光电池均能将化学能转化为电能
C.取回的月壤中含有的玻璃质,是一种新的化合物
D.展示的国旗材料为聚酰胺,是一种无机非金属材料
6.下列过程中吸热的是( )
A.生石灰溶于水 B.乙醇燃烧
C.Ba(OH)2·8H2O与NH4Cl晶体混合 D.盐酸与氢氧化钠混合
7.如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ· mol-1,下列说法或热化学方程式正确的是( )
A.C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ· mol-1
B.拆开1mol金刚石和1mol O2中的化学键需要吸收395.4kJ的热量
C.金刚石的稳定性强于石墨
D.石墨的总键能比金刚石的总键能小1.9 kJ
8.研究发现液态有机物是比较理想的储氢材料。甲苯储氢反应(+3H2→)的能量变化如图所示。
下列推断不正确的是( )
A.甲苯储氢反应的原子利用率为100%
B.甲苯储氢反应是放热反应
C.该反应的正反应活化能大于逆反应活化能
D.加入催化剂,不会改变反应热
9.已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ mol﹣1
B.C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=+2b kJ mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ mol﹣1
10.下列变化属于放热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.⑤ C.①④⑤ D.②④
11.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
( )
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632KJ能量
D.该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.
12.下列热化学方程式中,正确的是( )
A.乙烯的燃烧热为△H=akJ·mol-1,则乙烯燃烧热的热化学方程式可表示为:C2H4(g)+2O2(g)=2CO(g)+2H2O(g)△H=akJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ·mol-1
D.如图所示,N2O(g)和NO(g)反应生成N2(g)和NO2(g)的逆向活化能为348kJ·mol-1
13.已知N2(g)+3H2(g)=2NH3(g) ΔH=-92.3 kJ mol 1,则NH3(g) = N2(g)+ H2(g)的焓变为( )
A.+46.1 kJ/mol B.-46.1 kJ/mol
C.+ 92.3 kJ/mol D.-92.3 kJ/mol
14.下列有关说法正确的是( )
A.最好同时改变两个或多个变量来研究反应速率的变化规律
B.对于一个化学反应,它的焓变与其逆反应的焓变相同
C.可以根据重要化合物性质的递变规律,推出同周期元素性质的递变规律
D.HF、HCl、HBr、HI四种溶液中,酸性最强的是HF
15.若物质的量均为1 mol的A、B、C所具有的能量分别用Ea、Eb、Ec表示,则对于放热反应A=2B+C,下列关系错误的是( )
A.2Eb+Ec>Ea B.Ea>Ec C.Ea>Eb+Ec D.Ea>2Eb
16.下列说法中错误的是( )
A.在海底高压、低温下形成的晶体CH4·nH2O,俗称“可燃冰”,有可能成为人类未来的重要能源
B.向包有过氧化钠的脱脂棉吹气后脱脂棉燃烧,说明二氧化碳、水与过氧化钠反应是放热反应
C.有的物质即使充分燃烧,其产物也会污染环境污染
D.核电厂发电时,是将核燃料的化学能转变为电能
二、综合题
17.煤的气化和液化可实现煤的综合利用,提高煤的利用价值。煤的间接液化是指以煤为原料,先气化(主要以水作气化剂)制成合成气,然后再通过一系列作用将合成气转化成烃类燃料、醇类燃料和化学品的过程。
(1)Ⅰ.煤的气化
煤与水蒸气发生反应生成水煤气的反应为:C(s)+H2O(g) CO(g)+H2(g)。
一定温度下,在一个恒容的密闭容器中,加入足量的炭粉(体积忽略不计)与10 mol的水蒸气发生上述反应,下列叙述能说明该反应一定达到化学平衡状态的是______(填字母序号)。
A.v(H2O)=v(H2)时
B.容器内气体的密度不再随时间改变而变化
C.形成1 mol H-O键的同时,形成1 mol H-H键
D.容器内气体的平均摩尔质量不再随时间改变而变化
(2)Ⅱ.合成气的液化
将产生的CO与H2的混合气体,通过反应CO(g)+H2(g)→X(未配平,该反应为放热反应)合成X,是煤的液化的常用方法。
图中能够正确表示上述反应的能量变化的图像是 (填“A”或“B”)。
(3)将等物质的量的CO和H2分别充入一个2 L的密闭容器内,在一定条件下发生上述反应,反应过程中各物质的转化关如图。
①该反应的方程式为 (注:X要用具体的分子式或结构简式表示)。
②该反应前5 min内用H2表示的平均反应速率v(H2)= mol/(L·min)。
18.已知:Na2CO3 10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.4KJ mol﹣1
Na2CO3 10H2O(s)=Na2CO3 2H2O(s)+8H2O(g)△H2=+373.6KJ mol﹣1
H2O(g)═H2O(1)△H3=﹣44KJ mol﹣1
(1)写出Na2CO3 2H2O脱水分解后生成碳酸钠固体和液态水的热化学方程式 .
(2)已知1g乙醇(C2H5OH)完全燃烧生成CO2气体和液态水时,放出29.7KJ的热量,写出乙醇燃烧热的热化学方程式为 .
19.向某密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
(1)若t1=15
s,则t0~t1阶段的反应速率为v(C)= 。
(2)t4时刻改变的条件为 ,B的起始物质的量为 。
(3)t5时刻改变的条件为 。
(4)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式 。
20.根据有关知识回答下列问题。
(1)(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式 。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式 。
(3)(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。
A是石墨棒,B是一种金属,该金属是 (填名称)。
(4)B应接电源的 极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式 。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式 ,当放出标况下112mL氢气时,该溶液的pH= (室温下)。
(7)(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。
若X为铜,为减缓铁的腐蚀,开关K应置于 处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为 。
21.甲烷在化工领域中应用广泛,是一种重要能源。
(1)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分 步进行,其中,第 步的正反应活化能最大。
(2)用甲烷催化还原氮氧化物可以消除氮氧化物污染,发生的主反应如下:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0 kJ·mol 1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH1=-1160.0 kJ·mol 1
③CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH3
则:ΔH3= kJ·mol 1
(3)如图所示,装置甲为甲烷-空气燃料电池(电解质溶液为KOH溶液),通过装置乙实现铁棒上镀铜。
①电镀结束后,装置甲溶液中的阴离子除了OH-以外还含有 (忽略水解),装置乙中Cu电极的质量将 (填“变大”“变小”或“不变” )。
②在此过程中每消耗2.24L(标准状况下)甲烷,理论上装置乙中阴极质量变化 g。
(4)模拟工业上离子交换膜法制烧碱的方法,可以用甲烷-空气燃料电池作为电源,用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阴极反应式为 。此时通过阳离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阴离子交换膜的离子数。
②制得的硫酸溶液从出口 (填“A”“B”“C”或“D”)导出。
答案解析部分
1.【答案】B
【解析】【解答】根据图示是利用太阳能把燃烧产物转化为燃料CH4、CH3OH、NH3等,所以太阳能最终转化为热能。
故答案为;B
【分析】燃料最终转化为热能释放出来。
2.【答案】A
【解析】【解答】根据键能与反应热的关系,结合热化学方程式2CH4(g)=C2H2(g) +3H2(g) △H=+376.4 kJ/mol可得8×413.4-2×413.4-C≡C-3×436.0=376.4,解得C≡C的键能为796.0,选项A正确。由于C原子半径比H大,所以C—H键键长大于H—H键,B项错误; H2燃烧热285.8 kJ/mol是指1mol H2完全燃烧产生稳定的化合物时放出的热量,H2O的稳定状态为液态,正确的应该为2H2(g) +O2(g)= 2H2O(l) △H=﹣571.6 kJ/mol,C项错误;假设反应2CH4(g)= C2H2(g) +3H2(g) 的反应热为△H,则根据盖斯定律可得-2×890.3=△H-1299.6-3×285.8。解得△H=+376.4 kJ/mo。所以2CH4(g)=C2H2(g) +3H2(g) △H=+376.4 kJ/mol,D项错误。
故答案为:A
【分析】注意原子半径越小,键长越短,键能越大,物质越稳定。
3.【答案】C
【解析】【解答】紧扣燃烧热的定义可得正确答案为C。
故答案为:C
【分析】强酸与强碱的稀溶液反应生成可溶性盐和1mol水时放出的热量,通过实验测定为57.3KJ。而燃烧热是1mol可燃物完全燃烧生成稳定的化合物时放出的热量。
4.【答案】C
【解析】【解答】A.锌锰干电池是将化学能转化为电能,A不符合题意;
B.燃气燃烧是将化学能转化为热能,B不符合题意;
C.电池充电是将电能转化为化学能,C符合题意;
D. 火力发电是将机械能转化为电能,D不符合题意;
故答案为:C。
【分析】A.原电池是将化学能转化为电能;
B.燃烧是将化学能转化为热能;
C.电解将电能转化为化学能;
D. 火力发电是热能转化为机械能、机械能再转化为电能。
5.【答案】A
【解析】【解答】A.合金的硬度高于成分金属,钛铝合金的硬度高于各成分金属,故A符合题意;
B.锂离子电池能将化学能转化为电能,光电池将光能转化为电能,故B不符合题意;
C.玻璃中含有硅酸钠、硅酸钙、二氧化硅等,玻璃是混合物,故C不符合题意;
D.聚酰胺是有机合成材料,故D不符合题意;
故答案为:A。
【分析】B.锂离子电池将化学能转化为电能,光电池将光能转化为电能;
C.玻璃是混合物;
D.聚酰胺属于有机高分子材料。
6.【答案】C
【解析】【解答】解:A. 生石灰溶于水生成氢氧化钙,属于放热反应,A不符合题意;
B. 乙醇燃烧一定是放热反应,B不符合题意;
C. Ba(OH)2·8H2O与NH4Cl晶体混合属于吸热反应,C符合题意;
D. 盐酸与氢氧化钠混合发生中和反应,一定是放热反应,D不符合题意;
故答案为:C
【分析】A.生石灰与水反应放热;
B.燃烧反应都是放热反应;
C.Ba(OH)2·8H2O与NH4Cl的反应为吸热反应;
D.中和反应为放热反应;
7.【答案】A
【解析】【解答】A.由图得:①C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H=-395.4kJ mol-1,根据盖斯定律,将①-②可得:C(s,石墨)=C(s,金刚石) △H=+1.9kJ mol-1,故A符合题意;
B.由图得:C(s,金刚石)+O2(g)=CO2(g) △H=-395.4kJ mol-1,则拆开1mol金刚石和1mol O2中的化学键需要吸收的能量比形成2molC=O键放出的能量少395.4kJ,故B不符合题意;
C.根据图示,金刚石能量大于石墨的总能量,物质的能量越大,越不稳定,则石墨比金刚石稳定,故C不符合题意;
D.依据热化学方程式 C(s,石墨)=C(s,金刚石) △H=+1.9kJ mol-1,所以1mol石墨本身具有的总能量比1mol金刚石本身具有的总能量小1.9 kJ,故D不符合题意;
故答案为:A。
【分析】先根据图示写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,最后结合物质的能量越低越稳定以及△H=生成物的总能量-反应物的总能量分析解答。
8.【答案】C
【解析】【解答】A.甲苯储氢反应( +3H2→ ),该反应属于加成反应,反应物全部转化为生成物,原子利用率为100%,故A不符合题意;
B.根据能量变化图可知,反应物总能量大于生成物总能量,该反应为放热反应,故B不符合题意;
C.根据能量变化图可知,该反应的正反应活化能为E,从中间态到甲基环己烷为逆反应活化能,正反应活化能小于逆反应活化能,故C符合题意;
D.加入催化剂,可以改变正逆反应活化能,但不能改变反应的始态和终态,即不会改变反应热,故D不符合题意;
故答案为:C。
【分析】A.甲苯储氢反应为加成反应,加成反应的原子利用率为100%;
B.反应物的总能量高于生成物的总能量,反应放热;
C.因为反应物的总能量高于生成物的总能量,所以正反应的活化能低于逆反应的活化能;
D.催化剂降低了反应的活化能,始末状态不变,反应热不变。
9.【答案】C
【解析】【解答】解:充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和液态水,并放出热量2bkJ,或生成4mol二氧化碳气体和液态水,并放出热量4bkJ,则乙炔燃烧的热化学方程式为C2H2(g)+ O2(g)═2CO2(g)+H2O(l)△H=﹣2b kJ/mol
或2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=﹣4bkJ/mol;
故选C.
【分析】由物质的物质的量与反应放出的热量成正比可知以及热化学方程式的书写方法写出热化学方程式.
10.【答案】B
【解析】【解答】①液态水汽化属于物理变化,故①不符合题意;
②将胆矾加热变为白色粉末为分解反应,属于吸热反应,故②不符合题意;
③浓硫酸稀释属于物理变化,故③不符合题意;
④氯酸钾分解制氧气为分解反应,属于吸热反应,故④不符合题意;
⑤生石灰跟水反应生成熟石灰为化合反应,属于放热反应,故⑤符合题意;
故答案为B。
【分析】放热反应主要是酸和金属、酸碱中和、大部分化合反应
11.【答案】D
【解析】【解答】解:A.焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol﹣2×632kJ/mol=+180kJ/mol,反应是吸热反应,反应中反应物所具有的总能量低于生成物所具有的总能量,故A正确;
B.1mol O2(g)吸收498kJ能量形成2mol O原子,原子结合形成分子的过程是化学键形成过程,是放热过程,2mol O原子结合生成1mol O2(g)时需要放出498kJ能量,故B正确;
C.形成2molNO放热2×632KJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量,故C正确;
D.焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol﹣2×632kJ/mol=+180kJ/mol,热化学方程式无论反应物还是生成物必须标明聚集状态,焓变的数值和方程式的系数相对应,注明焓变的单位是kJ/mol,所以该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180KJ/mol,故D错误;
故选D.
【分析】A.依据焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,计算分析,反应中反应物所具有的总能量高于生成物所具有的总能量是放热反应,反之是吸热反应;
B.原子结合形成分子的过程是化学键形成过程,是放热过程;
C.依据图示可知形成2molNO放热2×632KJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量;
D.反应焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,并需注明物质的聚集状态.
12.【答案】D
【解析】【解答】A.乙烯的燃烧热为△H=akJ·mol-1,燃烧热表示可燃物完全燃烧生成稳定的氧化物,产物水为液体水,则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=akJ·mol-1,A项不符合题意;
B.将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,合成氨为可逆反应,0.5molN2不能完全反应生成,则1molN2(g)充分反应生成NH3(g)放热大于38.6kJ,放热反应的焓变为负值,则N2(g)+3H2(g) 2NH3(g)△H< 38.6kJ mol 1,B项不符合题意;
C.中和反应为放热反应,焓变为负值,生成硫酸钙放热,由HCl和NaOH反应的中和热△H= 57.3kJ mol 1可知,H2SO4和Ca(OH)2反应的△H<2×( 57.3)kJ mol 1,C项不符合题意;
D.由图可知,N2O(g)和NO(g)反应生成N2(g)和NO2(g)的逆向活化能为348kJ·mol-1,D项符合题意;
故答案为:D。
【分析】A、燃烧热的热化学方程式中,水的状态为液态;
B、合成氨气的反应为可逆反应,反应无法进行到底;
C、中和热以生产1mol H2O所放出的热量进行计算;
D、逆向活化能即看生成的键能。
13.【答案】A
【解析】【解答】正反应是放热反应,则逆反应是吸热反应,吸热和放热的数字相同,N2(g)+3H2(g)=2NH3(g) ΔH=-92.3 kJ mol 1,则2NH3(g) = N2(g)+3H2(g) ΔH=+92.3 kJ mol 1,由于焓变与计量系数有关,所以NH3(g) = N2(g)+ H2(g)的焓变为+46.1 kJ mol 1,故A符合题意。
故答案为A。
【分析】考查的是可逆反应的逆反应焓变问题,正逆反应热量数值相等,符号相反
14.【答案】C
【解析】【解答】A.要采用控制变量法研究反应速率的影响因素,必须只有一个变量,不能同时改变两个变量,A不符合题意;
B.可逆反应中,正反应和逆反应的焓变数值相同,但符号相反,B不符合题意;
C.根据重要化合物性质的递变规律,可推出同周期元素性质的递变规律,如:同一周期元素从左向右,简单氢化物的稳定性逐渐增强,元素非金属性逐渐增强,C符合题意;
D.元素的非金属性:F>Cl>Br>I,元素的非金属性越强,其与H形成的化学键就越强,越不容易断裂,电离产生H+的能力就越弱,所以相应的HF、HCl、HBr、HI四种溶液的酸性逐渐增强,则酸性最强的是HI,D不符合题意;
故答案为:C。
【分析】A.研究速率的影响因素时,需要进行控制变量法,控制一个条件改变,其他条件不变的方法。
B.焓变有正负号
C.主要是对元素周期律的运用
D.氢氟酸是弱酸,酸性最弱
15.【答案】A
【解析】【解答】A.反应A=2B+C是放热反应,则Ea-(2Eb+Ec)>0,所以2Eb+Ec<Ea,A符合题意;
B.反应A=2B+C是放热反应,则Ea>2Eb+Ec,所以Ea>Ec,B不符合题意;
C.反应A=2B+C是放热反应,则Ea>2Eb+Ec,因此Ea>Eb+Ec,C不符合题意;
D.反应A=2B+C是放热反应,则Ea>2Eb+Ec,因此Ea>2Eb,D不符合题意;
故答案为:A。
【分析】根据放热反应中反应物具有的总能量大于生成物具有的总能量;反应热等于断裂反应物化学键吸收的总能量与形成生成物化学键释放的总能量的差。
16.【答案】D
【解析】【解答】解:A.在海底形成的晶体CH4·nH2O,俗称“可燃冰”,有可能成为人类未来的重要能源,A不符合题意;
B.由题目给出的信息可知,脱脂棉燃烧起来,说明达到了着火点,因此为放热反应,B不符合题意;
C.有的物质即使充分燃烧其产物也会环境污染,如含硫或氮的物质,C不符合题意;
D.核电厂发电时将核能转化为电能,D符合题意。
故答案为:D
【分析】A、天然气水合物,有机化合物,即可燃冰,是分布于深海沉积物或陆域的永久冻土中,由天然气与水在高压低温条件下形成的类冰状的结晶物质;
B、反应放热,达到了脱脂棉的着火点,使其燃烧;
C、S和N的化合物即使充分燃烧,其产物也会对环境造成危害,形成酸雨等;
D、了解核电的发电原理;
17.【答案】(1)B;D
(2)A
(3)CO(g)+2H2(g) CH3OH(l);0.4
【解析】【解答】(1) A.未指明反应速率是正反应速率还是逆反应速率,无法判断正反应速率是否等于逆反应速率,因此不能确定是否为平衡状态,A不正确;
B.反应物C是固体,反应发生使气体的质量增加,容器的容积不变,若容器内气体的密度不再随时间改变而变化,说明反应达到了平衡状态,B正确;
C.形成2 mol H-O键的同时会断裂1 mol H-H键,形成1 mol H-O键的同时会消耗0.5 mol H-H键,而同时又形成1 mol H-H键,说明正反应速率不等于逆反应速率,反应未达到平衡,C不正确;
D.若容器内气体的平均摩尔质量不再随时间改变而变化,说明气体的质量不变,气体的物质的量不变,反应达到平衡状态,D正确;
故答案为:BD;
(2)由于CO与H2反应生成X的反应是放热反应,说明反应物CO与H2的能量比生成物X的能量高,则能够表示该反应的能量变化的图示是A;
(3)①在5 min内CO变化的物质的量是2 mol,H2变化的物质的量是4 mol,X变化的物质的量为2 mol,△n(CO):△n(H2):△n(X)=1:2:1,由于物质反应的物质的量的比等于方程式中相应物质的化学计量数的比,根据质量守恒定律,可知X分子式是CH3OH或CH4O,5 min后各种物质都存在,且它们的物质的量不变,说明反应为可逆反应,故该反应方程式为:CO(g)+2H2(g) CH3OH(l);
②该反应前5 min内用H2表示的平均反应速率v(H2)= =0.4 mol/(L·min)。
【分析】(1)判断平衡可以从速率是否相等,浓度是否发生改变,质量分数是否发生改变、以及气体的质量是否改变考虑
(2)放热反应,反应物的能量高于生成物的能量
(3)根据物质的变化量之比等于化学计量系数之比即可写出方程式,利用公式v= 进行计算即可
18.【答案】(1)Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol
(2)C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.2kJ mol﹣1
【解析】【解答】解:(1)①Na2CO3 10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ mol﹣1②Na2CO3 10H2O(s)═Na2CO3 H2O(s)+9H2O(g)△H2=+373.6kJ mol﹣1③H2O(g)=H2O(l)△H3=﹣44kJ mol﹣1由盖斯定律①﹣②+③得到:Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol,故答案为:Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l)△H=+70.8KJ/mol;(2)燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为46×29.7kJ=1366.2kJ,其燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.2kJ mol﹣1,故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=﹣1366.2kJ mol﹣1.
【分析】(1)①Na2CO3 10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ mol﹣1②Na2CO3 10H2O(s)═Na2CO3 H2O(s)+9H2O(g)△H2=+373.6kJ mol﹣1③H2O(g)=H2O(l)△H3=﹣44kJ mol﹣1由盖斯定律①﹣②+③得到:Na2CO3 2H2O(s)═Na2CO3(s)+2H2O(l),据此进行分析;(2)表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式.
19.【答案】(1)0.02 mol·L-1·s-1
(2)减小压强;2 mol
(3)升高温度
(4)2A(g)+B(g) 3C(g) ΔH=+2.5Q kJ·mol-1
【解析】【解答】(1)若t1=15s,生成物C在t0~t1时间段的平均反应速率为:v= = =0.02mol L-1 s-1,故答案为:0.02mol L-1 s-1;(2)t4~t5阶段改变条件后,正逆反应速率都减小且相等,所以不可能是降低温度,应该为减小压强;反应中A的浓度变化为:1mol/L-0.8mol/L=0.2mol/L,C的浓度变化为:0.6mol/L-0.3mol/L=0.3mol/L,反应中A与C的化学计量数之比为0.2:0.3=2:3,根据t4~t5阶段改变压强平衡不移动可知,该反应的方程式为2A(g)+B(g) 3C(g);由方程式可知反应过程中消耗的B的物质的量浓度为:(1mol/L-0.8mol/L)× =0.1mol/L,所以B的起始浓度为0.4mol/L+0.1mol/L=0.5mol/L,向某密闭容器中加入4mol A、1.2mol C和一定量的B三种气体,A的起始浓度为1.0mol/L,体积= =4L,物质的量=0.5mol/L×4L=2mol,
故答案为:减小压强; 2mol;(3)该反应是体积不变的反应,而t5~t6阶段正逆反应速率都增大,说明是升高了温度;升高温度后正反应速率大于逆反应速率,说明该反应为吸热反应,逆反应为放热反应,
故答案为:升高温度;(4)依据(2)的计算得到A的物质的量共变化物质的量=(1mol/L-0.8mol/L)×4L=0.8mol/L,而此过程中容器与外界的热交换总量为QkJ,所以2molA反应热量变化为2.5QkJ,所以反应的热化学方程式为:2A(g)+B(g) 3C(g)△H=+2.5QkJ/mol,故答案为:2A(g)+B(g) 3C(g)△H=+2.5QkJ/mol。
【分析】(1)根据v=计算t0~t1阶段以C物质的浓度变化表示的反应速率;
(2)t4~t5阶段正逆反应速率减小且相等,如是降低温度,平衡移动发生移动,则正逆反应速率不相等,所以是减小了压强;根据A、C浓度的变化判断二者计量数关系,根据t4~t5阶段判断化学方程式,然后根据化学方程式计算;
(3)根据t5~t6阶段正逆反应速率变化可知,t5时升高了温度.
(4)根据反应中A和C的浓度变化量之比,得到反应中A与C的化学计量数之比,再根据t4~t5阶段改变压强平衡不移动可知化学反应方程式,再求得容器与外界的热交换总量为QkJ,进而解答该题。
20.【答案】(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-27kJ/mol
(2)O2 + 4H+ + 4e-= 2H2O
(3)铜
(4)通入O2
(5)2H++2e-=H2↑
(6)2Cl-+2H2O 2OH-+H2↑+Cl2↑;13
(7)N 处
(8)牺牲阳极的阴极保护法
【解析】【解答】(1)已知:a、Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ mol-1,B、C(石墨)+CO2(g)=2CO(g)△H2=+172kJ mol-1,依据盖斯定律a-b×3得到:Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g)△H=489-172×3=-27kJ/mol,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-27kJ/mol;
(2)CO-O2燃料电池(以H2SO4溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳,原电池负极电极反应为:CO+H2O-2e-=CO2+2H+,正极电极反应为氧气得到电子发生还原反应,在酸性溶液中的电极反应为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
(3)要实现铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4,只能利用电解原理,A是石墨棒,B是一种金属,只能是铜,故答案为:铜;
(4)根据反应方程式,铜被氧化,因此B应接电源的正极,即通入O2的一极,故答案为:通入O2;
(5)该装置,溶液中的氢离子在阴极发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(6)用石墨作电极电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成,电池反应式为2Cl-+2H2O H2↑+Cl2↑+2OH-;设生成氢氧根离子的物质的量为x,
2Cl-+2H2O H2↑+Cl2↑+ 2OH-
22.4L 2mol
0.112L x
22.4L:2mol=0.112L:x,解得:x= =0.01mol,c(OH-)= =0.1mol/L,则溶液的pH=13,故答案为:2Cl-+2H2O 2OH-+H2↑+Cl2↑,13;
(7)若X为铜,为减缓铁的腐蚀,铁比铜活泼,所以要采用外加电流的阴极保护法,所以为延缓铁腐蚀,K应置于N处,故答案为:N处;
(8)若X为锌,开关K置于M处,该方法为牺牲阳极的阴极保护法,故答案为:牺牲阳极的阴极保护法。
【分析】(1)由盖斯定律计算反应热,从而得出反应的热化学方程式;
(2)该燃料电池中,O2在正极发生得电子的还原反应;
(3)由电池总反应,确定该金属为Cu;
(4)在该电解池中,Cu做阳极,与电源的正极相连;
(5)在该电解池中,H+在阴极发生得电子的还原反应;
(6)电解饱和食盐水的总反应为: 2Cl-+2H2O 2OH-+H2↑+Cl2↑ ;根据公式计算产生H2的物质的脸,进而求出产生n(OH-),根据公式c(H+)×c(OH-)=Kw,求溶液中c(H+),进而求出溶液的pH;
(7)缓解铜的腐蚀,铜应作为原电池的正极,或电解池的阴极;
开关置于M处时,为原电池,铁做正极,锌做负极,为牺牲阳极的阴极保护法;
21.【答案】(1)4;4
(2)-867
(3)CO;变小;25.6
(4)2H2O+2e =H2↑+2OH ;大于;A
【解析】【解答】(1)由图可知,反应过程中能量变化出现了4个峰,即吸收了4次活化能,经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,即正反应方向第4步吸收的能量最多,对应的正反应活化能最大;
(2)由热化学方程式可知,③式可由由×(①+②)得到,根据盖斯定律,ΔH3=×(-1160-574)=-867kJ/mol;
(3)①a是燃料电池的负极,负极发生氧化反应, a极的电极反应是CH4-8e - + 10OH- = CO+ 7H2O,因此溶液中存在CO;乙装置中Cu电极为阳极,阳极反应Cu-2e-=Cu2+,故Cu电极质量变小;
②CH4的物质的量为=0.1mol,转移电子的物质的量为0.8mol,乙装置中阴极反应为Cu2++2e-=Cu,生成Cu的物质的量为0.4mol,质量为0.4mol×64g/mol=25.6g;
(4)①若用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,阴极是水得到电子生成OH-和H2,2H2O+2e =H2↑+2OH ;阳极是水失去电子生成H+、O2,2H2O-4e =O2↑+4H+,K+穿过阳离子交换膜进入阴极区形成KOH,穿过阴离子交换膜进入阳极区形成H2SO4,根据电荷守恒,K+的穿过的数目应是的2倍,即阳离子数目大于阴离子数目;
②H2SO4在阳极区形成,B出的是气体,即O2,H2SO4从A口出。
【分析】(1)有多少组峰则有多少步反应,活化能越大则上升的峰值越高;
(2)盖斯定律的应用要注意,判断列出的热化学方程式的对应关系,左右两边相同的物质互相抵消则相加,在同一边相同的物质互相抵消则相减;
(3) ① 甲烷燃料电池在碱性条件下不会生成二氧化碳而是生成碳酸根;
② 结合公式n=V/Vm和化学计量数之比等于物质的量之比判断;
(4) ① 阴极为氢离子放电,其电极反应式为水得到电子生成氢气和氢氧根离子;
② 硫酸根离子为阴离子,移向阳极,同时氢氧根离子在阳极放电,氢离子浓度增加,形成硫酸。
