江苏省盐城市联盟校2023-2024学年高三上学期第二次联考化学试卷(含答案)
文档属性
| 名称 | 江苏省盐城市联盟校2023-2024学年高三上学期第二次联考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 459.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 09:33:59 | ||
图片预览



文档简介
2023-2024学年度第一学期联盟校第二次学情检测
高三年级化学试题
(总分100分 考试时间75分钟)
注意事项:
1.本试卷中所有试题必须作答在答题纸上规定的位置,否则不给分。
2.答题前,务必将自己的姓名、准考证号用0.5毫米黑色墨水签字笔填写在试卷及答题纸上。
3.作答非选择题时必须用黑色字迹0.5毫米签字笔书写在答题纸的指定位置上,作答选择题必须用2B铅笔在答题纸上将对应题目的选项涂黑。如需改动,请用橡皮擦干净后,再选涂其它答案,请保持答题纸清洁,不折叠、不破损。
可能用到的相对原子质量:H:1 N:14 O:16 Cl:35.5 F:19 Sc:45
一、单项选择题:(共14题,每题3分,共42分。每题只有一个选项最符合题意。)
1.中华古诗词精深唯美,下列有关说法不正确的是
A. “百宝都从海舶来,玻璃大镜比门排”:制玻璃的原料之.--可用作制光导纤维
B. “粉身碎骨全不怕,要留清白在人间”:有化学能和热能的相互转化
C. “独忆飞絮鹅毛下,非复青丝马尾垂”:鉴别丝和飞絮可用灼烧的方法
D. “纷纷灿烂如星陨,赫赫喧豗似火攻”:烟花利用的“焰色反应”属于化学变化
2.反应CH3CH2CH2OHCH2CH=CH2↑+H2O可用于制备丙烯。下列表示反应中相关微粒的化学用语正确的是
A.硫原子的结构示意图: B.H2O的电子式:
C.聚丙烯的结构简式: D.中子数为10的氧原子:
3.下列实验操作规范的是
A.①灼烧干海带
B.②检验铜与浓硫酸反应的氧化产物
C.③用CCl4萃取碘水中的碘,振荡、放气
D.④配制溶液定容后摇匀
4.H2S是一种易燃的有毒气体(燃烧热为562.2kJ/mol),是制取多种硫化物的原料;硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性Na2TeO3溶液制备Te。下列化学反应表示正确的是
A.H2S的燃烧:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=+1124.4kJ/mol
B.CuSe和浓硫酸反应:CuSe+H2SO4=CuSO4+H2Se↑
C.向Ba(OH)2溶液中滴加足量NaHSO4溶液至溶液呈中性:H+++Ba2++OH-=BaSO4↓+H2O
D.电解强碱性Na2TeO3溶液的阴极反应:+4e-+3H2O=Te+6OH-
阅读下列资料,完成5-6题
肼是一种应用广泛的化工原料。具有很高的燃烧热,可用作火箭和燃料电池的燃料。N2H4、N2O4常用作火箭发射的推进剂。氧化亚铜(Cu2O)主要用于制造杀虫剂、分析试剂和红色玻璃等。在潮湿的空气中会逐渐氧化为黑色的氧化铜。以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应为:4(CH3COO)2Cu+N2H4+2H2O=2Cu2O↓+N2+8CH3COOH。生成的沉淀需用水洗涤后,用乙醇洗涤。
5.以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应说法不正确的是
A.N2H4易溶于水是因为N2H4能形成分子间氢键
B.如图所示氧离子处于Cu形成的正四面体的中心
C.Cu2O的晶胞中,Cu的配位数是2
D.沉淀用水洗后,再用乙醇洗可以除去Cu2O表面的水,防止被氧气氧化
6.火箭推进剂发生的反应为:2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g)。下列有关说法正确的是
A.充有N2O4的密闭容器中存在:N2O4(g)2NO2(g),当c(N2O4)=c(NO2)时,该可逆反应到达限度
B.碱性N2H4-空气燃料电池工作时,负极电极反应式为N2H4+4e-+4OH-=N2+4H2O
C.反应每生成0.3molN2,转移电子的数目为0.8×6.02×1023
D.N2H4的水溶液中存在:N2H4+H2O+OH-,向稀溶液中加水稀释,值变大
7.下列说法正确的是
A.将铁屑放入稀HNO3中可以证明Fe比H2活泼
B.氯气使湿润的淀粉KI试纸变蓝,KI被还原
C.O、Cl的某些单质或两元素之间形成的某些化合物可作水的消毒剂
D.SO2使溴水褪色与乙烯使溴水褪色的原理相同
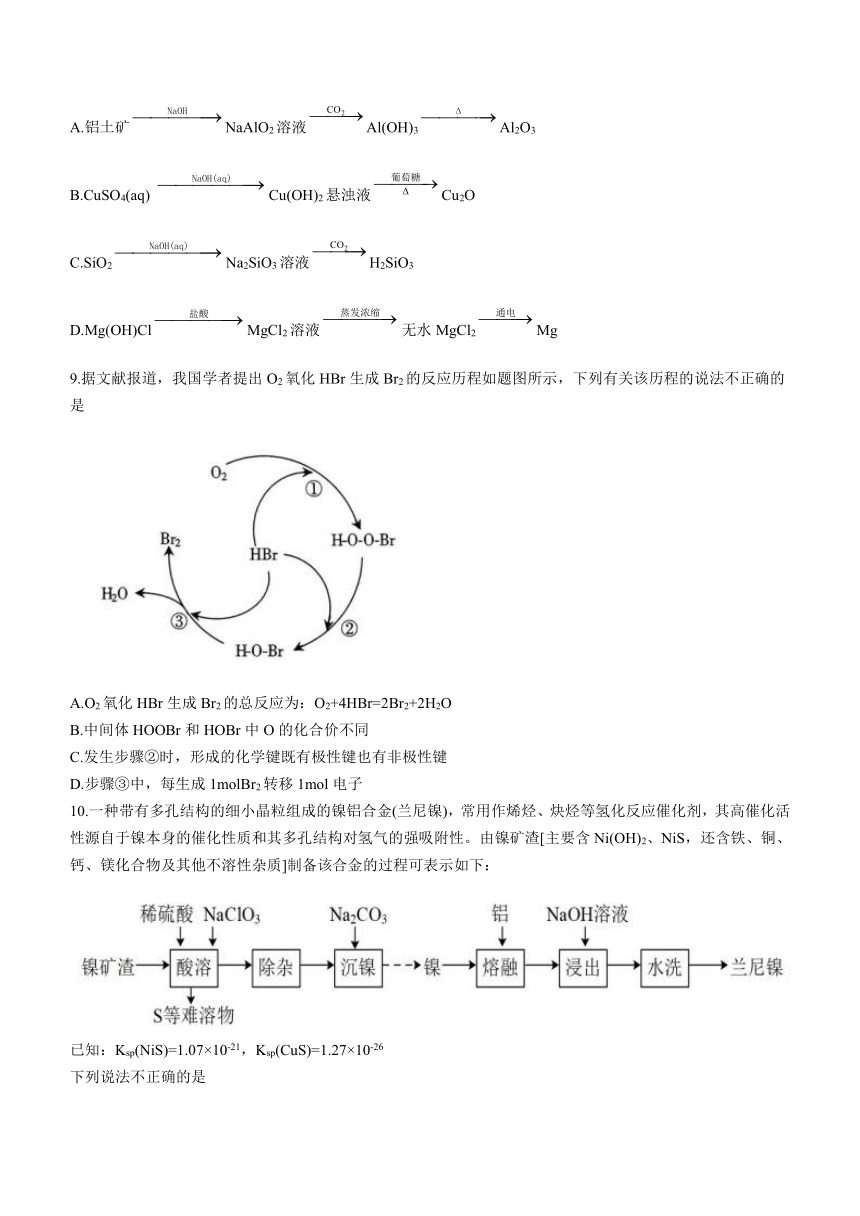
8.下列物质的转化在给定条件下不能实现的是
A.铝土矿NaAlO2溶液Al(OH)3Al2O3
B.CuSO4(aq) Cu(OH)2悬浊液Cu2O
C.SiO2Na2SiO3溶液H2SiO3
D.Mg(OH)ClMgCl2溶液无水MgCl2Mg
9.据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如题图所示,下列有关该历程的说法不正确的是
A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O
B.中间体HOOBr和HOBr中O的化合价不同
C.发生步骤②时,形成的化学键既有极性键也有非极性键
D.步骤③中,每生成1molBr2转移1mol电子
10.一种带有多孔结构的细小晶粒组成的镍铝合金(兰尼镍),常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含Ni(OH)2、NiS,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备该合金的过程可表示如下:
已知:Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-26
下列说法不正确的是
A. “酸溶”过程中,NiS发生的反应为3NiS++6H+=3Ni2++3S+Cl-+3H2O
B. “除杂”过程中加入NiS除去Cu2+发生的反应是:NiS+Cu2+CuS+Ni2+,该反应的平衡常数K=8.43×104
C. “浸出”步骤中NaOH溶液的作用是除去熔融过程中过量的铝
D.使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应。
11.化合物F是酮洛芬的同分异构体:
下列叙述正确的是
A.酮洛芬中含有2个手性碳原子
B.鉴别化合物F和酮洛芬可用NaHCO3溶液或银氨溶液
C.在一定条件,化合物F和酮洛芬均可发生氧化、还原、消去反应
D.在一定条件,1mol酮洛芬与H2反应最多消耗6molH2
12.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向FeBr2溶液中通入少量Cl2 溶液由浅绿色变为黄色 氧化性:Cl2>Br2
B 向Na2SO3溶液中滴加盐酸 有气体产生 非金属性:Cl>S
C 向pH=3的HA和HB溶液中分别加水稀释至100倍 pH(HA)>pH(HB) 酸性:HA>HB
D 向重晶石中加入饱和碳酸钠溶液 重晶石逐渐溶解 溶度积:Ksp(BaCO3)13.室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:用pH试纸测量0.1mol/LNaHSO3溶液的pH,测得pH约为5。
实验2:将0.1mol/LNaHSO3溶液放置一段时间,测得pH约为3。
实验3:往溴水中加入Na2SO3溶液,溴水颜色褪去。
实验4:向0.1mol/LNa2SO3溶液中滴加HCl至pH=7。
下列说法正确的是
A.从实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)B.实验2所得的溶液酸性比原溶液强是因为发生了还原反应
C.实验4所得溶液中存在:c(Na+)=c()+2c()+c(Cl-)
D.实验3的化学方程式:Br2++2OH-=2Br-++H2O
14.一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右图所示,下列说法不正确的是
A.生成乙烯的速率:v(M)一定小于v(N)
B.当温度高于250℃,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低
C.平衡常数:KM>KN
D.若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为7.7%。
二、非选择题:(共4题,共58分)
l5.(14分)稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
己知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中Sc3F与氯化物形成的沉淀,在强酸中部分溶解。
②“脱水除铵”是沉淀的热分解过程。
(1)钛(Ti)原子的外围电子排布式为_____________。
(2)“焙烧”过程生成Sc2O,的化学方程式为_____________。
(3)“脱水除铵”过程中残留固体质量随温度的变化关系如图所示,在380~400℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3。则“沉钪”过程中ScF3与氯化物形成的沉淀的化学式为______。(写出计算过程)
(4)传统制备ScF3,的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常其中含有ScOF杂质,原因是______________(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是_____。
16.(15分)化合物G可通过如下图所示的方法进行合成:
(1)1molE分子中采取sp2杂化的碳原子数目是_________。
(2)A→B的反应需经历A→X→B的过程,X的分子式为C10H13NO6,则X的结构简式为_________。
(3)E→F的反应类型为_________。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①能发生银镜反应,能与FeCl3溶液发生显色反应。
②分子中含有4种不同化学环境的氢,峰面积之比为1:2:2:6。
(5)设计以和CH3CH2Cl为原料制取的合成路线流程图
____________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
17.(14分)硫代硫酸钠(Na2S2O3)常用作分析试剂及还原剂,易溶于水,在中性或碱性环境中稳定。某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠。回答下列问题:
Ⅰ:硫代硫酸钠的结构与运用
(1)己知Na2S2O3中的结构与相似,可看作用一个S原子代替了一个S=O中的O原子,写出的结构式___________。
(2) Na2S2O3做脱氯剂可除去自来水中残留的Cl2,从而消除Cl2对环境的污染,该反应原理中氧化剂与还原剂的物质的量之比为_______。
Ⅱ:硫代硫酸钠的制备
(3)为防止生成有害气体,并提高原料利用率,配制三颈烧瓶内混合溶液的方法为________。
A.将Na2S固体溶于Na2CO3溶液 B.将Na2CO3固体溶于Na2S溶液
(4)为保证Na2CO3和Na2S得到充分利用,两者的物质的量之比应为_________。
(5)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因___________。
(6)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为___________。(实验中可选用的试剂有:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水。提示:室温时CaCO3饱和溶液的pH=9.5)
18.(15分)氮氧化物(NOx)、SO2、CO和CO2等气体会造成环境问题。研究这些气体具有重要意义。
I:已知反应2CO(g)+2NO(g)2CO2(g)+N2(g) △H=akJ/mol分三步进行,各步的相对能量变化如图Ⅰ、Ⅱ、Ⅲ所示(相对能量单位:kJ/mol):
(1)反应Ⅱ逆反应的活化能E2(逆)=____________
(2)反应ⅢN2O(g)+CO2(g)+CO(g)2CO2(g)+N2(g)的△H=________________。
Ⅱ:一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g)将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应。
(3)下列能说明反应达到平衡状态的是_____
a.混合气体颜色保持不变
b.容器内气体密度不变
c.SO3和NO的体积比为1:1而且保持不变
d.每生成1molSO3的同时消耗1molNO
(4)测得上述反应平衡时NO2与SO2体积比为1:5,则SO2的平衡转化率为______,此条件下平衡常数K=_______。
2023-2024学年度第一学期联盟校第二次学情检测
高三化学试题参考答案
一、单项选择题:(共14题,每题3分。每题只有一个选项最符合题意。)
1-5:DBCDA 6-10:CCDCC 11-14:BCCA
二、非选择题:(本大题共4题,共58分)
15.(1)3d24s2(2分)
(2)2Sc2(C2O4)3+3O22Sc2O3+12CO2(3分)
(3)3NH4Cl·ScF3·6H2O
200-300℃时,减少的质量为7.41-5.25=2.16g,则水的物质的量为=0.12mol(1分)
380-400℃时,NH4Cl分解,其物质的量为=0.06mol(1分)
剩余固体为ScF3,其物质的量为=0.02mol(1分)
则沉淀的化学式为:3NH4Cl·ScF3·6H2O(1分)
(4)ScF3+H2OScOF+2HF(或ScF3·6H2O=ScOF+2HF+5H2O(加热、高温均可)(3分)
“除铵”时NH4Cl分解生成HCl,抑制Sc3+的水解(2分)
16.(1)8mol或8×6.02×1023(2分)
(2) (3分)
(3)取代反应(2分)
(4) 或(3分)
(5)(5分)
17.(1) (2分)
(2)4:1(2分)
(3)A(2分)
(4)1:2(2分)
(5) +2H+=S↓+SO2↑+H2O(3分)
(6)取少量样品于试管(烧杯)中,加水溶解,(1分)加入过量的CaCl2溶液,振荡(搅拌),(1分)静置,测上层清液的pH,若大于9.5,则含有NaOH(1分)
18.(1)643.5kJ/mol(3分)
(2)(a+314.3)kJ/mol(3分)
(3)ad(3分,选对1个给1分,选对2个给3分,选错不给分)
(4)或37.5%(3分);1.8(3分)
高三年级化学试题
(总分100分 考试时间75分钟)
注意事项:
1.本试卷中所有试题必须作答在答题纸上规定的位置,否则不给分。
2.答题前,务必将自己的姓名、准考证号用0.5毫米黑色墨水签字笔填写在试卷及答题纸上。
3.作答非选择题时必须用黑色字迹0.5毫米签字笔书写在答题纸的指定位置上,作答选择题必须用2B铅笔在答题纸上将对应题目的选项涂黑。如需改动,请用橡皮擦干净后,再选涂其它答案,请保持答题纸清洁,不折叠、不破损。
可能用到的相对原子质量:H:1 N:14 O:16 Cl:35.5 F:19 Sc:45
一、单项选择题:(共14题,每题3分,共42分。每题只有一个选项最符合题意。)
1.中华古诗词精深唯美,下列有关说法不正确的是
A. “百宝都从海舶来,玻璃大镜比门排”:制玻璃的原料之.--可用作制光导纤维
B. “粉身碎骨全不怕,要留清白在人间”:有化学能和热能的相互转化
C. “独忆飞絮鹅毛下,非复青丝马尾垂”:鉴别丝和飞絮可用灼烧的方法
D. “纷纷灿烂如星陨,赫赫喧豗似火攻”:烟花利用的“焰色反应”属于化学变化
2.反应CH3CH2CH2OHCH2CH=CH2↑+H2O可用于制备丙烯。下列表示反应中相关微粒的化学用语正确的是
A.硫原子的结构示意图: B.H2O的电子式:
C.聚丙烯的结构简式: D.中子数为10的氧原子:
3.下列实验操作规范的是
A.①灼烧干海带
B.②检验铜与浓硫酸反应的氧化产物
C.③用CCl4萃取碘水中的碘,振荡、放气
D.④配制溶液定容后摇匀
4.H2S是一种易燃的有毒气体(燃烧热为562.2kJ/mol),是制取多种硫化物的原料;硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性Na2TeO3溶液制备Te。下列化学反应表示正确的是
A.H2S的燃烧:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=+1124.4kJ/mol
B.CuSe和浓硫酸反应:CuSe+H2SO4=CuSO4+H2Se↑
C.向Ba(OH)2溶液中滴加足量NaHSO4溶液至溶液呈中性:H+++Ba2++OH-=BaSO4↓+H2O
D.电解强碱性Na2TeO3溶液的阴极反应:+4e-+3H2O=Te+6OH-
阅读下列资料,完成5-6题
肼是一种应用广泛的化工原料。具有很高的燃烧热,可用作火箭和燃料电池的燃料。N2H4、N2O4常用作火箭发射的推进剂。氧化亚铜(Cu2O)主要用于制造杀虫剂、分析试剂和红色玻璃等。在潮湿的空气中会逐渐氧化为黑色的氧化铜。以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应为:4(CH3COO)2Cu+N2H4+2H2O=2Cu2O↓+N2+8CH3COOH。生成的沉淀需用水洗涤后,用乙醇洗涤。
5.以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应说法不正确的是
A.N2H4易溶于水是因为N2H4能形成分子间氢键
B.如图所示氧离子处于Cu形成的正四面体的中心
C.Cu2O的晶胞中,Cu的配位数是2
D.沉淀用水洗后,再用乙醇洗可以除去Cu2O表面的水,防止被氧气氧化
6.火箭推进剂发生的反应为:2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g)。下列有关说法正确的是
A.充有N2O4的密闭容器中存在:N2O4(g)2NO2(g),当c(N2O4)=c(NO2)时,该可逆反应到达限度
B.碱性N2H4-空气燃料电池工作时,负极电极反应式为N2H4+4e-+4OH-=N2+4H2O
C.反应每生成0.3molN2,转移电子的数目为0.8×6.02×1023
D.N2H4的水溶液中存在:N2H4+H2O+OH-,向稀溶液中加水稀释,值变大
7.下列说法正确的是
A.将铁屑放入稀HNO3中可以证明Fe比H2活泼
B.氯气使湿润的淀粉KI试纸变蓝,KI被还原
C.O、Cl的某些单质或两元素之间形成的某些化合物可作水的消毒剂
D.SO2使溴水褪色与乙烯使溴水褪色的原理相同
8.下列物质的转化在给定条件下不能实现的是
A.铝土矿NaAlO2溶液Al(OH)3Al2O3
B.CuSO4(aq) Cu(OH)2悬浊液Cu2O
C.SiO2Na2SiO3溶液H2SiO3
D.Mg(OH)ClMgCl2溶液无水MgCl2Mg
9.据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如题图所示,下列有关该历程的说法不正确的是
A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O
B.中间体HOOBr和HOBr中O的化合价不同
C.发生步骤②时,形成的化学键既有极性键也有非极性键
D.步骤③中,每生成1molBr2转移1mol电子
10.一种带有多孔结构的细小晶粒组成的镍铝合金(兰尼镍),常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含Ni(OH)2、NiS,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备该合金的过程可表示如下:
已知:Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-26
下列说法不正确的是
A. “酸溶”过程中,NiS发生的反应为3NiS++6H+=3Ni2++3S+Cl-+3H2O
B. “除杂”过程中加入NiS除去Cu2+发生的反应是:NiS+Cu2+CuS+Ni2+,该反应的平衡常数K=8.43×104
C. “浸出”步骤中NaOH溶液的作用是除去熔融过程中过量的铝
D.使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应。
11.化合物F是酮洛芬的同分异构体:
下列叙述正确的是
A.酮洛芬中含有2个手性碳原子
B.鉴别化合物F和酮洛芬可用NaHCO3溶液或银氨溶液
C.在一定条件,化合物F和酮洛芬均可发生氧化、还原、消去反应
D.在一定条件,1mol酮洛芬与H2反应最多消耗6molH2
12.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向FeBr2溶液中通入少量Cl2 溶液由浅绿色变为黄色 氧化性:Cl2>Br2
B 向Na2SO3溶液中滴加盐酸 有气体产生 非金属性:Cl>S
C 向pH=3的HA和HB溶液中分别加水稀释至100倍 pH(HA)>pH(HB) 酸性:HA>HB
D 向重晶石中加入饱和碳酸钠溶液 重晶石逐渐溶解 溶度积:Ksp(BaCO3)
实验1:用pH试纸测量0.1mol/LNaHSO3溶液的pH,测得pH约为5。
实验2:将0.1mol/LNaHSO3溶液放置一段时间,测得pH约为3。
实验3:往溴水中加入Na2SO3溶液,溴水颜色褪去。
实验4:向0.1mol/LNa2SO3溶液中滴加HCl至pH=7。
下列说法正确的是
A.从实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)
C.实验4所得溶液中存在:c(Na+)=c()+2c()+c(Cl-)
D.实验3的化学方程式:Br2++2OH-=2Br-++H2O
14.一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右图所示,下列说法不正确的是
A.生成乙烯的速率:v(M)一定小于v(N)
B.当温度高于250℃,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低
C.平衡常数:KM>KN
D.若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为7.7%。
二、非选择题:(共4题,共58分)
l5.(14分)稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
己知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中Sc3F与氯化物形成的沉淀,在强酸中部分溶解。
②“脱水除铵”是沉淀的热分解过程。
(1)钛(Ti)原子的外围电子排布式为_____________。
(2)“焙烧”过程生成Sc2O,的化学方程式为_____________。
(3)“脱水除铵”过程中残留固体质量随温度的变化关系如图所示,在380~400℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3。则“沉钪”过程中ScF3与氯化物形成的沉淀的化学式为______。(写出计算过程)
(4)传统制备ScF3,的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常其中含有ScOF杂质,原因是______________(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是_____。
16.(15分)化合物G可通过如下图所示的方法进行合成:
(1)1molE分子中采取sp2杂化的碳原子数目是_________。
(2)A→B的反应需经历A→X→B的过程,X的分子式为C10H13NO6,则X的结构简式为_________。
(3)E→F的反应类型为_________。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①能发生银镜反应,能与FeCl3溶液发生显色反应。
②分子中含有4种不同化学环境的氢,峰面积之比为1:2:2:6。
(5)设计以和CH3CH2Cl为原料制取的合成路线流程图
____________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
17.(14分)硫代硫酸钠(Na2S2O3)常用作分析试剂及还原剂,易溶于水,在中性或碱性环境中稳定。某实验小组用如图装置(夹持、加热仪器己略去)制备硫代硫酸钠。回答下列问题:
Ⅰ:硫代硫酸钠的结构与运用
(1)己知Na2S2O3中的结构与相似,可看作用一个S原子代替了一个S=O中的O原子,写出的结构式___________。
(2) Na2S2O3做脱氯剂可除去自来水中残留的Cl2,从而消除Cl2对环境的污染,该反应原理中氧化剂与还原剂的物质的量之比为_______。
Ⅱ:硫代硫酸钠的制备
(3)为防止生成有害气体,并提高原料利用率,配制三颈烧瓶内混合溶液的方法为________。
A.将Na2S固体溶于Na2CO3溶液 B.将Na2CO3固体溶于Na2S溶液
(4)为保证Na2CO3和Na2S得到充分利用,两者的物质的量之比应为_________。
(5)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因___________。
(6)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为___________。(实验中可选用的试剂有:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水。提示:室温时CaCO3饱和溶液的pH=9.5)
18.(15分)氮氧化物(NOx)、SO2、CO和CO2等气体会造成环境问题。研究这些气体具有重要意义。
I:已知反应2CO(g)+2NO(g)2CO2(g)+N2(g) △H=akJ/mol分三步进行,各步的相对能量变化如图Ⅰ、Ⅱ、Ⅲ所示(相对能量单位:kJ/mol):
(1)反应Ⅱ逆反应的活化能E2(逆)=____________
(2)反应ⅢN2O(g)+CO2(g)+CO(g)2CO2(g)+N2(g)的△H=________________。
Ⅱ:一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g)将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应。
(3)下列能说明反应达到平衡状态的是_____
a.混合气体颜色保持不变
b.容器内气体密度不变
c.SO3和NO的体积比为1:1而且保持不变
d.每生成1molSO3的同时消耗1molNO
(4)测得上述反应平衡时NO2与SO2体积比为1:5,则SO2的平衡转化率为______,此条件下平衡常数K=_______。
2023-2024学年度第一学期联盟校第二次学情检测
高三化学试题参考答案
一、单项选择题:(共14题,每题3分。每题只有一个选项最符合题意。)
1-5:DBCDA 6-10:CCDCC 11-14:BCCA
二、非选择题:(本大题共4题,共58分)
15.(1)3d24s2(2分)
(2)2Sc2(C2O4)3+3O22Sc2O3+12CO2(3分)
(3)3NH4Cl·ScF3·6H2O
200-300℃时,减少的质量为7.41-5.25=2.16g,则水的物质的量为=0.12mol(1分)
380-400℃时,NH4Cl分解,其物质的量为=0.06mol(1分)
剩余固体为ScF3,其物质的量为=0.02mol(1分)
则沉淀的化学式为:3NH4Cl·ScF3·6H2O(1分)
(4)ScF3+H2OScOF+2HF(或ScF3·6H2O=ScOF+2HF+5H2O(加热、高温均可)(3分)
“除铵”时NH4Cl分解生成HCl,抑制Sc3+的水解(2分)
16.(1)8mol或8×6.02×1023(2分)
(2) (3分)
(3)取代反应(2分)
(4) 或(3分)
(5)(5分)
17.(1) (2分)
(2)4:1(2分)
(3)A(2分)
(4)1:2(2分)
(5) +2H+=S↓+SO2↑+H2O(3分)
(6)取少量样品于试管(烧杯)中,加水溶解,(1分)加入过量的CaCl2溶液,振荡(搅拌),(1分)静置,测上层清液的pH,若大于9.5,则含有NaOH(1分)
18.(1)643.5kJ/mol(3分)
(2)(a+314.3)kJ/mol(3分)
(3)ad(3分,选对1个给1分,选对2个给3分,选错不给分)
(4)或37.5%(3分);1.8(3分)
同课章节目录
