第一章 有机化合物的结构特点与研究方法 测试题(含解析) 2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第一章 有机化合物的结构特点与研究方法 测试题(含解析) 2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 715.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 09:56:43 | ||
图片预览




文档简介
第一章 有机化合物的结构特点与研究方法测试题
一、单选题(共12题)
1.已知碳碳单键可绕键轴自由旋转,某烃的结构简式如下图所示,下列说法中正确的是
A.该物质所有原子均可共面
B.分子中至少有10个碳原子处于同一平面上
C.分子中至少有11个碳原子处于同一平面上
D.该烃与苯互为同系物
2.为测定某有机物的结构,用核磁共振仪处理后得到的核磁共振氢谱如图所示,则该有机物可能是
A. B.(CH3)4C C.CH3CH2OH D.CH3OCH3
3.下列说法正确的是
A.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈
B.苯都能与发生加成反应,说明苯的分子中含碳碳双键
C.新戊烷有一种一氯取代物
D.金属钠在加热条件下生成氧化钠
4.下列说法正确的是(均不考虑立体异构)
A.和 互为同分异构体
B.的一氯代物有7种
C.(CH3)2CHCHClCH3的同分异构体有7种
D.分子式为C4H8O2且官能团与相同的物质共有5种
5.人类对有机化学的研究经历了以下几个阶段:
①研究有机化合物组成、结构、性质和应用
②根据需要对有机化合物分子进行设计和合成
③从天然的动植物中提取、分离出一些纯净物。
这是有机化学发展的必经之路。下列按先后顺序排列的是
A.①②③ B.③②① C.③①② D.②①③
6.某苯的同系物的分子式为C11H16,经分析分子式中除含苯环外(不含其它环状结构),还含有两个“—CH3”,两个“—CH2—”、一个“”它的可能结构式有
A.2 种 B.3 种 C.4 种 D.5 种
7.下列说法正确的是
A.有和两种结构
B.分子中可能所有原子均共面
C.在碳原子数小于10的烷烃中,一氯代物不存在同分异构体的有4种
D.异戊烷有9种二氯代物
8.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。已知它的核磁共振氢谱图中共有3组峰,则该烃的结构简式是
A. B.CH3CH2CH2CH2CH3
C. D.
9.有机物M由C、H、O三种元素组成,可作为溶剂从中草药中提取青蒿素。有关M的结构信息如下:
ⅰ.M的红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰。
ⅱ.M的核磁共振氢谱(图1,两组峰面积之比为2:3)、质谱(图2)如下所示。
下列分析不正确的是
A.M不属于醇类物质 B.M的分子中含羧基和醛基
C.M的结构简式为 D.M的相对分子质量为74
10.下列物质中互为同分异构体的是
A.O2和O3 B.
C.CH3COOH和HCOOCH3 D.和
11.下列关于有机化学史的说法,正确的是
A.贝采利乌斯提出了测定有机物元素组成的方法
B.凯库勒提出了碳价四面体学说
C.李比希提出了有机化学概念
D.维勒最早用人工方法将无机物转变为有机物
12.下列关于丙氨酸的说法中,正确的是
A.Ⅰ和Ⅱ的结构和性质完全不相同
B.Ⅰ和Ⅱ呈镜面对称,都是非极性分子
C.Ⅰ和Ⅱ具有完全相同的组成和原子排列
D.Ⅰ和Ⅱ中化学键的种类与数目不完全相同
二、非选择题(共10题)
13.乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
该新药分子中有 种不同化学环境的C原子。
14.单键、双键和三键
成键类型 碳碳单键 碳碳双键 碳碳三键
表示方式 —C≡C—
成键方式 1个碳原子与周围 个原子成键 1个碳原子与周围 个原子成键 1个碳原子与周围 个原子成键
成键类型 碳碳单键 碳碳双键 碳碳三键
碳原子的饱和性
空间构型
碳原子与周围4个原子形成 结构 形成双键的碳原子以及与之相连的原子处于同一 上 形成三键的碳原子以及与之相连的原子处于同一 上
15.共价键的类型
σ键 π键
轨道重叠方式
轨道重叠程度
对称类型
键的强度
旋转情况
与反应类型的关系
成键规律
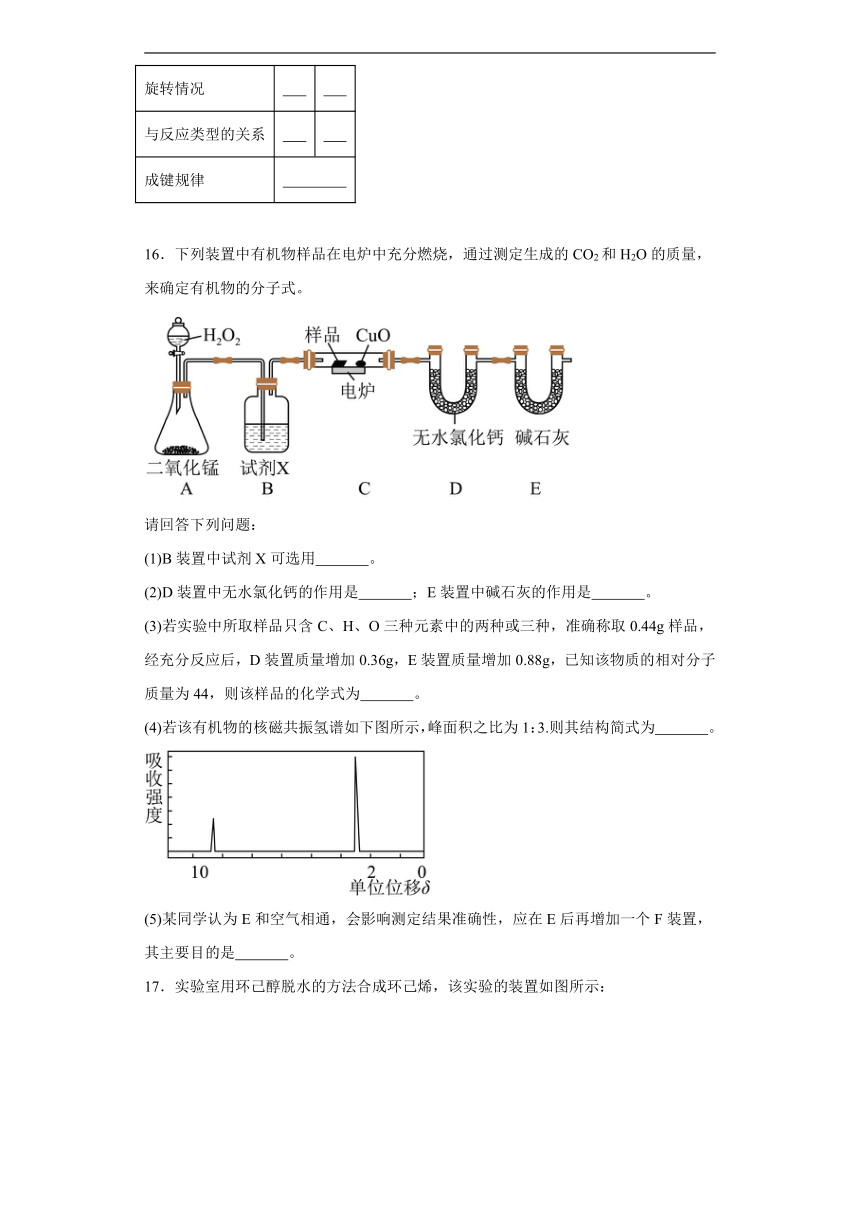
16.下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物的分子式。
请回答下列问题:
(1)B装置中试剂X可选用 。
(2)D装置中无水氯化钙的作用是 ;E装置中碱石灰的作用是 。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D装置质量增加0.36g,E装置质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为 。
(4)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3.则其结构简式为 。
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个F装置,其主要目的是 。
17.实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:
可能用到的有关数据如下:
相对分子质量 密度/(g·cm-3) 沸点/℃ 溶解性
环己醇 100 0.9618 161 微溶于水
环己烯 82 0.8102 83 难溶于水
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是 ;
(2)a中发生主要反应的化学方程式为 ;
(3)本实验最容易产生的有机副产物的结构简式为 。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(4)用碳酸钠溶液洗涤的作用是 ,操作X的名称为 。
Ⅲ.产物分析及产率计算:
(5)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有 种不同化学环境的氢原子。
②本实验所得环己烯的产率是 。
18.选用适当的试剂(写化学式)和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中。
序号 物质 试剂 除杂方法
① 乙炔(H2S)
② 溴苯(Br2)
③ 苯甲酸(NaCl)
④ 95.6%工业乙醇制无水乙醇
19.为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1:2:3。
试回答下列问题:
(1)有机物A的相对分子质量是 ;
(2)有机物A的最简式分子式是 ,分子式是
(3)写出有机物A的结构简式: 。
(4)写出有机物A的一种同分异构体结构简式: 。
20.由C、H、O三种元素组成的链状有机化合物X,只含有羟基和羧基两种官能团,且羟基数目大于羧基数目。称取2.04 g纯净的X,与足量金属钠充分反应,生成672 mL氢气(标准状况)。请确定摩尔质量最小的X分子中羟基、羧基数目及该X的相对分子质量 (要求写出简要推理过程)。
21.0.2mol某有机物和0.4molO2在密闭容器中燃烧后,产物通过浓H2SO4后,浓H2SO4增重10.8g;通过灼热的CuO充分反应后,CuO失重3.2g;再将气体通入足量澄清石灰水,得到沉淀40g,无气体剩余。若已知等量该有机物与9.2gNa恰好完全反应,请回答:
(1)该有机物的结构简式是 。
(2)写出该有机物的一种主要用途: 。
22.某含、、三种元素的未知物,现对进行分析探究。
(1)经燃烧分析实验测定,该未知物中碳的质量分数为41.38%,氢的质量分数为3.45%,则的实验式为 。
(2)利用质谱法测定得的相对分子质量为116,则的分子式为 。
(3)的红外光谱图如下,分析该图得出中含2种官能团,官能团的名称是 、 。
(4)的核磁共振氢谱图如下,综合分析的结构简式为 。
参考答案:
1.C
A.甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面,两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面,如图所示(已编号)的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,所有原子不可能共面,A错误;
B.由A分析可知,分子中至少有11个碳原子处于同一平面上,B错误;
C.由A分析可知,分子中至少有11个碳原子处于同一平面上,C正确;
D.该有机物含有2个苯环,不是苯的同系物,D错误;
故选C。
2.A
A.由核磁共振氢谱可知,该有机物中有两种氢原子,个数比为,选项A符合题意;
B.的核磁共振氢谱有1组峰,选项B不符合题意;
C.的核磁共振氢谱有3组峰,选项C不符合题意;
D.的核磁共振氢谱有1组峰,选项D不符合题意;
答案选A。
3.C
A.乙醇与Na反应比水与Na反应更缓和,因乙醇中羟基H不如水中H活泼,故A错误;
B.苯分子中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键,故B错误;
C.新戊烷(C(CH3)4)中有1种H原子,其一氯代物有1种,故C正确;
D.金属钠在加热条件下生成过氧化钠,故D错误;
故选C。
4.C
A.的分子式为C10H14O,的分子式为C10H16O,不是同分异构体,A错误;
B.的一氯代物有苯环上4种、苯环上甲基1种、丙醇基上两甲基算1种,共6种,B错误;
C.(CH3)2CHCHClCH3的同分异构体,即戊烷的一氯取代,有碳链异构正、异、新三种,正戊烷的一氯取代有3种,异戊烷的一氯取代有4种,新戊烷的一氯取代有1种,故(CH3)2CHCHClCH3的同分异构体有7种,C正确;
D.具有的官能团是酯基,分子式为C4H8O2的同分异构体有、、、,共4种,D错误;
故答案选择C。
5.C
研究有机物首先要从天然植物中提取分离,再研究有机物的组成、结构和性质,再根据需要对有机物进行设计和合成,所以顺序为③①②。
故选:C。
6.C
计算该分子的不饱和度为,含有苯环那么其不再含有其他不饱和键。已知还含有两个“—CH3”,两个“—CH2—”、一个“”,苯环为一取代。若-CH2-不与甲基相连,若一个-CH2-与一个-CH3相连为,若两个-CH2-与两个-CH3为,共有4种。
故选C。
7.C
A.有机物CF2Cl2是四面体结构,不是平面构型,故 和是同一种结构,A错误;
B.中含有C原子周围连接4个单键的结构,则不可能所有原子均共面,B错误;
C.在碳原子数小于10的烷烃中,一氯代物不存在同分异构体,说明该烷烃只有一种等效氢,符合条件的为甲烷、乙烷、2,2-二甲基丙烷、2,2,3,3-四甲基丁烷,共4种,C正确;
D.异戊烷二氯代物为(CH3)2CHCH2CHCl2、(CH3)2CHCHClCH2Cl、(CH3)2CClCH2CH2Cl、CH2ClCH(CH3)CH2CH2Cl、(CH3)2CHCCl2CH3、(CH3)2CClCHClCH3、CH2ClCH(CH3)CHClCH3、CH2ClC(CH3)ClCH2CH3、CHCl2CH(CH3)CH2CH3、(CH2Cl)2CHCH2CH3,共有10种,D错误;
故选C。
8.B
1mol该烃燃烧需氧气179.2L(标准状况),即,由核磁共振氢谱可知,该烃有3种不同化学环境的氢原子,据此分析:
A.该烃的分子式为C6H14,1mol C6H14的耗氧量为9.5mol,A错误;
B.CH3CH2CH2CH2CH3有3种等效氢原子,分子式为C5H12,1mol C5H12耗氧量为8mol,B正确;
C.该烃有4种不同化学环境的氢原子,C错误;
D.该烃有2种不同化学环境的氢原子,D错误;
故选B。
9.B
由图2可知有机物M的相对分子质量为74;M的红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰,则M为醚类,饱和一元醚的结构通式为CnH2n+2O,则12n+2n+2+16=74,n=4,则分子式为C4H10O;又M的核磁共振氢谱(图1,两组峰面积之比为2:3),则M的结构简式为CH3CH2OCH2CH3。
A.根据分析,M为醚类,M不属于醇类物质,A正确;
B.M的分子中含醚键,B错误;
C.M的结构简式为CH3CH2OCH2CH3,C正确;
D.M的相对分子质量为74,D正确;
故选B。
10.C
A.O2和O3是由氧元素形成的性质不同的单质,二者互为同素异形体,A错误;
B.根据甲烷的正四面体结构判断,图示结构表示同一种物质,B错误;
C.CH3COOH和HCOOCH3分子式均为C2H4O2,结构不同,二者互为同分异构体,C正确;
D.2-甲基丙烷和2-甲基丁烷结构相似,分子组成相差1个CH2原子团,二者互为同系物,D错误。
故选C。
11.D
A.贝采利乌斯在1806年最早提出“有机化学”这个名称,李比希最早提出了测定有机物元素组成的方法,A错误;
B.范托夫提出了碳价四面体学说,凯库勒提出了苯的分子结构,B错误;
C.从A选项的分析中可知,有机化学概念是由贝采利乌斯在1806年最早提出,C错误;
D.德国化学家维勒用氰酸铵合成尿素,最早用人工方法将无机物转变为有机物,D正确;
故选D。
12.C
A.Ⅰ和Ⅱ在某些性质上有所不同,但它们有着相同的官能团,化学性质相似,故A错误;
B.根据其结构可知,结构不对称,两种分子都是极性分子,故B错误;
C.根据其结构可知,Ⅰ和Ⅱ具有完全相同的组成和原子排列,故C正确;
D.Ⅰ和Ⅱ互为对映异构体,所含化学键的种类与数目是相同的,故D错误。
答案选C。
13.8
根据该物质的结构简式可知,分子属于中心对称,存在8种不同化学环境的C()。
14. 4 3 2 饱和 不饱和 不饱和 四面体 平面 直线 四面体 平面 直线
【解析】略
15. “头碰头” “肩并肩” 大 小 轴对称 镜面对称 轨道重叠程度较大,强度较大,较牢固 轨道重叠程度较小,不如σ键牢固,易断裂 可绕键轴旋转而不破坏化学键 不能绕键轴旋转 取代反应 加成反应 一般情况下,有机化合物中的单键是σ键;双键中含有一个σ键和一个π键;三键中含有一个σ键和两个π键
根据σ键、π键的形成及结构特点可知,答案为:
σ键 π键
轨道重叠方式 “头碰头” “肩并肩”
轨道重叠程度 大 小
对称类型 轴对称 镜面对称
键的强度 轨道重叠程度较大,强度较大,较牢固 轨道重叠程度较小,不如σ键牢固,易断裂
旋转情况 可绕键轴旋转而不破坏化学键 可绕键轴旋转而不破坏化学键
与反应类型的关系 取代反应 加成反应
成键规律 一般情况下,有机化合物中的单键是σ键;双键中含有一个σ键和一个π键;三键中含有一个σ键和两个π键
16. 浓硫酸 吸收生成的水 吸收生成的二氧化碳 C2H4O CH3CHO 吸收空气中的二氧化碳和水蒸气
实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O),E用来吸收二氧化碳,测定生成二氧化碳的质量,D用来吸收水,测定生成水的质量,B用于干燥通入E中的氧气、A用来制取反应所需的氧气、C是在电炉加热时用纯氧气氧化管内样品;核磁共振氢谱可以确定有机物分子中有多少种氢原子,以及不同环境氢原子的个数比;据此解答。
(1)A中生成氧气中由水蒸气,会干扰实验测定,因此B中应加浓硫酸吸收氧气中水蒸气或干燥氧气,故答案为:浓硫酸;
(2)实验需测定生成的CO2和H2O的质量,无水氯化钙用于吸收生成的水测定水的质量,碱石灰用于吸收二氧化碳,确定其质量,故答案为:吸收生成的水;吸收生成的二氧化碳;
(3)D管增重的质量为水的质量,所以n(H2O)==0.02mol,所以有机物中n(H)=0.04mol,E管增重的质量为二氧化碳的质量,所以n(CO2)==0.02mol,所以该有机物中n(C)=0.02mol,有机物中C、H元素总质量为0.04mol×1g/mol+0.02mol×12g/mol=0.28g,所以还有0.44g-0.28g=0.16g氧原子,n(O)==0.01mol,所以有机物中n(C):n(H):n(O)=0.02:0.04:0.01=2:4:1,已知该物质的相对分子质量为44,则分子式为:C2H4O;故答案为:C2H4O;
(3)若该有机物的核磁共振氢谱如图所示,峰面积之比为1:3,所以分子中含两种氢原子,且数量比为1:3,则其结构简式应为CH3CHO;故答案为:CH3CHO;
(4) E装置直接与空气接触,可能吸收空气中的水和二氧化碳,导致测得结果不准确,所以在E后再增加一个F装置,吸收空气中的二氧化碳和水蒸气。故答案为:吸收空气中的二氧化碳和水蒸气;
17. 防止a中液体暴沸 +H2O ) 除去粗产品中的硫酸 蒸馏 3 75%
由环己醇分子内脱水制环己烯,需加入浓硫酸作催化剂和吸水剂,同时加热,并需将温度迅速升至消去所需温度,防止分子内脱水成醚;为防止冷凝管因受热不均而破裂,应先通冷却水,再给蒸馏烧瓶加热,并收集苯乙烯沸点附近的馏分。
(1)液体加热时,易产生受热不均现象,所以加入碎瓷片的作用是防止a中液体暴沸;答案为:防止a中液体暴沸;
(2)a中,环己醇在浓硫酸作用下发生消去反应,生成环己烯和水,反应的化学方程式为 +H2O;答案为: +H2O;
(3)因为环己醇消去所需温度高于环己醇分子间脱水的温度,所以本实验最容易产生的有机副产物的结构简式为 。答案为: ;
(4)因为反应混合物中加入硫酸,所以用碳酸钠溶液洗涤的作用是除去粗产品中的硫酸,操作X是将产品与杂质利用沸点差异分开,所以其名称为蒸馏。答案为:除去粗产品中的硫酸;蒸馏;
(5)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中氢原子有3种,所以有3种不同化学环境的氢原子。答案为:3;
②本实验中, +H2O,则10.0g环己醇的物质的量为=0.1mol,理论上生成环己烯的物质的量为0.1mol,质量为8.2g,所得环己烯的产率是=75%。答案为:75%。
【点睛】依据乙醇消去制乙烯的经验,环己醇分子内脱水的温度应高于环己醇分子间脱水的温度,所以制得的环己烯中一定混有环己醚,为减少副产物的生成,需将温度迅速升高。
18. NaOH或CuSO4溶液 洗气 NaOH溶液 分液 H2O 重结晶 CaO 蒸馏
①乙炔与NaOH或CuSO4溶液不反应,H2S与NaOH或CuSO4溶液反应,则除杂试剂为NaOH或CuSO4溶液,除杂方法为洗气;
②溴苯与NaOH溶液不反应,且互不相溶;而Br2与NaOH溶液反应,则除杂试剂为NaOH 溶液,除杂方法为分液;
③苯甲酸溶解度随温度变化较大,NaCl溶解度随温度变化较小,因此除杂试剂为H2O,除杂方法为重结晶;
④乙醇与氧化钙不反应,氧化钙与水反应生成氢氧化钙,因此除杂试剂为氧化钙;由于乙醇的沸点较低,除杂方法为蒸馏;
故正确答案为:
序号 物质 试剂 除杂方法
① 乙炔(H2S) NaOH或CuSO4溶液 洗气
② 溴苯(Br2) NaOH溶液 分液
③ 苯甲酸(NaCl) H2O 重结晶
④ 95.6%工业乙醇制无水乙醇 CaO 蒸馏
19. 46 C2H6O C2H6O CH3CH2OH CH3OCH3
(1)由A的质谱图中最大质荷比为46可知,有机物A的相对分子质量是46,故答案为:46;
(2)由二氧化碳的物质的量和水的质量可知,2.3g有机物A中碳原子的质量为0.1mol×12g/mol=1.2g,氢原子的质量为×2×1g/mol=0.3g,则有机物A中氧原子的物质的量为=0.05mol,由碳原子、氢原子和氧原子的物质的量比为0.1mol:0.3mol:0.05mol=2:6:1可知,有机物A的最简式为C2H6O,由有机物A的相对分子质量是46可知,有机物A的分子式为C2H6O,故答案为:C2H6O;C2H6O;
(3) 分子式为C2H6O的有机物可能为CH3CH2OH和CH3OCH3,由有机物A的核磁共振氢谱有3组峰,三个峰的面积之比是1:2:3可知,A的结构简式为CH3CH2OH,故答案为:CH3CH2OH;
(4) CH3CH2OH和CH3OCH3的分子式相同,结构不同,互为同分异构体,则A的同分异构体结构简式为CH3OCH3,故答案为:CH3OCH3。
20.n(H2)=0.03 mol,设X中羟基和羧基的总数为m个(m≥3)则n(X)=(0.03×2)/m=0.06/m mol,M(X)=2.04m/0.06=34m g·mol 1 m=4,M(X)=136 g·mol 1,含有3个羟基和1个羧基,相对分子质量为136。
利用X和足量金属钠反应计算羟基和羧基的总数目,其关系为2-OH~H2、H2~2-COOH,进而推理出摩尔质量最小的X。
n(H2)==0.03 mol,由于2-OH~H2、2-COOH ~H2,设X中羟基和羧基的总数为m个(m>2,且为整数),则n(X)==,34m g/mol。当m=3,M(X)=102g/mol, 羟基数目大于羧基数目,说明含有2个羟基和1个羧基,说明X分子式有4个O,碳和氢的摩尔质量=102-16×4=38g/mol,分子式为C3H2O4, 2个羟基和1个羧基就占了3个H原子,可知这个分子式不合理,m=3不成立;当m=4,M(X)=136g/mol,说明含有3个羟基和1个羧基,同上分析可知分子式为C4H8O5,该分子式合理,例如可能的结构简式为。故答案是:含有3个羟基和1个羧基,相对分子质量为136。
【点睛】注意当C原子数很少时,氢原子很多,就会不符碳原子4价键原则,即当C原子为n时,在烃的含氧衍生物中H原子最多为2n+2。
21.(1)CH2OHCH2OH
(2)汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等
(1)浓H2SO4增重10.8g,说明反应产物中含水10.8g,水的物质的量为,通过灼热的CuO充分反应后,CuO失重3.2g,失去的重量为氧化铜中氧的质量,则氧化铜中氧的物质的量为,故CO的物质的量也为0.2mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,将与氧化铜反应后的气体通入足量澄清石灰水,得到沉淀40g,沉淀的物质的量为,则有机物燃烧产生的CO2的物质的量为0.4mol-0.2mol=0.2mol,则有机物分子中,,,所以有机物的分子式为:C2H6O2,等量该有机物与9.2gNa恰好完全反应, 9.2gNa的物质的量为0.4mol,0.2mol该有机物与0.4mol钠恰好反应,说明有机物中含有2个羟基,该有机物的结构简式为CH2OHCH2OH;
(2)根据(1)可知,该有机物为乙二醇,乙二醇的用途主要有:汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等。
22. CHO C4H4O4 羧基 碳碳双键 HOOC CH=CH COOH
(1)根据各元素的质量分数确定原子个数比,进而确定实验式;
(2)根据质谱图A的相对分子质量和实验式计算分子式;
(3)根据A的红外光谱图得出A中含官能团的种类;
(4)根据A的核磁共振氢谱图中氢原子种类和等效H个数比确定结构简式。
(1)碳的质量分数是41.38%,氢的质量分数是3.45%,则氧元素质量分数是1-41.38%-3.45%=55.17%,则该物质中碳、氢、氧原子个数之比=:: =3.45:3.45:3.45=1:1:1,则该有机物的实验式为CHO;
(2)A的相对分子质量为116,A的实验式为CHO,设A的分子式为CnHnOn,则12×n+4×n+16×n=116,解得n=4,则A的分子式为C4H4O4;
(3)根据A的红外光谱图得出A中含有的2种官能团分别为:碳碳双键、羧基;
(4)根据A的核磁共振氢谱图可知有两种类型的氢原子,且等效H个数比为1:1,则A的结构简式为HOOC CH=CH COOH
一、单选题(共12题)
1.已知碳碳单键可绕键轴自由旋转,某烃的结构简式如下图所示,下列说法中正确的是
A.该物质所有原子均可共面
B.分子中至少有10个碳原子处于同一平面上
C.分子中至少有11个碳原子处于同一平面上
D.该烃与苯互为同系物
2.为测定某有机物的结构,用核磁共振仪处理后得到的核磁共振氢谱如图所示,则该有机物可能是
A. B.(CH3)4C C.CH3CH2OH D.CH3OCH3
3.下列说法正确的是
A.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈
B.苯都能与发生加成反应,说明苯的分子中含碳碳双键
C.新戊烷有一种一氯取代物
D.金属钠在加热条件下生成氧化钠
4.下列说法正确的是(均不考虑立体异构)
A.和 互为同分异构体
B.的一氯代物有7种
C.(CH3)2CHCHClCH3的同分异构体有7种
D.分子式为C4H8O2且官能团与相同的物质共有5种
5.人类对有机化学的研究经历了以下几个阶段:
①研究有机化合物组成、结构、性质和应用
②根据需要对有机化合物分子进行设计和合成
③从天然的动植物中提取、分离出一些纯净物。
这是有机化学发展的必经之路。下列按先后顺序排列的是
A.①②③ B.③②① C.③①② D.②①③
6.某苯的同系物的分子式为C11H16,经分析分子式中除含苯环外(不含其它环状结构),还含有两个“—CH3”,两个“—CH2—”、一个“”它的可能结构式有
A.2 种 B.3 种 C.4 种 D.5 种
7.下列说法正确的是
A.有和两种结构
B.分子中可能所有原子均共面
C.在碳原子数小于10的烷烃中,一氯代物不存在同分异构体的有4种
D.异戊烷有9种二氯代物
8.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。已知它的核磁共振氢谱图中共有3组峰,则该烃的结构简式是
A. B.CH3CH2CH2CH2CH3
C. D.
9.有机物M由C、H、O三种元素组成,可作为溶剂从中草药中提取青蒿素。有关M的结构信息如下:
ⅰ.M的红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰。
ⅱ.M的核磁共振氢谱(图1,两组峰面积之比为2:3)、质谱(图2)如下所示。
下列分析不正确的是
A.M不属于醇类物质 B.M的分子中含羧基和醛基
C.M的结构简式为 D.M的相对分子质量为74
10.下列物质中互为同分异构体的是
A.O2和O3 B.
C.CH3COOH和HCOOCH3 D.和
11.下列关于有机化学史的说法,正确的是
A.贝采利乌斯提出了测定有机物元素组成的方法
B.凯库勒提出了碳价四面体学说
C.李比希提出了有机化学概念
D.维勒最早用人工方法将无机物转变为有机物
12.下列关于丙氨酸的说法中,正确的是
A.Ⅰ和Ⅱ的结构和性质完全不相同
B.Ⅰ和Ⅱ呈镜面对称,都是非极性分子
C.Ⅰ和Ⅱ具有完全相同的组成和原子排列
D.Ⅰ和Ⅱ中化学键的种类与数目不完全相同
二、非选择题(共10题)
13.乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
该新药分子中有 种不同化学环境的C原子。
14.单键、双键和三键
成键类型 碳碳单键 碳碳双键 碳碳三键
表示方式 —C≡C—
成键方式 1个碳原子与周围 个原子成键 1个碳原子与周围 个原子成键 1个碳原子与周围 个原子成键
成键类型 碳碳单键 碳碳双键 碳碳三键
碳原子的饱和性
空间构型
碳原子与周围4个原子形成 结构 形成双键的碳原子以及与之相连的原子处于同一 上 形成三键的碳原子以及与之相连的原子处于同一 上
15.共价键的类型
σ键 π键
轨道重叠方式
轨道重叠程度
对称类型
键的强度
旋转情况
与反应类型的关系
成键规律
16.下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物的分子式。
请回答下列问题:
(1)B装置中试剂X可选用 。
(2)D装置中无水氯化钙的作用是 ;E装置中碱石灰的作用是 。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D装置质量增加0.36g,E装置质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为 。
(4)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3.则其结构简式为 。
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个F装置,其主要目的是 。
17.实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:
可能用到的有关数据如下:
相对分子质量 密度/(g·cm-3) 沸点/℃ 溶解性
环己醇 100 0.9618 161 微溶于水
环己烯 82 0.8102 83 难溶于水
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是 ;
(2)a中发生主要反应的化学方程式为 ;
(3)本实验最容易产生的有机副产物的结构简式为 。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(4)用碳酸钠溶液洗涤的作用是 ,操作X的名称为 。
Ⅲ.产物分析及产率计算:
(5)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有 种不同化学环境的氢原子。
②本实验所得环己烯的产率是 。
18.选用适当的试剂(写化学式)和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中。
序号 物质 试剂 除杂方法
① 乙炔(H2S)
② 溴苯(Br2)
③ 苯甲酸(NaCl)
④ 95.6%工业乙醇制无水乙醇
19.为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1molCO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1:2:3。
试回答下列问题:
(1)有机物A的相对分子质量是 ;
(2)有机物A的最简式分子式是 ,分子式是
(3)写出有机物A的结构简式: 。
(4)写出有机物A的一种同分异构体结构简式: 。
20.由C、H、O三种元素组成的链状有机化合物X,只含有羟基和羧基两种官能团,且羟基数目大于羧基数目。称取2.04 g纯净的X,与足量金属钠充分反应,生成672 mL氢气(标准状况)。请确定摩尔质量最小的X分子中羟基、羧基数目及该X的相对分子质量 (要求写出简要推理过程)。
21.0.2mol某有机物和0.4molO2在密闭容器中燃烧后,产物通过浓H2SO4后,浓H2SO4增重10.8g;通过灼热的CuO充分反应后,CuO失重3.2g;再将气体通入足量澄清石灰水,得到沉淀40g,无气体剩余。若已知等量该有机物与9.2gNa恰好完全反应,请回答:
(1)该有机物的结构简式是 。
(2)写出该有机物的一种主要用途: 。
22.某含、、三种元素的未知物,现对进行分析探究。
(1)经燃烧分析实验测定,该未知物中碳的质量分数为41.38%,氢的质量分数为3.45%,则的实验式为 。
(2)利用质谱法测定得的相对分子质量为116,则的分子式为 。
(3)的红外光谱图如下,分析该图得出中含2种官能团,官能团的名称是 、 。
(4)的核磁共振氢谱图如下,综合分析的结构简式为 。
参考答案:
1.C
A.甲基与苯环平面结构通过单键相连,甲基的C原子处于苯的H原子位置,所以处于苯环这个平面,两个苯环相连,与苯环相连的碳原子处于另一个苯的H原子位置,也处于另一个苯环这个平面,如图所示(已编号)的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,所有原子不可能共面,A错误;
B.由A分析可知,分子中至少有11个碳原子处于同一平面上,B错误;
C.由A分析可知,分子中至少有11个碳原子处于同一平面上,C正确;
D.该有机物含有2个苯环,不是苯的同系物,D错误;
故选C。
2.A
A.由核磁共振氢谱可知,该有机物中有两种氢原子,个数比为,选项A符合题意;
B.的核磁共振氢谱有1组峰,选项B不符合题意;
C.的核磁共振氢谱有3组峰,选项C不符合题意;
D.的核磁共振氢谱有1组峰,选项D不符合题意;
答案选A。
3.C
A.乙醇与Na反应比水与Na反应更缓和,因乙醇中羟基H不如水中H活泼,故A错误;
B.苯分子中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键,故B错误;
C.新戊烷(C(CH3)4)中有1种H原子,其一氯代物有1种,故C正确;
D.金属钠在加热条件下生成过氧化钠,故D错误;
故选C。
4.C
A.的分子式为C10H14O,的分子式为C10H16O,不是同分异构体,A错误;
B.的一氯代物有苯环上4种、苯环上甲基1种、丙醇基上两甲基算1种,共6种,B错误;
C.(CH3)2CHCHClCH3的同分异构体,即戊烷的一氯取代,有碳链异构正、异、新三种,正戊烷的一氯取代有3种,异戊烷的一氯取代有4种,新戊烷的一氯取代有1种,故(CH3)2CHCHClCH3的同分异构体有7种,C正确;
D.具有的官能团是酯基,分子式为C4H8O2的同分异构体有、、、,共4种,D错误;
故答案选择C。
5.C
研究有机物首先要从天然植物中提取分离,再研究有机物的组成、结构和性质,再根据需要对有机物进行设计和合成,所以顺序为③①②。
故选:C。
6.C
计算该分子的不饱和度为,含有苯环那么其不再含有其他不饱和键。已知还含有两个“—CH3”,两个“—CH2—”、一个“”,苯环为一取代。若-CH2-不与甲基相连,若一个-CH2-与一个-CH3相连为,若两个-CH2-与两个-CH3为,共有4种。
故选C。
7.C
A.有机物CF2Cl2是四面体结构,不是平面构型,故 和是同一种结构,A错误;
B.中含有C原子周围连接4个单键的结构,则不可能所有原子均共面,B错误;
C.在碳原子数小于10的烷烃中,一氯代物不存在同分异构体,说明该烷烃只有一种等效氢,符合条件的为甲烷、乙烷、2,2-二甲基丙烷、2,2,3,3-四甲基丁烷,共4种,C正确;
D.异戊烷二氯代物为(CH3)2CHCH2CHCl2、(CH3)2CHCHClCH2Cl、(CH3)2CClCH2CH2Cl、CH2ClCH(CH3)CH2CH2Cl、(CH3)2CHCCl2CH3、(CH3)2CClCHClCH3、CH2ClCH(CH3)CHClCH3、CH2ClC(CH3)ClCH2CH3、CHCl2CH(CH3)CH2CH3、(CH2Cl)2CHCH2CH3,共有10种,D错误;
故选C。
8.B
1mol该烃燃烧需氧气179.2L(标准状况),即,由核磁共振氢谱可知,该烃有3种不同化学环境的氢原子,据此分析:
A.该烃的分子式为C6H14,1mol C6H14的耗氧量为9.5mol,A错误;
B.CH3CH2CH2CH2CH3有3种等效氢原子,分子式为C5H12,1mol C5H12耗氧量为8mol,B正确;
C.该烃有4种不同化学环境的氢原子,C错误;
D.该烃有2种不同化学环境的氢原子,D错误;
故选B。
9.B
由图2可知有机物M的相对分子质量为74;M的红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰,则M为醚类,饱和一元醚的结构通式为CnH2n+2O,则12n+2n+2+16=74,n=4,则分子式为C4H10O;又M的核磁共振氢谱(图1,两组峰面积之比为2:3),则M的结构简式为CH3CH2OCH2CH3。
A.根据分析,M为醚类,M不属于醇类物质,A正确;
B.M的分子中含醚键,B错误;
C.M的结构简式为CH3CH2OCH2CH3,C正确;
D.M的相对分子质量为74,D正确;
故选B。
10.C
A.O2和O3是由氧元素形成的性质不同的单质,二者互为同素异形体,A错误;
B.根据甲烷的正四面体结构判断,图示结构表示同一种物质,B错误;
C.CH3COOH和HCOOCH3分子式均为C2H4O2,结构不同,二者互为同分异构体,C正确;
D.2-甲基丙烷和2-甲基丁烷结构相似,分子组成相差1个CH2原子团,二者互为同系物,D错误。
故选C。
11.D
A.贝采利乌斯在1806年最早提出“有机化学”这个名称,李比希最早提出了测定有机物元素组成的方法,A错误;
B.范托夫提出了碳价四面体学说,凯库勒提出了苯的分子结构,B错误;
C.从A选项的分析中可知,有机化学概念是由贝采利乌斯在1806年最早提出,C错误;
D.德国化学家维勒用氰酸铵合成尿素,最早用人工方法将无机物转变为有机物,D正确;
故选D。
12.C
A.Ⅰ和Ⅱ在某些性质上有所不同,但它们有着相同的官能团,化学性质相似,故A错误;
B.根据其结构可知,结构不对称,两种分子都是极性分子,故B错误;
C.根据其结构可知,Ⅰ和Ⅱ具有完全相同的组成和原子排列,故C正确;
D.Ⅰ和Ⅱ互为对映异构体,所含化学键的种类与数目是相同的,故D错误。
答案选C。
13.8
根据该物质的结构简式可知,分子属于中心对称,存在8种不同化学环境的C()。
14. 4 3 2 饱和 不饱和 不饱和 四面体 平面 直线 四面体 平面 直线
【解析】略
15. “头碰头” “肩并肩” 大 小 轴对称 镜面对称 轨道重叠程度较大,强度较大,较牢固 轨道重叠程度较小,不如σ键牢固,易断裂 可绕键轴旋转而不破坏化学键 不能绕键轴旋转 取代反应 加成反应 一般情况下,有机化合物中的单键是σ键;双键中含有一个σ键和一个π键;三键中含有一个σ键和两个π键
根据σ键、π键的形成及结构特点可知,答案为:
σ键 π键
轨道重叠方式 “头碰头” “肩并肩”
轨道重叠程度 大 小
对称类型 轴对称 镜面对称
键的强度 轨道重叠程度较大,强度较大,较牢固 轨道重叠程度较小,不如σ键牢固,易断裂
旋转情况 可绕键轴旋转而不破坏化学键 可绕键轴旋转而不破坏化学键
与反应类型的关系 取代反应 加成反应
成键规律 一般情况下,有机化合物中的单键是σ键;双键中含有一个σ键和一个π键;三键中含有一个σ键和两个π键
16. 浓硫酸 吸收生成的水 吸收生成的二氧化碳 C2H4O CH3CHO 吸收空气中的二氧化碳和水蒸气
实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O),E用来吸收二氧化碳,测定生成二氧化碳的质量,D用来吸收水,测定生成水的质量,B用于干燥通入E中的氧气、A用来制取反应所需的氧气、C是在电炉加热时用纯氧气氧化管内样品;核磁共振氢谱可以确定有机物分子中有多少种氢原子,以及不同环境氢原子的个数比;据此解答。
(1)A中生成氧气中由水蒸气,会干扰实验测定,因此B中应加浓硫酸吸收氧气中水蒸气或干燥氧气,故答案为:浓硫酸;
(2)实验需测定生成的CO2和H2O的质量,无水氯化钙用于吸收生成的水测定水的质量,碱石灰用于吸收二氧化碳,确定其质量,故答案为:吸收生成的水;吸收生成的二氧化碳;
(3)D管增重的质量为水的质量,所以n(H2O)==0.02mol,所以有机物中n(H)=0.04mol,E管增重的质量为二氧化碳的质量,所以n(CO2)==0.02mol,所以该有机物中n(C)=0.02mol,有机物中C、H元素总质量为0.04mol×1g/mol+0.02mol×12g/mol=0.28g,所以还有0.44g-0.28g=0.16g氧原子,n(O)==0.01mol,所以有机物中n(C):n(H):n(O)=0.02:0.04:0.01=2:4:1,已知该物质的相对分子质量为44,则分子式为:C2H4O;故答案为:C2H4O;
(3)若该有机物的核磁共振氢谱如图所示,峰面积之比为1:3,所以分子中含两种氢原子,且数量比为1:3,则其结构简式应为CH3CHO;故答案为:CH3CHO;
(4) E装置直接与空气接触,可能吸收空气中的水和二氧化碳,导致测得结果不准确,所以在E后再增加一个F装置,吸收空气中的二氧化碳和水蒸气。故答案为:吸收空气中的二氧化碳和水蒸气;
17. 防止a中液体暴沸 +H2O ) 除去粗产品中的硫酸 蒸馏 3 75%
由环己醇分子内脱水制环己烯,需加入浓硫酸作催化剂和吸水剂,同时加热,并需将温度迅速升至消去所需温度,防止分子内脱水成醚;为防止冷凝管因受热不均而破裂,应先通冷却水,再给蒸馏烧瓶加热,并收集苯乙烯沸点附近的馏分。
(1)液体加热时,易产生受热不均现象,所以加入碎瓷片的作用是防止a中液体暴沸;答案为:防止a中液体暴沸;
(2)a中,环己醇在浓硫酸作用下发生消去反应,生成环己烯和水,反应的化学方程式为 +H2O;答案为: +H2O;
(3)因为环己醇消去所需温度高于环己醇分子间脱水的温度,所以本实验最容易产生的有机副产物的结构简式为 。答案为: ;
(4)因为反应混合物中加入硫酸,所以用碳酸钠溶液洗涤的作用是除去粗产品中的硫酸,操作X是将产品与杂质利用沸点差异分开,所以其名称为蒸馏。答案为:除去粗产品中的硫酸;蒸馏;
(5)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中氢原子有3种,所以有3种不同化学环境的氢原子。答案为:3;
②本实验中, +H2O,则10.0g环己醇的物质的量为=0.1mol,理论上生成环己烯的物质的量为0.1mol,质量为8.2g,所得环己烯的产率是=75%。答案为:75%。
【点睛】依据乙醇消去制乙烯的经验,环己醇分子内脱水的温度应高于环己醇分子间脱水的温度,所以制得的环己烯中一定混有环己醚,为减少副产物的生成,需将温度迅速升高。
18. NaOH或CuSO4溶液 洗气 NaOH溶液 分液 H2O 重结晶 CaO 蒸馏
①乙炔与NaOH或CuSO4溶液不反应,H2S与NaOH或CuSO4溶液反应,则除杂试剂为NaOH或CuSO4溶液,除杂方法为洗气;
②溴苯与NaOH溶液不反应,且互不相溶;而Br2与NaOH溶液反应,则除杂试剂为NaOH 溶液,除杂方法为分液;
③苯甲酸溶解度随温度变化较大,NaCl溶解度随温度变化较小,因此除杂试剂为H2O,除杂方法为重结晶;
④乙醇与氧化钙不反应,氧化钙与水反应生成氢氧化钙,因此除杂试剂为氧化钙;由于乙醇的沸点较低,除杂方法为蒸馏;
故正确答案为:
序号 物质 试剂 除杂方法
① 乙炔(H2S) NaOH或CuSO4溶液 洗气
② 溴苯(Br2) NaOH溶液 分液
③ 苯甲酸(NaCl) H2O 重结晶
④ 95.6%工业乙醇制无水乙醇 CaO 蒸馏
19. 46 C2H6O C2H6O CH3CH2OH CH3OCH3
(1)由A的质谱图中最大质荷比为46可知,有机物A的相对分子质量是46,故答案为:46;
(2)由二氧化碳的物质的量和水的质量可知,2.3g有机物A中碳原子的质量为0.1mol×12g/mol=1.2g,氢原子的质量为×2×1g/mol=0.3g,则有机物A中氧原子的物质的量为=0.05mol,由碳原子、氢原子和氧原子的物质的量比为0.1mol:0.3mol:0.05mol=2:6:1可知,有机物A的最简式为C2H6O,由有机物A的相对分子质量是46可知,有机物A的分子式为C2H6O,故答案为:C2H6O;C2H6O;
(3) 分子式为C2H6O的有机物可能为CH3CH2OH和CH3OCH3,由有机物A的核磁共振氢谱有3组峰,三个峰的面积之比是1:2:3可知,A的结构简式为CH3CH2OH,故答案为:CH3CH2OH;
(4) CH3CH2OH和CH3OCH3的分子式相同,结构不同,互为同分异构体,则A的同分异构体结构简式为CH3OCH3,故答案为:CH3OCH3。
20.n(H2)=0.03 mol,设X中羟基和羧基的总数为m个(m≥3)则n(X)=(0.03×2)/m=0.06/m mol,M(X)=2.04m/0.06=34m g·mol 1 m=4,M(X)=136 g·mol 1,含有3个羟基和1个羧基,相对分子质量为136。
利用X和足量金属钠反应计算羟基和羧基的总数目,其关系为2-OH~H2、H2~2-COOH,进而推理出摩尔质量最小的X。
n(H2)==0.03 mol,由于2-OH~H2、2-COOH ~H2,设X中羟基和羧基的总数为m个(m>2,且为整数),则n(X)==,34m g/mol。当m=3,M(X)=102g/mol, 羟基数目大于羧基数目,说明含有2个羟基和1个羧基,说明X分子式有4个O,碳和氢的摩尔质量=102-16×4=38g/mol,分子式为C3H2O4, 2个羟基和1个羧基就占了3个H原子,可知这个分子式不合理,m=3不成立;当m=4,M(X)=136g/mol,说明含有3个羟基和1个羧基,同上分析可知分子式为C4H8O5,该分子式合理,例如可能的结构简式为。故答案是:含有3个羟基和1个羧基,相对分子质量为136。
【点睛】注意当C原子数很少时,氢原子很多,就会不符碳原子4价键原则,即当C原子为n时,在烃的含氧衍生物中H原子最多为2n+2。
21.(1)CH2OHCH2OH
(2)汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等
(1)浓H2SO4增重10.8g,说明反应产物中含水10.8g,水的物质的量为,通过灼热的CuO充分反应后,CuO失重3.2g,失去的重量为氧化铜中氧的质量,则氧化铜中氧的物质的量为,故CO的物质的量也为0.2mol,根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,将与氧化铜反应后的气体通入足量澄清石灰水,得到沉淀40g,沉淀的物质的量为,则有机物燃烧产生的CO2的物质的量为0.4mol-0.2mol=0.2mol,则有机物分子中,,,所以有机物的分子式为:C2H6O2,等量该有机物与9.2gNa恰好完全反应, 9.2gNa的物质的量为0.4mol,0.2mol该有机物与0.4mol钠恰好反应,说明有机物中含有2个羟基,该有机物的结构简式为CH2OHCH2OH;
(2)根据(1)可知,该有机物为乙二醇,乙二醇的用途主要有:汽车发动机的抗冻剂、生产聚酯纤维、合成涤纶等。
22. CHO C4H4O4 羧基 碳碳双键 HOOC CH=CH COOH
(1)根据各元素的质量分数确定原子个数比,进而确定实验式;
(2)根据质谱图A的相对分子质量和实验式计算分子式;
(3)根据A的红外光谱图得出A中含官能团的种类;
(4)根据A的核磁共振氢谱图中氢原子种类和等效H个数比确定结构简式。
(1)碳的质量分数是41.38%,氢的质量分数是3.45%,则氧元素质量分数是1-41.38%-3.45%=55.17%,则该物质中碳、氢、氧原子个数之比=:: =3.45:3.45:3.45=1:1:1,则该有机物的实验式为CHO;
(2)A的相对分子质量为116,A的实验式为CHO,设A的分子式为CnHnOn,则12×n+4×n+16×n=116,解得n=4,则A的分子式为C4H4O4;
(3)根据A的红外光谱图得出A中含有的2种官能团分别为:碳碳双键、羧基;
(4)根据A的核磁共振氢谱图可知有两种类型的氢原子,且等效H个数比为1:1,则A的结构简式为HOOC CH=CH COOH
