第3讲 酸和碱的性质研究(第2课时) 同步课件(共25张PPT内嵌视频)-2023-2024学年九年级化学第二学期同步精品课堂(沪教版上海)
文档属性
| 名称 | 第3讲 酸和碱的性质研究(第2课时) 同步课件(共25张PPT内嵌视频)-2023-2024学年九年级化学第二学期同步精品课堂(沪教版上海) |

|
|
| 格式 | pptx | ||
| 文件大小 | 184.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 00:00:00 | ||
图片预览








文档简介
(共25张PPT)
第3讲 酸和碱的性质研究(第2课时)
第五章 初识酸和碱
授课人:
第一部分
Part One
课堂导入
一、课堂导入
油烟净中含有氢氧化钠
炉具清洁剂中含有氢氧化钠
用于改良酸性土壤的熟石灰
氢氧化铝可治疗胃酸过多
人类社会不只需要酸,同样也离不开碱。你了解这些常见碱的性质吗?
一、碱的性质研究
几种碱的物理性质
【实验操作】
1.观察固体氢氧化钠、氢氧化钙、氢氧化铁、氢氧化铜和氨水的颜色及气味。
2.各取少量固体放入小烧杯中,露置在空气中2min左右,观察它们的表面有什么变化。然后在小烧杯中加适量水,搅拌,观察固体是否会溶解,并感受溶液温度的变化。
一、碱的性质研究
氢氧化钠(NaOH)
一、碱的性质研究
氢氧化钙[Ca(OH)2]
一、碱的性质研究
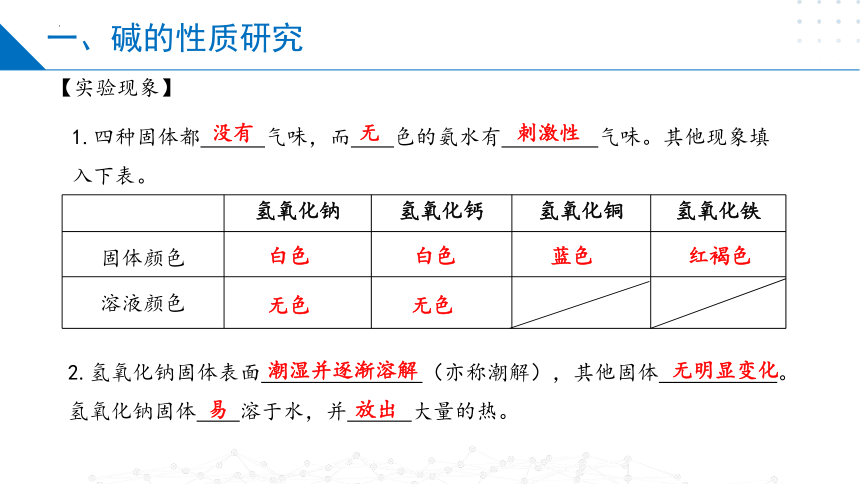
1.四种固体都 气味,而 色的氨水有 气味。其他现象填入下表。
没有
无
刺激性
【实验现象】
氢氧化钠 氢氧化钙 氢氧化铜 氢氧化铁
固体颜色
溶液颜色
白色
白色
蓝色
红褐色
无色
2.氢氧化钠固体表面 (亦称潮解),其他固体 。氢氧化钠固体 溶于水,并 大量的热。
潮湿并逐渐溶解
无明显变化
易
放出
无色
一、碱的性质研究
【总结】碱的物理性质
·氢氧化钠[NaOH]、氢氧化钙[Ca(OH)2]和氨水[NH3·H2O]是可溶性碱,氢氧化铁[Fe(OH)3]、氢氧化铜[Cu(OH)2]是难溶性碱,其中氨水有刺激性气味。
·氢氧化钠和氢氧化钙都是白色固体,氢氧化铜为蓝色固体,氢氧化铁是红褐色固体。
·氢氧化钠固体易潮解。
一、碱的性质研究
我们前面学过哪些碱的化学性质了呢?
酚酞遇碱变红
石蕊遇碱变蓝
无色酚酞
紫石色蕊
NaOH+HCl=NaCl+H2O
一、碱的性质研究
除此之外,碱还能与二氧化碳反应:
Ca(OH)2+CO2 =CaCO3↓ +H2O
检验二氧化碳
CO2+2NaOH=Na2CO3+H2O
吸收二氧化碳
在氢氧化钠溶液中通入二氧化碳气体有什么现象?
如何证明二者发生了反应?
一、碱的性质研究
学生实验
氨氧化钠溶液与二氧化碳气体的反应
【实验操作】
1.在盛有少量氢氧化钠溶液的试管中,通过导管吹入二氧化碳气体。
2.如右图所示,集气瓶中充满二氧化碳气体。瓶口的双孔塞中,一孔插连小气球的导管,另一孔插胶头滴管。胶头滴管中盛有氢氧化钠溶液。塞紧双孔塞,把胶头滴管中的氢氧化钠溶液滴入集气瓶中,振荡。
一、碱的性质研究
一、碱的性质研究
【实验现象】
集气瓶中的小气球逐渐膨胀。
【实验结论】
氢氧化钠溶液与二氧化碳气体发生了化学反应。
【原理分析】
二氧化碳与氢氧化钠反应后,集气瓶中气体压强明显减小,空气通过导管进入小气球而使小气球体积变大。
CO2 + 2NaOH = Na2CO3 + H2O
思考:
除了CO2,碱还能与其他氧化物发生反应吗
一、碱的性质研究
除了CO2之外,氢氧化钠还能与二氧化硫反应生成亚硫酸钠和水,其反应的化学方程式为:
2NaOH + SO2 === Na2SO3 + H2O
亚硫酸钠
像二氧化碳、二氧化硫等能与碱反应生成盐和水的氧化物称为酸性氧化物。
非金属氧化物大多数是酸性氧化物。
一、碱的性质研究
固体氢氧化钠长时间露置在空气中,可能会发生哪些变化 你认为固体氢氧化钠应怎样保存
思考:
氢氧化钠在空气中因吸收水分而潮解,除此之外还能与二氧化碳发生反应:
所以,氢氧化钠必须密封保存。
CO2 + 2NaOH = Na2CO3 + H2O
一、碱的性质研究
由于碱溶液中都有OH-,因此它们具有相似的化学性质。
(2)碱与某些非金属氧化物反应
碱 + 非金属氧化物→金属化合物+ 水
如:2NaOH + CO2 ==== Na2CO3 + H2O
Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
(1)碱与酸碱指示剂的作用。
紫色石蕊溶液遇到碱溶液变蓝色;
无色酚酞溶液遇到碱溶液变红色。
小结:碱的通性
一、碱的性质研究
(3)与酸反应(中和反应)
碱 + 酸 → 盐 + 水
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O;
(4)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
CuSO4 +Ca(OH)2 =Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
一、碱的性质研究
拓展视野
什么是酸 什么是碱 人们对它们的认识是一个不断完善的过程。
17世纪前,人们凭感官的感受来判断酸和碱:酸是指有酸味的物质,碱是指有涩味、有滑腻感的物质。17世纪末,英国科学家波义耳提出:凡能溶解金属并使石蕊试液变红的溶液称为酸。
18世纪,法国科学家拉瓦锡提出:非金属氧化物溶于水就是酸,金属氧化物溶于水就是碱。直至1883年,瑞典化学家阿伦尼乌斯创立了电离学说,规定电离时所产生的阳离子全部是氢离子的化合物是酸,电离时所产生的阴离子全部是氢氧根离子的化合物是碱。
随着科学的发展,科学家又提出各种新的酸碱理论。
酸碱理论的发展史
一、碱的性质研究
氢氧化钠用途
制取肥皂
石油
去除油污
造纸
干燥剂
NaOH有吸水性可以做干燥剂,干燥H2、O2、NH3等气体(不能干燥CO2、SO2等)
氢氧化钠与油脂发生反应
一、碱的性质研究
探究与实践
用PH试纸逐个测试白醋、柠檬汁、洗发液、护发素、石灰水、玻璃洗涤剂、脱排油烟机清洗剂的pH,将检测结果填在下表中:
实验对象 PH 实验对象 PH
白醋 石灰水
柠檬汁 玻璃洗涤剂
洗发液 脱排油烟机清洗剂
护发素
一、碱的性质研究
一、碱的性质研究
探究与实践
用PH试纸逐个测试白醋、柠檬汁、洗发液、护发素、石灰水、玻璃洗涤剂、脱排油烟机清洗剂的pH,将检测结果填在下表中:
实验对象 PH 实验对象 PH
白醋 石灰水
柠檬汁 玻璃洗涤剂
洗发液 脱排油烟机清洗剂
护发素
3
2
5
6
8
9
12
1.氢氧化钠是白色固体,将氢氧化钠露置在空气中容易吸收水分,表面___________并逐渐__________,这种现象叫__________。由于氢氧化钠固体具有吸水性,故常用作某些气体的________________。
2.氢氧化钙俗称___________或____________,由_________和______反应得到,化学方程式为___________________________________。
检验CO2气体的试剂是__________________________。
典例分析
潮湿
溶解
潮解
干燥剂
熟石灰
消石灰
生石灰
水
CaO+H2O===Ca(OH)2
澄清的石灰水
3.下列各氧化物中,属于酸性氧化物的是( )
A.氧化镁 B. 水
C.氧化铜 D.二氧化硫
4. 氢氧化钠不能用于( )
A. 干燥潮湿的氧气 B.吸收工业尾气中的二氧化硫
C.中和盐酸的酸性 D. 除去铁钉表面的铁锈
D
典例分析
D
5.能够将氢氧化钠溶液和澄清石灰水区别开的方法是( )
A.观察颜色 B.滴加酚酞溶液
C.滴加石蕊溶液 D.通入二氧化碳
6.在盛放氢氧化钠溶液试剂的瓶口上出现了一层白色的固体物质,它的主要成分是( )
A.NaOH晶体 B.Na2SO4晶体
C.CaCO3粉未 D.碳酸钠晶体
D
典例分析
D
第3讲 酸和碱的性质研究(第2课时)
第五章 初识酸和碱
授课人:
第一部分
Part One
课堂导入
一、课堂导入
油烟净中含有氢氧化钠
炉具清洁剂中含有氢氧化钠
用于改良酸性土壤的熟石灰
氢氧化铝可治疗胃酸过多
人类社会不只需要酸,同样也离不开碱。你了解这些常见碱的性质吗?
一、碱的性质研究
几种碱的物理性质
【实验操作】
1.观察固体氢氧化钠、氢氧化钙、氢氧化铁、氢氧化铜和氨水的颜色及气味。
2.各取少量固体放入小烧杯中,露置在空气中2min左右,观察它们的表面有什么变化。然后在小烧杯中加适量水,搅拌,观察固体是否会溶解,并感受溶液温度的变化。
一、碱的性质研究
氢氧化钠(NaOH)
一、碱的性质研究
氢氧化钙[Ca(OH)2]
一、碱的性质研究
1.四种固体都 气味,而 色的氨水有 气味。其他现象填入下表。
没有
无
刺激性
【实验现象】
氢氧化钠 氢氧化钙 氢氧化铜 氢氧化铁
固体颜色
溶液颜色
白色
白色
蓝色
红褐色
无色
2.氢氧化钠固体表面 (亦称潮解),其他固体 。氢氧化钠固体 溶于水,并 大量的热。
潮湿并逐渐溶解
无明显变化
易
放出
无色
一、碱的性质研究
【总结】碱的物理性质
·氢氧化钠[NaOH]、氢氧化钙[Ca(OH)2]和氨水[NH3·H2O]是可溶性碱,氢氧化铁[Fe(OH)3]、氢氧化铜[Cu(OH)2]是难溶性碱,其中氨水有刺激性气味。
·氢氧化钠和氢氧化钙都是白色固体,氢氧化铜为蓝色固体,氢氧化铁是红褐色固体。
·氢氧化钠固体易潮解。
一、碱的性质研究
我们前面学过哪些碱的化学性质了呢?
酚酞遇碱变红
石蕊遇碱变蓝
无色酚酞
紫石色蕊
NaOH+HCl=NaCl+H2O
一、碱的性质研究
除此之外,碱还能与二氧化碳反应:
Ca(OH)2+CO2 =CaCO3↓ +H2O
检验二氧化碳
CO2+2NaOH=Na2CO3+H2O
吸收二氧化碳
在氢氧化钠溶液中通入二氧化碳气体有什么现象?
如何证明二者发生了反应?
一、碱的性质研究
学生实验
氨氧化钠溶液与二氧化碳气体的反应
【实验操作】
1.在盛有少量氢氧化钠溶液的试管中,通过导管吹入二氧化碳气体。
2.如右图所示,集气瓶中充满二氧化碳气体。瓶口的双孔塞中,一孔插连小气球的导管,另一孔插胶头滴管。胶头滴管中盛有氢氧化钠溶液。塞紧双孔塞,把胶头滴管中的氢氧化钠溶液滴入集气瓶中,振荡。
一、碱的性质研究
一、碱的性质研究
【实验现象】
集气瓶中的小气球逐渐膨胀。
【实验结论】
氢氧化钠溶液与二氧化碳气体发生了化学反应。
【原理分析】
二氧化碳与氢氧化钠反应后,集气瓶中气体压强明显减小,空气通过导管进入小气球而使小气球体积变大。
CO2 + 2NaOH = Na2CO3 + H2O
思考:
除了CO2,碱还能与其他氧化物发生反应吗
一、碱的性质研究
除了CO2之外,氢氧化钠还能与二氧化硫反应生成亚硫酸钠和水,其反应的化学方程式为:
2NaOH + SO2 === Na2SO3 + H2O
亚硫酸钠
像二氧化碳、二氧化硫等能与碱反应生成盐和水的氧化物称为酸性氧化物。
非金属氧化物大多数是酸性氧化物。
一、碱的性质研究
固体氢氧化钠长时间露置在空气中,可能会发生哪些变化 你认为固体氢氧化钠应怎样保存
思考:
氢氧化钠在空气中因吸收水分而潮解,除此之外还能与二氧化碳发生反应:
所以,氢氧化钠必须密封保存。
CO2 + 2NaOH = Na2CO3 + H2O
一、碱的性质研究
由于碱溶液中都有OH-,因此它们具有相似的化学性质。
(2)碱与某些非金属氧化物反应
碱 + 非金属氧化物→金属化合物+ 水
如:2NaOH + CO2 ==== Na2CO3 + H2O
Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
(1)碱与酸碱指示剂的作用。
紫色石蕊溶液遇到碱溶液变蓝色;
无色酚酞溶液遇到碱溶液变红色。
小结:碱的通性
一、碱的性质研究
(3)与酸反应(中和反应)
碱 + 酸 → 盐 + 水
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O;
(4)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
CuSO4 +Ca(OH)2 =Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Ca(OH)2 + Na2CO3==2NaOH + CaCO3↓
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
一、碱的性质研究
拓展视野
什么是酸 什么是碱 人们对它们的认识是一个不断完善的过程。
17世纪前,人们凭感官的感受来判断酸和碱:酸是指有酸味的物质,碱是指有涩味、有滑腻感的物质。17世纪末,英国科学家波义耳提出:凡能溶解金属并使石蕊试液变红的溶液称为酸。
18世纪,法国科学家拉瓦锡提出:非金属氧化物溶于水就是酸,金属氧化物溶于水就是碱。直至1883年,瑞典化学家阿伦尼乌斯创立了电离学说,规定电离时所产生的阳离子全部是氢离子的化合物是酸,电离时所产生的阴离子全部是氢氧根离子的化合物是碱。
随着科学的发展,科学家又提出各种新的酸碱理论。
酸碱理论的发展史
一、碱的性质研究
氢氧化钠用途
制取肥皂
石油
去除油污
造纸
干燥剂
NaOH有吸水性可以做干燥剂,干燥H2、O2、NH3等气体(不能干燥CO2、SO2等)
氢氧化钠与油脂发生反应
一、碱的性质研究
探究与实践
用PH试纸逐个测试白醋、柠檬汁、洗发液、护发素、石灰水、玻璃洗涤剂、脱排油烟机清洗剂的pH,将检测结果填在下表中:
实验对象 PH 实验对象 PH
白醋 石灰水
柠檬汁 玻璃洗涤剂
洗发液 脱排油烟机清洗剂
护发素
一、碱的性质研究
一、碱的性质研究
探究与实践
用PH试纸逐个测试白醋、柠檬汁、洗发液、护发素、石灰水、玻璃洗涤剂、脱排油烟机清洗剂的pH,将检测结果填在下表中:
实验对象 PH 实验对象 PH
白醋 石灰水
柠檬汁 玻璃洗涤剂
洗发液 脱排油烟机清洗剂
护发素
3
2
5
6
8
9
12
1.氢氧化钠是白色固体,将氢氧化钠露置在空气中容易吸收水分,表面___________并逐渐__________,这种现象叫__________。由于氢氧化钠固体具有吸水性,故常用作某些气体的________________。
2.氢氧化钙俗称___________或____________,由_________和______反应得到,化学方程式为___________________________________。
检验CO2气体的试剂是__________________________。
典例分析
潮湿
溶解
潮解
干燥剂
熟石灰
消石灰
生石灰
水
CaO+H2O===Ca(OH)2
澄清的石灰水
3.下列各氧化物中,属于酸性氧化物的是( )
A.氧化镁 B. 水
C.氧化铜 D.二氧化硫
4. 氢氧化钠不能用于( )
A. 干燥潮湿的氧气 B.吸收工业尾气中的二氧化硫
C.中和盐酸的酸性 D. 除去铁钉表面的铁锈
D
典例分析
D
5.能够将氢氧化钠溶液和澄清石灰水区别开的方法是( )
A.观察颜色 B.滴加酚酞溶液
C.滴加石蕊溶液 D.通入二氧化碳
6.在盛放氢氧化钠溶液试剂的瓶口上出现了一层白色的固体物质,它的主要成分是( )
A.NaOH晶体 B.Na2SO4晶体
C.CaCO3粉未 D.碳酸钠晶体
D
典例分析
D
