化学人教版(2019)必修第一册3.2金属材料(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2金属材料(共16张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 56.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 10:12:33 | ||
图片预览




文档简介
(共16张PPT)
第二节 金属材料
铝合金锅
钛合金羽毛球拍
镍合金门锁
钢铁材料
铂合金首饰
钠钾合金
金属材料:包括纯金属和它们的合金。
在生产生活中,多数使用合金。
一、合金
定义:由两种或两种以上金属(或金属与非金属)熔合形成的具有金属特性的物质。
性能:具有许多优良的物理、化学或机械性能;可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节合金的性能。
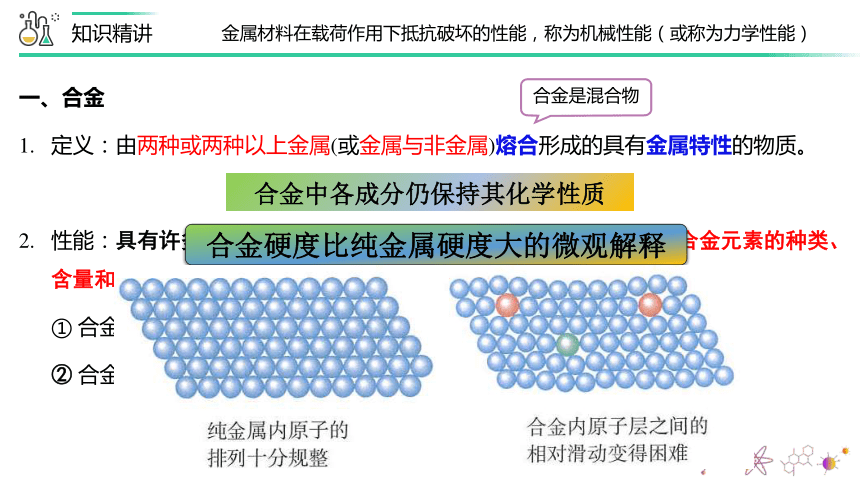
① 合金硬度一般比它的各成分金属大。
② 合金熔点比它的各成分金属低。
合金中各成分仍保持其化学性质
合金是混合物
金属材料在载荷作用下抵抗破坏的性能,称为机械性能(或称为力学性能)
合金硬度比纯金属硬度大的微观解释
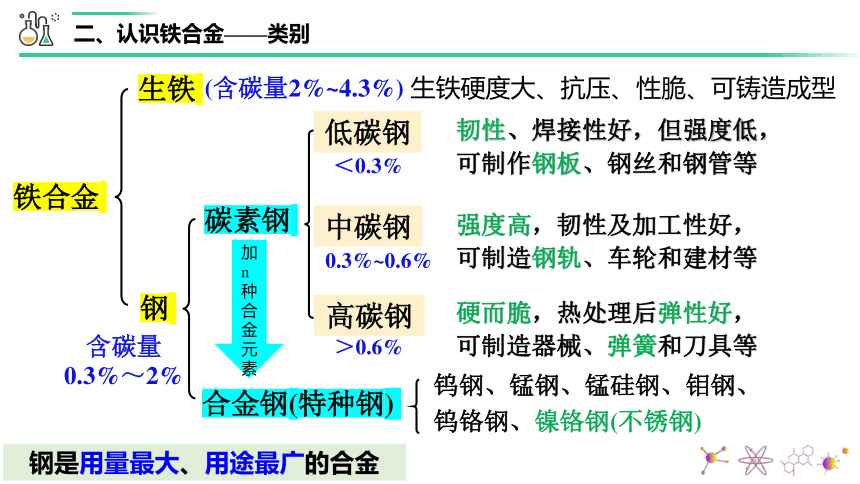
(含碳量2%~4.3%) 生铁硬度大、抗压、性脆、可铸造成型
碳素钢
生铁
钢
含碳量0.3%~2%
合金钢(特种钢)
低碳钢
中碳钢
高碳钢
钨钢、锰钢、锰硅钢、钼钢、钨铬钢、镍铬钢(不锈钢)
铁合金
韧性、焊接性好,但强度低,可制作钢板、钢丝和钢管等
强度高,韧性及加工性好,可制造钢轨、车轮和建材等
硬而脆,热处理后弹性好,可制造器械、弹簧和刀具等
<0.3%
0.3%~0.6%
>0.6%
钢是用量最大、用途最广的合金
加n种合金元素
二、认识铁合金——类别
启示
合金元素不同,其性能不同
结构决定性能,性能决定其用途
改变合金元素来开发新功能的金属材料
钢: ①含碳量越低,韧性越好,硬度越低;
②含碳量越高,韧性越差,硬度越高。
合金钢是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能。与钢铁相比,主要表现在机械强度、韧性、硬度、可塑性、耐腐蚀性等方面
不锈钢是最常见的一种合金钢,合金元素主要是铬Cr和镍Ni。通常不锈钢中含Cr 18%,含Ni8%(有的不锈钢含Cr 17%-19%,含Ni 8%-13%)。① 合金硬度一般比它的各成分金属大。
不锈钢在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力。
铬 Cr—防氧化元素
镍 Ni—防腐蚀元素
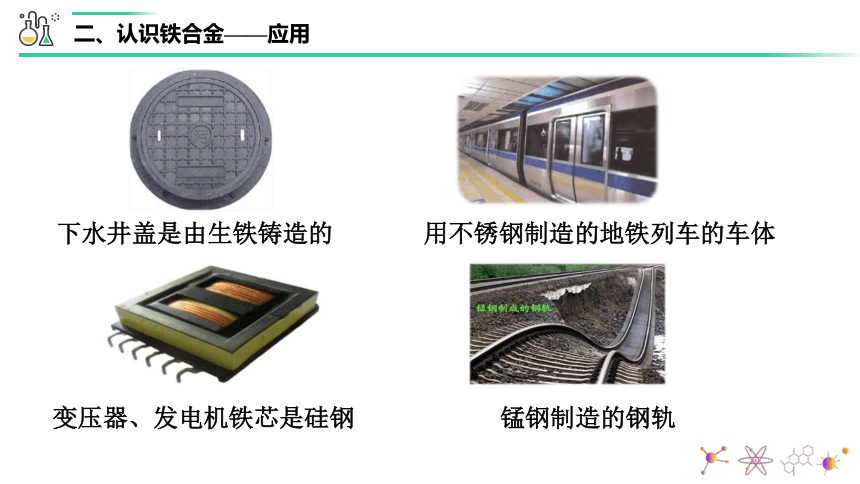
下水井盖是由生铁铸造的
用不锈钢制造的地铁列车的车体
变压器、发电机铁芯是硅钢
锰钢制造的钢轨
二、认识铁合金——应用
【练习1】下列关于合金的叙述中正确的是( )
B
A、合金是由两种或多种金属熔合而成的
B、日常生活中用到的五角硬币属于铜合金
C、合金的熔点一定比其他成分金属的熔点高
D、下水井盖是由纯铁铸造的
三、铝和铝合金
铝 ( Al ) ——地壳中含量最多的金属元素
物理性质—金属通性:固体、银白色金属光泽、良好的导电性、导热性和延展性
—金属铝个性:密度小、质软、熔点低。
化学性质: ① 微观结构 ② 氧化还原、化合价角度 ③金属活动性顺序
地壳中元素含量:O>Si>Al>Fe>Ca>Na>K>Mg>Zn
Al 的化学性质活泼,
具有较强的还原性,
可与氧化性物质反应。
Al 活动性位于H前,
可以置换酸中的H+。
铝与氧气在常温下反应,表面生成一层致密的氧化铝薄膜(起保护作用,防止进一步氧化)
铝与盐酸反应:a) 打磨的铝条不断溶解,有气泡产生
过一段时间后,将点燃的木条放在试管口,可听到轻微的爆鸣声
b) 未打磨的铝条与盐酸反应:刚开始没有气泡
2Al + 3O2 = 2Al2O3
2Al + 6HCl = 2AlCl3 + 3H2↑
2、铝的化学性质
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6H+ = 2Al3+ + 3H2↑
Al2O3 + 6H+ = 2Al3+ + 3H2O
铝、氧化铝均能与酸发生反应
铝与氢氧化钠反应
a) 打磨的铝条不断溶解,有气泡产生
将点燃的木条放在试管口,可听到轻微的爆鸣声;燃烧时发出淡蓝色火焰
b) 未打磨的铝条与氢氧化钠反应:刚开始没有气泡
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
2、铝的化学性质
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑
Al2O3 + 2OH- + 3H2O = 2[Al(OH)4]-
铝、氧化铝均能与碱发生反应
氧化铝 (Al2O3)
物理性质—致密的氧化铝薄膜。
化学性质: 两性氧化物(既能与酸反应、又能与碱反应)
铝及其化合物的相互转化
Al3+ + 3OH- = Al(OH)3↓
Al(OH)3 + OH- = [Al(OH)4]-
① AlCl3 溶液和过量氢氧化钠反应,有没有沉淀生成?
最终没有沉淀
铝和氧化铝均既能与酸反应,又能与碱反应,
所以铝制品不宜蒸煮或长时间存放酸性或碱性食物。
Al3+ + 4OH- = [Al(OH)4]-
② AlCl3 溶液和过量氨水反应,有没有沉淀生成?
Al3+ + 3NH3 H2O = Al(OH)3↓ + 3NH4+
最终有沉淀产生
Al(OH)3 是两性氢氧化物
铝合金 (硬度更大、强度更高)
铝合金是目前用途广泛的合金之一。
制取
性能
用途
密度小、强度高、塑性好、易于成型、具有较强的抗腐蚀能力等
制造炊具、门窗、飞机和宇宙飞船外壳的原料:
硬铝:向铝中加入少量的Cu、Mg、Si 、Mn、Zn及稀土元素等;铝硅合金
合金 主要成分 主要性能 主要用途
青铜 铜、锡 强度高、可塑性好、 耐磨、耐腐蚀 机械零件,如轴承、齿轮等
黄铜 铜、锌 强度高、可塑性好、 易加工、耐腐蚀 机械零件、仪表、日用品
白铜 铜、镍、锌 光泽好、耐磨、耐腐蚀、易加工 钱币、代替银做饰品
铜合金
【对应训练】下列关于铝及铝合金的叙述中,不正确的是( )
A.铝是地壳中含量最多的金属元素
B.在自然界中,既存在游离态,又存在化合态的铝
C.生活中铝制品通常是铝合金制造的,其表面有致密的氧化膜,起保护内部金
属的作用
D.纯铝硬度和强度小,硬铝(含Cu、Mg、Mn、Si等)密度小、强度高,是制造航
天设备的理想材料
B
近年来,为了满足某些尖端技术发展的需要,人们设计和合成了许多新型合金。
例如:储氢合金、钛合金、耐热合金、形状记忆合金等新型合金。
氢能是人类未来的理想能源之一,氢能的利用存在两大难题。
制取
储存
H2 是一种易燃易爆的气体
高压压缩入钢瓶,气态和液态储存,
笨重、不方便、不安全
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料,
稍稍加热又容易分解,室温下吸、放氢的速率快,可被用于大型电池等。
第二节 金属材料
铝合金锅
钛合金羽毛球拍
镍合金门锁
钢铁材料
铂合金首饰
钠钾合金
金属材料:包括纯金属和它们的合金。
在生产生活中,多数使用合金。
一、合金
定义:由两种或两种以上金属(或金属与非金属)熔合形成的具有金属特性的物质。
性能:具有许多优良的物理、化学或机械性能;可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节合金的性能。
① 合金硬度一般比它的各成分金属大。
② 合金熔点比它的各成分金属低。
合金中各成分仍保持其化学性质
合金是混合物
金属材料在载荷作用下抵抗破坏的性能,称为机械性能(或称为力学性能)
合金硬度比纯金属硬度大的微观解释
(含碳量2%~4.3%) 生铁硬度大、抗压、性脆、可铸造成型
碳素钢
生铁
钢
含碳量0.3%~2%
合金钢(特种钢)
低碳钢
中碳钢
高碳钢
钨钢、锰钢、锰硅钢、钼钢、钨铬钢、镍铬钢(不锈钢)
铁合金
韧性、焊接性好,但强度低,可制作钢板、钢丝和钢管等
强度高,韧性及加工性好,可制造钢轨、车轮和建材等
硬而脆,热处理后弹性好,可制造器械、弹簧和刀具等
<0.3%
0.3%~0.6%
>0.6%
钢是用量最大、用途最广的合金
加n种合金元素
二、认识铁合金——类别
启示
合金元素不同,其性能不同
结构决定性能,性能决定其用途
改变合金元素来开发新功能的金属材料
钢: ①含碳量越低,韧性越好,硬度越低;
②含碳量越高,韧性越差,硬度越高。
合金钢是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能。与钢铁相比,主要表现在机械强度、韧性、硬度、可塑性、耐腐蚀性等方面
不锈钢是最常见的一种合金钢,合金元素主要是铬Cr和镍Ni。通常不锈钢中含Cr 18%,含Ni8%(有的不锈钢含Cr 17%-19%,含Ni 8%-13%)。① 合金硬度一般比它的各成分金属大。
不锈钢在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力。
铬 Cr—防氧化元素
镍 Ni—防腐蚀元素
下水井盖是由生铁铸造的
用不锈钢制造的地铁列车的车体
变压器、发电机铁芯是硅钢
锰钢制造的钢轨
二、认识铁合金——应用
【练习1】下列关于合金的叙述中正确的是( )
B
A、合金是由两种或多种金属熔合而成的
B、日常生活中用到的五角硬币属于铜合金
C、合金的熔点一定比其他成分金属的熔点高
D、下水井盖是由纯铁铸造的
三、铝和铝合金
铝 ( Al ) ——地壳中含量最多的金属元素
物理性质—金属通性:固体、银白色金属光泽、良好的导电性、导热性和延展性
—金属铝个性:密度小、质软、熔点低。
化学性质: ① 微观结构 ② 氧化还原、化合价角度 ③金属活动性顺序
地壳中元素含量:O>Si>Al>Fe>Ca>Na>K>Mg>Zn
Al 的化学性质活泼,
具有较强的还原性,
可与氧化性物质反应。
Al 活动性位于H前,
可以置换酸中的H+。
铝与氧气在常温下反应,表面生成一层致密的氧化铝薄膜(起保护作用,防止进一步氧化)
铝与盐酸反应:a) 打磨的铝条不断溶解,有气泡产生
过一段时间后,将点燃的木条放在试管口,可听到轻微的爆鸣声
b) 未打磨的铝条与盐酸反应:刚开始没有气泡
2Al + 3O2 = 2Al2O3
2Al + 6HCl = 2AlCl3 + 3H2↑
2、铝的化学性质
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6H+ = 2Al3+ + 3H2↑
Al2O3 + 6H+ = 2Al3+ + 3H2O
铝、氧化铝均能与酸发生反应
铝与氢氧化钠反应
a) 打磨的铝条不断溶解,有气泡产生
将点燃的木条放在试管口,可听到轻微的爆鸣声;燃烧时发出淡蓝色火焰
b) 未打磨的铝条与氢氧化钠反应:刚开始没有气泡
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
2、铝的化学性质
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑
Al2O3 + 2OH- + 3H2O = 2[Al(OH)4]-
铝、氧化铝均能与碱发生反应
氧化铝 (Al2O3)
物理性质—致密的氧化铝薄膜。
化学性质: 两性氧化物(既能与酸反应、又能与碱反应)
铝及其化合物的相互转化
Al3+ + 3OH- = Al(OH)3↓
Al(OH)3 + OH- = [Al(OH)4]-
① AlCl3 溶液和过量氢氧化钠反应,有没有沉淀生成?
最终没有沉淀
铝和氧化铝均既能与酸反应,又能与碱反应,
所以铝制品不宜蒸煮或长时间存放酸性或碱性食物。
Al3+ + 4OH- = [Al(OH)4]-
② AlCl3 溶液和过量氨水反应,有没有沉淀生成?
Al3+ + 3NH3 H2O = Al(OH)3↓ + 3NH4+
最终有沉淀产生
Al(OH)3 是两性氢氧化物
铝合金 (硬度更大、强度更高)
铝合金是目前用途广泛的合金之一。
制取
性能
用途
密度小、强度高、塑性好、易于成型、具有较强的抗腐蚀能力等
制造炊具、门窗、飞机和宇宙飞船外壳的原料:
硬铝:向铝中加入少量的Cu、Mg、Si 、Mn、Zn及稀土元素等;铝硅合金
合金 主要成分 主要性能 主要用途
青铜 铜、锡 强度高、可塑性好、 耐磨、耐腐蚀 机械零件,如轴承、齿轮等
黄铜 铜、锌 强度高、可塑性好、 易加工、耐腐蚀 机械零件、仪表、日用品
白铜 铜、镍、锌 光泽好、耐磨、耐腐蚀、易加工 钱币、代替银做饰品
铜合金
【对应训练】下列关于铝及铝合金的叙述中,不正确的是( )
A.铝是地壳中含量最多的金属元素
B.在自然界中,既存在游离态,又存在化合态的铝
C.生活中铝制品通常是铝合金制造的,其表面有致密的氧化膜,起保护内部金
属的作用
D.纯铝硬度和强度小,硬铝(含Cu、Mg、Mn、Si等)密度小、强度高,是制造航
天设备的理想材料
B
近年来,为了满足某些尖端技术发展的需要,人们设计和合成了许多新型合金。
例如:储氢合金、钛合金、耐热合金、形状记忆合金等新型合金。
氢能是人类未来的理想能源之一,氢能的利用存在两大难题。
制取
储存
H2 是一种易燃易爆的气体
高压压缩入钢瓶,气态和液态储存,
笨重、不方便、不安全
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料,
稍稍加热又容易分解,室温下吸、放氢的速率快,可被用于大型电池等。
