福建省福州市闽侯县第一中学2023-2024学年高二上学期12月第二次月考化学试题(含答案)
文档属性
| 名称 | 福建省福州市闽侯县第一中学2023-2024学年高二上学期12月第二次月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 888.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 10:17:07 | ||
图片预览




文档简介
2023-2024学年第一学期闽侯一中第二次月考
高二化学试卷
(考试时间:75分钟 满分:100分)2023.12
第Ⅰ卷(选择题,共51分)
一、单选题(每题3分,共48分。每题只有一个选项符合题意)
1.下列有关电解质及其电离的说法正确的是( )
A.升温促进水的电离,从而使水的值减小
B.氨水导电性一定比溶液的导电性弱
C.某醋酸溶液的,说明醋酸是弱电解质
D.在水中能电离产生,故其溶液显酸性
2.下列有关物质的用途或现象与盐的水解无关的是( )
A.某雨水样品采集后放置一段时间,由4.68变为4.28
B.实验室中盛放溶液的试剂瓶不能用磨口玻璃塞
C.用饱和氯化铁溶液滴入沸水制备氢氧化铁胶体
D.浓度相同的①溶液②溶液中,大小的顺序为①>②
3.下列方程式书写正确的是( )
A.在水溶液中的电离方程式:
B.的电离方程式:
C.水解的离子方程式:
D.水解的离子方程式:
4.下列说法正确的是( )
A.用干燥的试纸来测定溶液的
B.将溶液从常温加热至80℃,溶液的变小但仍保持中性
C.滴定时,眼睛要注视滴定管中液面的变化
D.常温下,为3的醋酸与等体积为11的溶液混合,所得溶液呈中性
5.常温下,由水电离产生的与的乘积为,下列各组离子可能大量共存的是( )
A.、、、 B.、,、
C.、、、 D.、、、
6.将 (甲)、 (乙)等物质的量浓度的水溶液加水稀释,下图水电离出的与加入水的体积V的关系正确的是( )
A.a B.b C.c D.d
7.设为阿伏加德罗常数的值。下列说法正确的是( )
A.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为
B.3.2g乙烷完全燃烧断开键的数目为
C.0.1mol 和0.1mol 于密闭容器中充分反应后,分子的总数为
D.室温下,的溶液中,离子的数目为
8.在一个不导热的密闭反应器中,只发生两个反应:
; ;
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
A.等压时,通入惰性气体,的物质的量不变
B.等压时,通入气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入气体,的物质的量浓度增大
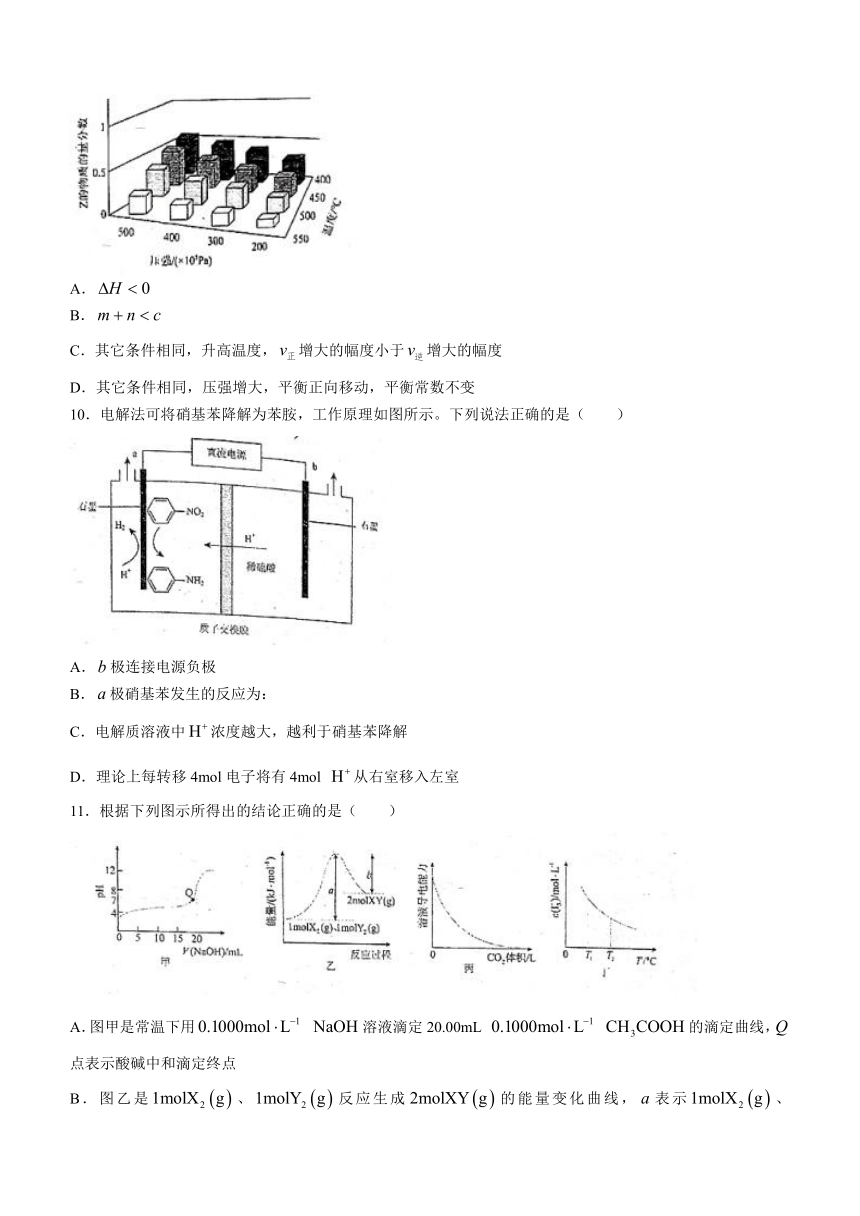
9.为探究外界条件对反应:的影响,以和的物质的量之.比为开始反应,通过实验得到不同条件下反应1达到平衡时的物质的量分数与压强及温度的关系,实验结果如图所示。下列判断不正确的是( )
A.
B.
C.其它条件相同,升高温度,增大的幅度小于增大的幅度
D.其它条件相同,压强增大,平衡正向移动,平衡常数不变
10.电解法可将硝基苯降解为苯胺,工作原理如图所示。下列说法正确的是( )
A.极连接电源负极
B.极硝基苯发生的反应为:
C.电解质溶液中浓度越大,越利于硝基苯降解
D.理论上每转移4mol电子将有4mol 从右室移入左室
11.根据下列图示所得出的结论正确的是( )
A.图甲是常温下用 溶液滴定20.00mL 的滴定曲线,点表示酸碱中和滴定终点
B.图乙是、反应生成的能量变化曲线,表示、变成气态原子过程中吸收的能量
C.图丙表示表示通入饱和溶液中,溶液导电能力的变化
D.图丁是中的平衡浓度随温度变化的曲线,说明平衡常数
12.在密闭容器中进行反应:.该反应的反应速率()随时间()变化的关系如图所示,若、时刻只改变一个条件,下列说法正确的是( )
A.在时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
B.在时,采取的措施可以是升高温度
C.在时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
D.在时,容器内的体积分数是整个过程中的最大值
13.催化生成的过程由以下三步基元反应构成:
第1步:;
第2步:;
第3步:
下列说法正确的是( )
A.第2步是总反应的决速步
B.三步基元反应都是放热反应
C.该过程共有两种中间产物
D.总反应的焓变为
14.浓度均为、体积均为的和溶液,分别加水稀释的变化如图所示。下列叙述错误的是( )
A.的碱性强于的碱性
B.的电离程度:点大于点
C.若两溶液无限稀释,则它们的相等
D.当时,若两溶液同时升高温度,则增大
15.氯化氢直接氧化法制氯气的反应是。刚性容器中,进料浓度比分别等于1:1、4:1、7:1时,平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
A.
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当进料比过低时,的转化率较低,且不利于分离和
D.若的初始浓度为,进料比为1:1时,
16.常温下,用盐酸滴定20.00mL未知浓度一元弱碱溶液,滴定曲线如图所示。下列有关说法错误的是( )
A.该一元碱溶液浓度为
B.点:
C.、、点水的电离程度逐渐增大
D.常温下,的电离常数
第Ⅱ卷(非选择题共52分)
二、填空题(本题共4小题,共52分)
17.(12分)常温下某学生用的标准溶液滴定未知浓度的醋酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴指示剂
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有错误的是______(填序号)。
(2)用标准溶液滴定时,应将标准溶液注入______中(从图中选填“甲”或“乙”)。
(3)实验中应选用______作指示剂,判断达到滴定终点的依据是______。
(4)第一次滴定前后,碱式滴定管中的液面位置如图所示,则标准溶液的实际用量为______mL。
(5)若滴定过程中出现以下情况,对结果的影响(填“偏高”、“偏低”或“无影响”)分别是:滴定前未用标准液润洗碱式滴定管。______;滴定结束后读数时俯视液面______。
(6)若上述实验是滴定未知浓度的盐酸,当两者恰好完全反应后又多滴了半滴标准溶液(一滴约为0.05mL),此时混合溶液的体积为50mL,则混合溶液的=______。
18.(16分)弱电解质有许多,如:醋酸、碳酸、氢氰酸、一水合氨等。已知:25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:25℃时,三种酸的电离平衡常数如下:
化学式
电离平衡常数
回答下列问题:
(1)的溶液中,、、、从大到小的顺序是______。
(2)相同条件下,取体积,均相同的和溶液,分别和足量的铝粉反应。生成相同体积的氢气时,用时较少的是______;最终生成氢气的体积较多的是______。
(3)25℃时,相等的三种溶液①溶液、②溶液、③溶液,浓度由大到小的顺序为______(填序号);溶液①的原因是______(用离子方程式表示)。
(4)25℃时,向溶液中通入少量,反应的离子方程式为______;
(5)将浓度为的与 溶液等体积混合,则混合溶液中______(填“>”、“<”或“=”);
(6)常温下,向浓度为、体积为的氨水中逐滴加入一定浓度的盐酸,用计测溶液的随盐酸的加入量而降低的滴定曲线,点两种溶液恰好完全反应。根据图中信息回答下列问题:
①该温度时的电离常数=______;
②比较、、三点时的溶液中,由水电离出的由大到小顺序为______;
19.按照要求回答下列问题。(11分)
(1)在强碱性条件下用电解法除去废水中的,装置如图所示,阳极和阳极区依次发生的反应有:
ⅰ.
ⅱ.
ⅲ.
除去1mol,外电路中至少需要转移______mol电子。
(2)为了使电解池连续工作,需要不断补充及______。
(3)用溶液吸收烟气中的,将所得的溶液进行电解,可循环再生,同时得到,其原理如下图所示(电极材料为石墨)。
①图中极要连接电源的______填“正”或“负”)极,口流出的物质是______。
②放电的电极反应式为______。
(4)用零价铁()去除水体中的硝酸盐()已成为环境修复研究的热点之一、还原酸性水体中的的反应原理如图所示。
①作负极的物质是______。
②正极的电极反应式是______。
20.(13分)丙酮蒸气热裂解可生产乙烯酮,反应为 ,现对该热裂解反应进行研究,回答下列问题:
化学键
键能 412 348 612
(1)根据表格中的键能数据,计算=______;
(2)在恒容绝热密闭容器中,充入丙酮蒸气,可以判断下列到达平衡状态的是______(填序号)。
A.消耗速率与生成速率相等
B.容器内密度不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
(3)丙酮的平衡转化率随温度、压强变化如图所示:
①图中表示的物理量是______:
②、两点化学平衡常数______(填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是______。
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)。
①经过时间,丙酮分解10%。用单位时间内气体分压变化表示的反应速率=______kPa/min;
②该条件平衡时丙酮分解率为,则=______(以分压表示,分压=总压×物质的量分数)。
(5)其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图所示。
①工业上选择催化剂______(填“甲”或“乙”)。
②在催化剂甲作用下,温度高于210℃时,丙酮转化率降低的原因可能是______(写一条即可)。
2023-2024学年第一学期闽侯一中第二次月考
高二化学参考答案
1 2 3 4 5 6 7 8
A A C B A D B A
9 10 11 12 13 14 15 16
B D B A C D C C
17.(12分)(1)①(2)乙
(3)酚酞,滴入最后半滴标准液时,溶液由无色变为粉红色,且半分钟不褪色
(4)26.10
(5)偏大,偏小(6)10
18.(16分)(1)
(2)、
(3)①>③>②(2分)
(4)(2分)
(5)<(2分)
(6)①(2分)②(2分)
19.(11分)(1)5(2)
(3)①负 ②(浓度较大的)硫酸 ③
(4)①铁() ②
20.(13分)(1)+84(2分)
(2)ACD(2分)
(3)①压强(1分) ②<(1分) ③升高温度(1分)
(4)①(2分) ②(2分)
(5)乙(1分) 催化剂活性降低或副反应增多等(1分)
高二化学试卷
(考试时间:75分钟 满分:100分)2023.12
第Ⅰ卷(选择题,共51分)
一、单选题(每题3分,共48分。每题只有一个选项符合题意)
1.下列有关电解质及其电离的说法正确的是( )
A.升温促进水的电离,从而使水的值减小
B.氨水导电性一定比溶液的导电性弱
C.某醋酸溶液的,说明醋酸是弱电解质
D.在水中能电离产生,故其溶液显酸性
2.下列有关物质的用途或现象与盐的水解无关的是( )
A.某雨水样品采集后放置一段时间,由4.68变为4.28
B.实验室中盛放溶液的试剂瓶不能用磨口玻璃塞
C.用饱和氯化铁溶液滴入沸水制备氢氧化铁胶体
D.浓度相同的①溶液②溶液中,大小的顺序为①>②
3.下列方程式书写正确的是( )
A.在水溶液中的电离方程式:
B.的电离方程式:
C.水解的离子方程式:
D.水解的离子方程式:
4.下列说法正确的是( )
A.用干燥的试纸来测定溶液的
B.将溶液从常温加热至80℃,溶液的变小但仍保持中性
C.滴定时,眼睛要注视滴定管中液面的变化
D.常温下,为3的醋酸与等体积为11的溶液混合,所得溶液呈中性
5.常温下,由水电离产生的与的乘积为,下列各组离子可能大量共存的是( )
A.、、、 B.、,、
C.、、、 D.、、、
6.将 (甲)、 (乙)等物质的量浓度的水溶液加水稀释,下图水电离出的与加入水的体积V的关系正确的是( )
A.a B.b C.c D.d
7.设为阿伏加德罗常数的值。下列说法正确的是( )
A.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为
B.3.2g乙烷完全燃烧断开键的数目为
C.0.1mol 和0.1mol 于密闭容器中充分反应后,分子的总数为
D.室温下,的溶液中,离子的数目为
8.在一个不导热的密闭反应器中,只发生两个反应:
; ;
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
A.等压时,通入惰性气体,的物质的量不变
B.等压时,通入气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入气体,的物质的量浓度增大
9.为探究外界条件对反应:的影响,以和的物质的量之.比为开始反应,通过实验得到不同条件下反应1达到平衡时的物质的量分数与压强及温度的关系,实验结果如图所示。下列判断不正确的是( )
A.
B.
C.其它条件相同,升高温度,增大的幅度小于增大的幅度
D.其它条件相同,压强增大,平衡正向移动,平衡常数不变
10.电解法可将硝基苯降解为苯胺,工作原理如图所示。下列说法正确的是( )
A.极连接电源负极
B.极硝基苯发生的反应为:
C.电解质溶液中浓度越大,越利于硝基苯降解
D.理论上每转移4mol电子将有4mol 从右室移入左室
11.根据下列图示所得出的结论正确的是( )
A.图甲是常温下用 溶液滴定20.00mL 的滴定曲线,点表示酸碱中和滴定终点
B.图乙是、反应生成的能量变化曲线,表示、变成气态原子过程中吸收的能量
C.图丙表示表示通入饱和溶液中,溶液导电能力的变化
D.图丁是中的平衡浓度随温度变化的曲线,说明平衡常数
12.在密闭容器中进行反应:.该反应的反应速率()随时间()变化的关系如图所示,若、时刻只改变一个条件,下列说法正确的是( )
A.在时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
B.在时,采取的措施可以是升高温度
C.在时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
D.在时,容器内的体积分数是整个过程中的最大值
13.催化生成的过程由以下三步基元反应构成:
第1步:;
第2步:;
第3步:
下列说法正确的是( )
A.第2步是总反应的决速步
B.三步基元反应都是放热反应
C.该过程共有两种中间产物
D.总反应的焓变为
14.浓度均为、体积均为的和溶液,分别加水稀释的变化如图所示。下列叙述错误的是( )
A.的碱性强于的碱性
B.的电离程度:点大于点
C.若两溶液无限稀释,则它们的相等
D.当时,若两溶液同时升高温度,则增大
15.氯化氢直接氧化法制氯气的反应是。刚性容器中,进料浓度比分别等于1:1、4:1、7:1时,平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
A.
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当进料比过低时,的转化率较低,且不利于分离和
D.若的初始浓度为,进料比为1:1时,
16.常温下,用盐酸滴定20.00mL未知浓度一元弱碱溶液,滴定曲线如图所示。下列有关说法错误的是( )
A.该一元碱溶液浓度为
B.点:
C.、、点水的电离程度逐渐增大
D.常温下,的电离常数
第Ⅱ卷(非选择题共52分)
二、填空题(本题共4小题,共52分)
17.(12分)常温下某学生用的标准溶液滴定未知浓度的醋酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴指示剂
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有错误的是______(填序号)。
(2)用标准溶液滴定时,应将标准溶液注入______中(从图中选填“甲”或“乙”)。
(3)实验中应选用______作指示剂,判断达到滴定终点的依据是______。
(4)第一次滴定前后,碱式滴定管中的液面位置如图所示,则标准溶液的实际用量为______mL。
(5)若滴定过程中出现以下情况,对结果的影响(填“偏高”、“偏低”或“无影响”)分别是:滴定前未用标准液润洗碱式滴定管。______;滴定结束后读数时俯视液面______。
(6)若上述实验是滴定未知浓度的盐酸,当两者恰好完全反应后又多滴了半滴标准溶液(一滴约为0.05mL),此时混合溶液的体积为50mL,则混合溶液的=______。
18.(16分)弱电解质有许多,如:醋酸、碳酸、氢氰酸、一水合氨等。已知:25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:25℃时,三种酸的电离平衡常数如下:
化学式
电离平衡常数
回答下列问题:
(1)的溶液中,、、、从大到小的顺序是______。
(2)相同条件下,取体积,均相同的和溶液,分别和足量的铝粉反应。生成相同体积的氢气时,用时较少的是______;最终生成氢气的体积较多的是______。
(3)25℃时,相等的三种溶液①溶液、②溶液、③溶液,浓度由大到小的顺序为______(填序号);溶液①的原因是______(用离子方程式表示)。
(4)25℃时,向溶液中通入少量,反应的离子方程式为______;
(5)将浓度为的与 溶液等体积混合,则混合溶液中______(填“>”、“<”或“=”);
(6)常温下,向浓度为、体积为的氨水中逐滴加入一定浓度的盐酸,用计测溶液的随盐酸的加入量而降低的滴定曲线,点两种溶液恰好完全反应。根据图中信息回答下列问题:
①该温度时的电离常数=______;
②比较、、三点时的溶液中,由水电离出的由大到小顺序为______;
19.按照要求回答下列问题。(11分)
(1)在强碱性条件下用电解法除去废水中的,装置如图所示,阳极和阳极区依次发生的反应有:
ⅰ.
ⅱ.
ⅲ.
除去1mol,外电路中至少需要转移______mol电子。
(2)为了使电解池连续工作,需要不断补充及______。
(3)用溶液吸收烟气中的,将所得的溶液进行电解,可循环再生,同时得到,其原理如下图所示(电极材料为石墨)。
①图中极要连接电源的______填“正”或“负”)极,口流出的物质是______。
②放电的电极反应式为______。
(4)用零价铁()去除水体中的硝酸盐()已成为环境修复研究的热点之一、还原酸性水体中的的反应原理如图所示。
①作负极的物质是______。
②正极的电极反应式是______。
20.(13分)丙酮蒸气热裂解可生产乙烯酮,反应为 ,现对该热裂解反应进行研究,回答下列问题:
化学键
键能 412 348 612
(1)根据表格中的键能数据,计算=______;
(2)在恒容绝热密闭容器中,充入丙酮蒸气,可以判断下列到达平衡状态的是______(填序号)。
A.消耗速率与生成速率相等
B.容器内密度不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
(3)丙酮的平衡转化率随温度、压强变化如图所示:
①图中表示的物理量是______:
②、两点化学平衡常数______(填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是______。
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)。
①经过时间,丙酮分解10%。用单位时间内气体分压变化表示的反应速率=______kPa/min;
②该条件平衡时丙酮分解率为,则=______(以分压表示,分压=总压×物质的量分数)。
(5)其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图所示。
①工业上选择催化剂______(填“甲”或“乙”)。
②在催化剂甲作用下,温度高于210℃时,丙酮转化率降低的原因可能是______(写一条即可)。
2023-2024学年第一学期闽侯一中第二次月考
高二化学参考答案
1 2 3 4 5 6 7 8
A A C B A D B A
9 10 11 12 13 14 15 16
B D B A C D C C
17.(12分)(1)①(2)乙
(3)酚酞,滴入最后半滴标准液时,溶液由无色变为粉红色,且半分钟不褪色
(4)26.10
(5)偏大,偏小(6)10
18.(16分)(1)
(2)、
(3)①>③>②(2分)
(4)(2分)
(5)<(2分)
(6)①(2分)②(2分)
19.(11分)(1)5(2)
(3)①负 ②(浓度较大的)硫酸 ③
(4)①铁() ②
20.(13分)(1)+84(2分)
(2)ACD(2分)
(3)①压强(1分) ②<(1分) ③升高温度(1分)
(4)①(2分) ②(2分)
(5)乙(1分) 催化剂活性降低或副反应增多等(1分)
同课章节目录
