第30讲电解池金属的腐蚀与防护-2024高考化学一轮复习课件(共21张PPT)
文档属性
| 名称 | 第30讲电解池金属的腐蚀与防护-2024高考化学一轮复习课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 10:19:28 | ||
图片预览


文档简介
(共21张PPT)
第30讲
电解池 金属的腐蚀与防护
诊断性评价
(2022·广东,10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
√
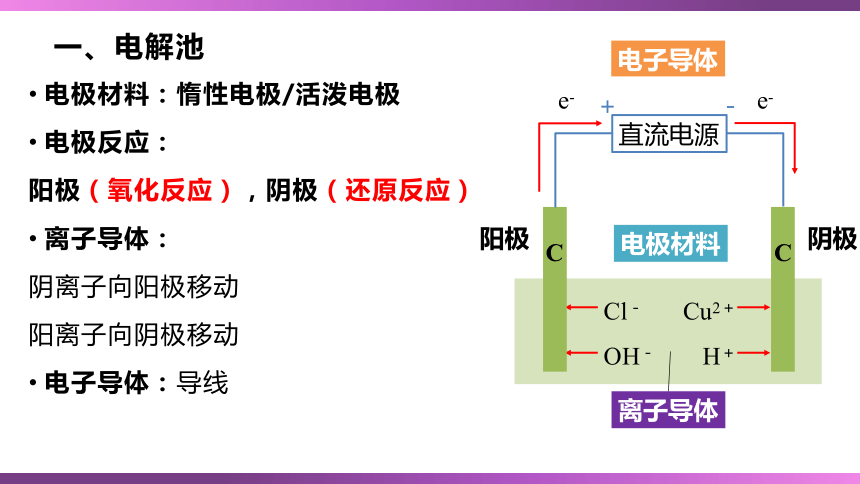
一、电解池
电极材料:惰性电极/活泼电极
电极反应:
阳极(氧化反应),阴极(还原反应)
离子导体:
阴离子向阳极移动
阳离子向阴极移动
电子导体:导线
离子导体
Cu2+
H+
Cl-
OH-
+ -
直流电源
C
C
e-
e-
阴极
阳极
电子导体
电极材料
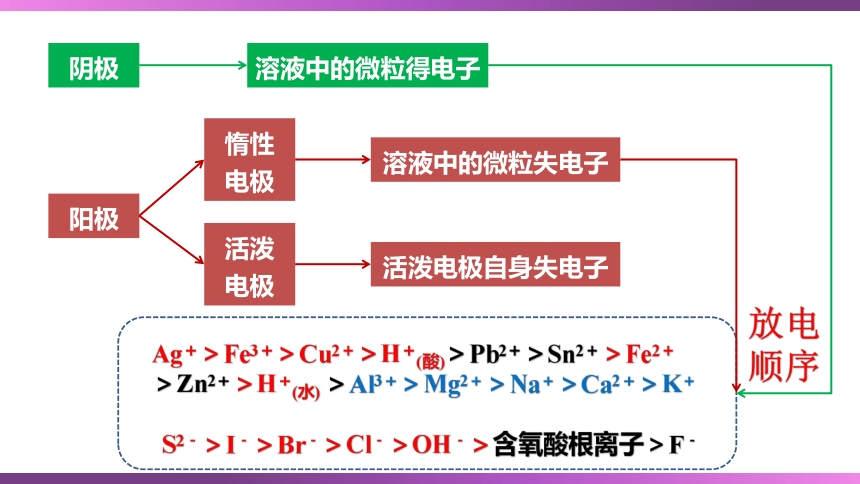
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
阴极
阳极
溶液中的微粒得电子
惰性
电极
活泼
电极
溶液中的微粒失电子
活泼电极自身失电子
放电
顺序
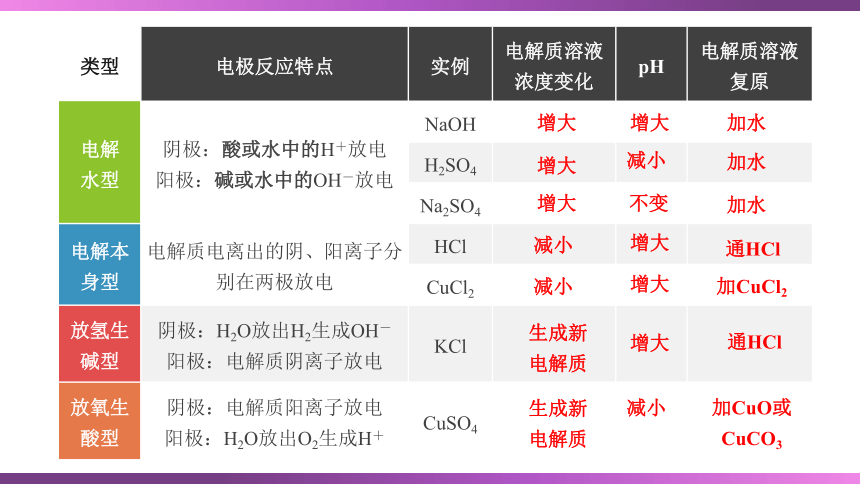
类型 电极反应特点 实例 电解质溶液浓度变化 pH 电解质溶液
复原
电解 水型 阴极:酸或水中的H+放电 阳极:碱或水中的OH-放电 NaOH
H2SO4
Na2SO4
电解本身型 电解质电离出的阴、阳离子分别在两极放电 HCl
CuCl2
放氢生 碱型 阴极:H2O放出H2生成OH- 阳极:电解质阴离子放电 KCl
放氧生 酸型 阴极:电解质阳离子放电 阳极:H2O放出O2生成H+ CuSO4
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
生成新
电解质
生成新
电解质
不变
加水
加水
加水
通HCl
通HCl
加CuCl2
加CuO或
CuCO3
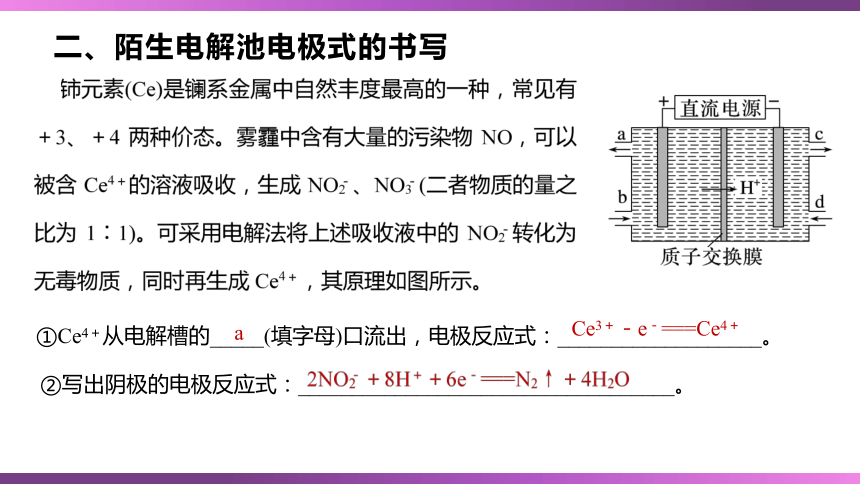
二、陌生电解池电极式的书写
①Ce4+从电解槽的_____(填字母)口流出,电极反应式:___________________。
a
Ce3+-e-===Ce4+
②写出阴极的电极反应式:___________________________________。
三、电解池中的竞争、先后问题
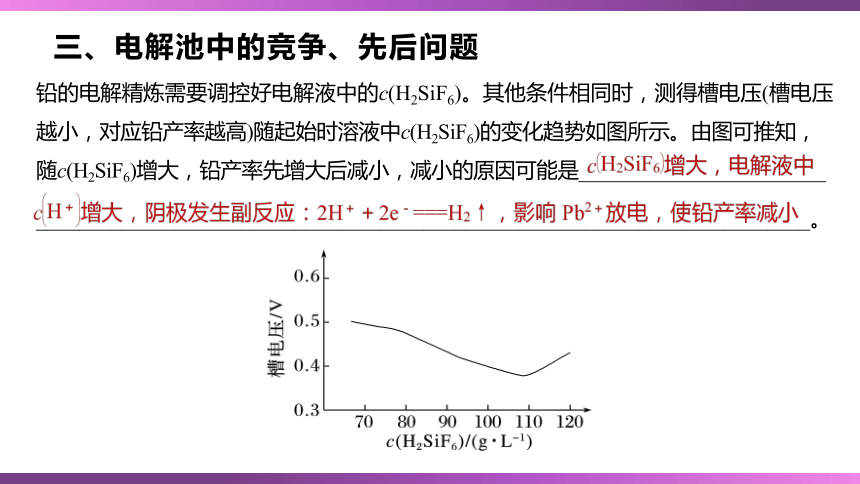
铅的电解精炼需要调控好电解液中的c(H2SiF6)。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中c(H2SiF6)的变化趋势如图所示。由图可推知,
随c(H2SiF6)增大,铅产率先增大后减小,减小的原因可能是_______________________
________________________________________________________________________。
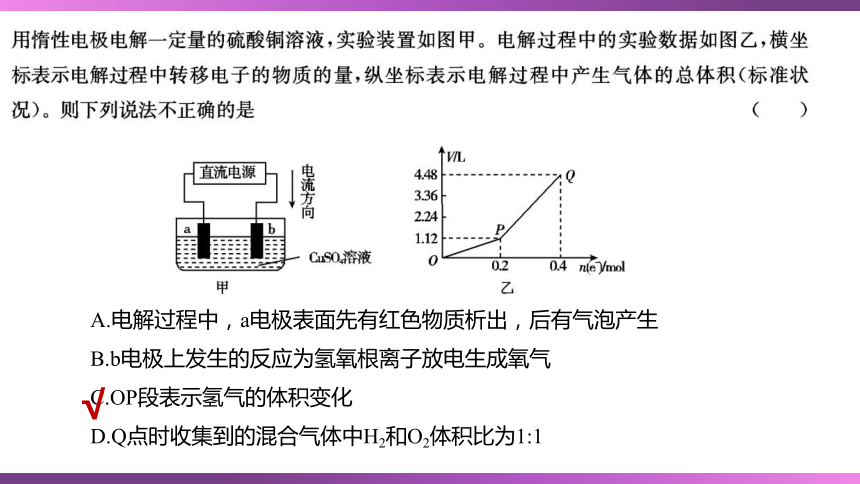
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应为氢氧根离子放电生成氧气
C.OP段表示氢气的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
√
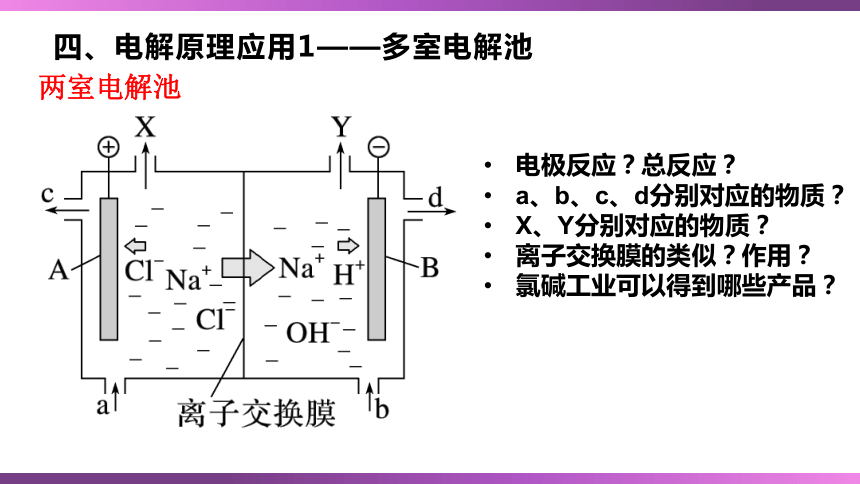
四、电解原理应用1——多室电解池
两室电解池
电极反应?总反应?
a、b、c、d分别对应的物质?
X、Y分别对应的物质?
离子交换膜的类似?作用?
氯碱工业可以得到哪些产品?
利用三室电解装置制备NH4NO3,其工作原理如图所示。
三室电解池
电极反应?总反应?
物质A为?
a、b分别对应何种离子交换膜?
A
a
b
技巧:找到电极反应
关注目标产物
确定离子交换膜种类
四室电解池
利用“四室电渗析法”制备H3PO2(次磷酸)
电极反应?
a、b、c分别对应何种离子交换膜?
技巧:关注隔室名称
确定离子交换膜种类
a
b
c
四、电解原理应用2——电解精炼
粗铜与精铜分别放哪一极?
粗铜
精铜
(含Zn、Fe、Ni、Ag、Au等杂质)
Cu-2e-=Cu2+
氧化反应
阳极
Zn-2e-=Zn2+
等等
还原反应
阴极
Cu2+ + 2e-=Cu
CuSO4溶液
电解质溶液选用什么?
电解结束后,阳极泥中含有Au、Pt、Ag等,
电解质溶液中的金属阳离子有Zn2+、Cu2+等,
需定期补充电解液
依据得失电子守恒,溶液中的铜离子浓度有何变化?
但电解液中Cu2+的浓度减小
四、电解原理应用3——电镀
阴极材料
(镀件)
阳极材料
(镀层金属)
离子导体
(含镀层金属离子的盐溶液)
电子导体
电极反应
(氧化)
电极反应
(还原)
助剂
电解液浓度
电压
大小
电解
时间
电极
间距
表面光滑程度
调控
电镀是材料表面处理中不可或缺的一部分,解答下列问题:
(1)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______________
___________________________________________________。
(2)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜。
阳极反应式:______________________________;
阴极反应式:__________________;
总反应方程式:_____________________________。
(3)用有机阳离子、 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为_________________________________。
若改用AlCl3水溶液作电解液,则阴极产物为________。
用铜作阳极
可补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
负
H2
五、金属的腐蚀
化学腐蚀与电化学腐蚀的区别?
不纯的金属接触到电解质溶液发生原电池反应
负极:Fe-2e-===Fe2+
负极:Fe-2e-===Fe2+
正极:2H++2e-===H2↑
正极:O2+2H2O+4e-===4OH-
腐蚀速率比较
如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为_______________。
⑤④②①③⑥
对同一电解质溶液来说,腐蚀速率的快慢 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀;外界条件相同时,电解质浓度越大,金属腐蚀越快
对同一金属来说,在不同溶液中腐蚀速率的快慢 强电解质溶液中>弱电解质溶液中>非电解质溶液中;活动性不同的两种金属,活动性差别越大,腐蚀速率越快
六、金属的防护
改变金属材料的组成
在金属表面覆盖保护层
电化学防护法
牺牲阳极法
外加电流法
终结性评价
1.(2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
2.(2021·全国乙卷,12)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题, 通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是
A.阳极发生将海水中的Cl-氧化生成Cl2
的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
√
3.(2022·海南,9)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如图。
下列有关说法正确的是
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
√
4.(2022·北京,13)利用下图装置进行铁上电镀铜的实验探究。下列说法不正确的是
装置示意图 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol·L-1 CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3 [Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
√
第30讲
电解池 金属的腐蚀与防护
诊断性评价
(2022·广东,10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
√
一、电解池
电极材料:惰性电极/活泼电极
电极反应:
阳极(氧化反应),阴极(还原反应)
离子导体:
阴离子向阳极移动
阳离子向阴极移动
电子导体:导线
离子导体
Cu2+
H+
Cl-
OH-
+ -
直流电源
C
C
e-
e-
阴极
阳极
电子导体
电极材料
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
阴极
阳极
溶液中的微粒得电子
惰性
电极
活泼
电极
溶液中的微粒失电子
活泼电极自身失电子
放电
顺序
类型 电极反应特点 实例 电解质溶液浓度变化 pH 电解质溶液
复原
电解 水型 阴极:酸或水中的H+放电 阳极:碱或水中的OH-放电 NaOH
H2SO4
Na2SO4
电解本身型 电解质电离出的阴、阳离子分别在两极放电 HCl
CuCl2
放氢生 碱型 阴极:H2O放出H2生成OH- 阳极:电解质阴离子放电 KCl
放氧生 酸型 阴极:电解质阳离子放电 阳极:H2O放出O2生成H+ CuSO4
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
生成新
电解质
生成新
电解质
不变
加水
加水
加水
通HCl
通HCl
加CuCl2
加CuO或
CuCO3
二、陌生电解池电极式的书写
①Ce4+从电解槽的_____(填字母)口流出,电极反应式:___________________。
a
Ce3+-e-===Ce4+
②写出阴极的电极反应式:___________________________________。
三、电解池中的竞争、先后问题
铅的电解精炼需要调控好电解液中的c(H2SiF6)。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中c(H2SiF6)的变化趋势如图所示。由图可推知,
随c(H2SiF6)增大,铅产率先增大后减小,减小的原因可能是_______________________
________________________________________________________________________。
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应为氢氧根离子放电生成氧气
C.OP段表示氢气的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
√
四、电解原理应用1——多室电解池
两室电解池
电极反应?总反应?
a、b、c、d分别对应的物质?
X、Y分别对应的物质?
离子交换膜的类似?作用?
氯碱工业可以得到哪些产品?
利用三室电解装置制备NH4NO3,其工作原理如图所示。
三室电解池
电极反应?总反应?
物质A为?
a、b分别对应何种离子交换膜?
A
a
b
技巧:找到电极反应
关注目标产物
确定离子交换膜种类
四室电解池
利用“四室电渗析法”制备H3PO2(次磷酸)
电极反应?
a、b、c分别对应何种离子交换膜?
技巧:关注隔室名称
确定离子交换膜种类
a
b
c
四、电解原理应用2——电解精炼
粗铜与精铜分别放哪一极?
粗铜
精铜
(含Zn、Fe、Ni、Ag、Au等杂质)
Cu-2e-=Cu2+
氧化反应
阳极
Zn-2e-=Zn2+
等等
还原反应
阴极
Cu2+ + 2e-=Cu
CuSO4溶液
电解质溶液选用什么?
电解结束后,阳极泥中含有Au、Pt、Ag等,
电解质溶液中的金属阳离子有Zn2+、Cu2+等,
需定期补充电解液
依据得失电子守恒,溶液中的铜离子浓度有何变化?
但电解液中Cu2+的浓度减小
四、电解原理应用3——电镀
阴极材料
(镀件)
阳极材料
(镀层金属)
离子导体
(含镀层金属离子的盐溶液)
电子导体
电极反应
(氧化)
电极反应
(还原)
助剂
电解液浓度
电压
大小
电解
时间
电极
间距
表面光滑程度
调控
电镀是材料表面处理中不可或缺的一部分,解答下列问题:
(1)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______________
___________________________________________________。
(2)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜。
阳极反应式:______________________________;
阴极反应式:__________________;
总反应方程式:_____________________________。
(3)用有机阳离子、 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为_________________________________。
若改用AlCl3水溶液作电解液,则阴极产物为________。
用铜作阳极
可补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定
2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
负
H2
五、金属的腐蚀
化学腐蚀与电化学腐蚀的区别?
不纯的金属接触到电解质溶液发生原电池反应
负极:Fe-2e-===Fe2+
负极:Fe-2e-===Fe2+
正极:2H++2e-===H2↑
正极:O2+2H2O+4e-===4OH-
腐蚀速率比较
如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为_______________。
⑤④②①③⑥
对同一电解质溶液来说,腐蚀速率的快慢 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀;外界条件相同时,电解质浓度越大,金属腐蚀越快
对同一金属来说,在不同溶液中腐蚀速率的快慢 强电解质溶液中>弱电解质溶液中>非电解质溶液中;活动性不同的两种金属,活动性差别越大,腐蚀速率越快
六、金属的防护
改变金属材料的组成
在金属表面覆盖保护层
电化学防护法
牺牲阳极法
外加电流法
终结性评价
1.(2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
2.(2021·全国乙卷,12)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题, 通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是
A.阳极发生将海水中的Cl-氧化生成Cl2
的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
√
3.(2022·海南,9)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如图。
下列有关说法正确的是
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
√
4.(2022·北京,13)利用下图装置进行铁上电镀铜的实验探究。下列说法不正确的是
装置示意图 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol·L-1 CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3 [Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析出,镀层更致密
√
同课章节目录
