第32讲化学反应速率与影响因素-2024年高考化学一轮复习课件(共23张PPT)
文档属性
| 名称 | 第32讲化学反应速率与影响因素-2024年高考化学一轮复习课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 944.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 10:19:45 | ||
图片预览





文档简介
(共23张PPT)
第32讲
化学反应速率及影响因素
诊断性评价
(2022·广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·
L-1·min-1
√
一、化学反应速率定义
速率公式
单位
速率比值关系、速率大小比较
其他
①平均速率
②不同物质表示的反应速率,数值不同,意义相同
③固体或纯液体的浓度视为常数
概念辨析
1.对于任何化学反应来说,反应速率越大,反应现象越明显( )
×
3.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
4.同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快( )
×
×
×
①v(CO)=1.5 mol·L-1·min-1
②v(NO2)=0.7 mol·L-1·min-1
③v(N2)=0.4 mol·L-1·min-1
④v(CO2)=1.1 mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
请比较上述5种情况反应的快慢:___________________(由大到小的顺序)。
③>①>②>⑤>④
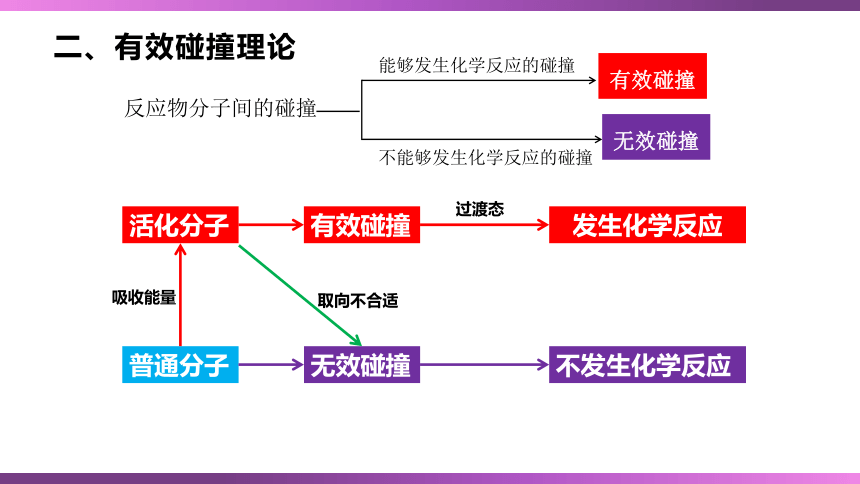
二、有效碰撞理论
反应物分子间的碰撞
能够发生化学反应的碰撞
不能够发生化学反应的碰撞
有效碰撞
无效碰撞
普通分子
无效碰撞
活化分子
不发生化学反应
有效碰撞
发生化学反应
取向不合适
吸收能量
过渡态
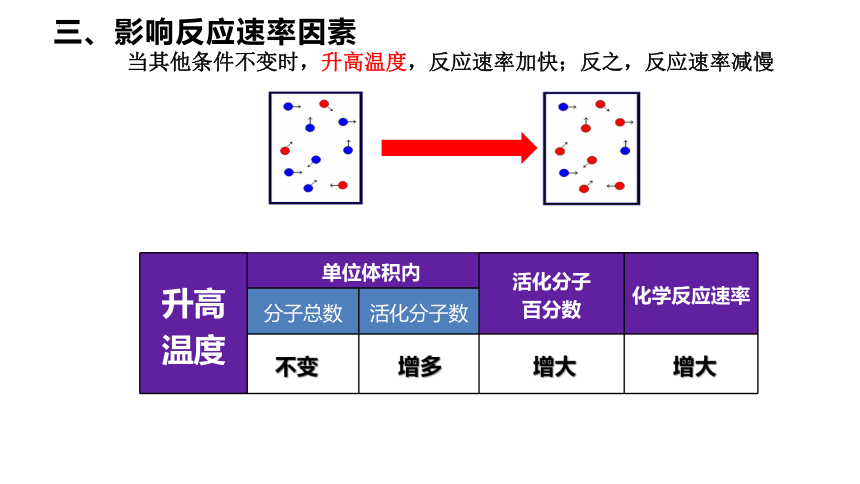
升高温度 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
当其他条件不变时,升高温度,反应速率加快;反之,反应速率减慢
不变
增大
增大
增多
三、影响反应速率因素
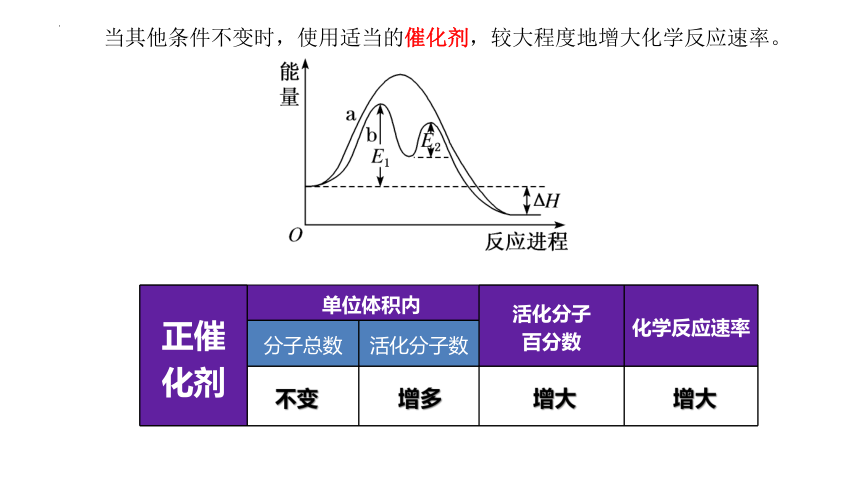
当其他条件不变时,使用适当的催化剂,较大程度地增大化学反应速率。
正催化剂 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
不变
增大
增大
增多
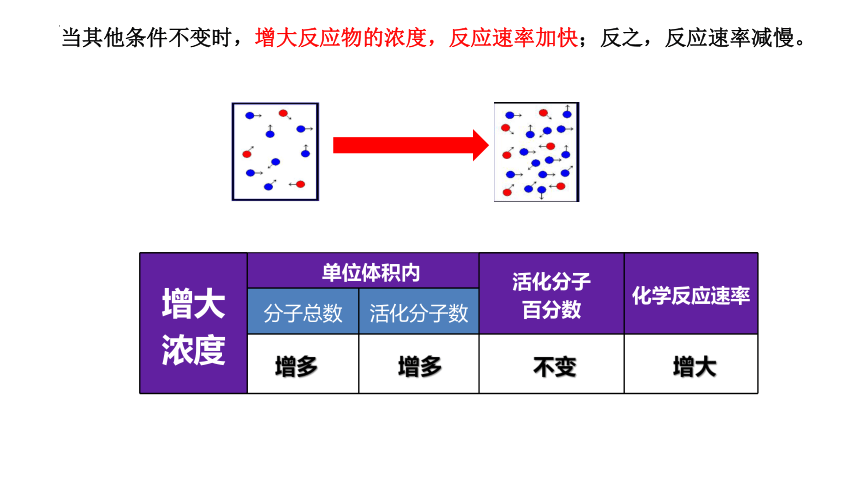
当其他条件不变时,增大反应物的浓度,反应速率加快;反之,反应速率减慢。
增大浓度 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
增多
增大
不变
增多
当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于
增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,
反应速率减慢。
增大压强 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
增多
增大
不变
增多
单位体积内
活化分子数
单位体积内
分子总数
活化分子
百分数
=
×
与有效碰撞分数有关
f=
与活化能、温度有关
f 增大
温度升高
减小活化能
惰性气体对反应速率的影响
恒温恒容 通入惰性气体,总压增大,反应物浓度不变,反应速率不变
恒温恒压 通入惰性气体,总体积增大,反应物浓度减小,反应速率减小
概念辨析
×
1.催化剂参与化学反应,改变了活化能,但反应前后物理和化学性质保持不变( )
2.升温时吸热反应速率增大,放热反应速率减小( )
3.一定量的锌与过量的稀硫酸反应制取氢气,滴入少量硫酸铜与醋酸钠均能够提高反应速率( )
4.增大反应物的浓度,能够增大活化分子的百分数,所以反应速率增大( )
5.100 mL 2 mol·L-1盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变( )
×
×
×
×
四、控制变量法研究化学反应速率
确定实验变量
控制其他变量(溶液体积要保持一致)
设置对照,排除无关变量
去除无效数据
已知:2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究H2C2O4溶液和酸性KMnO4溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略溶液体积变化):下列说法不正确的是
编号 0.01 mol·L-1酸性KMnO4溶液体积/mL 0.1 mol·L-1 H2C2O4溶液体积/mL 水的体积/mL 反应温度/℃ 反应时
间/min
Ⅰ 2 2 0 20 2.1
Ⅱ V1 2 1 20 5.5
Ⅲ V2 2 0 50 0.5
A.V1=1,V2=2
B.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响
C.实验计时是从溶液混合开始,溶液呈紫红色时结束
D.实验Ⅲ中用酸性KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=0.01 mol·L-1·min-1
√
五、化学反应速率的计算——基于三段式
一定温度下反应:4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应速率,其比值是1∶2∶3
C.在2 min末的反应速率,用B表示为0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的瞬时速率的值都是逐渐减小的
√
五、化学反应速率的计算——基于陌生物理量
温度为T1时,2 g某合金4 min内吸收氢气240 mL,吸氢速率v=_____mL·g-1·min-1。
30
关注单位,结合信息
五、化学反应速率的计算——基于压强
有分压,直接以p列三段式
(1)已知:2N2O5(g) 2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3× kPa·min-1。t=62 min时,测得体系中 =2.9 kPa,则此时的
=________kPa,v=____________kPa·min-1。
30.0
6.0×10-2
工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550 ℃时,在1 L的恒温容器中,反应过程中的部分数据见下表:
反应时间/min SO2(g) /mol O2(g) /mol SO3(g) /mol
0 4 2 0
5 1.5
10 2
15 1
若在起始时总压为p0 kPa,反应速率若用单位时间内分压的变化表示,气态物质分压
=总压×气态物质的物质的量分数,则10 min内SO2(g)的反应速率v(SO2)=____ kPa·min-1。
无分压,列以n列三段式,求n%(关注前后气体总n 变化)
五、化学反应速率的计算——基于速率方程
Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min 0 20 40 60 80 120
x(HI) 1 0.91 0.85 0.815 0.795 0.784
x(HI) 0 0.60 0.73 0.773 0.780 0.784
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、
k逆为速率常数,则k逆为_____(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=____________min-1。
1.95×10-3
结论:K=k正/k逆
某合成氨速率方程为: ,根据表中数据, ;
-1
反应级数计算,利用多组数据联立
终结性评价
1.(2021·辽宁,12)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
A.其他条件相同时,催化剂浓度越大,反应速
率越大
B.其他条件相同时,降冰片烯浓度越大,反应
速率越大
C.条件①,反应速率为0.012 mol·L-1·min-1
D.条件②,降冰片烯起始浓度为3.0 mol·L-1时,半衰期为62.5 min
√
2.(2022·浙江6月选考,20)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
√
第32讲
化学反应速率及影响因素
诊断性评价
(2022·广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·
L-1·min-1
√
一、化学反应速率定义
速率公式
单位
速率比值关系、速率大小比较
其他
①平均速率
②不同物质表示的反应速率,数值不同,意义相同
③固体或纯液体的浓度视为常数
概念辨析
1.对于任何化学反应来说,反应速率越大,反应现象越明显( )
×
3.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
4.同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快( )
×
×
×
①v(CO)=1.5 mol·L-1·min-1
②v(NO2)=0.7 mol·L-1·min-1
③v(N2)=0.4 mol·L-1·min-1
④v(CO2)=1.1 mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
请比较上述5种情况反应的快慢:___________________(由大到小的顺序)。
③>①>②>⑤>④
二、有效碰撞理论
反应物分子间的碰撞
能够发生化学反应的碰撞
不能够发生化学反应的碰撞
有效碰撞
无效碰撞
普通分子
无效碰撞
活化分子
不发生化学反应
有效碰撞
发生化学反应
取向不合适
吸收能量
过渡态
升高温度 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
当其他条件不变时,升高温度,反应速率加快;反之,反应速率减慢
不变
增大
增大
增多
三、影响反应速率因素
当其他条件不变时,使用适当的催化剂,较大程度地增大化学反应速率。
正催化剂 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
不变
增大
增大
增多
当其他条件不变时,增大反应物的浓度,反应速率加快;反之,反应速率减慢。
增大浓度 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
增多
增大
不变
增多
当其他条件不变时,对于有气体参加的反应,增大压强(减少容器的容积)相当于
增大反应浓度,反应速率加快;减小压强(增大容器的容积)相当于减小反应浓度,
反应速率减慢。
增大压强 单位体积内 活化分子 百分数 化学反应速率
分子总数 活化分子数
增多
增大
不变
增多
单位体积内
活化分子数
单位体积内
分子总数
活化分子
百分数
=
×
与有效碰撞分数有关
f=
与活化能、温度有关
f 增大
温度升高
减小活化能
惰性气体对反应速率的影响
恒温恒容 通入惰性气体,总压增大,反应物浓度不变,反应速率不变
恒温恒压 通入惰性气体,总体积增大,反应物浓度减小,反应速率减小
概念辨析
×
1.催化剂参与化学反应,改变了活化能,但反应前后物理和化学性质保持不变( )
2.升温时吸热反应速率增大,放热反应速率减小( )
3.一定量的锌与过量的稀硫酸反应制取氢气,滴入少量硫酸铜与醋酸钠均能够提高反应速率( )
4.增大反应物的浓度,能够增大活化分子的百分数,所以反应速率增大( )
5.100 mL 2 mol·L-1盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变( )
×
×
×
×
四、控制变量法研究化学反应速率
确定实验变量
控制其他变量(溶液体积要保持一致)
设置对照,排除无关变量
去除无效数据
已知:2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究H2C2O4溶液和酸性KMnO4溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实验(忽略溶液体积变化):下列说法不正确的是
编号 0.01 mol·L-1酸性KMnO4溶液体积/mL 0.1 mol·L-1 H2C2O4溶液体积/mL 水的体积/mL 反应温度/℃ 反应时
间/min
Ⅰ 2 2 0 20 2.1
Ⅱ V1 2 1 20 5.5
Ⅲ V2 2 0 50 0.5
A.V1=1,V2=2
B.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响
C.实验计时是从溶液混合开始,溶液呈紫红色时结束
D.实验Ⅲ中用酸性KMnO4溶液的浓度变化表示的反应速率v(KMnO4)=0.01 mol·L-1·min-1
√
五、化学反应速率的计算——基于三段式
一定温度下反应:4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应速率,其比值是1∶2∶3
C.在2 min末的反应速率,用B表示为0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的瞬时速率的值都是逐渐减小的
√
五、化学反应速率的计算——基于陌生物理量
温度为T1时,2 g某合金4 min内吸收氢气240 mL,吸氢速率v=_____mL·g-1·min-1。
30
关注单位,结合信息
五、化学反应速率的计算——基于压强
有分压,直接以p列三段式
(1)已知:2N2O5(g) 2N2O4(g)+O2(g),起始时N2O5(g)为35.8 kPa,分解的反应速率v=2×10-3× kPa·min-1。t=62 min时,测得体系中 =2.9 kPa,则此时的
=________kPa,v=____________kPa·min-1。
30.0
6.0×10-2
工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550 ℃时,在1 L的恒温容器中,反应过程中的部分数据见下表:
反应时间/min SO2(g) /mol O2(g) /mol SO3(g) /mol
0 4 2 0
5 1.5
10 2
15 1
若在起始时总压为p0 kPa,反应速率若用单位时间内分压的变化表示,气态物质分压
=总压×气态物质的物质的量分数,则10 min内SO2(g)的反应速率v(SO2)=____ kPa·min-1。
无分压,列以n列三段式,求n%(关注前后气体总n 变化)
五、化学反应速率的计算——基于速率方程
Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g),在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min 0 20 40 60 80 120
x(HI) 1 0.91 0.85 0.815 0.795 0.784
x(HI) 0 0.60 0.73 0.773 0.780 0.784
上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、
k逆为速率常数,则k逆为_____(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=____________min-1。
1.95×10-3
结论:K=k正/k逆
某合成氨速率方程为: ,根据表中数据, ;
-1
反应级数计算,利用多组数据联立
终结性评价
1.(2021·辽宁,12)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
A.其他条件相同时,催化剂浓度越大,反应速
率越大
B.其他条件相同时,降冰片烯浓度越大,反应
速率越大
C.条件①,反应速率为0.012 mol·L-1·min-1
D.条件②,降冰片烯起始浓度为3.0 mol·L-1时,半衰期为62.5 min
√
2.(2022·浙江6月选考,20)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
√
同课章节目录
