第43讲沉淀溶解平衡及图像分析-2024年高考化学一轮复习课件(共21张PPT)
文档属性
| 名称 | 第43讲沉淀溶解平衡及图像分析-2024年高考化学一轮复习课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 10:23:27 | ||
图片预览




文档简介
(共21张PPT)
第43讲
沉淀溶解平衡及图像分析
(2020·全国卷Ⅱ,9)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
√
诊断性评价
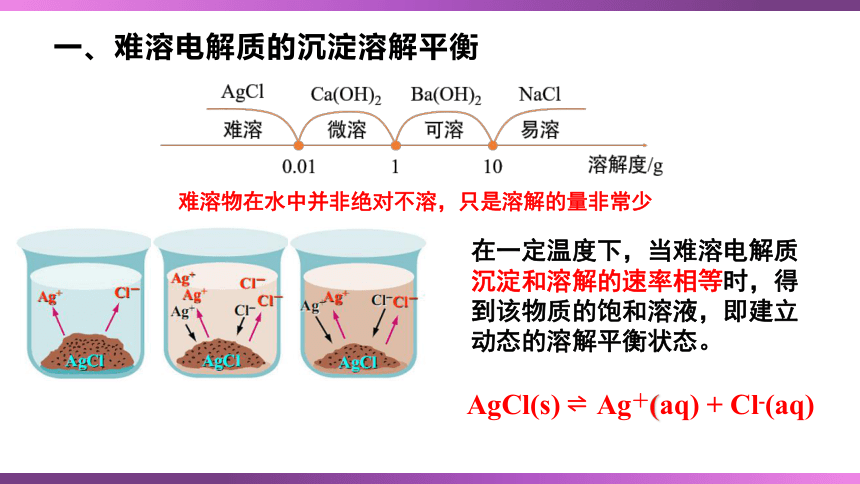
一、难溶电解质的沉淀溶解平衡
难溶物在水中并非绝对不溶,只是溶解的量非常少
在一定温度下,当难溶电解质沉淀和溶解的速率相等时,得到该物质的饱和溶液,即建立动态的溶解平衡状态。
AgCl(s) Ag+(aq) + Cl-(aq)
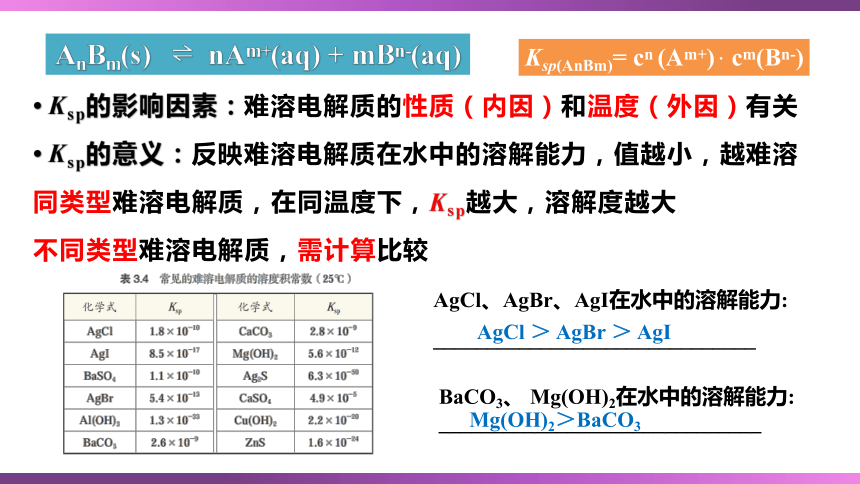
Ksp的影响因素:难溶电解质的性质(内因)和温度(外因)有关
Ksp的意义:反映难溶电解质在水中的溶解能力,值越小,越难溶
同类型难溶电解质,在同温度下,Ksp越大,溶解度越大
不同类型难溶电解质,需计算比较
AnBm(s) nAm+(aq) + mBn-(aq)
Ksp(AnBm)= cn (Am+) . cm(Bn-)
AgCl、AgBr、AgI在水中的溶解能力:
______________________________
AgCl > AgBr > AgI
BaCO3、 Mg(OH)2在水中的溶解能力:
______________________________
Mg(OH)2>BaCO3
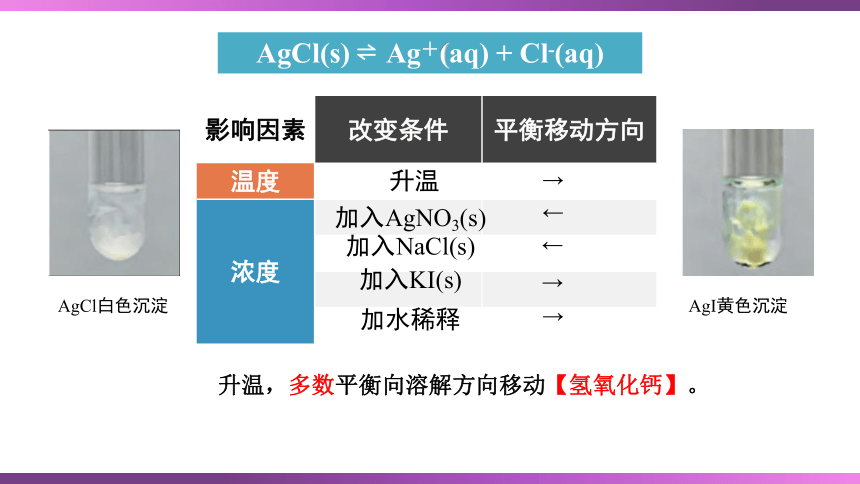
AgCl(s) Ag+(aq) + Cl-(aq)
影响因素 改变条件 平衡移动方向
温度
浓度
加入AgNO3(s)
加入NaCl(s)
加水稀释
→
←
→
←
加入KI(s)
→
AgCl白色沉淀
AgI黄色沉淀
升温
升温,多数平衡向溶解方向移动【氢氧化钙】。
二、难溶电解质的生成、溶解与转化
沉淀生成
工艺流程中调节溶液的pH
工艺流程中也通过添加含有S2-的沉淀剂
沉淀溶解
Mg(OH)2难溶于水,能溶于NH4Cl溶液的原因
PbSO4不溶于水,但可溶于CH3COONH4溶液的原因
沉淀转化
由一种沉淀转化为另一种沉淀的过程,实质是沉淀溶解平衡的移动
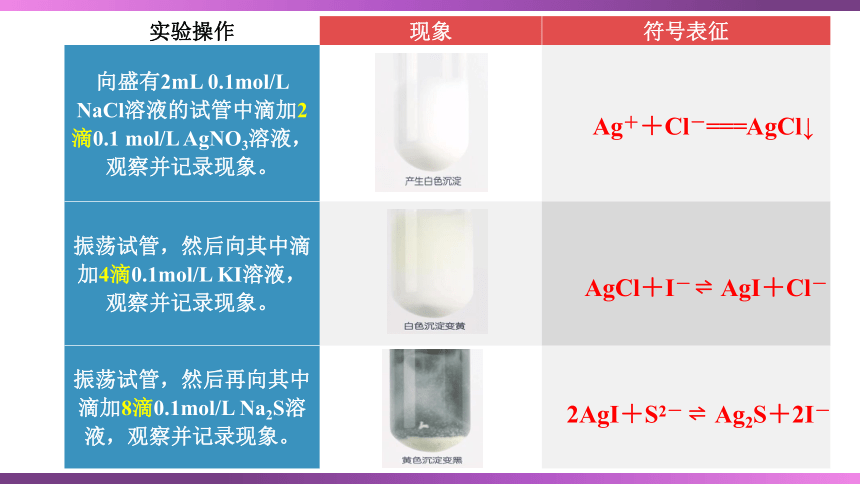
实验操作 现象 符号表征
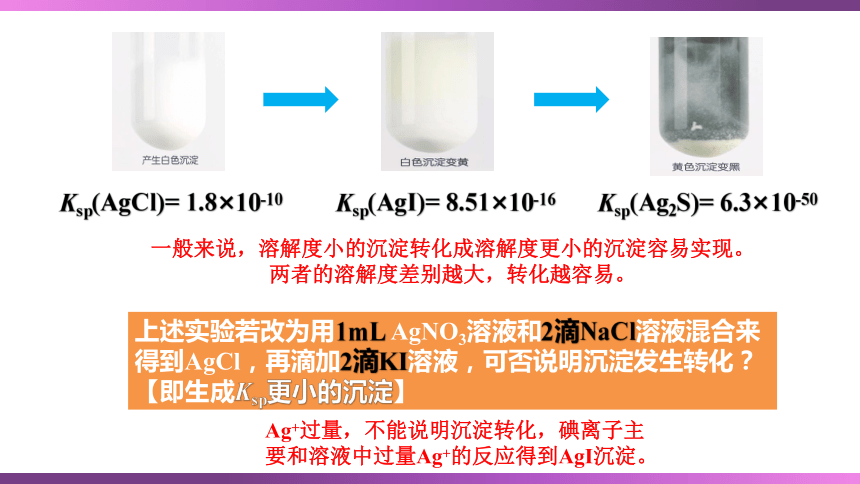
向盛有2mL 0.1mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,观察并记录现象。
振荡试管,然后向其中滴加4滴0.1mol/L KI溶液,观察并记录现象。
振荡试管,然后再向其中滴加8滴0.1mol/L Na2S溶液,观察并记录现象。
Ag++Cl-===AgCl↓
AgCl+I- AgI+Cl-
2AgI+S2- Ag2S+2I-
一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
两者的溶解度差别越大,转化越容易。
Ksp(Ag2S)= 6.3×10-50
Ksp(AgCl)= 1.8×10-10
Ksp(AgI)= 8.51×10-16
上述实验若改为用1mL AgNO3溶液和2滴NaCl溶液混合来得到AgCl,再滴加2滴KI溶液,可否说明沉淀发生转化?【即生成Ksp更小的沉淀】
Ag+过量,不能说明沉淀转化,碘离子主要和溶液中过量Ag+的反应得到AgI沉淀。
实验操作 现象 符号表征
向盛有2mL0.1mol/LMgCl2溶液 的试管中滴加2~4滴2mol/LNaOH溶液,观察并记录现象。
上述试管中滴加4滴0.1mol/L的FeCl3溶液,观察并记录现象。
Mg2++2OH-===Mg(OH)2↓
3Mg(OH)2(s)+2Fe3+(aq)
2Fe(OH)3(s)+3Mg2+(aq)
Ksp[Mg(OH)2]=5.6×10-12 Ksp[Fe(OH)3]=2.8×10-39
NaOH过量,不能说明沉淀转化,只能说明Fe3+和溶液中过量的NaOH反应得到的Fe(OH)3沉淀。
三、难溶电解质沉淀溶解平衡的计算
考点1:判定某温度下难溶电解质的沉淀或溶解情况Qc~Ksp关系
25 ℃时,在1.00 L 0.03 mol·L-1 AgNO3溶液中加入0.50 L 0.06 mol·L-1的CaCl2溶液,能否生成AgCl沉淀?(已知:AgCl的Ksp=1.8×10-10)
考点2:沉淀pH的计算
常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20,计算有关Cu2+沉淀的pH。
(1)某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH为 。
5
6
化学上通常认为残留在溶液中的金属离子浓度小于10-5mol/L时,沉淀达到完全
考点3:沉淀的先后顺序
考点4:沉淀的转化
Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6,请计算说明说明CaCO3能否转化为CaSO4
考点5:比值计算
某温度下,溶液中含有I-、Cl-等离子,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =__________。(Ksp(AgCl)=1.6×10-10,Ksp(AgI)=8×10-17)
5×10-7
四、难溶电解质沉淀溶解平衡的图像分析
考点1:常规型曲线
饱和与不饱和溶液对应情况?
平衡状态对应情况?Q~Ksp关系?
在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由c点到d点?
考点2:负对数型曲线
曲线判断?
Ksp关系判断?
点的判断?
考点3:沉淀滴定曲线
25 ℃时,用0.100 0 mol·L-1的AgNO3溶液分别滴定体积均为V0 mL且浓度均为 0.100 0 mol·L-1的KCl、KBr及KI溶液,其滴定曲线如图。
已知:25 ℃时,AgCl、AgBr及AgI溶度积常数依次
为1.8×10-10、5.0×10-13、8.3×10-17,下列说法正确
的是
A.V0=45.00
B.滴定曲线①表示KCl的滴定曲线
C.滴定KCl时,可加入少量的KI作指示剂
D.当AgNO3溶液滴定至60.00 mL时,溶液中c(I-)<c(Br-)<c(Cl-)
√
终结性评价
3.25×103
选项 操作 现象 结论
A 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的悬浊液中 出现黑色沉淀 Ksp(AgCl)>Ksp(Ag2S)
B 向盛有2 mL 0.1 mol·L-1AgNO3溶液的试管中滴加1 mL 0.1 mol·L-1 NaCl溶液,再向其中滴加4~5滴0.1 mol· L-1KI溶液 先有白色沉淀生成,后又产生黄色沉淀 Ksp(AgCl)>Ksp(AgI)
C 向AgI悬浊液中滴入Na2S溶液 固体变黑 Ksp(Ag2S)>Ksp(AgI)
D 将H2S气体通入浓度均为0.01 mol· L-1的ZnSO4和CuSO4溶液中 先出现CuS黑色沉淀 Ksp(CuS)<Ksp(ZnS)
2.分别进行下列操作,由现象得出的结论正确的是
√
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
√
第43讲
沉淀溶解平衡及图像分析
(2020·全国卷Ⅱ,9)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
√
诊断性评价
一、难溶电解质的沉淀溶解平衡
难溶物在水中并非绝对不溶,只是溶解的量非常少
在一定温度下,当难溶电解质沉淀和溶解的速率相等时,得到该物质的饱和溶液,即建立动态的溶解平衡状态。
AgCl(s) Ag+(aq) + Cl-(aq)
Ksp的影响因素:难溶电解质的性质(内因)和温度(外因)有关
Ksp的意义:反映难溶电解质在水中的溶解能力,值越小,越难溶
同类型难溶电解质,在同温度下,Ksp越大,溶解度越大
不同类型难溶电解质,需计算比较
AnBm(s) nAm+(aq) + mBn-(aq)
Ksp(AnBm)= cn (Am+) . cm(Bn-)
AgCl、AgBr、AgI在水中的溶解能力:
______________________________
AgCl > AgBr > AgI
BaCO3、 Mg(OH)2在水中的溶解能力:
______________________________
Mg(OH)2>BaCO3
AgCl(s) Ag+(aq) + Cl-(aq)
影响因素 改变条件 平衡移动方向
温度
浓度
加入AgNO3(s)
加入NaCl(s)
加水稀释
→
←
→
←
加入KI(s)
→
AgCl白色沉淀
AgI黄色沉淀
升温
升温,多数平衡向溶解方向移动【氢氧化钙】。
二、难溶电解质的生成、溶解与转化
沉淀生成
工艺流程中调节溶液的pH
工艺流程中也通过添加含有S2-的沉淀剂
沉淀溶解
Mg(OH)2难溶于水,能溶于NH4Cl溶液的原因
PbSO4不溶于水,但可溶于CH3COONH4溶液的原因
沉淀转化
由一种沉淀转化为另一种沉淀的过程,实质是沉淀溶解平衡的移动
实验操作 现象 符号表征
向盛有2mL 0.1mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,观察并记录现象。
振荡试管,然后向其中滴加4滴0.1mol/L KI溶液,观察并记录现象。
振荡试管,然后再向其中滴加8滴0.1mol/L Na2S溶液,观察并记录现象。
Ag++Cl-===AgCl↓
AgCl+I- AgI+Cl-
2AgI+S2- Ag2S+2I-
一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
两者的溶解度差别越大,转化越容易。
Ksp(Ag2S)= 6.3×10-50
Ksp(AgCl)= 1.8×10-10
Ksp(AgI)= 8.51×10-16
上述实验若改为用1mL AgNO3溶液和2滴NaCl溶液混合来得到AgCl,再滴加2滴KI溶液,可否说明沉淀发生转化?【即生成Ksp更小的沉淀】
Ag+过量,不能说明沉淀转化,碘离子主要和溶液中过量Ag+的反应得到AgI沉淀。
实验操作 现象 符号表征
向盛有2mL0.1mol/LMgCl2溶液 的试管中滴加2~4滴2mol/LNaOH溶液,观察并记录现象。
上述试管中滴加4滴0.1mol/L的FeCl3溶液,观察并记录现象。
Mg2++2OH-===Mg(OH)2↓
3Mg(OH)2(s)+2Fe3+(aq)
2Fe(OH)3(s)+3Mg2+(aq)
Ksp[Mg(OH)2]=5.6×10-12 Ksp[Fe(OH)3]=2.8×10-39
NaOH过量,不能说明沉淀转化,只能说明Fe3+和溶液中过量的NaOH反应得到的Fe(OH)3沉淀。
三、难溶电解质沉淀溶解平衡的计算
考点1:判定某温度下难溶电解质的沉淀或溶解情况Qc~Ksp关系
25 ℃时,在1.00 L 0.03 mol·L-1 AgNO3溶液中加入0.50 L 0.06 mol·L-1的CaCl2溶液,能否生成AgCl沉淀?(已知:AgCl的Ksp=1.8×10-10)
考点2:沉淀pH的计算
常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20,计算有关Cu2+沉淀的pH。
(1)某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH为 。
5
6
化学上通常认为残留在溶液中的金属离子浓度小于10-5mol/L时,沉淀达到完全
考点3:沉淀的先后顺序
考点4:沉淀的转化
Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6,请计算说明说明CaCO3能否转化为CaSO4
考点5:比值计算
某温度下,溶液中含有I-、Cl-等离子,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =__________。(Ksp(AgCl)=1.6×10-10,Ksp(AgI)=8×10-17)
5×10-7
四、难溶电解质沉淀溶解平衡的图像分析
考点1:常规型曲线
饱和与不饱和溶液对应情况?
平衡状态对应情况?Q~Ksp关系?
在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由c点到d点?
考点2:负对数型曲线
曲线判断?
Ksp关系判断?
点的判断?
考点3:沉淀滴定曲线
25 ℃时,用0.100 0 mol·L-1的AgNO3溶液分别滴定体积均为V0 mL且浓度均为 0.100 0 mol·L-1的KCl、KBr及KI溶液,其滴定曲线如图。
已知:25 ℃时,AgCl、AgBr及AgI溶度积常数依次
为1.8×10-10、5.0×10-13、8.3×10-17,下列说法正确
的是
A.V0=45.00
B.滴定曲线①表示KCl的滴定曲线
C.滴定KCl时,可加入少量的KI作指示剂
D.当AgNO3溶液滴定至60.00 mL时,溶液中c(I-)<c(Br-)<c(Cl-)
√
终结性评价
3.25×103
选项 操作 现象 结论
A 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的悬浊液中 出现黑色沉淀 Ksp(AgCl)>Ksp(Ag2S)
B 向盛有2 mL 0.1 mol·L-1AgNO3溶液的试管中滴加1 mL 0.1 mol·L-1 NaCl溶液,再向其中滴加4~5滴0.1 mol· L-1KI溶液 先有白色沉淀生成,后又产生黄色沉淀 Ksp(AgCl)>Ksp(AgI)
C 向AgI悬浊液中滴入Na2S溶液 固体变黑 Ksp(Ag2S)>Ksp(AgI)
D 将H2S气体通入浓度均为0.01 mol· L-1的ZnSO4和CuSO4溶液中 先出现CuS黑色沉淀 Ksp(CuS)<Ksp(ZnS)
2.分别进行下列操作,由现象得出的结论正确的是
√
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
√
同课章节目录
