第40讲盐类的水解-2024年高考化学一轮复习课件(共20张PPT)
文档属性
| 名称 | 第40讲盐类的水解-2024年高考化学一轮复习课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 10:24:02 | ||
图片预览







文档简介
(共20张PPT)
第40讲
盐类的水解
诊断性评价
(2021·广东,8)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是
A.0.001 mol·L-1 GHCl水溶液的pH=3
B.0.001 mol·L-1 GHCl水溶液加水稀释,pH升高
C.GHCl在水中的电离方程式为GHCl===G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
√
一、盐类水解的本质
原理:在水溶液中,盐电离出来的离子跟水电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解(Hydrolysis)
本质:促进了水的电离
反应特点:一般为可逆;一般为吸热;一般较微弱
规律:无弱不水解,有弱才水解,越弱越水解;谁强显谁性,同强显中性
分类:强酸强碱盐、强酸弱碱盐、强碱弱酸盐(NaHCO3、NaHSO3)、弱酸弱碱盐(CH3COONH4、NH4HCO3、NH4(CO3)2)
方程式书写:
①一般为可逆,少数用“=”表示
②一般不打“↑”或“↓”
③多元弱酸盐:分步书写,以第一步为主;多元弱碱盐:水解反应的离子方程式一步完成。
TiCl4 + (x+2)H2O = TiO2·xH2O↓ +4HCl
Al3++3HCO3- = Al(OH)3↓+3CO2↑
概念辨析
1.盐溶液显酸碱性,一定是由水解引起的( )
2.溶液呈中性的盐一定是强酸、强碱生成的盐( )
3.pH相同的盐酸和氯化铵溶液中由水电离出的c(H+)相同( )
4.盐类加入水中,水的电离一定被促进( )
×
×
×
×
考点1:用离子方程式表示水解过程
氯化铁溶液显酸性的原因:
碳酸钠溶液能去除油污的原因:
泡沫灭火器的原理:
铝离子与硫离子不能大量共存的原因:
Al3++3HCO3- = Al(OH)3↓+3CO2↑
2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
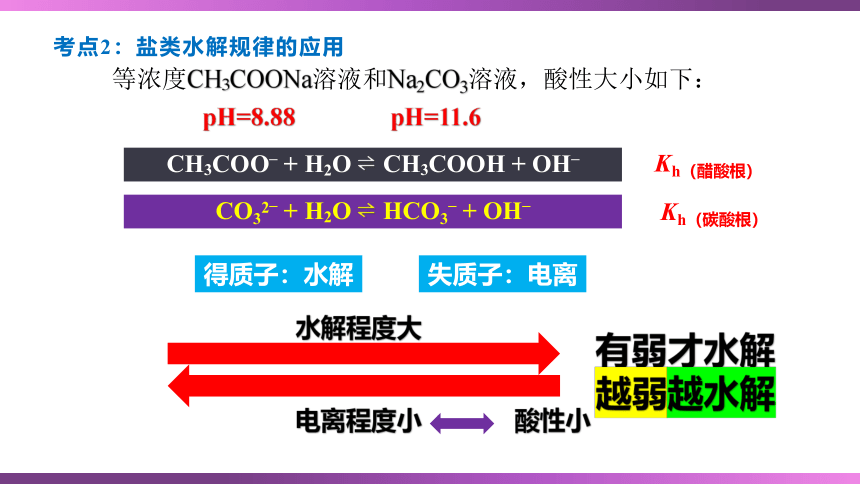
考点2:盐类水解规律的应用
等浓度CH3COONa溶液和Na2CO3溶液,酸性大小如下:
CH3COO– + H2O CH3COOH + OH–
CO32– + H2O HCO3– + OH–
pH=11.6
pH=8.88
Kh(醋酸根)
Kh(碳酸根)
得质子:水解
失质子:电离
水解程度大
电离程度小
酸性小
有弱才水解
越弱越水解
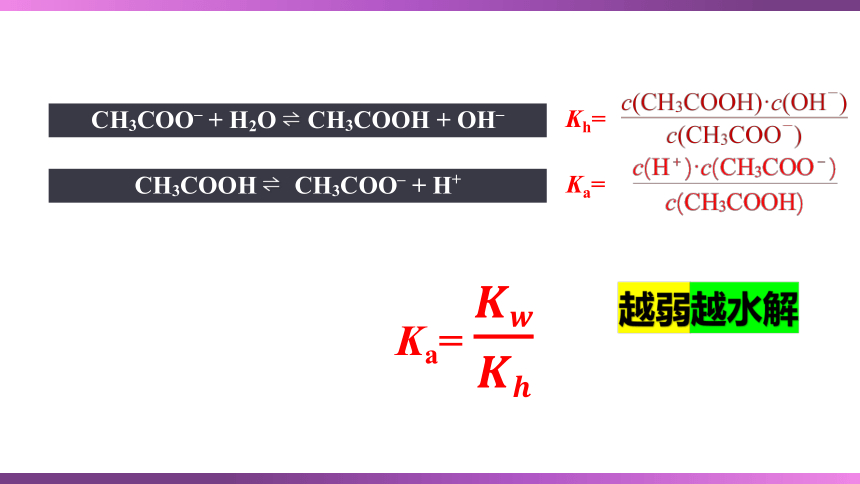
CH3COO– + H2O CH3COOH + OH–
Kh=
CH3COOH CH3COO– + H+
Ka=
Ka=
越弱越水解
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH–
Kh1
Kh2
H2CO3 H++HCO3-
HCO3- H++CO32-
Ka1 =
Ka2 =
Ka1=
Ka2=
CH3COOH Ka=1.8×10-5
HCN Ka=4.9×10-10
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
(1)相同物质的量浓度的①CH3COONa、②Na2CO3、③NaHCO3、④NaCN溶液,pH由大到小的顺序:________________,水的电离程度由大到小的顺序:___________。
(2)相同pH的①CH3COONa,②Na2CO3,③NaHCO3,④NaCN溶液,物质的量浓度由大到小的顺序:________________。
②>④>③>①
②>④>③>①
①>③>④>②
二、盐类水解的影响因素与应用
水解程度影响因素
内因:盐本身的性质
外因:引起水解平衡移动的因素
Kh
LCP
考点1:内因对盐类水解的影响
Cu2++2H2O Cu(OH)2+2H+
TiCl4 + (x+2)H2O = TiO2·xH2O↓ +4HCl
NH4++H2O NH3 · H2O + H+
Fe3++3H2O Fe(OH)3+3H+
SiCl4 +3H2O = H2SiO3+4HCl↑
阳离子所带电荷数是影响盐类水解的重要因素之一
烟雾弹
钛白粉制备
弱酸根离子也是影响盐类水解的重要因素之一
Na2CO3____Na2SO3
Na2CO3____NaHCO3
>
>
考点2:外因对盐类水解的影响
当温度、浓度等外界条件改变时,会引起水解平衡的移动,从而影响盐类水解的程度。其中浓度的影响通常包括:加水稀释、加入适量的酸或碱及能与酸或碱反应的盐等。
温度的影响
热的纯碱溶液可以去除油污
浓度的影响
FeCl3溶液的配制,NH4Cl溶液可以去除铁锈,AlCl3等溶液蒸干
外加离子的影响
泡沫灭火器,铵态氮肥与草木灰混用
实例 Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件 平衡移动方向 水解程度
滴加浓盐酸
加入氯化铁晶体
升高温度
加水稀释
概念辨析
1.稀溶液中,盐的浓度越小,水解程度越大,其溶液酸性(或碱性)也越强( )
2.水解平衡右移,盐的离子的水解程度一定增大( )
3.用Na2S溶液与AlCl3溶液混合可以制备Al2S3 ( )
4.水解相互促进的离子在同一溶液中一定不能共存( )
×
×
×
×
考点3:溶液蒸干问题
原溶液 AlCl3 FeCl3 MgCl2
蒸干灼烧后产物
SOCl2+H2O=SO2↑+HCl
原溶液 Ca(HCO3)2 NaHCO3 NH4Cl
蒸干灼烧后产物
固体受热易分解
原溶液 Na2SO3 FeSO4
蒸干灼烧后产物
固体受热易被氧化
原溶液 Fe2(SO4)3 Na2CO3
蒸干灼烧后产物
能得到原物质
终结性评价
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
√
1.(2022·海南,13改编)NaClO溶液具有漂白能力,已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是
A.0.01 mol·L-1溶液中,c(ClO-)>0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
2.(2019·北京,12)实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡
移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,
是因为CH3COO-、Cu2+水解平衡移动方向不同
√
3.(2022·湖南,13)为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1 mol·L-1)。
实验 操作与现象
① 在5 mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色
② 在5 mL FeCl3溶液中滴加2滴Na2SO3溶液,变红褐色;再滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
③ 在5 mL Na2SO3溶液中滴加2滴FeCl3溶液,变红褐色;将上述混合液分成两份,一份滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成;另一份煮沸,产生红褐色沉淀
依据上述实验现象,结论不合理的是
A.实验①说明加热促进Fe3+水解反应
B.实验②说明Fe3+既发生了水解反应,又发生了还原反应
C.实验③说明Fe3+发生了水解反应,但没有发生还原反应
D.整个实验说明 对Fe3+的水解反应无影响,但对还原反应有影响
√
第40讲
盐类的水解
诊断性评价
(2021·广东,8)鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是
A.0.001 mol·L-1 GHCl水溶液的pH=3
B.0.001 mol·L-1 GHCl水溶液加水稀释,pH升高
C.GHCl在水中的电离方程式为GHCl===G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
√
一、盐类水解的本质
原理:在水溶液中,盐电离出来的离子跟水电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解(Hydrolysis)
本质:促进了水的电离
反应特点:一般为可逆;一般为吸热;一般较微弱
规律:无弱不水解,有弱才水解,越弱越水解;谁强显谁性,同强显中性
分类:强酸强碱盐、强酸弱碱盐、强碱弱酸盐(NaHCO3、NaHSO3)、弱酸弱碱盐(CH3COONH4、NH4HCO3、NH4(CO3)2)
方程式书写:
①一般为可逆,少数用“=”表示
②一般不打“↑”或“↓”
③多元弱酸盐:分步书写,以第一步为主;多元弱碱盐:水解反应的离子方程式一步完成。
TiCl4 + (x+2)H2O = TiO2·xH2O↓ +4HCl
Al3++3HCO3- = Al(OH)3↓+3CO2↑
概念辨析
1.盐溶液显酸碱性,一定是由水解引起的( )
2.溶液呈中性的盐一定是强酸、强碱生成的盐( )
3.pH相同的盐酸和氯化铵溶液中由水电离出的c(H+)相同( )
4.盐类加入水中,水的电离一定被促进( )
×
×
×
×
考点1:用离子方程式表示水解过程
氯化铁溶液显酸性的原因:
碳酸钠溶液能去除油污的原因:
泡沫灭火器的原理:
铝离子与硫离子不能大量共存的原因:
Al3++3HCO3- = Al(OH)3↓+3CO2↑
2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
考点2:盐类水解规律的应用
等浓度CH3COONa溶液和Na2CO3溶液,酸性大小如下:
CH3COO– + H2O CH3COOH + OH–
CO32– + H2O HCO3– + OH–
pH=11.6
pH=8.88
Kh(醋酸根)
Kh(碳酸根)
得质子:水解
失质子:电离
水解程度大
电离程度小
酸性小
有弱才水解
越弱越水解
CH3COO– + H2O CH3COOH + OH–
Kh=
CH3COOH CH3COO– + H+
Ka=
Ka=
越弱越水解
CO32– + H2O HCO3– + OH–
HCO3– + H2O H2CO3 + OH–
Kh1
Kh2
H2CO3 H++HCO3-
HCO3- H++CO32-
Ka1 =
Ka2 =
Ka1=
Ka2=
CH3COOH Ka=1.8×10-5
HCN Ka=4.9×10-10
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
(1)相同物质的量浓度的①CH3COONa、②Na2CO3、③NaHCO3、④NaCN溶液,pH由大到小的顺序:________________,水的电离程度由大到小的顺序:___________。
(2)相同pH的①CH3COONa,②Na2CO3,③NaHCO3,④NaCN溶液,物质的量浓度由大到小的顺序:________________。
②>④>③>①
②>④>③>①
①>③>④>②
二、盐类水解的影响因素与应用
水解程度影响因素
内因:盐本身的性质
外因:引起水解平衡移动的因素
Kh
LCP
考点1:内因对盐类水解的影响
Cu2++2H2O Cu(OH)2+2H+
TiCl4 + (x+2)H2O = TiO2·xH2O↓ +4HCl
NH4++H2O NH3 · H2O + H+
Fe3++3H2O Fe(OH)3+3H+
SiCl4 +3H2O = H2SiO3+4HCl↑
阳离子所带电荷数是影响盐类水解的重要因素之一
烟雾弹
钛白粉制备
弱酸根离子也是影响盐类水解的重要因素之一
Na2CO3____Na2SO3
Na2CO3____NaHCO3
>
>
考点2:外因对盐类水解的影响
当温度、浓度等外界条件改变时,会引起水解平衡的移动,从而影响盐类水解的程度。其中浓度的影响通常包括:加水稀释、加入适量的酸或碱及能与酸或碱反应的盐等。
温度的影响
热的纯碱溶液可以去除油污
浓度的影响
FeCl3溶液的配制,NH4Cl溶液可以去除铁锈,AlCl3等溶液蒸干
外加离子的影响
泡沫灭火器,铵态氮肥与草木灰混用
实例 Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件 平衡移动方向 水解程度
滴加浓盐酸
加入氯化铁晶体
升高温度
加水稀释
概念辨析
1.稀溶液中,盐的浓度越小,水解程度越大,其溶液酸性(或碱性)也越强( )
2.水解平衡右移,盐的离子的水解程度一定增大( )
3.用Na2S溶液与AlCl3溶液混合可以制备Al2S3 ( )
4.水解相互促进的离子在同一溶液中一定不能共存( )
×
×
×
×
考点3:溶液蒸干问题
原溶液 AlCl3 FeCl3 MgCl2
蒸干灼烧后产物
SOCl2+H2O=SO2↑+HCl
原溶液 Ca(HCO3)2 NaHCO3 NH4Cl
蒸干灼烧后产物
固体受热易分解
原溶液 Na2SO3 FeSO4
蒸干灼烧后产物
固体受热易被氧化
原溶液 Fe2(SO4)3 Na2CO3
蒸干灼烧后产物
能得到原物质
终结性评价
D.25 ℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+)
√
1.(2022·海南,13改编)NaClO溶液具有漂白能力,已知25 ℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是
A.0.01 mol·L-1溶液中,c(ClO-)>0.01 mol·L-1
B.长期露置在空气中,释放Cl2,漂白能力减弱
2.(2019·北京,12)实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡
移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,
是因为CH3COO-、Cu2+水解平衡移动方向不同
√
3.(2022·湖南,13)为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1 mol·L-1)。
实验 操作与现象
① 在5 mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色
② 在5 mL FeCl3溶液中滴加2滴Na2SO3溶液,变红褐色;再滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
③ 在5 mL Na2SO3溶液中滴加2滴FeCl3溶液,变红褐色;将上述混合液分成两份,一份滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成;另一份煮沸,产生红褐色沉淀
依据上述实验现象,结论不合理的是
A.实验①说明加热促进Fe3+水解反应
B.实验②说明Fe3+既发生了水解反应,又发生了还原反应
C.实验③说明Fe3+发生了水解反应,但没有发生还原反应
D.整个实验说明 对Fe3+的水解反应无影响,但对还原反应有影响
√
同课章节目录
