专题2《化学反应速率与化学平衡》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 15:06:45 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》
一、单选题(共13题)
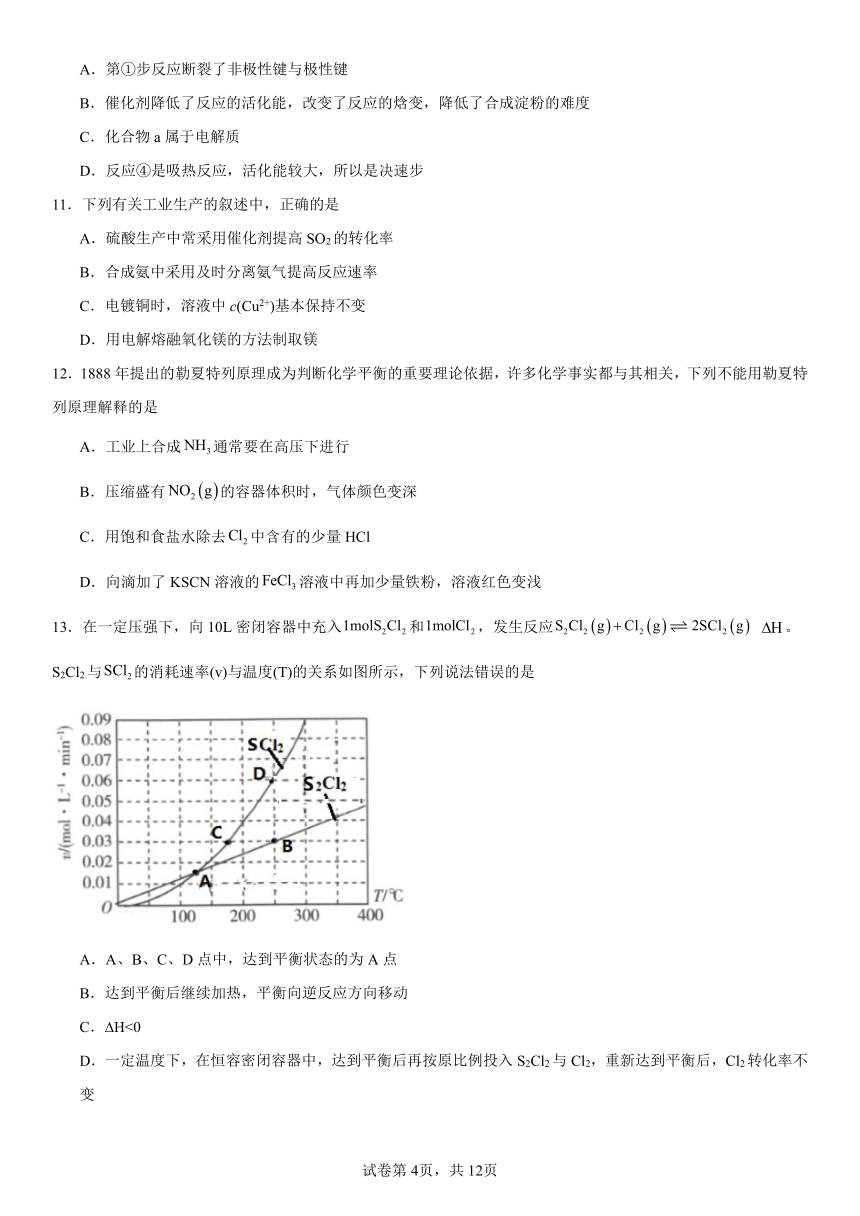
1.在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙所示),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是。
A.此过程为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程从有序到无序,混乱度增大
D.此过程是自发可逆的
2.下列有关说法正确的是
A.在潮湿的空气中,白铁皮(镀锌)镀层受损后,比受损前更容易生锈
B.对于反应,增大反应容器体积,达到平衡时,减小
C.反应 达到平衡后,升高温度,反应速率和的平衡转化率均增大
D.恒温恒容下,反应,当气体密度不变时,可判断反应达到了平衡
3.下列事实不能用勒夏特列原理解释的是
A.鼓入过量空气有利于SO2转化为SO3
B.工业合成氨选择400—500℃的较高温度
C.合成氨时采用循环操作及将氨液化分离,可提高原料的利用率
D.打开汽水瓶,看到有大量的气泡逸出
4.四氯化钛是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为。在条件下,转化为有两种方法,其反应的热化学方程式分别为:
①直接氯化
②碳氯化
对于反应,下列说法正确的是
A.
B.E(总反应物)(总生成物)(E表示物质能量)
C.反应中每消耗,转移电子的数目为
D.升高温度、增大压强均能提高产率
5.下列实验事实不能用勒夏特列原理解释的是
A.打开啤酒瓶盖,喷出大量泡沫
B.新制的氯水在光照下颜色逐渐变浅
C.实验室用排饱和食盐水而不用排水法收集氯气
D.H2、I2、HI平衡混合气加压后颜色变深
6.下列实验中,反应速率加快是由催化剂引起的是
A.在炭粉中加入KClO3 ,点燃时燃烧更为剧烈
B.H2O2中加入少量FeCl3,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快
7.反应2X(g)+Y(g)2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
8.t℃时,向容积为2L的刚性容器中充入1mol 和一定量的发生反应;,HCHO的平衡分压与起始的关系如图所示。已知:初始加入2mol 时,容器内混合气体的总压强为1.2p kPa,为以分压表示的平衡常数,分压=总压×物质的量分数。下列叙述正确的是
A.e点:
B.随增大,HCHO的平衡分压不断增大
C.a点时反应的压强平衡常数
D.b点时再投入1mol 、1.5mol ,平衡时,的转化率减小
9.我国科学家使用双功能催化剂催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率,反应过程示意图如下,下列说法正确的是
A.过程Ⅰ、过程Ⅱ均为放热过程
B.图中显示:起始时的2个H2O都参与了反应过程
C.过程Ⅲ只生成了极性共价键
D.使用催化剂降低了水煤气变换反应的ΔH
10.2021年我国科学家以为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①
②
③
④
A.第①步反应断裂了非极性键与极性键
B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度
C.化合物a属于电解质
D.反应④是吸热反应,活化能较大,所以是决速步
11.下列有关工业生产的叙述中,正确的是
A.硫酸生产中常采用催化剂提高SO2的转化率
B.合成氨中采用及时分离氨气提高反应速率
C.电镀铜时,溶液中c(Cu2+)基本保持不变
D.用电解熔融氧化镁的方法制取镁
12.1888年提出的勒夏特列原理成为判断化学平衡的重要理论依据,许多化学事实都与其相关,下列不能用勒夏特列原理解释的是
A.工业上合成通常要在高压下进行
B.压缩盛有的容器体积时,气体颜色变深
C.用饱和食盐水除去中含有的少量HCl
D.向滴加了KSCN溶液的溶液中再加少量铁粉,溶液红色变浅
13.在一定压强下,向10L密闭容器中充入和,发生反应 。S2Cl2与的消耗速率(v)与温度(T)的关系如图所示,下列说法错误的是
A.A、B、C、D点中,达到平衡状态的为A点
B.达到平衡后继续加热,平衡向逆反应方向移动
C. H<0
D.一定温度下,在恒容密闭容器中,达到平衡后再按原比例投入S2Cl2与Cl2,重新达到平衡后,Cl2转化率不变
二、填空题(共9题)
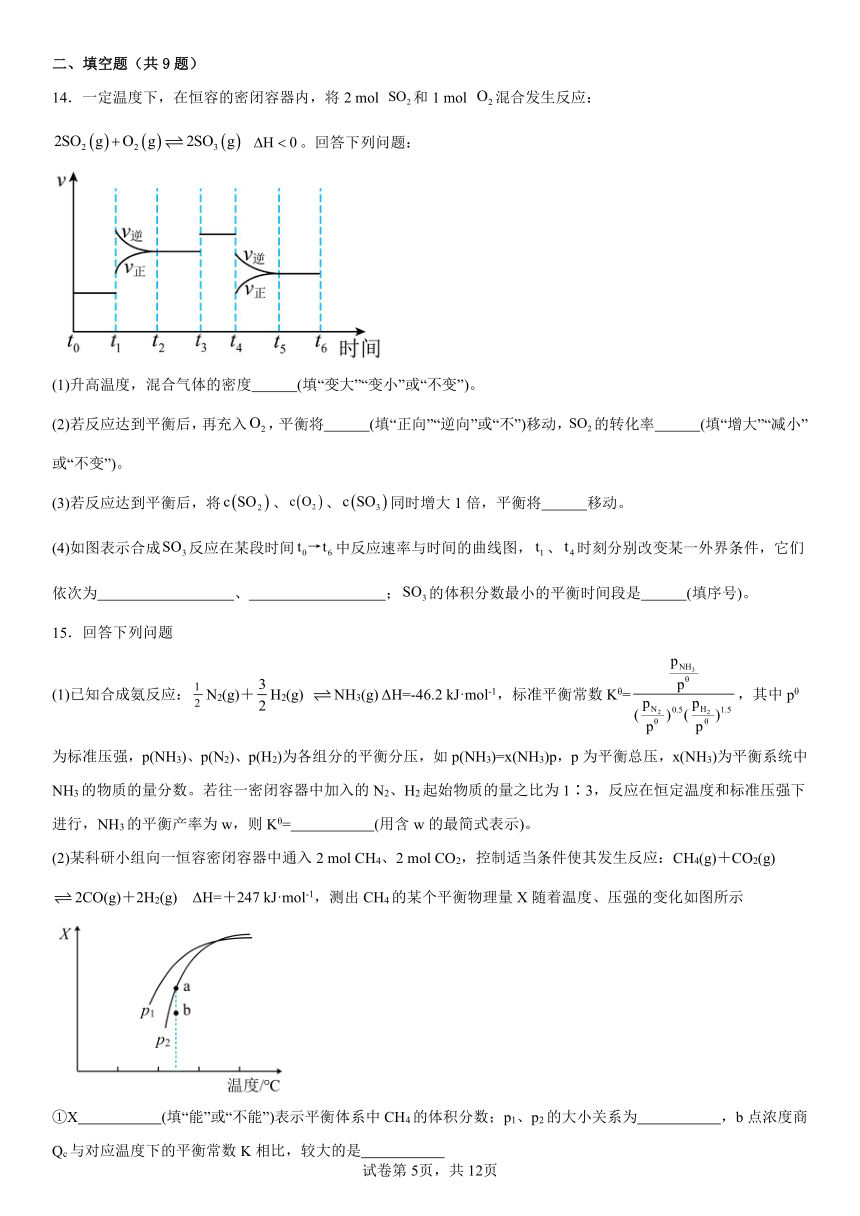
14.一定温度下,在恒容的密闭容器内,将2 mol 和1 mol 混合发生反应: 。回答下列问题:
(1)升高温度,混合气体的密度 (填“变大”“变小”或“不变”)。
(2)若反应达到平衡后,再充入,平衡将 (填“正向”“逆向”或“不”)移动,的转化率 (填“增大”“减小”或“不变”)。
(3)若反应达到平衡后,将、、同时增大1倍,平衡将 移动。
(4)如图表示合成反应在某段时间中反应速率与时间的曲线图,、时刻分别改变某一外界条件,它们依次为 、 ;的体积分数最小的平衡时间段是 (填序号)。
15.回答下列问题
(1)已知合成氨反应:N2(g)+H2(g) NH3(g) ΔH=-46.2 kJ·mol-1,标准平衡常数Kθ=,其中pθ为标准压强,p(NH3)、p(N2)、p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。若往一密闭容器中加入的N2、H2起始物质的量之比为1∶3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则Kθ= (用含w的最简式表示)。
(2)某科研小组向一恒容密闭容器中通入2 mol CH4、2 mol CO2,控制适当条件使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol-1,测出CH4的某个平衡物理量X随着温度、压强的变化如图所示
①X (填“能”或“不能”)表示平衡体系中CH4的体积分数;p1、p2的大小关系为 ,b点浓度商Qc与对应温度下的平衡常数K相比,较大的是
②若容器容积为2 L,a点时c(CH4)=0.4 mol·L-1,则相应温度下的平衡常数K=
16.石油产品中含者H2S及COS等多种有机硫化物,石油化工催生出多种脱硫技术,请回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)S2(g)+2H2(g) ΔH1=+180kJ·mol-1
②CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
计算反应③:CH4(g)+2H2S(g) CS2(g)+4H2(g) ΔH3= kJ·mol-1
(2)工业生产中应用:COS的水解反应为COS(g) + H2O(g) CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[]的转化关系如图甲所示。
① 向起始容器中投入一定量反应物,一定可以判断反应到达平衡状态的是 (填字母)。
A.容器中气体密度不变 B.保持不变
C.该反应化学平衡常数保持不变 D.υ逆(COS)= υ正(H2S)
② 根据图甲和图乙判断该反应的最佳条件为:投料比[] ;温度
③ 当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是 ; 。(写出两条)
(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示,则阳极区发生的总反应为 。
(4)可以用K2CO3溶液吸收H2S,其原理:K2CO3+ H2SKHS +KHCO3,该反应的平衡常数为 。( 已知H2CO3的Ka1=4.2×10-7 ,Ka2=5.6×10-11 ;H2S的Ka1=5.6×10-8 ,Ka2=1.2×10-15)
17.雾霾主要成分为灰尘、、、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)以氨气为脱硝剂时,可将还原为。
已知:
i. △H= a kJ·
ii. △H= b kJ·
则反应的 △H= kJ·。
(2)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为: △H <0某温度时,在体积为1L的刚性密闭容器中充入2 mol和1mol发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是 (填标号)。
A. B.混合气体密度不再改变
C.的体积分数不再改变 D.与的体积比不再改变
②欲增加的平衡转化率,可采取的措施有 (填标号)。
A.充入氦气 B.升高温度
C.充入2 mol D.充入2 mol 和1mol
③达到平衡时,混合气体总压为p,的浓度为0.5,则的转化率为 ,平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
④若在不同压强下进行反应,体系中物质的量分数x()与反应时间的关系如图所示,a、b两点的压强商Qp(以分压表示)较大的是 (填“a”或“b”)。
18.氮气是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
① 将一定量的N2(g)和H2(g)放入1 L的密闭容器中,在500 ℃、2×107 Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。计算此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
③在不同的条件下,测定合成氨反应的速率与时间的关系如图所示:
如果t2、t4、t6、t8时都仅改变了一个条件,可看出t2时刻的v正 v逆(填“>”、“=”或“<”);t4时改变的条件是 ; 在t2时刻的H2转化率 t5时刻(填“>”、“=”或“<”);t8时改变的条件是 。
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
①用O2表示0~2 s内该反应的平均速率v = 。
②能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
③能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
19.在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
实验序号 0 10 20 30 40 50 60
1 80℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 80℃ n2 0.60 0.50 0.50 0.50 0.50 0.50
3 80℃ n3 0.92 0.75 0.63 0.60 0.60 0.60
4 73℃ 1.0 0.90 0.80 0.75 0.70 0.65 0.65
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),理由是
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的 。
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是 , 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
20.工业上利用CO2和H2合成甲醇,既能减少温室气体排放,又能合成重要工业燃料。发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H。其它条件不变时,反应相同时间CO2的转化率随温度T的变化情况如图所示。
回答下面问题:
(1)x点的v(正) v(逆)(填“大于”“小于”或“等于”,下同),x点的v(正) y点的v(逆),△H 0。
(2)在某体积不变的绝热刚性容器中发生上述反应,下列说法正确的是 。
A.混合气体的密度不再发生变化时反应达到化学平衡状态
B.混合气体的浓度商Qc逐渐增大,最后不再变化时,Qc=Kc
C.该反应的化学反应速率随着反应的进行不断加快
D.达到平衡后升高温度,气体压强增大,化学平衡可能正向移动
(3)在一定温度和压强下,若原料气中的CO2和H2的物质的量之比=M,如图是M与CH3OH平衡百分含量(a%)的关系。
①M1= 。
②在平衡状态x点时,CO2的平衡转化率为 %。
③在平衡状态y点时,用百分含量表示的平衡常数K= 。
(4)在合成甲醇的反应中同时存在:CO2(g)+H2(g)CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可以采取的措施是 、 (写出两点)。在某密闭容器中通入1molCO2和3molH2,在催化剂作用下,同时发生:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)和②CO2(g)+H2(g)CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则反应②的化学平衡常数是 (保留三位小数)。
21.CH3OH(g)+H2O(g)CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(3)判断该可逆反应达到平衡状态的依据是(填序号) 。
A. v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D .CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
22.含碳化合物种类繁多。回答下列问题:
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g)CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为 %。
(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)CH4(g)+2H2O(g)。已知反应达平衡时H2的体积分数随温度的升高面增加。达平衡后温度从300°C升至400°C,v正 (填“增大”“减小”或“不变”,,下同),重新达到平衡,平衡常数K ,CO2转化率α ;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO)/mol·L-1 c(H2)/mol·L-1 c(CH4)/mol·L-1 c(H2O)/mol·L-1
平衡I a b c d
平衡II m n x y
则a、b、c、d与m、n、x、y之间的关系式为 。
(3)已知pKa=-lgKa,25°C时,H2C2O4的pKa1=1.2,pKa2=4.19,草酸溶液中各含碳物种的分布分数α(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。则图中a= ,b= 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.由图可看出,此过程气体分子由有序变为混乱,为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程,A正确;
B.由题意知ΔH=0,B正确;
C.由图可看出,此过程从有序到无序,混乱度增大,C正确;
D.ΔS>0,由ΔH-TΔS<0知,该过程的逆过程不能自发进行,D错误;
答案选D。
2.D
【详解】A.在潮湿的空气中,白铁皮(镀锌)镀层受损后,由于金属Zn的活动性比Fe强,在构成的原电池反应中Zn为负极,仍然会对铁起保护作用,所以Fe不会比受损前更容易生锈,A错误;
B.该反应的化学平衡常数,由于化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以当反应达到平衡时不变,B错误;
C.升高温度,化学反应速率加快。由于该反应的正反应是放热反应,所以升高温度,会使化学平衡逆向移动,最终导致的平衡转化率降低,C错误;
D.该反应的反应前后气体的质量会发生改变,容器的容积不变,若气体密度不变时,则气体的质量不变,因此反应达到了平衡状态,D正确。
故选D。
3.B
【详解】A.SO2生成SO3,反应方程式为2SO2+O22SO3,鼓入过量空气,增加氧气的浓度,平衡向正反应方向进行,有利于SO2转化成SO3,符合勒夏特列原理,故A不符合题意;
B.合成氨为放热反应,升高温度不利于合成氨,但工业上合成氨选择400-500℃的较高温度,使催化剂催化效果达到较大,催化剂对化学反应平衡移动无影响,不符合勒夏特列原理,故B符合题意;
C.将氨液化分离,减少生成物浓度,促使平衡向正反应方向进行,提高原料率的转化率,符合勒夏特列原理,故C不符合题意;
D.存在CO2(g)CO2(aq),打开汽水瓶,压强减小,平衡向左进行,符合勒夏特列原理,故D不符合题意;
答案为B。
4.C
【详解】A.该反应前后气体分子数不变,但固体转化为气体的过程中熵增大,,故A错误;
B.该反应为吸热反应,反应物的总能量小于生成物的总能量,故B错误;
C.有反应可知氯气在反应中作氧化剂转化为,1mol得2mol电子,消耗,转移电子的数目为,故C正确;
D.由已知直接氯化反应为吸热反应,碳氯化反应为放热反应,升高温度有利于直接氯化反应但不利于碳氯化反应;直接氯化反应反应前后气体分子数相等,增大压强平衡不移动,不利于提高产率,碳氯化反应,反应后气体分子数增大,增大压强平衡逆向移动,会降低产率,故D错误;
故选:C。
5.D
【详解】A.啤酒中有大量二氧化碳,在啤酒中存在平衡:CO2(g)+2H2O(l)H2CO3(aq),打开瓶盖,压强减小,平衡逆向移动,二氧化碳从啤酒中逸出,能用勒夏特列原理解释,故A不选;
B.氯水是氯气溶于水形成的水溶液,氯气溶于水时发生了可逆反应:Cl2+H2OHCl+HClO,光照下HClO会分解,生成物HClO浓度降低,平衡正向移动,氯水颜色变浅,能用勒夏特列原理解释,故B不选;
C.氯气能溶于水,在氯水中有如下平衡:Cl2+H2O H++Cl-+HClO,饱和食盐水中有大量的Cl-,可以降低氯气在水中的溶解度,从而可以用排饱和食盐水的方法收集氯气,可以用勒夏特列原理解释,故C不选;
D.H2+I2(g)2HI,加压平衡不移动,颜色加深的原因是容器体积减小,I2浓度增大,不能用勒夏特列原理解释,故D选;
故选D。
6.B
【详解】A.炭粉中加入KClO3 ,点燃时燃烧更为剧烈,是因为碳的燃烧使氯酸钾分解产生氧气,氧气具有助燃性,所以燃烧更为剧烈,与催化剂无关,错误;
B.H2O2中加入少量FeCl3,即可迅速放出气体,说明铁离子在过氧化氢分解中起催化作用,分解速率加快,与催化剂有关,正确;
C.增大反应物与氧气的接触面积,燃烧的更充分,与催化剂无关,错误;
D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快,是因为Zn与硫酸铜发生置换反应生成的Cu与Zn形成原电池,加快反应速率,与催化剂无关,错误;
故选B。
7.C
【详解】压强相同时温度越高反应速率越快,达到平衡所需时间越短,所以T1>T2;温度相同时压强越大反应速率越快,达到平衡所需时间越短,所以P1>P2,故答案为C。
8.C
【分析】由图可知随着加入氢气量的增多平衡正向移动产物的分压增大,abc构成曲线上的点均为平衡点,e点不是平衡点,依此答题。
【详解】A.e点对应的平衡点是b点,所以此时生成物压强小于平衡压强,平衡需向正反应方向移动,所以,A错误;
B.随增大,相当于增加氢气的浓度,平衡向右移动,生成的HCHO越来越多,平衡分压不断增大,当时剩余的反应物越来越多所以HCHO的平衡分压会减小,B错误;
C.根据c点加入2mol氢气,=2则起始加入1mol二氧化碳,由三段式分析:,体积不变时压强之比等于物质的量之比所以,,甲醛的物质的量为0.5摩尔,分压是0.2p kPa,所以平衡状态中二氧化碳、氢气、甲醛、水蒸气的分压分别为:0.2p kPa、0.4p kPa、0.2p kPa、0.2p kPa,,,平衡常数只与温度有关所以a点时反应的压强平衡常数,C正确;
D.b点时再投入1mol 、1.5mol ,相当于对原平衡体系体积缩小一半,压强增大平衡右移,所以平衡时,的转化率增大,D错误;
故选C。
9.B
【详解】A.从图中可以看出,过程Ⅰ、过程Ⅱ都断裂O-H共价键,所以均为吸热过程,A错误;
B.图示显示:在过程Ⅰ、过程Ⅱ中,2个H2O都断裂部分O-H键,所以起始时的2个H2O都参与了反应,B正确;
C.过程Ⅲ中CO、氢氧原子团和氢原子形成了二氧化碳、水和氢气,H2中的化学键为非极性键,C错误;
D.使用催化剂只能降低反应的活化能,但不能改变反应物和生成物的总能量,所以不能降低水煤气变换反应的ΔH,D错误;
故选B。
10.D
【详解】A.第①步反应断裂了非极性键,因为H2与CO2只含有非极性键,A错误;
B.催化剂降低了反应的活化能,降低了合成淀粉的难度,但是不能改变反应的焓变,B错误;
C.化合物a属于非电解质,C错误;
D.反应④△H>0,是吸热反应,活化能较大,所以是决速步,D正确;
答案选D。
11.C
【详解】A.硫酸生产中采用催化剂,可以加快反应速率、缩短反应达到平衡的时间,但不能提高SO2的转化率,故A错误;
B.合成氨中采用及时分离氨气,是为了促进平衡正向移动,提高产率,但氨气浓度减小,反应速率减慢,故B错误;
C.电镀时,阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极铜溶解质量约等于阴极析出铜的质量,所以溶液中c(Cu2+)基本保持不变,故C正确;
D.制取金属Mg是电解熔融的氯化镁,氧化镁的熔点太高,熔融时需要消耗大量的能量,不宜采用电解熔融物的方法,故D错误;
故选C。
12.B
【详解】A.合成的反应为,该反应是气体体积减小的反应,增大压强,平衡正向移动,可以提高生产的效率,能用勒夏特列原理解释,A项不符合题意;
B.反应过程中,压缩盛有NO2(g)的容器体积时,气体颜色变深是NO2的浓度增大导致的,与勒夏特列原理无关,B项符合题意;
C.氯气和水反应生成氯化氢和次氯酸,是化学平衡,饱和氯化钠溶液中氯离子浓度大,平衡逆向进行,降低氯气溶解度,能用勒夏特列原理解释,C项不符合题意;
D.加入固体KSCN,发生反应,溶液呈红色,加入铁粉后,Fe和反应生成,c()减小,平衡逆向移动,溶液颜色变浅,可以用勒夏特列原理解释,D项不符合题意;
故选B。
13.A
【详解】A.根据反应可知, 时,反应达到平衡状态,由图象可知,B、D点时,反应达到平衡状态,A错误;
B.达平衡后继续加热,,即,v(正)C.升温平衡逆向移动,故该反应的 H<0,C正确。
D.再按原比例投入反应物,相当于对反应容器进行加压,反应物转化率不变,D正确。
故答案选择A。
14.(1)不变
(2) 正向 增大
(3)正向
(4) 升高温度 降低压强 t5-t6
【详解】(1)由质量守恒定律可知,反应前后气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,则升高温度,混合气体的密度不变,故答案为:不变;
(2)反应达到平衡后,再充入氧气,生成物的浓度增大,平衡向正反应方向移动,二氧化硫的转化率增大,故答案为:正向;增大;
(3)反应达到平衡后,将二氧化硫、氧气和三氧化硫的浓度均增大一倍,反应的浓度熵Qc==,浓度熵小于平衡常数,则平衡向正反应方向移动,故答案为:正向;
(4)由图可知,t1时刻条件改变的瞬间正、逆反应速率同时增大,且逆反应速率增大幅度大于正反应速率,平衡向逆反应方向移动,则改变的条件为升高温度;t3时刻条件改变的瞬间正、逆反应速率相等,且同等幅度增大,化学平衡不移动,则改变的条件为使用催化剂;t4时刻条件改变的瞬间正、逆反应速率同时减小,且正反应速率减小幅度大于逆反应速率,平衡向逆反应方向移动,则改变的条件为降低压强,所以三氧化硫体积分数最小的平衡时间段为t5-t6,故答案为:升高温度;降低压强;t5-t6。
15.(1)
(2) 不能 p1【详解】(1)设n(N2)=1 mol,则n(H2)=3 mol,N2转化的为a mol,
理论生成NH3 2 mol,故=w,a=w,又因为p=pθ,因此:Kθ=。
(2)①压强一定时升高温度,X表示的物理量增加,而升温有利于平衡向右移动,故X不能表示平衡体系中CH4的体积分数;X可以看成是平衡体系中CH4的转化率,由于正反应是气体分子数增加的反应,压强越小越有利于平衡向右移动,CH4的平衡转化率越大,故p1②甲烷和CO2的初始浓度均为1 mol·L-1,反应中甲烷消耗的浓度为0.6 mol·L-1,由此可求出平衡时c(CO2)=c(CH4)=(1-0.6)mol·L-1=0.4 mol·L-1、c(CO)=c(H2)=2×0.6mol·L-1=1.2 mol·L-1,故K==12.96。
16.(1)+261kJ·mol-1
(2) D 10∶1 160℃ 催化剂活性降低 平衡向逆反应方向移动
(3)
(4)1×103
【详解】(1)根据盖斯定律,由反应①+反应②可得反应③,故ΔH1+ΔH2=ΔH3,即ΔH3=(+180kJ·mol-1)+(+81kJ·mol-1)=+261kJ·mol-1。
(2)①A.根据质量守恒定律,混合气体的质量不变,容器的体积不变,密度,故气体的密度始终不变,当容器中气体的密度不发生变化时不能证明反应达到平衡,A项错误;B.根据反应方程式,COS与H2O的化学计量数之比是1∶1,故在反应过程中两者的浓度之比应该保持不变,保持不变不能证明反应达到平衡,B项错误;C.化学平衡常数只与温度有关,当温度一定时化学平衡常数不变,C项错误;D.根据反应方程式,υ正(COS)= υ正(H2S),则υ逆(H2S)= υ正(H2S),即υ逆(COS)= υ正(H2S)正反应速率等于逆反应速率,说明反应达到平衡,D项正确;故选D。②根据图甲可知,最佳投料比=10∶1,由图乙可知,最佳温度为160℃。③当温度升高到一定值后,COS转化率降低,可能的原因是反应放热,升高温度平衡逆向移动,也可能是催化剂的活性降低。
(3)该装置为电解池, CO2在ZnO@石墨烯电极上转化为CO,得到电子,发生还原反应,为阴极,石墨烯电极为阳极,失去电子,发生氧化反应,阳极发生了两个反应,首先失去电子转化为EDTA-Fe3+,EDTA-Fe3+再与H2S反应得到EDTA-Fe2+、2分子H+和S,化学方程式表示为、,故总反应为
(4)用K2CO3溶液吸收H2S,其原理的离子方程式可以表示为:,该反应的平衡常数K= = = = ,故该反应的平衡常数K=1×103。
17. (b-3a) C D 50% 5/4p(或) b
【详解】(1)对反应进行标号: △H1= a kJ·①, △H2= b kJ·②,将反应②-①3得, △H3,;
(2)①A.、能判断反应达到平衡,仅无法判断是否达到平衡,A项错误;
B.体积为1L的刚性密闭容器中充入2 mol和1mol发生反应,反应前后总质量不变,反应过程中体积始终保持为1L,质量体积均不变,密度不会改变,故无法判断反应是否达到平衡,B项错误;
C.的体积分数不再改变且总体积为1L,表明的体积不变,即物质的量不再改变,反应达到平衡,C项正确;
D.在反应过程中,与的体积比始终为1:1,故与的体积比不再改变无法判断反应是否达到平衡,D项错误;
答案选C;
②A.恒容条件下充入氦气对平衡无影响,不会改变的平衡转化率,A项错误;
B.该反应△H<0,升高温度,平衡向逆向移动,的平衡转化率减小,B项错误;
C.充入2 mol,平衡向正向移动,但的转化率降低,C项错误;
D.充入2 mol 和1mol ,投料比为2:1,相当于增大压强,平衡向正向移动,的平衡转化率增加,D项正确;
答案选D。
③达到平衡时,的浓度为0.5,列出三段式:
容器体积为1L,所以=1mol,=0.5mol,=0.5mol,=,NO2的平衡转化率为;反应物与生成物总物质的量为2.5mol,,,;
④对于该反应而言,增大压强,平衡向正向移动,NO2的转化率增大,所以x()减小,结合图象可以推测a点压强大于b点,即pa>pb,a点和b点的x()相同,并且从题③可知与总压强成反比,所以b点的压强熵大于a点的压强熵。
18. 33.3% 3.7 ad < 降低压强 > 使用催化剂 1.5×10-3 mol·L-1·s-1 bc c
【详解】(1)①达到平衡时NH3为0.1 mol,说明H2转化了0.15mol,因此开始时H2的物质的量为0.15mol+0.3mol=0.45mol,所以该条件下H2的转化率为×100%=33.3%;此温度下该反应平衡常数K===3.7;
②a.向容器中按原比例再充入原料气,容器内压强将增大,平衡将正向移动,H2的转化率将增加,故a可行;
b.向容器中再充入惰性气体不会改变参加反应物质的浓度和压强,因此平衡不移动,故b不可行;
c.催化剂只是能够同等程度改变化学反应速率,不会改变化学平衡,所以改进催化剂后不会使平衡发生移动,故c不可行;
d.液化生成物分离出氨,会降低生成物浓度,平衡将正向移动,能够提高H2转化率,故d可行;
综上所述,可行的是ad项,故答案为ad;
③将图像补充完整即为: ,由图可知,t2时刻v正t5时刻;
t8所改变条件使正逆反应速率同等程度增大,平衡不发生移动,所以改变的条件是加入了催化剂,故答案为:<;降低压强;>;使用催化剂;
(2)图中b、c浓度均减小,且Δc(b)=2Δc(c),a浓度逐渐增大,结合化学方程式可知,a为NO2,b为NO,c为O2,
①0~2 s内Δc(O2)=0.005mol/L-0.002mol/L=0.003mol/L,==1.5×10-3 mol·L-1·s-1;
② a.未告知该反应速率所表示方向,因此无法判断反应是否平衡;
b.该反应是气体非等体积反应,反应过程中气体物质的量会发生变化,同温同容时,气体压强之比等于其物质的量之比,因此反应过程中容器内压强会发生变化,当容器内压强不再发生变化时,可说明反应达到平衡状态;
c.任意时刻均满足v逆(NO)=2v逆(O2),若v逆(NO)=2v正(O2),则v正(O2)= v逆(O2),可说明反应达到平衡状态;
d.反应过程中,气体总质量不变,容器体积不变,因此气体的密度不变,所以不能用密度判断反应是否达到平衡;
综上所述,能说明反应以及达到平衡状态的是bc项,故答案为bc;
③ 强化外界条件,化学反应速率将增大,弱化外界条件,化学反应速率将减小,若该条件能够使平衡发生移动,则平衡向能够减弱所改变条件的方向移动,
a.及时分离出NO2气体,容器内压强将降低,使化学反应速率降低,同时生成物浓度降低,平衡将正向移动;
b.适当升高温度将加快化学反应速率,该反应正向为放热反应,因此平衡将逆向移动;
c.增大O2的浓度,容器内压强将增大,使化学反应速率将增大,同时化学平衡将正向移动;
d.催化剂只是同等程度增大正逆反应速率,不会改变化学平衡;
综上所述,能使该反应的反应速率增大,且平衡向正反应方向移动的是c项,故答案为c。
19. 0.0065 mol L﹣1 min﹣1 用催化剂 > < 温度降低,C的平衡浓度增大,说明正反应放热 abd a+c=5 b+1/2c=3 3<a≤5
【分析】(1)①反应速率v= c/ t,实验2中达到平衡时C的物质的量和实验1相同,但达到平衡所需时间比实验1短,说明改变的条件是加入了催化剂,温度不变实验3中的数据分析可知达到平衡状态C的物质的量为0.6mol大于实验1、2 达到平衡状态C的物质的量,说明C的起始量大于1.0mol;
②比较实验4和实验1,温度降低,起始量相同,达到平衡C的物质的量增大,说明升温平衡逆向进行;
(2)A.10~15min,反应速率增大;
B.10~15min未到达平衡,且改变条件,速率增大,反应进行向正反应进行,可能为使用催化剂或升高温度或增大压强;
C.20min时若缩小了容器体积,则20min时B的物质的量不会变化;
D.20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应增大B的物质的量,可能是增加了B的量。
(3)2A(g)+B(g) 2C(g),反应前后气体体积减小,压强不变,说明达到相同平衡状态,结合等效平衡的判断依据,恒温恒容条件下,通过极值转化,满足起始量是“等量等效”分析计算;欲使起始时反应表现为向正反应方向进行,A的物质的量大于平衡时的物质的量,但起始总量不能超过5mol,据此答题。
【详解】(1)①在实验1中反应在10至20min内反应的平均速率v(C)= c/ t=[(0.8-0.67)/2)]/(20-10)=0.0065 mol L﹣1 min﹣1,实验2中达到平衡时C的物质的量和实验1相同都为0.5mol,但达到平衡所需时间实验2为20min,实验1为40min,需要时间短,说明是增大反应速率不改变化学平衡,改变的条件是加入了催化剂,温度不变实验3中的数据分析可知达到平衡状态C的物质的量为0.6mol大于实验1、2 达到平衡状态C的物质的量,说明C的起始量大于1.0mol;
综上所述,本题正确答案为:0.0065 mol L﹣1 min﹣1 ,用催化剂,>;
②比较实验4和实验1,达到平衡C的物质的量为0.5mol,0.7mol,实验4是温度降低达到平衡C的物质的量增大,依据化学平衡移动原理可知,升温平衡向吸热反应方向进行,证明该反应的正反应为放热反应,Q<0;
综上所述,本题正确答案为:<;温度降低,C的平衡浓度增大,说明正反应放热;
(2)a。10~15min未到达平衡,图象斜率可知改变条件,反应速率都增大,所以可能是改变的条件为升温,故a正确;
b。10~15min未到达平衡,且改变条件后,反应速率都增大,反应向着正反应方向进行,可能为使用催化剂或升高温度或增大压强,故b正确;
c。20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应增大B的物质的量;如果缩小容器体积,则20min时B的物质的量不会变化,故c错误;
d。20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应该是增大了B的物质的量,故d正确;
综上所述,本题正确答案为:abd;
(3)①一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8;若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8,说明反应达到相同平衡状态,极值转化后等量等效计算分析,
2A(g)+B(g) 2C(g)
起始量(mol) 5 3 0
起始量(mol) a b c
极值转化量(mol) a+c b+1/2c 0
a、b、c必须满足的关系是等量等效,a+c=5, b+1/2c=3,
综上所述,本题正确答案为:a+c=5,b+1/2c=3;
②根据Ⅰ中的计算可知,设消耗B物质的量为x
2A(g)+B(g) 2C(g)
起始量(mol) 5 3 0
变化量(mol) 2x x 2x
平衡量(mol) 5﹣2x 3﹣x 2x
器内气体压强为P(始)的7/8,气体压强之比等于气体物质的量之比,5﹣2x+3﹣x+2x=7/8(5+3),x=1mol,反应达到平衡时,参加反应的A为2mol,则平衡时A的物质的量为3mol,欲使起始时反应表现为向正反应方向进行,A的物质的量大于平衡时的物质的量,但起始总量不能超过5mol,所以有3<a≤5;
综上所述。本题正确答案为:3<a≤5。
20.(1) 大于 小于 小于
(2)B
(3) 3(或3:1) 50% 4
(4) 选用合适的催化剂、增大压强 适当降低温度等 0.033
【详解】(1)根据图象分析可知,250以前,由于温度低,速率慢,还没达到平衡,则x点的v(正)大于v(逆);250以后达到平衡,温度升高,平衡逆移,反应放热,y点的v(正)等于y点的v(逆),大于平衡前的x点的v(正),答案为:大于;小于;小于;
(2)A.混合气体的密度为气体的总质量与气体总体积之比,为衡量,则混合气体的密度不变,反应不一定达到平衡状态,A错误;
B.恒容绝热体系,反应放热,所以温度不断升高,是反应速率不断增大,正向建立平衡,反应物不断减小,生成物不断增大,混合气体的浓度商Qc逐渐增大,最后不再变化时,Qc=Kc,B正确;
C.起初该反应的化学反应速率随着反应的进行不断加快,但反应到一定时间后,反应物的浓度逐渐减小,导致速率会有所下降,C错误;
D.根据分析可知,反应为气体分子数减小的放热反应,结合理想气体状态方程PV=nRT可知,达到平衡后升高温度,平衡逆向移动,D错误;
答案选B;
(3)①原料气中的CO2和H2的物质的量之比等于化学计量数之比时,原料利用率最高,CH3OH平衡百分含量(a%)最大,故答案为:3(或3:1);
②在平衡状态x点时,CH3OH平衡百分含量(a%)为25%,二氧化碳初始投入浓度为1mol/L,CO2的平衡转化率为x,则三段式列出如下:
,,解得x=0.5,所以CO2的平衡转化率为=50%;平衡常数;
③在平衡状态y点时投料比虽然改变,但温度不变,所以其平衡常数与投料比为2:1的平衡常数苏相同,结合上问所求即为4;
(4)在合成甲醇的反应中同时存在:CO2(g)+H2(g)CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可提高主反应的转化率,如选用合适的催化剂、增大压强,或适当降低温度;
在某密闭容器中通入1molCO2和3molH2,在催化剂作用下,同时发生:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)和②CO2(g)+H2(g)CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则根据三段式思想可知,平衡时n(CO2)=1-0.3-0.1=0.6mol,n(H2)=3-0.33-0.1=2mol,n(H2O)=0.3mol+0.1mol=0.4mol,设密闭容器的体积为V,则反应②的化学平衡常数K=。
21. 减小 增大 0.01mol/(L·s) CD BC
【分析】(1)在其它条件不变的情况下,针对可逆反应,降低温度,正逆反应速率均减小;加压,体积缩小,浓度增大,正逆反应速率均增大;
(2)根据气体的压强之比和气体的总量成正比规律,结合三段式列方程进行计算求出甲醇的变化量,最后根据v= c/ t计算。
(3)根据平衡状态的判断的标准进行分析:v正=v逆,各组分浓度保持不变及由此衍生出的物理量进行分析判断;
(4)根据平衡移动规律进行分析。
【详解】(1)在其它条件不变的情况下降低温度,正逆反应速率均减小;在其它条件不变的情况下加压,体积缩小,浓度增大,正逆反应速率均增大;
故答案为减小;增大 ;
(2)密闭容器(体积为2L)中发生可逆反应,设甲醇的变化量为xmol,
CH3OH(g)+H2O(g)CO2(g)+3H2(g);
起始量 1mol 3mol 0 0
变化量 x x x 3x
20s后量 1-x 3-x x 3x
根据气体的压强之比和气体的总量成正比可知,(1-x+3-x+x+3x):(1+3)=1.2:1,计算出x=0.4mol;甲醇表示该反应的速率为(0.4/2)/20=0.01mol/(L·s);
故答案为0.01mol/(L·s);
(3)A. v正(CH3OH)=v正(CO2)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡,故A错误;
B.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故B错误;
C.混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故C正确;
D.平衡时各物质的浓度保持不变, CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故D正确;
故答案选CD。
(4)A.该反应正反应是吸热反应,升高温度,平衡正反应移动,故A错误;
B.该反应正反应是吸热反应,降低温度,平衡向逆反应移动,故B正确;
C.该反应正反应是体积增大的反应,增大压强,平衡逆反应移动,故C正确;
故答案选BC。
22.(1)40
(2) 增大 减小 减小
(3) 1.2 4.19
【解析】(1)
设CO(g)和H2O(g)的物质的量均为1,,此温度下该反应的平衡常数K=16,则,得x=0.8mol,则平衡时体系中H2的物质的量分数为。
(2)
升高温度,正逆反应速率均增大,则v正增大,v逆增大;已知H2的体积分数随温度的升高而增加,说明升温,平衡逆移,△H<0,平衡常数K减小,转化率α(H2)减小;温度相同,平衡常数相同,则。
(3)
A点表示c(H2C2O4)=c(HC2O),Ka1=,c(H+)=Ka1,pH=-lg(H+)=-lgKa1=PKa1=1.2,即a=1.2。同理B点表示c(C2O)=c(HC2O),Ka2=,c(H+)=Ka2,pH=-lg(H+)=-lgKa2=PKa2=4.19,b=4.19。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13题)
1.在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙所示),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是。
A.此过程为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程
B.此过程为自发过程,而且没有热量的吸收或放出
C.此过程从有序到无序,混乱度增大
D.此过程是自发可逆的
2.下列有关说法正确的是
A.在潮湿的空气中,白铁皮(镀锌)镀层受损后,比受损前更容易生锈
B.对于反应,增大反应容器体积,达到平衡时,减小
C.反应 达到平衡后,升高温度,反应速率和的平衡转化率均增大
D.恒温恒容下,反应,当气体密度不变时,可判断反应达到了平衡
3.下列事实不能用勒夏特列原理解释的是
A.鼓入过量空气有利于SO2转化为SO3
B.工业合成氨选择400—500℃的较高温度
C.合成氨时采用循环操作及将氨液化分离,可提高原料的利用率
D.打开汽水瓶,看到有大量的气泡逸出
4.四氯化钛是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为。在条件下,转化为有两种方法,其反应的热化学方程式分别为:
①直接氯化
②碳氯化
对于反应,下列说法正确的是
A.
B.E(总反应物)(总生成物)(E表示物质能量)
C.反应中每消耗,转移电子的数目为
D.升高温度、增大压强均能提高产率
5.下列实验事实不能用勒夏特列原理解释的是
A.打开啤酒瓶盖,喷出大量泡沫
B.新制的氯水在光照下颜色逐渐变浅
C.实验室用排饱和食盐水而不用排水法收集氯气
D.H2、I2、HI平衡混合气加压后颜色变深
6.下列实验中,反应速率加快是由催化剂引起的是
A.在炭粉中加入KClO3 ,点燃时燃烧更为剧烈
B.H2O2中加入少量FeCl3,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快
7.反应2X(g)+Y(g)2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
8.t℃时,向容积为2L的刚性容器中充入1mol 和一定量的发生反应;,HCHO的平衡分压与起始的关系如图所示。已知:初始加入2mol 时,容器内混合气体的总压强为1.2p kPa,为以分压表示的平衡常数,分压=总压×物质的量分数。下列叙述正确的是
A.e点:
B.随增大,HCHO的平衡分压不断增大
C.a点时反应的压强平衡常数
D.b点时再投入1mol 、1.5mol ,平衡时,的转化率减小
9.我国科学家使用双功能催化剂催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率,反应过程示意图如下,下列说法正确的是
A.过程Ⅰ、过程Ⅱ均为放热过程
B.图中显示:起始时的2个H2O都参与了反应过程
C.过程Ⅲ只生成了极性共价键
D.使用催化剂降低了水煤气变换反应的ΔH
10.2021年我国科学家以为原料人工合成淀粉,其效率约为传统农业生产淀粉的8.5倍,其部分合成路线如图所示,下列有关说法正确的是
①
②
③
④
A.第①步反应断裂了非极性键与极性键
B.催化剂降低了反应的活化能,改变了反应的焓变,降低了合成淀粉的难度
C.化合物a属于电解质
D.反应④是吸热反应,活化能较大,所以是决速步
11.下列有关工业生产的叙述中,正确的是
A.硫酸生产中常采用催化剂提高SO2的转化率
B.合成氨中采用及时分离氨气提高反应速率
C.电镀铜时,溶液中c(Cu2+)基本保持不变
D.用电解熔融氧化镁的方法制取镁
12.1888年提出的勒夏特列原理成为判断化学平衡的重要理论依据,许多化学事实都与其相关,下列不能用勒夏特列原理解释的是
A.工业上合成通常要在高压下进行
B.压缩盛有的容器体积时,气体颜色变深
C.用饱和食盐水除去中含有的少量HCl
D.向滴加了KSCN溶液的溶液中再加少量铁粉,溶液红色变浅
13.在一定压强下,向10L密闭容器中充入和,发生反应 。S2Cl2与的消耗速率(v)与温度(T)的关系如图所示,下列说法错误的是
A.A、B、C、D点中,达到平衡状态的为A点
B.达到平衡后继续加热,平衡向逆反应方向移动
C. H<0
D.一定温度下,在恒容密闭容器中,达到平衡后再按原比例投入S2Cl2与Cl2,重新达到平衡后,Cl2转化率不变
二、填空题(共9题)
14.一定温度下,在恒容的密闭容器内,将2 mol 和1 mol 混合发生反应: 。回答下列问题:
(1)升高温度,混合气体的密度 (填“变大”“变小”或“不变”)。
(2)若反应达到平衡后,再充入,平衡将 (填“正向”“逆向”或“不”)移动,的转化率 (填“增大”“减小”或“不变”)。
(3)若反应达到平衡后,将、、同时增大1倍,平衡将 移动。
(4)如图表示合成反应在某段时间中反应速率与时间的曲线图,、时刻分别改变某一外界条件,它们依次为 、 ;的体积分数最小的平衡时间段是 (填序号)。
15.回答下列问题
(1)已知合成氨反应:N2(g)+H2(g) NH3(g) ΔH=-46.2 kJ·mol-1,标准平衡常数Kθ=,其中pθ为标准压强,p(NH3)、p(N2)、p(H2)为各组分的平衡分压,如p(NH3)=x(NH3)p,p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。若往一密闭容器中加入的N2、H2起始物质的量之比为1∶3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则Kθ= (用含w的最简式表示)。
(2)某科研小组向一恒容密闭容器中通入2 mol CH4、2 mol CO2,控制适当条件使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol-1,测出CH4的某个平衡物理量X随着温度、压强的变化如图所示
①X (填“能”或“不能”)表示平衡体系中CH4的体积分数;p1、p2的大小关系为 ,b点浓度商Qc与对应温度下的平衡常数K相比,较大的是
②若容器容积为2 L,a点时c(CH4)=0.4 mol·L-1,则相应温度下的平衡常数K=
16.石油产品中含者H2S及COS等多种有机硫化物,石油化工催生出多种脱硫技术,请回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)S2(g)+2H2(g) ΔH1=+180kJ·mol-1
②CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
计算反应③:CH4(g)+2H2S(g) CS2(g)+4H2(g) ΔH3= kJ·mol-1
(2)工业生产中应用:COS的水解反应为COS(g) + H2O(g) CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[]的转化关系如图甲所示。
① 向起始容器中投入一定量反应物,一定可以判断反应到达平衡状态的是 (填字母)。
A.容器中气体密度不变 B.保持不变
C.该反应化学平衡常数保持不变 D.υ逆(COS)= υ正(H2S)
② 根据图甲和图乙判断该反应的最佳条件为:投料比[] ;温度
③ 当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是 ; 。(写出两条)
(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示,则阳极区发生的总反应为 。
(4)可以用K2CO3溶液吸收H2S,其原理:K2CO3+ H2SKHS +KHCO3,该反应的平衡常数为 。( 已知H2CO3的Ka1=4.2×10-7 ,Ka2=5.6×10-11 ;H2S的Ka1=5.6×10-8 ,Ka2=1.2×10-15)
17.雾霾主要成分为灰尘、、、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)以氨气为脱硝剂时,可将还原为。
已知:
i. △H= a kJ·
ii. △H= b kJ·
则反应的 △H= kJ·。
(2)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为: △H <0某温度时,在体积为1L的刚性密闭容器中充入2 mol和1mol发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是 (填标号)。
A. B.混合气体密度不再改变
C.的体积分数不再改变 D.与的体积比不再改变
②欲增加的平衡转化率,可采取的措施有 (填标号)。
A.充入氦气 B.升高温度
C.充入2 mol D.充入2 mol 和1mol
③达到平衡时,混合气体总压为p,的浓度为0.5,则的转化率为 ,平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
④若在不同压强下进行反应,体系中物质的量分数x()与反应时间的关系如图所示,a、b两点的压强商Qp(以分压表示)较大的是 (填“a”或“b”)。
18.氮气是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
① 将一定量的N2(g)和H2(g)放入1 L的密闭容器中,在500 ℃、2×107 Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。计算此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
③在不同的条件下,测定合成氨反应的速率与时间的关系如图所示:
如果t2、t4、t6、t8时都仅改变了一个条件,可看出t2时刻的v正 v逆(填“>”、“=”或“<”);t4时改变的条件是 ; 在t2时刻的H2转化率 t5时刻(填“>”、“=”或“<”);t8时改变的条件是 。
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g) ΔH<0体系中,各成分浓度随时间的变化如图所示。
①用O2表示0~2 s内该反应的平均速率v = 。
②能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
③能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
19.在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
实验序号 0 10 20 30 40 50 60
1 80℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 80℃ n2 0.60 0.50 0.50 0.50 0.50 0.50
3 80℃ n3 0.92 0.75 0.63 0.60 0.60 0.60
4 73℃ 1.0 0.90 0.80 0.75 0.70 0.65 0.65
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),理由是
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的 。
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是 , 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
20.工业上利用CO2和H2合成甲醇,既能减少温室气体排放,又能合成重要工业燃料。发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H。其它条件不变时,反应相同时间CO2的转化率随温度T的变化情况如图所示。
回答下面问题:
(1)x点的v(正) v(逆)(填“大于”“小于”或“等于”,下同),x点的v(正) y点的v(逆),△H 0。
(2)在某体积不变的绝热刚性容器中发生上述反应,下列说法正确的是 。
A.混合气体的密度不再发生变化时反应达到化学平衡状态
B.混合气体的浓度商Qc逐渐增大,最后不再变化时,Qc=Kc
C.该反应的化学反应速率随着反应的进行不断加快
D.达到平衡后升高温度,气体压强增大,化学平衡可能正向移动
(3)在一定温度和压强下,若原料气中的CO2和H2的物质的量之比=M,如图是M与CH3OH平衡百分含量(a%)的关系。
①M1= 。
②在平衡状态x点时,CO2的平衡转化率为 %。
③在平衡状态y点时,用百分含量表示的平衡常数K= 。
(4)在合成甲醇的反应中同时存在:CO2(g)+H2(g)CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可以采取的措施是 、 (写出两点)。在某密闭容器中通入1molCO2和3molH2,在催化剂作用下,同时发生:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)和②CO2(g)+H2(g)CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则反应②的化学平衡常数是 (保留三位小数)。
21.CH3OH(g)+H2O(g)CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(3)判断该可逆反应达到平衡状态的依据是(填序号) 。
A. v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D .CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
22.含碳化合物种类繁多。回答下列问题:
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g)CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为 %。
(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)CH4(g)+2H2O(g)。已知反应达平衡时H2的体积分数随温度的升高面增加。达平衡后温度从300°C升至400°C,v正 (填“增大”“减小”或“不变”,,下同),重新达到平衡,平衡常数K ,CO2转化率α ;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO)/mol·L-1 c(H2)/mol·L-1 c(CH4)/mol·L-1 c(H2O)/mol·L-1
平衡I a b c d
平衡II m n x y
则a、b、c、d与m、n、x、y之间的关系式为 。
(3)已知pKa=-lgKa,25°C时,H2C2O4的pKa1=1.2,pKa2=4.19,草酸溶液中各含碳物种的分布分数α(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。则图中a= ,b= 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.由图可看出,此过程气体分子由有序变为混乱,为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程,A正确;
B.由题意知ΔH=0,B正确;
C.由图可看出,此过程从有序到无序,混乱度增大,C正确;
D.ΔS>0,由ΔH-TΔS<0知,该过程的逆过程不能自发进行,D错误;
答案选D。
2.D
【详解】A.在潮湿的空气中,白铁皮(镀锌)镀层受损后,由于金属Zn的活动性比Fe强,在构成的原电池反应中Zn为负极,仍然会对铁起保护作用,所以Fe不会比受损前更容易生锈,A错误;
B.该反应的化学平衡常数,由于化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以当反应达到平衡时不变,B错误;
C.升高温度,化学反应速率加快。由于该反应的正反应是放热反应,所以升高温度,会使化学平衡逆向移动,最终导致的平衡转化率降低,C错误;
D.该反应的反应前后气体的质量会发生改变,容器的容积不变,若气体密度不变时,则气体的质量不变,因此反应达到了平衡状态,D正确。
故选D。
3.B
【详解】A.SO2生成SO3,反应方程式为2SO2+O22SO3,鼓入过量空气,增加氧气的浓度,平衡向正反应方向进行,有利于SO2转化成SO3,符合勒夏特列原理,故A不符合题意;
B.合成氨为放热反应,升高温度不利于合成氨,但工业上合成氨选择400-500℃的较高温度,使催化剂催化效果达到较大,催化剂对化学反应平衡移动无影响,不符合勒夏特列原理,故B符合题意;
C.将氨液化分离,减少生成物浓度,促使平衡向正反应方向进行,提高原料率的转化率,符合勒夏特列原理,故C不符合题意;
D.存在CO2(g)CO2(aq),打开汽水瓶,压强减小,平衡向左进行,符合勒夏特列原理,故D不符合题意;
答案为B。
4.C
【详解】A.该反应前后气体分子数不变,但固体转化为气体的过程中熵增大,,故A错误;
B.该反应为吸热反应,反应物的总能量小于生成物的总能量,故B错误;
C.有反应可知氯气在反应中作氧化剂转化为,1mol得2mol电子,消耗,转移电子的数目为,故C正确;
D.由已知直接氯化反应为吸热反应,碳氯化反应为放热反应,升高温度有利于直接氯化反应但不利于碳氯化反应;直接氯化反应反应前后气体分子数相等,增大压强平衡不移动,不利于提高产率,碳氯化反应,反应后气体分子数增大,增大压强平衡逆向移动,会降低产率,故D错误;
故选:C。
5.D
【详解】A.啤酒中有大量二氧化碳,在啤酒中存在平衡:CO2(g)+2H2O(l)H2CO3(aq),打开瓶盖,压强减小,平衡逆向移动,二氧化碳从啤酒中逸出,能用勒夏特列原理解释,故A不选;
B.氯水是氯气溶于水形成的水溶液,氯气溶于水时发生了可逆反应:Cl2+H2OHCl+HClO,光照下HClO会分解,生成物HClO浓度降低,平衡正向移动,氯水颜色变浅,能用勒夏特列原理解释,故B不选;
C.氯气能溶于水,在氯水中有如下平衡:Cl2+H2O H++Cl-+HClO,饱和食盐水中有大量的Cl-,可以降低氯气在水中的溶解度,从而可以用排饱和食盐水的方法收集氯气,可以用勒夏特列原理解释,故C不选;
D.H2+I2(g)2HI,加压平衡不移动,颜色加深的原因是容器体积减小,I2浓度增大,不能用勒夏特列原理解释,故D选;
故选D。
6.B
【详解】A.炭粉中加入KClO3 ,点燃时燃烧更为剧烈,是因为碳的燃烧使氯酸钾分解产生氧气,氧气具有助燃性,所以燃烧更为剧烈,与催化剂无关,错误;
B.H2O2中加入少量FeCl3,即可迅速放出气体,说明铁离子在过氧化氢分解中起催化作用,分解速率加快,与催化剂有关,正确;
C.增大反应物与氧气的接触面积,燃烧的更充分,与催化剂无关,错误;
D.锌与稀硫酸反应中加入少量硫酸铜,产生氢气速率加快,是因为Zn与硫酸铜发生置换反应生成的Cu与Zn形成原电池,加快反应速率,与催化剂无关,错误;
故选B。
7.C
【详解】压强相同时温度越高反应速率越快,达到平衡所需时间越短,所以T1>T2;温度相同时压强越大反应速率越快,达到平衡所需时间越短,所以P1>P2,故答案为C。
8.C
【分析】由图可知随着加入氢气量的增多平衡正向移动产物的分压增大,abc构成曲线上的点均为平衡点,e点不是平衡点,依此答题。
【详解】A.e点对应的平衡点是b点,所以此时生成物压强小于平衡压强,平衡需向正反应方向移动,所以,A错误;
B.随增大,相当于增加氢气的浓度,平衡向右移动,生成的HCHO越来越多,平衡分压不断增大,当时剩余的反应物越来越多所以HCHO的平衡分压会减小,B错误;
C.根据c点加入2mol氢气,=2则起始加入1mol二氧化碳,由三段式分析:,体积不变时压强之比等于物质的量之比所以,,甲醛的物质的量为0.5摩尔,分压是0.2p kPa,所以平衡状态中二氧化碳、氢气、甲醛、水蒸气的分压分别为:0.2p kPa、0.4p kPa、0.2p kPa、0.2p kPa,,,平衡常数只与温度有关所以a点时反应的压强平衡常数,C正确;
D.b点时再投入1mol 、1.5mol ,相当于对原平衡体系体积缩小一半,压强增大平衡右移,所以平衡时,的转化率增大,D错误;
故选C。
9.B
【详解】A.从图中可以看出,过程Ⅰ、过程Ⅱ都断裂O-H共价键,所以均为吸热过程,A错误;
B.图示显示:在过程Ⅰ、过程Ⅱ中,2个H2O都断裂部分O-H键,所以起始时的2个H2O都参与了反应,B正确;
C.过程Ⅲ中CO、氢氧原子团和氢原子形成了二氧化碳、水和氢气,H2中的化学键为非极性键,C错误;
D.使用催化剂只能降低反应的活化能,但不能改变反应物和生成物的总能量,所以不能降低水煤气变换反应的ΔH,D错误;
故选B。
10.D
【详解】A.第①步反应断裂了非极性键,因为H2与CO2只含有非极性键,A错误;
B.催化剂降低了反应的活化能,降低了合成淀粉的难度,但是不能改变反应的焓变,B错误;
C.化合物a属于非电解质,C错误;
D.反应④△H>0,是吸热反应,活化能较大,所以是决速步,D正确;
答案选D。
11.C
【详解】A.硫酸生产中采用催化剂,可以加快反应速率、缩短反应达到平衡的时间,但不能提高SO2的转化率,故A错误;
B.合成氨中采用及时分离氨气,是为了促进平衡正向移动,提高产率,但氨气浓度减小,反应速率减慢,故B错误;
C.电镀时,阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极铜溶解质量约等于阴极析出铜的质量,所以溶液中c(Cu2+)基本保持不变,故C正确;
D.制取金属Mg是电解熔融的氯化镁,氧化镁的熔点太高,熔融时需要消耗大量的能量,不宜采用电解熔融物的方法,故D错误;
故选C。
12.B
【详解】A.合成的反应为,该反应是气体体积减小的反应,增大压强,平衡正向移动,可以提高生产的效率,能用勒夏特列原理解释,A项不符合题意;
B.反应过程中,压缩盛有NO2(g)的容器体积时,气体颜色变深是NO2的浓度增大导致的,与勒夏特列原理无关,B项符合题意;
C.氯气和水反应生成氯化氢和次氯酸,是化学平衡,饱和氯化钠溶液中氯离子浓度大,平衡逆向进行,降低氯气溶解度,能用勒夏特列原理解释,C项不符合题意;
D.加入固体KSCN,发生反应,溶液呈红色,加入铁粉后,Fe和反应生成,c()减小,平衡逆向移动,溶液颜色变浅,可以用勒夏特列原理解释,D项不符合题意;
故选B。
13.A
【详解】A.根据反应可知, 时,反应达到平衡状态,由图象可知,B、D点时,反应达到平衡状态,A错误;
B.达平衡后继续加热,,即,v(正)
D.再按原比例投入反应物,相当于对反应容器进行加压,反应物转化率不变,D正确。
故答案选择A。
14.(1)不变
(2) 正向 增大
(3)正向
(4) 升高温度 降低压强 t5-t6
【详解】(1)由质量守恒定律可知,反应前后气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,则升高温度,混合气体的密度不变,故答案为:不变;
(2)反应达到平衡后,再充入氧气,生成物的浓度增大,平衡向正反应方向移动,二氧化硫的转化率增大,故答案为:正向;增大;
(3)反应达到平衡后,将二氧化硫、氧气和三氧化硫的浓度均增大一倍,反应的浓度熵Qc==,浓度熵小于平衡常数,则平衡向正反应方向移动,故答案为:正向;
(4)由图可知,t1时刻条件改变的瞬间正、逆反应速率同时增大,且逆反应速率增大幅度大于正反应速率,平衡向逆反应方向移动,则改变的条件为升高温度;t3时刻条件改变的瞬间正、逆反应速率相等,且同等幅度增大,化学平衡不移动,则改变的条件为使用催化剂;t4时刻条件改变的瞬间正、逆反应速率同时减小,且正反应速率减小幅度大于逆反应速率,平衡向逆反应方向移动,则改变的条件为降低压强,所以三氧化硫体积分数最小的平衡时间段为t5-t6,故答案为:升高温度;降低压强;t5-t6。
15.(1)
(2) 不能 p1
理论生成NH3 2 mol,故=w,a=w,又因为p=pθ,因此:Kθ=。
(2)①压强一定时升高温度,X表示的物理量增加,而升温有利于平衡向右移动,故X不能表示平衡体系中CH4的体积分数;X可以看成是平衡体系中CH4的转化率,由于正反应是气体分子数增加的反应,压强越小越有利于平衡向右移动,CH4的平衡转化率越大,故p1
16.(1)+261kJ·mol-1
(2) D 10∶1 160℃ 催化剂活性降低 平衡向逆反应方向移动
(3)
(4)1×103
【详解】(1)根据盖斯定律,由反应①+反应②可得反应③,故ΔH1+ΔH2=ΔH3,即ΔH3=(+180kJ·mol-1)+(+81kJ·mol-1)=+261kJ·mol-1。
(2)①A.根据质量守恒定律,混合气体的质量不变,容器的体积不变,密度,故气体的密度始终不变,当容器中气体的密度不发生变化时不能证明反应达到平衡,A项错误;B.根据反应方程式,COS与H2O的化学计量数之比是1∶1,故在反应过程中两者的浓度之比应该保持不变,保持不变不能证明反应达到平衡,B项错误;C.化学平衡常数只与温度有关,当温度一定时化学平衡常数不变,C项错误;D.根据反应方程式,υ正(COS)= υ正(H2S),则υ逆(H2S)= υ正(H2S),即υ逆(COS)= υ正(H2S)正反应速率等于逆反应速率,说明反应达到平衡,D项正确;故选D。②根据图甲可知,最佳投料比=10∶1,由图乙可知,最佳温度为160℃。③当温度升高到一定值后,COS转化率降低,可能的原因是反应放热,升高温度平衡逆向移动,也可能是催化剂的活性降低。
(3)该装置为电解池, CO2在ZnO@石墨烯电极上转化为CO,得到电子,发生还原反应,为阴极,石墨烯电极为阳极,失去电子,发生氧化反应,阳极发生了两个反应,首先失去电子转化为EDTA-Fe3+,EDTA-Fe3+再与H2S反应得到EDTA-Fe2+、2分子H+和S,化学方程式表示为、,故总反应为
(4)用K2CO3溶液吸收H2S,其原理的离子方程式可以表示为:,该反应的平衡常数K= = = = ,故该反应的平衡常数K=1×103。
17. (b-3a) C D 50% 5/4p(或) b
【详解】(1)对反应进行标号: △H1= a kJ·①, △H2= b kJ·②,将反应②-①3得, △H3,;
(2)①A.、能判断反应达到平衡,仅无法判断是否达到平衡,A项错误;
B.体积为1L的刚性密闭容器中充入2 mol和1mol发生反应,反应前后总质量不变,反应过程中体积始终保持为1L,质量体积均不变,密度不会改变,故无法判断反应是否达到平衡,B项错误;
C.的体积分数不再改变且总体积为1L,表明的体积不变,即物质的量不再改变,反应达到平衡,C项正确;
D.在反应过程中,与的体积比始终为1:1,故与的体积比不再改变无法判断反应是否达到平衡,D项错误;
答案选C;
②A.恒容条件下充入氦气对平衡无影响,不会改变的平衡转化率,A项错误;
B.该反应△H<0,升高温度,平衡向逆向移动,的平衡转化率减小,B项错误;
C.充入2 mol,平衡向正向移动,但的转化率降低,C项错误;
D.充入2 mol 和1mol ,投料比为2:1,相当于增大压强,平衡向正向移动,的平衡转化率增加,D项正确;
答案选D。
③达到平衡时,的浓度为0.5,列出三段式:
容器体积为1L,所以=1mol,=0.5mol,=0.5mol,=,NO2的平衡转化率为;反应物与生成物总物质的量为2.5mol,,,;
④对于该反应而言,增大压强,平衡向正向移动,NO2的转化率增大,所以x()减小,结合图象可以推测a点压强大于b点,即pa>pb,a点和b点的x()相同,并且从题③可知与总压强成反比,所以b点的压强熵大于a点的压强熵。
18. 33.3% 3.7 ad < 降低压强 > 使用催化剂 1.5×10-3 mol·L-1·s-1 bc c
【详解】(1)①达到平衡时NH3为0.1 mol,说明H2转化了0.15mol,因此开始时H2的物质的量为0.15mol+0.3mol=0.45mol,所以该条件下H2的转化率为×100%=33.3%;此温度下该反应平衡常数K===3.7;
②a.向容器中按原比例再充入原料气,容器内压强将增大,平衡将正向移动,H2的转化率将增加,故a可行;
b.向容器中再充入惰性气体不会改变参加反应物质的浓度和压强,因此平衡不移动,故b不可行;
c.催化剂只是能够同等程度改变化学反应速率,不会改变化学平衡,所以改进催化剂后不会使平衡发生移动,故c不可行;
d.液化生成物分离出氨,会降低生成物浓度,平衡将正向移动,能够提高H2转化率,故d可行;
综上所述,可行的是ad项,故答案为ad;
③将图像补充完整即为: ,由图可知,t2时刻v正
t8所改变条件使正逆反应速率同等程度增大,平衡不发生移动,所以改变的条件是加入了催化剂,故答案为:<;降低压强;>;使用催化剂;
(2)图中b、c浓度均减小,且Δc(b)=2Δc(c),a浓度逐渐增大,结合化学方程式可知,a为NO2,b为NO,c为O2,
①0~2 s内Δc(O2)=0.005mol/L-0.002mol/L=0.003mol/L,==1.5×10-3 mol·L-1·s-1;
② a.未告知该反应速率所表示方向,因此无法判断反应是否平衡;
b.该反应是气体非等体积反应,反应过程中气体物质的量会发生变化,同温同容时,气体压强之比等于其物质的量之比,因此反应过程中容器内压强会发生变化,当容器内压强不再发生变化时,可说明反应达到平衡状态;
c.任意时刻均满足v逆(NO)=2v逆(O2),若v逆(NO)=2v正(O2),则v正(O2)= v逆(O2),可说明反应达到平衡状态;
d.反应过程中,气体总质量不变,容器体积不变,因此气体的密度不变,所以不能用密度判断反应是否达到平衡;
综上所述,能说明反应以及达到平衡状态的是bc项,故答案为bc;
③ 强化外界条件,化学反应速率将增大,弱化外界条件,化学反应速率将减小,若该条件能够使平衡发生移动,则平衡向能够减弱所改变条件的方向移动,
a.及时分离出NO2气体,容器内压强将降低,使化学反应速率降低,同时生成物浓度降低,平衡将正向移动;
b.适当升高温度将加快化学反应速率,该反应正向为放热反应,因此平衡将逆向移动;
c.增大O2的浓度,容器内压强将增大,使化学反应速率将增大,同时化学平衡将正向移动;
d.催化剂只是同等程度增大正逆反应速率,不会改变化学平衡;
综上所述,能使该反应的反应速率增大,且平衡向正反应方向移动的是c项,故答案为c。
19. 0.0065 mol L﹣1 min﹣1 用催化剂 > < 温度降低,C的平衡浓度增大,说明正反应放热 abd a+c=5 b+1/2c=3 3<a≤5
【分析】(1)①反应速率v= c/ t,实验2中达到平衡时C的物质的量和实验1相同,但达到平衡所需时间比实验1短,说明改变的条件是加入了催化剂,温度不变实验3中的数据分析可知达到平衡状态C的物质的量为0.6mol大于实验1、2 达到平衡状态C的物质的量,说明C的起始量大于1.0mol;
②比较实验4和实验1,温度降低,起始量相同,达到平衡C的物质的量增大,说明升温平衡逆向进行;
(2)A.10~15min,反应速率增大;
B.10~15min未到达平衡,且改变条件,速率增大,反应进行向正反应进行,可能为使用催化剂或升高温度或增大压强;
C.20min时若缩小了容器体积,则20min时B的物质的量不会变化;
D.20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应增大B的物质的量,可能是增加了B的量。
(3)2A(g)+B(g) 2C(g),反应前后气体体积减小,压强不变,说明达到相同平衡状态,结合等效平衡的判断依据,恒温恒容条件下,通过极值转化,满足起始量是“等量等效”分析计算;欲使起始时反应表现为向正反应方向进行,A的物质的量大于平衡时的物质的量,但起始总量不能超过5mol,据此答题。
【详解】(1)①在实验1中反应在10至20min内反应的平均速率v(C)= c/ t=[(0.8-0.67)/2)]/(20-10)=0.0065 mol L﹣1 min﹣1,实验2中达到平衡时C的物质的量和实验1相同都为0.5mol,但达到平衡所需时间实验2为20min,实验1为40min,需要时间短,说明是增大反应速率不改变化学平衡,改变的条件是加入了催化剂,温度不变实验3中的数据分析可知达到平衡状态C的物质的量为0.6mol大于实验1、2 达到平衡状态C的物质的量,说明C的起始量大于1.0mol;
综上所述,本题正确答案为:0.0065 mol L﹣1 min﹣1 ,用催化剂,>;
②比较实验4和实验1,达到平衡C的物质的量为0.5mol,0.7mol,实验4是温度降低达到平衡C的物质的量增大,依据化学平衡移动原理可知,升温平衡向吸热反应方向进行,证明该反应的正反应为放热反应,Q<0;
综上所述,本题正确答案为:<;温度降低,C的平衡浓度增大,说明正反应放热;
(2)a。10~15min未到达平衡,图象斜率可知改变条件,反应速率都增大,所以可能是改变的条件为升温,故a正确;
b。10~15min未到达平衡,且改变条件后,反应速率都增大,反应向着正反应方向进行,可能为使用催化剂或升高温度或增大压强,故b正确;
c。20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应增大B的物质的量;如果缩小容器体积,则20min时B的物质的量不会变化,故c错误;
d。20min时A、C的物质的量不变,B的物质的量增大,反应向正反应移动,应该是增大了B的物质的量,故d正确;
综上所述,本题正确答案为:abd;
(3)①一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8;若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8,说明反应达到相同平衡状态,极值转化后等量等效计算分析,
2A(g)+B(g) 2C(g)
起始量(mol) 5 3 0
起始量(mol) a b c
极值转化量(mol) a+c b+1/2c 0
a、b、c必须满足的关系是等量等效,a+c=5, b+1/2c=3,
综上所述,本题正确答案为:a+c=5,b+1/2c=3;
②根据Ⅰ中的计算可知,设消耗B物质的量为x
2A(g)+B(g) 2C(g)
起始量(mol) 5 3 0
变化量(mol) 2x x 2x
平衡量(mol) 5﹣2x 3﹣x 2x
器内气体压强为P(始)的7/8,气体压强之比等于气体物质的量之比,5﹣2x+3﹣x+2x=7/8(5+3),x=1mol,反应达到平衡时,参加反应的A为2mol,则平衡时A的物质的量为3mol,欲使起始时反应表现为向正反应方向进行,A的物质的量大于平衡时的物质的量,但起始总量不能超过5mol,所以有3<a≤5;
综上所述。本题正确答案为:3<a≤5。
20.(1) 大于 小于 小于
(2)B
(3) 3(或3:1) 50% 4
(4) 选用合适的催化剂、增大压强 适当降低温度等 0.033
【详解】(1)根据图象分析可知,250以前,由于温度低,速率慢,还没达到平衡,则x点的v(正)大于v(逆);250以后达到平衡,温度升高,平衡逆移,反应放热,y点的v(正)等于y点的v(逆),大于平衡前的x点的v(正),答案为:大于;小于;小于;
(2)A.混合气体的密度为气体的总质量与气体总体积之比,为衡量,则混合气体的密度不变,反应不一定达到平衡状态,A错误;
B.恒容绝热体系,反应放热,所以温度不断升高,是反应速率不断增大,正向建立平衡,反应物不断减小,生成物不断增大,混合气体的浓度商Qc逐渐增大,最后不再变化时,Qc=Kc,B正确;
C.起初该反应的化学反应速率随着反应的进行不断加快,但反应到一定时间后,反应物的浓度逐渐减小,导致速率会有所下降,C错误;
D.根据分析可知,反应为气体分子数减小的放热反应,结合理想气体状态方程PV=nRT可知,达到平衡后升高温度,平衡逆向移动,D错误;
答案选B;
(3)①原料气中的CO2和H2的物质的量之比等于化学计量数之比时,原料利用率最高,CH3OH平衡百分含量(a%)最大,故答案为:3(或3:1);
②在平衡状态x点时,CH3OH平衡百分含量(a%)为25%,二氧化碳初始投入浓度为1mol/L,CO2的平衡转化率为x,则三段式列出如下:
,,解得x=0.5,所以CO2的平衡转化率为=50%;平衡常数;
③在平衡状态y点时投料比虽然改变,但温度不变,所以其平衡常数与投料比为2:1的平衡常数苏相同,结合上问所求即为4;
(4)在合成甲醇的反应中同时存在:CO2(g)+H2(g)CO(g)+H2O(g) △H>0,为了提高CH3OH的选择性,可提高主反应的转化率,如选用合适的催化剂、增大压强,或适当降低温度;
在某密闭容器中通入1molCO2和3molH2,在催化剂作用下,同时发生:①CO2(g)+3H2(g)CH3OH(g)+H2O(g)和②CO2(g)+H2(g)CO(g)+H2O(g),达到平衡后,测得n(CH3OH)=0.3mol,n(CO)=0.1mol,则根据三段式思想可知,平衡时n(CO2)=1-0.3-0.1=0.6mol,n(H2)=3-0.33-0.1=2mol,n(H2O)=0.3mol+0.1mol=0.4mol,设密闭容器的体积为V,则反应②的化学平衡常数K=。
21. 减小 增大 0.01mol/(L·s) CD BC
【分析】(1)在其它条件不变的情况下,针对可逆反应,降低温度,正逆反应速率均减小;加压,体积缩小,浓度增大,正逆反应速率均增大;
(2)根据气体的压强之比和气体的总量成正比规律,结合三段式列方程进行计算求出甲醇的变化量,最后根据v= c/ t计算。
(3)根据平衡状态的判断的标准进行分析:v正=v逆,各组分浓度保持不变及由此衍生出的物理量进行分析判断;
(4)根据平衡移动规律进行分析。
【详解】(1)在其它条件不变的情况下降低温度,正逆反应速率均减小;在其它条件不变的情况下加压,体积缩小,浓度增大,正逆反应速率均增大;
故答案为减小;增大 ;
(2)密闭容器(体积为2L)中发生可逆反应,设甲醇的变化量为xmol,
CH3OH(g)+H2O(g)CO2(g)+3H2(g);
起始量 1mol 3mol 0 0
变化量 x x x 3x
20s后量 1-x 3-x x 3x
根据气体的压强之比和气体的总量成正比可知,(1-x+3-x+x+3x):(1+3)=1.2:1,计算出x=0.4mol;甲醇表示该反应的速率为(0.4/2)/20=0.01mol/(L·s);
故答案为0.01mol/(L·s);
(3)A. v正(CH3OH)=v正(CO2)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡,故A错误;
B.容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故B错误;
C.混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故C正确;
D.平衡时各物质的浓度保持不变, CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故D正确;
故答案选CD。
(4)A.该反应正反应是吸热反应,升高温度,平衡正反应移动,故A错误;
B.该反应正反应是吸热反应,降低温度,平衡向逆反应移动,故B正确;
C.该反应正反应是体积增大的反应,增大压强,平衡逆反应移动,故C正确;
故答案选BC。
22.(1)40
(2) 增大 减小 减小
(3) 1.2 4.19
【解析】(1)
设CO(g)和H2O(g)的物质的量均为1,,此温度下该反应的平衡常数K=16,则,得x=0.8mol,则平衡时体系中H2的物质的量分数为。
(2)
升高温度,正逆反应速率均增大,则v正增大,v逆增大;已知H2的体积分数随温度的升高而增加,说明升温,平衡逆移,△H<0,平衡常数K减小,转化率α(H2)减小;温度相同,平衡常数相同,则。
(3)
A点表示c(H2C2O4)=c(HC2O),Ka1=,c(H+)=Ka1,pH=-lg(H+)=-lgKa1=PKa1=1.2,即a=1.2。同理B点表示c(C2O)=c(HC2O),Ka2=,c(H+)=Ka2,pH=-lg(H+)=-lgKa2=PKa2=4.19,b=4.19。
答案第1页,共2页
答案第1页,共2页
