河南省鹤壁市重点高中2023-2024学年高二上学期12月月考化学试题(含解析)
文档属性
| 名称 | 河南省鹤壁市重点高中2023-2024学年高二上学期12月月考化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 795.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-21 20:41:21 | ||
图片预览

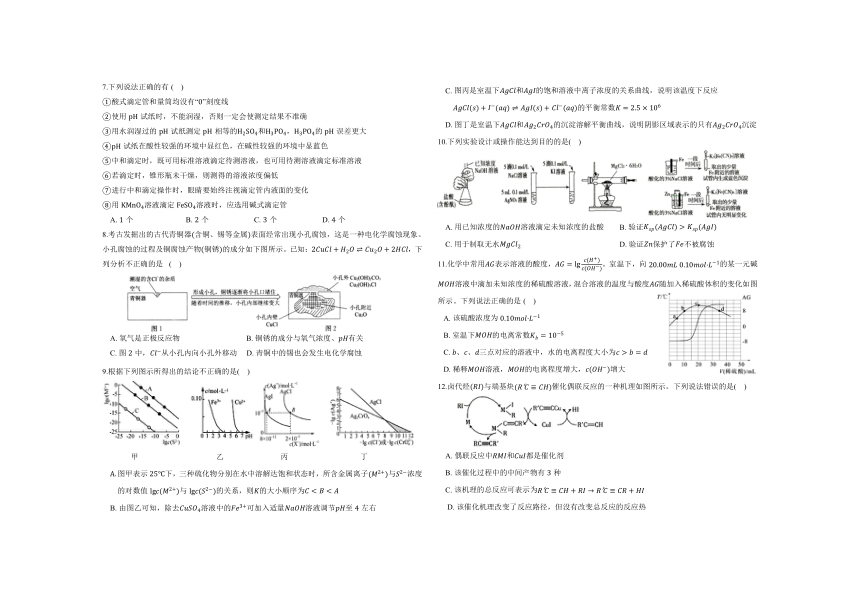

文档简介
鹤壁市高中2025届高二上学期第三次段考·化学试卷
可能用到的相对原子质量:Li-7 C-12 O-16 Mn-55 Ag-108
一、单选题(每题3分,14小题,共42分)
1.下列说法一定正确的是( )
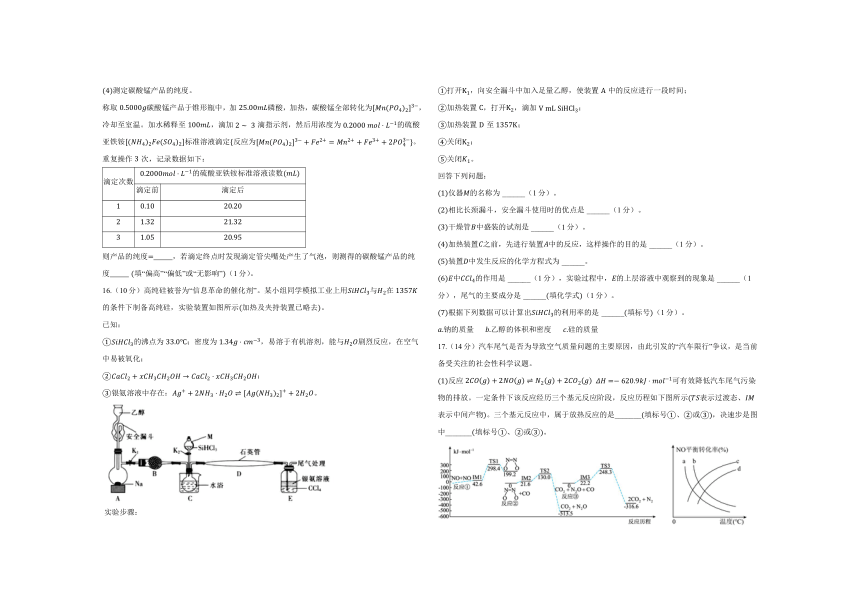
A. 某蒸馏水水样,则该水样中一定掺杂或溶解了某些溶质
B. 相同温度下,中和等的氨水、溶液,所需的物质的量前者更多
C. 相同温度下,相等的、溶液中,水电离的浓度相等
D. 氨水和硫酸反应后的溶液,若溶液呈中性,则
2.废旧铅蓄电池的铅膏中主要含有、、和,还有少量、的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
已知:室温下,;、,完全沉淀的分别是和;开始及完全沉淀的分别是和。下列说法正确的是( )
A. “脱硫”中转化反应的离子方程式:
B. “酸浸”中可以氧化、和
C. “酸浸”后溶液的约为,滤渣的主要成分是和
D. “沉铅”后滤液中,主要存在的阳离子有、、、
3.下列有关说法正确的是( )
A. ;.,若、反应放热,则
B. 一定条件下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为
C. ,则的燃烧热
D. ,则稀硫酸和足量氢氧化钡溶液反应放出的热量为
4.催化重整能够获得氢能,同时消除温室气体,催化重整过程中主要发生反应的热化学方程式如下:
反应
反应
反应
常压下,将::的混合气体置于密闭容器中,在不同温度下的重整体系中,平衡时各组分的物质的量分数如图所示。下列说法不正确的是( )
A. 反应是催化重整的主反应
B. 反应的
C. 间,反应的进行程度大于反应
D. 为提高平衡时的产率,应研发更合适的催化剂
5.下列方程式书写正确的是( )
A. 在水溶液中的电离方程式:
B. 的水解方程式:
C. 的水解方程式:
D. 的电离方程式:
6.相同温度、相同浓度下的八种溶液,其由小到大的顺序如图所示,图中代表的物质可能分别为( )
A. 、、 、
B. 、 、
C. 、
D. 、 、
7.下列说法正确的有( )
酸式滴定管和量筒均没有“”刻度线
使用试纸时,不能润湿,否则一定会使测定结果不准确
用水润湿过的试纸测定相等的和,的误差更大
试纸在酸性较强的环境中显红色,在碱性较强的环境中显蓝色
中和滴定时,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液
若滴定时,锥形瓶未干燥,则测得的溶液浓度偏低
进行中和滴定操作时,眼睛要始终注视滴定管内液面的变化
用溶液滴定溶液时,应选用碱式滴定管
A. 个 B. 个 C. 个 D. 个
8.考古发掘出的古代青铜器含铜、锡等金属表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物铜锈的成分如下图所示。已知:,下列分析不正确的是 ( )
A. 氧气是正极反应物 B. 铜锈的成分与氧气浓度、有关
C. 图中,从小孔内向小孔外移动 D. 青铜中的锡也会发生电化学腐蚀
9.根据下列图示所得出的结论不正确的是( )
甲 乙 丙 丁
图甲表示 下,三种硫化物分别在水中溶解达饱和状态时,所含金属离子与浓度的对数值 与 的关系,则的大小顺序为
B. 由图乙可知,除去溶液中的可加入适量溶液调节至左右
C. 图丙是室温下和的饱和溶液中离子浓度的关系曲线,说明该温度下反应
的平衡常数
D. 图丁是室温下和的沉淀溶解平衡曲线,说明阴影区域表示的只有沉淀
10.下列实验设计或操作能达到目的的是( )
A. 用已知浓度的溶液滴定未知浓度的盐酸 B. 验证
C. 用于制取无水 D. 验证保护了不被腐蚀
11.化学中常用表示溶液的酸度,。室温下,向的某一元碱溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度随加入稀硫酸体积的变化如图所示。下列说法正确的是( )
A. 该硫酸浓度为
B. 室温下的电离常数
C. 、、三点对应的溶液中,水的电离程度大小为
D. 稀释溶液,的电离程度增大,增大
12.卤代烃与端基炔催化偶联反应的一种机理如图所示。下列说法错误的是( )
A. 偶联反应中和都是催化剂
B. 该催化过程中的中间产物有种
C. 该机理的总反应可表示为
D. 该催化机理改变了反应路径,但没有改变总反应的反应热
13.常压下羰基化法精炼镍是工业上提纯镍的主要方法,其原理为
。已知:的沸点为,时该反应的平衡常数,固体杂质不参与反应。
第一阶段:调控温度使粗镍与反应,转化成气态;
第二阶段:将第一阶段反应后的气体分离出来,调控温度制得高纯镍。
下列判断正确的是 ( )
A. 第一阶段将粗镍粉碎有利于平衡正向移动
B. 第二阶段可以选择
C. 第一阶段的温度高于第二阶段的温度
D. 该反应达到平衡时,
14.在药物制剂中,抗氧剂与被保护的药物在与发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。、和是三种常用的抗氧剂。下列说法中,不正确的是( )
已知:溶于水发生反应:
实验用品 实验操作和现象
溶液
溶液
溶液 实验:溶液使紫色石蕊溶液变蓝,溶液使之变红。
实验:溶液与反应,保持体系中浓度不变,不同条件下, 随反应时间变化如图所示。
实验:调溶液的相同,保持体系中浓度不变,测得三者与的反应速率相同。
A. 溶液显碱性,原因是:
B. 溶液中的电离程度大于水解程度
C. 实验说明,在时抗氧性最强
D. 实验中,三种溶液在相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
二、填空题(共4小题,除特殊标注外,每空2分,共58分)
15.(15分)磁性材料产业是世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用含锰废水主要金属离子为、、,还含有少量、、和等为原料,生产的工艺流程如下:
已知该条件下、。
流程中含锰废水经过前三步预处理,得到主要含有的母液。
除铁铝时,在搅拌条件下先加入溶液,再加入溶液调节。加入溶液时发生反应的离子方程式为 。
除重金属时,滤渣的主要成分为 填化学式。
除钙镁时,为使沉淀完全当离子浓度降到时,可视为沉淀完全,需控制溶液中的最低浓度为 。
沉锰过程在为条件下充分进行,反应温度对锰沉淀率的影响如图所示。
沉锰过程发生反应的离子方程式为 。
当温度超过时,沉锰反应的锰沉淀率随温度升高而下降的原因是 。
沉锰后过滤得到粗产品,依次用去离子水和无水乙醇各洗涤次,再低温干燥,得
到纯净的。用无水乙醇洗涤的目的是 。
测定碳酸锰产品的纯度。
称取碳酸锰产品于锥形瓶中,加磷酸,加热,碳酸锰全部转化为,冷却至室温。加水稀释至,滴加滴指示剂,然后用浓度为的硫酸亚铁铵标准溶液滴定反应为。重复操作次,记录数据如下:
滴定次数 的硫酸亚铁铵标准溶液读数
滴定前 滴定后
则产品的纯度 ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰产品的纯度 填“偏高”“偏低”或“无影响”(1分)。
16.(10分)高纯硅被誉为“信息革命的催化剂”。某小组同学模拟工业上用与在的条件下制备高纯硅,实验装置如图所示加热及夹持装置已略去。
已知:
的沸点为;密度为,易溶于有机溶剂,能与剧烈反应,在空气中易被氧化;
;
银氨溶液中存在:。
实验步骤:
打开,向安全漏斗中加入足量乙醇,使装置中的反应进行一段时间;
加热装置,打开,滴加;
加热装置至;
关闭;
关闭。
回答下列问题:
仪器的名称为 ______(1分)。
相比长颈漏斗,安全漏斗使用时的优点是 ______(1分)。
干燥管中盛装的试剂是 ______(1分)。
加热装置之前,先进行装置中的反应,这样操作的目的是 ______(1分)。
装置中发生反应的化学方程式为 ______。
中的作用是 ______(1分),实验过程中,的上层溶液中观察到的现象是 ______(1分),尾气的主要成分是 ______填化学式(1分)。
根据下列数据可以计算出的利用率的是 ______填标号(1分)。
钠的质量 乙醇的体积和密度 硅的质量
17.(14分)汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。
反应 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示表示过渡态、表示中间产物。三个基元反应中,属于放热反应的是_______填标号、或,决速步是图中_______填标号、或。
探究温度、压强、对反应的影响,如上图所示,表示的是_______填标号、、、或。
在一定温度下向容积为的密闭容器中加入、,此时容器总压为,发生上述反应,时达平衡,此时测得氮气的物质的量为,则内用的分压变化量表示的平均速率为 _______。【已知,其中为平衡总压,为平衡系统中的物质的量分数】。
用可催化消除污染:
某条件下该反应速率,,该反应的平衡常数,则_______,_______。
一定温度下,在体积为的恒容密闭容器中加入和发生上述反应,若在相同时间内测得的转化率随温度的变化曲线如图,之间的转化率急剧下降的原因是_______。
18.(19分)I.某科研单位利用电化学原理,使用来制备硫酸,装置如下图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许通过。
通入的电极为______填“正极”或“负极”(1分),其电极反应式为____________________,此电极区溶液的______填“增大”“减小”或“不变”(1分)。
电解质溶液中的通过质子交换膜______填“向左”或“向右”(1分)移动,通入的电极反应式为___________。
如上图装置所示,、、、、、都是惰性电极,甲、乙中溶液的体积和浓度都相同假设通电前后溶液体积不变,、为外接直流电源的两极。将直流电源接通后,极附近呈红色。
极是电源的______填“正极”或“负极”,一段时间后,丁中极附近的颜色逐渐___填“变深”或“变浅”。
若甲、乙装置中的、、、电极均只有一种单质生成时,对应单质的物质的量之比为________。
现用丙装置给铜件镀银,则应是______。若乙溶液体积为,当乙中溶液的时,丙中镀件上析出银的质量为______,甲中溶液的______填“变大”“变小”或“不变”。
若将电极换为铁,其他装置都不变,则甲中发生的总反应的离子方程式为_______________。
鹤壁市高中2025届高二上学期第三次段考·化学答案
一、单选题(每题3分,14小题,共42分)
1-5 CCADD 6-10BBCBD 11-14 BABC
二、填空题(共4小题,除特殊标注外,每空2分,共58分)
15.(15分)【答案】
、
温度升高,受热分解或水解
有利于低温条件下快速干燥
偏低(1分)
16.(10分)【答案】
分液漏斗(1分)
漏斗下端不需插入液体中即可液封(1分)
无水氯化钙或(1分)
排尽装置内的空气 (1分)
防止倒吸; 产生白色沉淀;
(1分)
17.(14分)【答案】
;
;
以后,催化剂活性降低或失活,反应速率急剧下降导致转化率迅速变小
18.(19分)【答案】
I.负极(1分); ; 减小(1分)
向右(1分);
负极(1分); 变浅(1分)
或镀件、铜件; ; 变小
答案详解
1.【解析】A.由于温度未知,因此的蒸馏水也可能是中性,不能说明该水样中一定掺杂或溶解了某些溶质,故A错误;
B.相同温度下,等的氨水、溶液中的浓度相同,没有明确溶液的体积,不能比较中和时所需物质的量的多少,故B错误;
C.相同温度下,相同,相等的、溶液中浓度相同,则浓度相等,溶液中的为水电离出的,水电离出的和浓度相等,故C正确;
D.氨水和硫酸反应后的溶液,若溶液呈中性,则溶液中的溶质为和,且,溶液中存在电荷守恒,因此,故D错误。故选C。
2.【解析】铅膏加入碳酸钠脱硫, 和碳酸根离子反应转化为碳酸铅沉淀;过滤后固体加入醋酸、过氧化氢酸浸,“酸浸”中 具有氧化性,可以氧化转化为 、氧化 为三价铁离子;同时过氧化氢能使 转化为 ,调节使铁、铝转化为沉淀过滤除去,滤液加入氢氧化钠沉铅,一系列转化后得到;
A.已知:室温下 , ;则“脱硫”中 和碳酸根离子反应转化为碳酸铅沉淀,转化反应的离子方程式: ,A错误;
B.“酸浸”中 具有氧化性,可以氧化转化为 、氧化 为三价铁离子;同时过氧化氢能使 转化为 ,反应中铅化合价降低为氧化剂,则过氧化氢中氧元素化合价升高,过氧化氢为还原剂,B错误;
C. 、 ,完全沉淀的分别是和; 开始及完全沉淀的分别是和;则“酸浸”后溶液的约为,滤渣的主要成分是 和 ,C正确;
D.依据分析可知,在“酸浸”后溶液的约为,铁、铝离子转化为沉淀,加入氢氧化钠溶液,铅转化为沉淀,故沉铅后滤液中,主要存在的阳离子有 ,D错误;故选C。
3.【解析】A.气态的能量高于固态,则反应放出的热量多,由于反应放热,则,A正确;
B.合成氨反应为可逆反应,和置于密闭的容器中充分反应生成,放热,反应是可逆反应,不是氮气完全反应放出的热量,则反应放热不等于,B错误;
C.燃烧热为可燃物完全燃烧生成指定的物质,生成的水应为液态,C错误;
D.硫酸与氢氧化钡生成水及硫酸钡沉淀,硫酸消耗完放出的热量大于,D错误;故答案为:。
4.【解析】A.由图可知,随温度升高,、的物质的量分数变化趋势基本相同,可知反应是催化重整的主反应,故A正确;
B.反应,反应能自主发生,,可知反应的,故B正确;
C.反应中、是反应产物,且物质的量比:,是反应的产物,氢气是反应的反应物,氢气是反应的生成物,间,的量始终大于氢气,反应消耗氢气的量大于反应生成氢气的量,所以反应的进行程度大于反应,故C正确;
D.催化剂不能使平衡移动,选用更合适的催化剂不能提高平衡时的产率,故D错误;故选:。
5.【解析】A.在水溶液中的电离方程式为:,故A错误;
B.的水解为可逆反应,水解方程式为:,故B错误;
C. 多元弱酸根离子的水解分步进行,以第一步为主,的第一步水解方程式为:,故C错误;
D.为弱电解质,电离过程分步进行,主要以第一步为主,正确的电离方程式为:,故D正确;故选D。
6.【解析】由于显中性,故的溶液显酸性,且由于因电离显强酸性,酸性强弱相当于一元强酸,故要么是弱酸,要么是强酸弱碱盐;
溶液的碱性弱于,故应均为强碱弱酸盐,根据越弱越水解的规律可知,对应的酸的酸性应强于所对应的酸的酸性;
的碱性强于,故其要么是碱,要么是强碱弱酸盐,且需对应的酸的酸性弱于,据此分析。
A、相同温度、相同浓度下,、溶液中,中铵根离子浓度更大,故其酸性更强,更小,故A错误;
B、相同温度、相同浓度下,、溶液中,中铵根离子浓度更大,故其酸性更强,更小;、溶液均显碱性,且两者的碱性均弱于,且由于酸性,故CH、溶液后者的更大;是强碱,电离显碱性,溶液强于,故B正确;
C、相同温度、相同浓度下,的碱性强于,、的碱性均弱于,故C错误;
D、溶液显酸性,故D错误;故选:。
7.【解析】酸式滴定管有“”刻度线,在仪器的上端,量筒没有“”刻度线,故错误;
使用试纸时,如果润湿试纸测定的溶液呈酸性或碱性时,则使测定结果不准确产生误差,溶液呈中性,对测量结果没有影响,如果使用试纸测定气体的酸碱性时需要润湿,例如:测氨气等,故错误;
由于是强酸,是弱酸,在稀释相同倍数过程中,继续电离产生,使得该溶液中较溶液中大,则的增加的比小,所以的误差大,故错误;
试纸在酸性较强的环境中显红色,在碱性较强的环境中显蓝色,故正确;
中和滴定时,酸可滴定碱,也可碱滴定酸,即中和滴定时可用标准溶液滴定待测液,也可用待测液滴定标准溶液,故正确;
若滴定时,锥形瓶未干燥,对测得的溶液浓度无影响,故错误;
中和滴定中,眼睛观察锥形瓶内颜色的变化,可准确判断滴定终点,故错误;
用溶液滴定溶液时,由于具有强氧化性,会腐蚀橡胶,所以应选用酸式滴定管,故错误。
综上所述只有正确,即项正确。故选B。
8.【解析】A.青铜器含铜锡等金属表面出现小孔腐蚀,是因为形成原电池,正极上氧气发生得电子的还原反应,所以氧气是正极反应物,A正确
B.根据图可知,在锈蚀小孔外铜锈成分为、,元素化合价为价,在小孔附近铜锈是,小孔内壁铜锈成分是,元素化合价为价,小孔外氧气浓度大,元素价态高,小孔内氧气浓度小,元素价态低,铜锈成分与氧气浓度有关,在溶液酸性较强时可逆反应的平衡逆向移动,铜锈成分主要是,若溶液酸性弱,平衡正向移动,铜锈成分主要是,可见铜锈成分也与溶液的有关,B正确
C.小孔内壁铜锈成分是,会从小孔外向小孔内移动,C错误
D.由于的金属性比强,与构成原电池时,作负极,被氧化而发生电化学腐蚀,D正确。
9.【解析】A.与乘积越大,越小,则大小顺序为,A项正确;
B.由图乙可知,至左右,完全沉淀,还未沉淀,但是加入会引入新杂质,可加入等物质调节至左右,项错误;
C.反应平衡常数表达式为,项正确;
D.沉淀溶解平衡曲线下方的区域说明生成沉淀,故阴影部分只有沉淀,项正确。故选B。
10.【解析】A.与二氧化硅反应生成具有粘合性的硅酸钠,应选碱式滴定管,故A错误;
B.硝酸银过量,均为沉淀生成,由操作和现象不能比较大小,故B错误;
C.加热促进镁离子水解,且盐酸易挥发,应在气流中加热,故C错误;
D.下方装置构成原电池时,作负极,作正极被保护,则图中实验可验证保护了不被腐蚀,故D正确;故选D。
11.【解析】依题意,,,溶液呈碱性;,,溶液呈中性;,,溶液呈酸性。酸碱中和反应是放热反应,随着反应进行,溶液温度逐渐升高,溶液温度最高时恰好完全反应,因此点时酸碱恰好完全反应。此时溶液的,溶液呈酸性,则中和反应生成了强酸弱碱盐,是一元弱碱。
A.根据分析知,稀硫酸加入时恰好完全中和,设稀硫酸浓度为,则:
,
稀硫酸浓度为,A错误;
B.未加稀硫酸时,,则,常温下,根据两式可求得该溶液中,根据得的电离常数,B正确;
C.点为酸碱恰好完全反应时,生成了强酸弱碱盐,的水解促进水的电离。点时有一半被中和,混合溶液含有与,是弱碱,对水的电离有一定抑制作用,但不大;从点以后,硫酸过量,硫酸属于强酸,对水的电离抑制程度较大。因此水的电离程度:,C错误;
D.稀释溶液,的电离程度增大,但小于被稀释的程度,故减小,D错误;故选B。
12.【解析】A.由转化图可知,偶联反应中起催化作用的物质是和,参与反应过程,最后又重新生成,故A错误;
B.由转化关系可知,、、为该催化过程的中间产物,有种,故B正确;
C.由流程可知,转化图中右侧存在反应,该偶联反应的原理为,故C正确;
D.该催化机理改变了反应路径,且不改变反应热,故D正确;故选:。
13.【解析】A、粗镍粉碎是加快反应速率,而不影响平衡的移动,故A错误;
B、时反应达平衡状态,分解率较高,所以第二阶段可以选择,故B正确;
C、第一阶段为放热反应,降低温度有利于平衡正向移动,即向生成气态的方向移动;
第二阶段为吸热反应,升高温度有利于平衡向生成纯镍的方向移动,所以第一阶段的温度不一定高于第二阶段的温度,故C错误;
D、只要反应发生就有,所以不能说明达平衡状态,故D错误;
14.【解析】解:溶液使紫色石蕊溶液变蓝,溶液显碱性,原因是亚硫酸根离子水解溶液显碱性:,故A正确;
B.溶液 溶液使紫色石蕊溶液变红,说明溶液显酸性,说明溶液中的电离程度大于水解程度,故B正确;
C.图象分析碱性越强,抗氧化性越强,酸性越强抗氧化性越弱,在时离子浓度大,抗氧性最弱,故C错误;
D.溶于水发生反应:,调溶液的相同,保持体系中浓度不变,测得三者与的反应速率相同,故D正确;故选:。
A.溶液使紫色石蕊溶液变蓝,亚硫酸钠是强碱弱酸盐,亚硫酸根离子水解溶液显碱性;
B.溶液使紫色石蕊溶液变红,说明溶液显酸性;
C.图象分析可知,保持体系中浓度不变,时亚硫酸根离子浓度大;
D.已知:溶于水发生反应:,调溶液的相同,保持体系中浓度不变,测得三者与的反应速率相同。
16.【解析】从仪器的结构可知为分液漏斗,故答案为:分液漏斗;
安全漏斗中“安全”主要是防气体从漏斗中逸出,漏斗颈部残留液体能起到液封作用,使用时的优点是安全漏斗下端可以不插入液体中,而长颈漏斗下端必须插入液面下,
故答案为:漏斗下端不需插入液体中即可液封;
依题意,乙醇蒸气被无水氯化钙吸收,除去氢气中的乙醇蒸气,
故答案为:无水氯化钙或;
根据提示信息,实验前排尽装置内的空气,否则氢气和氧气在高温下会反应,
故答案为:排尽装置内的空气;
装置与反应生成和氯化氢,化学方程式为,
故答案为:;
装置有三个功能:吸收氯化氢、防倒吸、吸收,“防倒吸”原理:氯化氢不溶于四氯化碳,当氯化氢进入四氯化碳层时装置内气压不会剧减,故不会产生倒吸现象。根据平衡移动原理,,使反应的平衡向逆反应方向移动,银离子浓度增大,导致离子积大于氯化银的溶度积,生成氯化银,进入尾气,
故答案为:防止倒吸;产生白色沉淀;;
钠和乙醇生成的氢气有三个功能:排尽装置内的空气,作还原剂,作保护气停止加热后继续通入氢气,实际作还原剂的氢气质量是未知量,故不能根据钠或乙醇的量计算的利用率,可以根据生成硅的质量计算出的利用率,
故答案为:。
17.【解析】反应物的总能量高于生成物的总能量为放热反应,则放热反应为;反应的快慢是由慢反应决定的,反应所需的活化能越大,反应越慢,从图中可以看出的活化能最大,决速步是图中;
该反应为气体体积减小的放热反应,升高温度,平衡向逆反应方向移动,一氧化氮转化率减小,增大压强,平衡向正反应方向移动,一氧化氮转化率增大,则曲线是表示的曲线;
在一定温度下向容积为的密闭容器中加入、,此时容器总压为,发生上述反应,时达平衡,此时测得氮气的物质的量为,根据三段式进行计算:
恒温恒容条件下,压强之比等于物质的量之比,
,,
根据已知,其中为平衡总压,为平衡系统中的物质的量分数
则内用的分压变化量表示的平均速率为。;
根据反应方程式可知,反应的平衡常数;反应达到平衡时,正逆反应速率相等, ,所以 ,所以,;
根据反应分析,该反应为放热反应,升高温度,平衡向逆反应方向移动,间,温度升高,平衡逆移,氨气的转化率减小;以后,催化剂活性降低或失活,反应速率急剧下降导致转化率迅速变小
18.【解析】 在反应中失去电子被氧化,所以通入的电极为负极,其电极反应式为,因此此电极区减小;
故答案为:负;;减小;
溶液中的阳离子向正极移动,电解质溶液中的通过质子膜向右移动,通入氧气的是正极,电极反应式是;故答案为:向右;;
Ⅱ将直流电源接通后,极附近呈红色,说明极显碱性,是氢离子在该电极放电,所以极是阴极,为电源负极、为电源正极,可得出、、、均为阴极,、、、均为阳极;
电极是电源的负极,一段时间后,氢氧化铁胶体粒子带正电荷,氢氧化铁胶体粒子向阴极区移动,所以丁中极附近的颜色逐渐变浅;故答案为:负;变浅;
若甲、乙装置中的、、、电极均只有一种单质生成时,、、、电极分别生成的是、、、,假设通过的电子物质的量为,则生成物的物质的量分别为、、、,故对应单质的物质的量之比为:::;
故答案为:;
电镀装置中,镀层金属必须做阳极,镀件做阴极,所以应该是镀件;当乙中溶液的时此时乙溶液体积为,根据电极反应,则放电的氢离子的物质的量为:,当转移电子时,丙中镀件上析出银的质量;电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的变小;
故答案为:或镀件、铜件;;变小;
若将电极换为铁,其他装置都不变,则甲中的电极发生铁的氧化反应生成,发生的总反应的离子方程式为;
故答案为:。
可能用到的相对原子质量:Li-7 C-12 O-16 Mn-55 Ag-108
一、单选题(每题3分,14小题,共42分)
1.下列说法一定正确的是( )
A. 某蒸馏水水样,则该水样中一定掺杂或溶解了某些溶质
B. 相同温度下,中和等的氨水、溶液,所需的物质的量前者更多
C. 相同温度下,相等的、溶液中,水电离的浓度相等
D. 氨水和硫酸反应后的溶液,若溶液呈中性,则
2.废旧铅蓄电池的铅膏中主要含有、、和,还有少量、的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
已知:室温下,;、,完全沉淀的分别是和;开始及完全沉淀的分别是和。下列说法正确的是( )
A. “脱硫”中转化反应的离子方程式:
B. “酸浸”中可以氧化、和
C. “酸浸”后溶液的约为,滤渣的主要成分是和
D. “沉铅”后滤液中,主要存在的阳离子有、、、
3.下列有关说法正确的是( )
A. ;.,若、反应放热,则
B. 一定条件下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为
C. ,则的燃烧热
D. ,则稀硫酸和足量氢氧化钡溶液反应放出的热量为
4.催化重整能够获得氢能,同时消除温室气体,催化重整过程中主要发生反应的热化学方程式如下:
反应
反应
反应
常压下,将::的混合气体置于密闭容器中,在不同温度下的重整体系中,平衡时各组分的物质的量分数如图所示。下列说法不正确的是( )
A. 反应是催化重整的主反应
B. 反应的
C. 间,反应的进行程度大于反应
D. 为提高平衡时的产率,应研发更合适的催化剂
5.下列方程式书写正确的是( )
A. 在水溶液中的电离方程式:
B. 的水解方程式:
C. 的水解方程式:
D. 的电离方程式:
6.相同温度、相同浓度下的八种溶液,其由小到大的顺序如图所示,图中代表的物质可能分别为( )
A. 、、 、
B. 、 、
C. 、
D. 、 、
7.下列说法正确的有( )
酸式滴定管和量筒均没有“”刻度线
使用试纸时,不能润湿,否则一定会使测定结果不准确
用水润湿过的试纸测定相等的和,的误差更大
试纸在酸性较强的环境中显红色,在碱性较强的环境中显蓝色
中和滴定时,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液
若滴定时,锥形瓶未干燥,则测得的溶液浓度偏低
进行中和滴定操作时,眼睛要始终注视滴定管内液面的变化
用溶液滴定溶液时,应选用碱式滴定管
A. 个 B. 个 C. 个 D. 个
8.考古发掘出的古代青铜器含铜、锡等金属表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物铜锈的成分如下图所示。已知:,下列分析不正确的是 ( )
A. 氧气是正极反应物 B. 铜锈的成分与氧气浓度、有关
C. 图中,从小孔内向小孔外移动 D. 青铜中的锡也会发生电化学腐蚀
9.根据下列图示所得出的结论不正确的是( )
甲 乙 丙 丁
图甲表示 下,三种硫化物分别在水中溶解达饱和状态时,所含金属离子与浓度的对数值 与 的关系,则的大小顺序为
B. 由图乙可知,除去溶液中的可加入适量溶液调节至左右
C. 图丙是室温下和的饱和溶液中离子浓度的关系曲线,说明该温度下反应
的平衡常数
D. 图丁是室温下和的沉淀溶解平衡曲线,说明阴影区域表示的只有沉淀
10.下列实验设计或操作能达到目的的是( )
A. 用已知浓度的溶液滴定未知浓度的盐酸 B. 验证
C. 用于制取无水 D. 验证保护了不被腐蚀
11.化学中常用表示溶液的酸度,。室温下,向的某一元碱溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度随加入稀硫酸体积的变化如图所示。下列说法正确的是( )
A. 该硫酸浓度为
B. 室温下的电离常数
C. 、、三点对应的溶液中,水的电离程度大小为
D. 稀释溶液,的电离程度增大,增大
12.卤代烃与端基炔催化偶联反应的一种机理如图所示。下列说法错误的是( )
A. 偶联反应中和都是催化剂
B. 该催化过程中的中间产物有种
C. 该机理的总反应可表示为
D. 该催化机理改变了反应路径,但没有改变总反应的反应热
13.常压下羰基化法精炼镍是工业上提纯镍的主要方法,其原理为
。已知:的沸点为,时该反应的平衡常数,固体杂质不参与反应。
第一阶段:调控温度使粗镍与反应,转化成气态;
第二阶段:将第一阶段反应后的气体分离出来,调控温度制得高纯镍。
下列判断正确的是 ( )
A. 第一阶段将粗镍粉碎有利于平衡正向移动
B. 第二阶段可以选择
C. 第一阶段的温度高于第二阶段的温度
D. 该反应达到平衡时,
14.在药物制剂中,抗氧剂与被保护的药物在与发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。、和是三种常用的抗氧剂。下列说法中,不正确的是( )
已知:溶于水发生反应:
实验用品 实验操作和现象
溶液
溶液
溶液 实验:溶液使紫色石蕊溶液变蓝,溶液使之变红。
实验:溶液与反应,保持体系中浓度不变,不同条件下, 随反应时间变化如图所示。
实验:调溶液的相同,保持体系中浓度不变,测得三者与的反应速率相同。
A. 溶液显碱性,原因是:
B. 溶液中的电离程度大于水解程度
C. 实验说明,在时抗氧性最强
D. 实验中,三种溶液在相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
二、填空题(共4小题,除特殊标注外,每空2分,共58分)
15.(15分)磁性材料产业是世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用含锰废水主要金属离子为、、,还含有少量、、和等为原料,生产的工艺流程如下:
已知该条件下、。
流程中含锰废水经过前三步预处理,得到主要含有的母液。
除铁铝时,在搅拌条件下先加入溶液,再加入溶液调节。加入溶液时发生反应的离子方程式为 。
除重金属时,滤渣的主要成分为 填化学式。
除钙镁时,为使沉淀完全当离子浓度降到时,可视为沉淀完全,需控制溶液中的最低浓度为 。
沉锰过程在为条件下充分进行,反应温度对锰沉淀率的影响如图所示。
沉锰过程发生反应的离子方程式为 。
当温度超过时,沉锰反应的锰沉淀率随温度升高而下降的原因是 。
沉锰后过滤得到粗产品,依次用去离子水和无水乙醇各洗涤次,再低温干燥,得
到纯净的。用无水乙醇洗涤的目的是 。
测定碳酸锰产品的纯度。
称取碳酸锰产品于锥形瓶中,加磷酸,加热,碳酸锰全部转化为,冷却至室温。加水稀释至,滴加滴指示剂,然后用浓度为的硫酸亚铁铵标准溶液滴定反应为。重复操作次,记录数据如下:
滴定次数 的硫酸亚铁铵标准溶液读数
滴定前 滴定后
则产品的纯度 ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰产品的纯度 填“偏高”“偏低”或“无影响”(1分)。
16.(10分)高纯硅被誉为“信息革命的催化剂”。某小组同学模拟工业上用与在的条件下制备高纯硅,实验装置如图所示加热及夹持装置已略去。
已知:
的沸点为;密度为,易溶于有机溶剂,能与剧烈反应,在空气中易被氧化;
;
银氨溶液中存在:。
实验步骤:
打开,向安全漏斗中加入足量乙醇,使装置中的反应进行一段时间;
加热装置,打开,滴加;
加热装置至;
关闭;
关闭。
回答下列问题:
仪器的名称为 ______(1分)。
相比长颈漏斗,安全漏斗使用时的优点是 ______(1分)。
干燥管中盛装的试剂是 ______(1分)。
加热装置之前,先进行装置中的反应,这样操作的目的是 ______(1分)。
装置中发生反应的化学方程式为 ______。
中的作用是 ______(1分),实验过程中,的上层溶液中观察到的现象是 ______(1分),尾气的主要成分是 ______填化学式(1分)。
根据下列数据可以计算出的利用率的是 ______填标号(1分)。
钠的质量 乙醇的体积和密度 硅的质量
17.(14分)汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。
反应 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示表示过渡态、表示中间产物。三个基元反应中,属于放热反应的是_______填标号、或,决速步是图中_______填标号、或。
探究温度、压强、对反应的影响,如上图所示,表示的是_______填标号、、、或。
在一定温度下向容积为的密闭容器中加入、,此时容器总压为,发生上述反应,时达平衡,此时测得氮气的物质的量为,则内用的分压变化量表示的平均速率为 _______。【已知,其中为平衡总压,为平衡系统中的物质的量分数】。
用可催化消除污染:
某条件下该反应速率,,该反应的平衡常数,则_______,_______。
一定温度下,在体积为的恒容密闭容器中加入和发生上述反应,若在相同时间内测得的转化率随温度的变化曲线如图,之间的转化率急剧下降的原因是_______。
18.(19分)I.某科研单位利用电化学原理,使用来制备硫酸,装置如下图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许通过。
通入的电极为______填“正极”或“负极”(1分),其电极反应式为____________________,此电极区溶液的______填“增大”“减小”或“不变”(1分)。
电解质溶液中的通过质子交换膜______填“向左”或“向右”(1分)移动,通入的电极反应式为___________。
如上图装置所示,、、、、、都是惰性电极,甲、乙中溶液的体积和浓度都相同假设通电前后溶液体积不变,、为外接直流电源的两极。将直流电源接通后,极附近呈红色。
极是电源的______填“正极”或“负极”,一段时间后,丁中极附近的颜色逐渐___填“变深”或“变浅”。
若甲、乙装置中的、、、电极均只有一种单质生成时,对应单质的物质的量之比为________。
现用丙装置给铜件镀银,则应是______。若乙溶液体积为,当乙中溶液的时,丙中镀件上析出银的质量为______,甲中溶液的______填“变大”“变小”或“不变”。
若将电极换为铁,其他装置都不变,则甲中发生的总反应的离子方程式为_______________。
鹤壁市高中2025届高二上学期第三次段考·化学答案
一、单选题(每题3分,14小题,共42分)
1-5 CCADD 6-10BBCBD 11-14 BABC
二、填空题(共4小题,除特殊标注外,每空2分,共58分)
15.(15分)【答案】
、
温度升高,受热分解或水解
有利于低温条件下快速干燥
偏低(1分)
16.(10分)【答案】
分液漏斗(1分)
漏斗下端不需插入液体中即可液封(1分)
无水氯化钙或(1分)
排尽装置内的空气 (1分)
防止倒吸; 产生白色沉淀;
(1分)
17.(14分)【答案】
;
;
以后,催化剂活性降低或失活,反应速率急剧下降导致转化率迅速变小
18.(19分)【答案】
I.负极(1分); ; 减小(1分)
向右(1分);
负极(1分); 变浅(1分)
或镀件、铜件; ; 变小
答案详解
1.【解析】A.由于温度未知,因此的蒸馏水也可能是中性,不能说明该水样中一定掺杂或溶解了某些溶质,故A错误;
B.相同温度下,等的氨水、溶液中的浓度相同,没有明确溶液的体积,不能比较中和时所需物质的量的多少,故B错误;
C.相同温度下,相同,相等的、溶液中浓度相同,则浓度相等,溶液中的为水电离出的,水电离出的和浓度相等,故C正确;
D.氨水和硫酸反应后的溶液,若溶液呈中性,则溶液中的溶质为和,且,溶液中存在电荷守恒,因此,故D错误。故选C。
2.【解析】铅膏加入碳酸钠脱硫, 和碳酸根离子反应转化为碳酸铅沉淀;过滤后固体加入醋酸、过氧化氢酸浸,“酸浸”中 具有氧化性,可以氧化转化为 、氧化 为三价铁离子;同时过氧化氢能使 转化为 ,调节使铁、铝转化为沉淀过滤除去,滤液加入氢氧化钠沉铅,一系列转化后得到;
A.已知:室温下 , ;则“脱硫”中 和碳酸根离子反应转化为碳酸铅沉淀,转化反应的离子方程式: ,A错误;
B.“酸浸”中 具有氧化性,可以氧化转化为 、氧化 为三价铁离子;同时过氧化氢能使 转化为 ,反应中铅化合价降低为氧化剂,则过氧化氢中氧元素化合价升高,过氧化氢为还原剂,B错误;
C. 、 ,完全沉淀的分别是和; 开始及完全沉淀的分别是和;则“酸浸”后溶液的约为,滤渣的主要成分是 和 ,C正确;
D.依据分析可知,在“酸浸”后溶液的约为,铁、铝离子转化为沉淀,加入氢氧化钠溶液,铅转化为沉淀,故沉铅后滤液中,主要存在的阳离子有 ,D错误;故选C。
3.【解析】A.气态的能量高于固态,则反应放出的热量多,由于反应放热,则,A正确;
B.合成氨反应为可逆反应,和置于密闭的容器中充分反应生成,放热,反应是可逆反应,不是氮气完全反应放出的热量,则反应放热不等于,B错误;
C.燃烧热为可燃物完全燃烧生成指定的物质,生成的水应为液态,C错误;
D.硫酸与氢氧化钡生成水及硫酸钡沉淀,硫酸消耗完放出的热量大于,D错误;故答案为:。
4.【解析】A.由图可知,随温度升高,、的物质的量分数变化趋势基本相同,可知反应是催化重整的主反应,故A正确;
B.反应,反应能自主发生,,可知反应的,故B正确;
C.反应中、是反应产物,且物质的量比:,是反应的产物,氢气是反应的反应物,氢气是反应的生成物,间,的量始终大于氢气,反应消耗氢气的量大于反应生成氢气的量,所以反应的进行程度大于反应,故C正确;
D.催化剂不能使平衡移动,选用更合适的催化剂不能提高平衡时的产率,故D错误;故选:。
5.【解析】A.在水溶液中的电离方程式为:,故A错误;
B.的水解为可逆反应,水解方程式为:,故B错误;
C. 多元弱酸根离子的水解分步进行,以第一步为主,的第一步水解方程式为:,故C错误;
D.为弱电解质,电离过程分步进行,主要以第一步为主,正确的电离方程式为:,故D正确;故选D。
6.【解析】由于显中性,故的溶液显酸性,且由于因电离显强酸性,酸性强弱相当于一元强酸,故要么是弱酸,要么是强酸弱碱盐;
溶液的碱性弱于,故应均为强碱弱酸盐,根据越弱越水解的规律可知,对应的酸的酸性应强于所对应的酸的酸性;
的碱性强于,故其要么是碱,要么是强碱弱酸盐,且需对应的酸的酸性弱于,据此分析。
A、相同温度、相同浓度下,、溶液中,中铵根离子浓度更大,故其酸性更强,更小,故A错误;
B、相同温度、相同浓度下,、溶液中,中铵根离子浓度更大,故其酸性更强,更小;、溶液均显碱性,且两者的碱性均弱于,且由于酸性,故CH、溶液后者的更大;是强碱,电离显碱性,溶液强于,故B正确;
C、相同温度、相同浓度下,的碱性强于,、的碱性均弱于,故C错误;
D、溶液显酸性,故D错误;故选:。
7.【解析】酸式滴定管有“”刻度线,在仪器的上端,量筒没有“”刻度线,故错误;
使用试纸时,如果润湿试纸测定的溶液呈酸性或碱性时,则使测定结果不准确产生误差,溶液呈中性,对测量结果没有影响,如果使用试纸测定气体的酸碱性时需要润湿,例如:测氨气等,故错误;
由于是强酸,是弱酸,在稀释相同倍数过程中,继续电离产生,使得该溶液中较溶液中大,则的增加的比小,所以的误差大,故错误;
试纸在酸性较强的环境中显红色,在碱性较强的环境中显蓝色,故正确;
中和滴定时,酸可滴定碱,也可碱滴定酸,即中和滴定时可用标准溶液滴定待测液,也可用待测液滴定标准溶液,故正确;
若滴定时,锥形瓶未干燥,对测得的溶液浓度无影响,故错误;
中和滴定中,眼睛观察锥形瓶内颜色的变化,可准确判断滴定终点,故错误;
用溶液滴定溶液时,由于具有强氧化性,会腐蚀橡胶,所以应选用酸式滴定管,故错误。
综上所述只有正确,即项正确。故选B。
8.【解析】A.青铜器含铜锡等金属表面出现小孔腐蚀,是因为形成原电池,正极上氧气发生得电子的还原反应,所以氧气是正极反应物,A正确
B.根据图可知,在锈蚀小孔外铜锈成分为、,元素化合价为价,在小孔附近铜锈是,小孔内壁铜锈成分是,元素化合价为价,小孔外氧气浓度大,元素价态高,小孔内氧气浓度小,元素价态低,铜锈成分与氧气浓度有关,在溶液酸性较强时可逆反应的平衡逆向移动,铜锈成分主要是,若溶液酸性弱,平衡正向移动,铜锈成分主要是,可见铜锈成分也与溶液的有关,B正确
C.小孔内壁铜锈成分是,会从小孔外向小孔内移动,C错误
D.由于的金属性比强,与构成原电池时,作负极,被氧化而发生电化学腐蚀,D正确。
9.【解析】A.与乘积越大,越小,则大小顺序为,A项正确;
B.由图乙可知,至左右,完全沉淀,还未沉淀,但是加入会引入新杂质,可加入等物质调节至左右,项错误;
C.反应平衡常数表达式为,项正确;
D.沉淀溶解平衡曲线下方的区域说明生成沉淀,故阴影部分只有沉淀,项正确。故选B。
10.【解析】A.与二氧化硅反应生成具有粘合性的硅酸钠,应选碱式滴定管,故A错误;
B.硝酸银过量,均为沉淀生成,由操作和现象不能比较大小,故B错误;
C.加热促进镁离子水解,且盐酸易挥发,应在气流中加热,故C错误;
D.下方装置构成原电池时,作负极,作正极被保护,则图中实验可验证保护了不被腐蚀,故D正确;故选D。
11.【解析】依题意,,,溶液呈碱性;,,溶液呈中性;,,溶液呈酸性。酸碱中和反应是放热反应,随着反应进行,溶液温度逐渐升高,溶液温度最高时恰好完全反应,因此点时酸碱恰好完全反应。此时溶液的,溶液呈酸性,则中和反应生成了强酸弱碱盐,是一元弱碱。
A.根据分析知,稀硫酸加入时恰好完全中和,设稀硫酸浓度为,则:
,
稀硫酸浓度为,A错误;
B.未加稀硫酸时,,则,常温下,根据两式可求得该溶液中,根据得的电离常数,B正确;
C.点为酸碱恰好完全反应时,生成了强酸弱碱盐,的水解促进水的电离。点时有一半被中和,混合溶液含有与,是弱碱,对水的电离有一定抑制作用,但不大;从点以后,硫酸过量,硫酸属于强酸,对水的电离抑制程度较大。因此水的电离程度:,C错误;
D.稀释溶液,的电离程度增大,但小于被稀释的程度,故减小,D错误;故选B。
12.【解析】A.由转化图可知,偶联反应中起催化作用的物质是和,参与反应过程,最后又重新生成,故A错误;
B.由转化关系可知,、、为该催化过程的中间产物,有种,故B正确;
C.由流程可知,转化图中右侧存在反应,该偶联反应的原理为,故C正确;
D.该催化机理改变了反应路径,且不改变反应热,故D正确;故选:。
13.【解析】A、粗镍粉碎是加快反应速率,而不影响平衡的移动,故A错误;
B、时反应达平衡状态,分解率较高,所以第二阶段可以选择,故B正确;
C、第一阶段为放热反应,降低温度有利于平衡正向移动,即向生成气态的方向移动;
第二阶段为吸热反应,升高温度有利于平衡向生成纯镍的方向移动,所以第一阶段的温度不一定高于第二阶段的温度,故C错误;
D、只要反应发生就有,所以不能说明达平衡状态,故D错误;
14.【解析】解:溶液使紫色石蕊溶液变蓝,溶液显碱性,原因是亚硫酸根离子水解溶液显碱性:,故A正确;
B.溶液 溶液使紫色石蕊溶液变红,说明溶液显酸性,说明溶液中的电离程度大于水解程度,故B正确;
C.图象分析碱性越强,抗氧化性越强,酸性越强抗氧化性越弱,在时离子浓度大,抗氧性最弱,故C错误;
D.溶于水发生反应:,调溶液的相同,保持体系中浓度不变,测得三者与的反应速率相同,故D正确;故选:。
A.溶液使紫色石蕊溶液变蓝,亚硫酸钠是强碱弱酸盐,亚硫酸根离子水解溶液显碱性;
B.溶液使紫色石蕊溶液变红,说明溶液显酸性;
C.图象分析可知,保持体系中浓度不变,时亚硫酸根离子浓度大;
D.已知:溶于水发生反应:,调溶液的相同,保持体系中浓度不变,测得三者与的反应速率相同。
16.【解析】从仪器的结构可知为分液漏斗,故答案为:分液漏斗;
安全漏斗中“安全”主要是防气体从漏斗中逸出,漏斗颈部残留液体能起到液封作用,使用时的优点是安全漏斗下端可以不插入液体中,而长颈漏斗下端必须插入液面下,
故答案为:漏斗下端不需插入液体中即可液封;
依题意,乙醇蒸气被无水氯化钙吸收,除去氢气中的乙醇蒸气,
故答案为:无水氯化钙或;
根据提示信息,实验前排尽装置内的空气,否则氢气和氧气在高温下会反应,
故答案为:排尽装置内的空气;
装置与反应生成和氯化氢,化学方程式为,
故答案为:;
装置有三个功能:吸收氯化氢、防倒吸、吸收,“防倒吸”原理:氯化氢不溶于四氯化碳,当氯化氢进入四氯化碳层时装置内气压不会剧减,故不会产生倒吸现象。根据平衡移动原理,,使反应的平衡向逆反应方向移动,银离子浓度增大,导致离子积大于氯化银的溶度积,生成氯化银,进入尾气,
故答案为:防止倒吸;产生白色沉淀;;
钠和乙醇生成的氢气有三个功能:排尽装置内的空气,作还原剂,作保护气停止加热后继续通入氢气,实际作还原剂的氢气质量是未知量,故不能根据钠或乙醇的量计算的利用率,可以根据生成硅的质量计算出的利用率,
故答案为:。
17.【解析】反应物的总能量高于生成物的总能量为放热反应,则放热反应为;反应的快慢是由慢反应决定的,反应所需的活化能越大,反应越慢,从图中可以看出的活化能最大,决速步是图中;
该反应为气体体积减小的放热反应,升高温度,平衡向逆反应方向移动,一氧化氮转化率减小,增大压强,平衡向正反应方向移动,一氧化氮转化率增大,则曲线是表示的曲线;
在一定温度下向容积为的密闭容器中加入、,此时容器总压为,发生上述反应,时达平衡,此时测得氮气的物质的量为,根据三段式进行计算:
恒温恒容条件下,压强之比等于物质的量之比,
,,
根据已知,其中为平衡总压,为平衡系统中的物质的量分数
则内用的分压变化量表示的平均速率为。;
根据反应方程式可知,反应的平衡常数;反应达到平衡时,正逆反应速率相等, ,所以 ,所以,;
根据反应分析,该反应为放热反应,升高温度,平衡向逆反应方向移动,间,温度升高,平衡逆移,氨气的转化率减小;以后,催化剂活性降低或失活,反应速率急剧下降导致转化率迅速变小
18.【解析】 在反应中失去电子被氧化,所以通入的电极为负极,其电极反应式为,因此此电极区减小;
故答案为:负;;减小;
溶液中的阳离子向正极移动,电解质溶液中的通过质子膜向右移动,通入氧气的是正极,电极反应式是;故答案为:向右;;
Ⅱ将直流电源接通后,极附近呈红色,说明极显碱性,是氢离子在该电极放电,所以极是阴极,为电源负极、为电源正极,可得出、、、均为阴极,、、、均为阳极;
电极是电源的负极,一段时间后,氢氧化铁胶体粒子带正电荷,氢氧化铁胶体粒子向阴极区移动,所以丁中极附近的颜色逐渐变浅;故答案为:负;变浅;
若甲、乙装置中的、、、电极均只有一种单质生成时,、、、电极分别生成的是、、、,假设通过的电子物质的量为,则生成物的物质的量分别为、、、,故对应单质的物质的量之比为:::;
故答案为:;
电镀装置中,镀层金属必须做阳极,镀件做阴极,所以应该是镀件;当乙中溶液的时此时乙溶液体积为,根据电极反应,则放电的氢离子的物质的量为:,当转移电子时,丙中镀件上析出银的质量;电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的变小;
故答案为:或镀件、铜件;;变小;
若将电极换为铁,其他装置都不变,则甲中的电极发生铁的氧化反应生成,发生的总反应的离子方程式为;
故答案为:。
同课章节目录
