4.1元素周期表(第二课时)课件(共37张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1元素周期表(第二课时)课件(共37张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 08:16:16 | ||
图片预览






文档简介
(共37张PPT)
第一节:原子结构与元素周期律
任务 1
了解元素周期表的发展过程
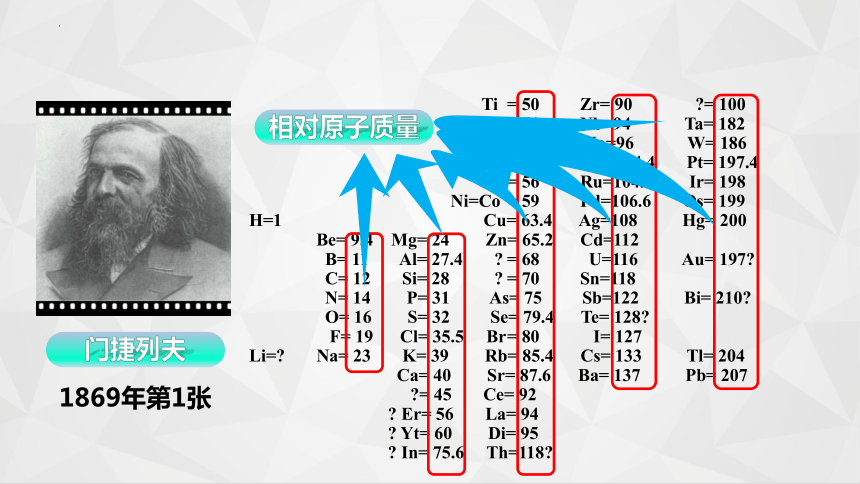
门捷列夫
1869年第1张
Ti = 50 Zr= 90 = 100
V = 51 Nb=94 Ta= 182
Cr = 52 Mo=96 W= 186
Mn= 55 Rh=104.4 Pt= 197.4
Fe = 56 Ru=104.4 Ir= 198
Ni=Co = 59 Pd=106.6 Os= 199
H=1 Cu= 63.4 Ag=108 Hg= 200
Be= 9.4 Mg= 24 Zn= 65.2 Cd=112
B= 11 Al= 27.4 = 68 U=116 Au= 197
C= 12 Si= 28 = 70 Sn=118
N= 14 P= 31 As= 75 Sb=122 Bi= 210
O= 16 S= 32 Se= 79.4 Te= 128
F= 19 Cl= 35.5 Br = 80 I= 127
Li= Na= 23 K= 39 Rb= 85.4 Cs= 133 Tl= 204
Ca= 40 Sr= 87.6 Ba= 137 Pb= 207
= 45 Ce= 92
Er= 56 La= 94
Yt= 60 Di= 95
In= 75.6 Th=118
相对原子质量
门捷列夫
1869年第1张
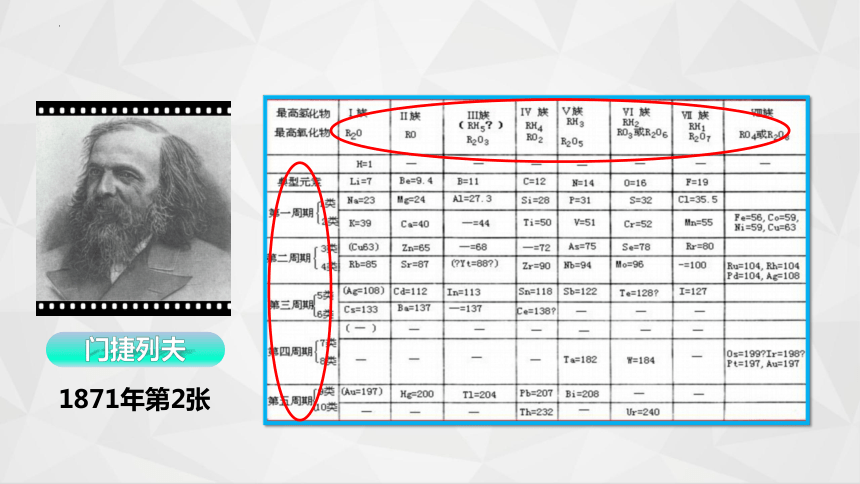
1871年第2张
门捷列夫
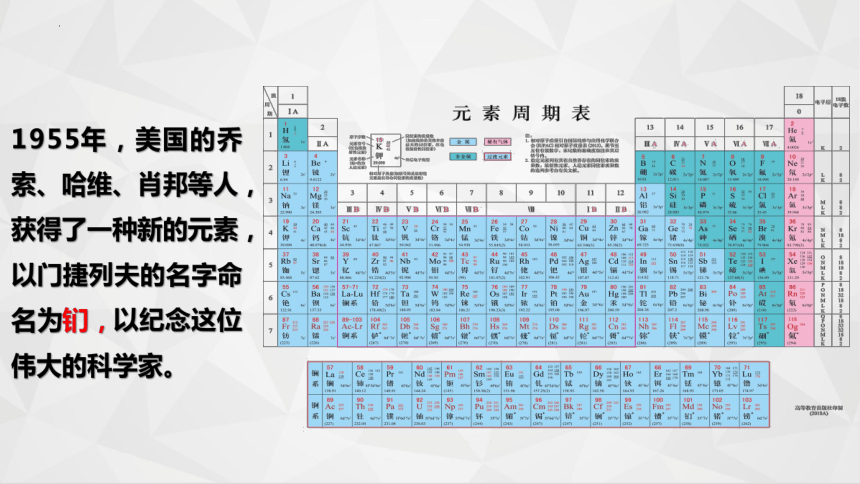
1955年,美国的乔索、哈维、肖邦等人,获得了一种新的元素,以门捷列夫的名字命名为钔,以纪念这位伟大的科学家。
任务 2
认识元素周期表的编排原则及结构
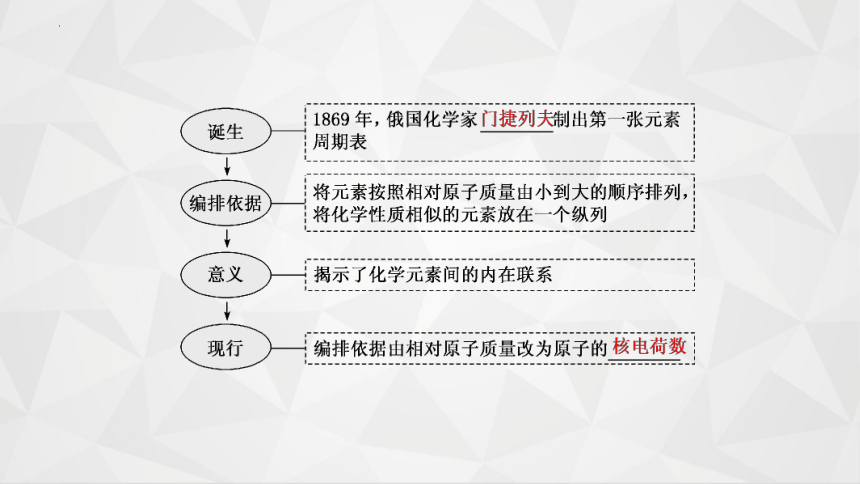
按____________________递增的顺序从左到右排列
将___________________的元素排成一个横行——周期
把________________________的元素排成一个纵列 ——族
原子的核电荷数
电子层数相同
最外层电子数相同
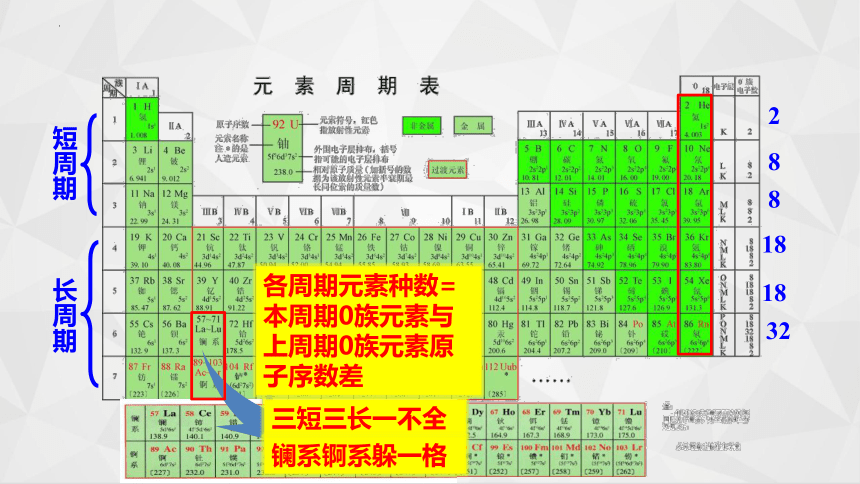
短周期
长周期
三短三长一不全
镧系锕系躲一格
2
8
8
18
18
32
各周期元素种数=本周期0族元素与上周期0族元素原子序数差
VIII族
A:主族
B:副族
0 族
七 A 七 B和 0族
3个纵行第VIII族
42、53、115号元素在什么位置?如何快速确定?
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2He
10Ne
18Ar
36kr
54Xe
86Rn
118Og
2
8
8
18
18
32
32
稀有气体定位法
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
C
第3周期第ⅣA族的元素是________;Na元素的原子序数为11,其相邻的同族元素的原子序数是________;短周期元素中,族序数等于周期序数的元素有______________,族序数等于周期序数2倍的元素有________,周期序数等于族序数2倍的元素有______。
Li
Si
3、19
H、Be、Al
C、S
螺旋时钟式元素周期表
塔式元素周期表
棱台型元素周期表
层式元素周期表
螺旋式元素周期表
透视式元素周期表
螺旋式元素周期表
多用途元素周期表
任务 3
初步认识碱金属元素原子的结构与性质
碱金属
元素名称 元素符号 核电荷数 原子结构 示意图 最外层电子数 最高价 电子 层数 原子半径
( nm)
锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
结构
决定
性质
相似性
递变性
化学性
质相似
(1) 易失去电子,表现出强还原性
(2)化合物中显+1价
最外层电子数相同
核电荷数增大
电子层数增大
原子半径增大
原子核对最外层电子的吸引力减小
失电子能力增强
还原性增强
任务 3
结合钠的化学性质,预测碱金属元素
化学性质的相似性与递变性
元素名称 与水反应 现象 化学方程式
锂
钠
钾
铷
铯
浮、熔、游、响、红
2Na+2H2O === 2NaOH+H2↑
2K+2H2O === 2KOH+H2↑
熔成小球,浮在水面上,四处游动,有轻微的爆鸣声,溶液变红(比钠和水反应剧烈)
不如钠剧烈
比钾剧烈
比铷剧烈
2Li+2H2O === 2LiOH+H2↑
2Rb+2H2O === 2RbOH+H2↑
2Cs+2H2O === 2CsOH+H2↑
相似性
递变性
均能与水反应
均作还原剂
产物中均生成碱和氢气
与水反应越来越剧烈
生成的碱,碱性逐渐增强
还原性逐渐增强
生成氢气的难易程度
越来越容易
元素名称 与O2反应 现象 化学方程式
锂
钠 剧烈燃烧,产生黄色 火焰,生成淡黄色固体
钾 剧烈燃烧(比钠剧烈),产生 紫色火焰,生成黄色固体(超氧化钾)
铷
铯
2Na+O2 === Na2O2
4Li+O2 === 2Li2O
K+O2 === KO2
不如钠剧烈
比钾剧烈
比铷剧烈
产物更加复杂
相似性
递变性
均能与氧气反应
均作还原剂
产物中均生成氧化物
与氧气反应越来越剧烈
生成的氧化物越来越复杂
还原性逐渐增强
单质 与氧气反应 与水反应 反应程度 氢氧化物的碱性 结论
Li
Na
K
Rb
Cs
反应越来越剧烈,产物越来越复杂
遇水燃烧,甚至爆炸
2Na+O2 === Na2O2
4Li+O2 === 2Li2O
2Na+2H2O === 2NaOH+H2↑
2K+2H2O ===2KOH+H2↑
2Li+2H2O === 2LiOH+H2↑
反应剧烈程度依次增强
氢氧化物的碱性依次增强
单质的还原性依次增强
均具有还原性
生成的氧化物越来越复杂
K+O2 === KO2
任务 4
了解碱金属元素物理性质的相似性与递变性
碱金属元素 颜色、状态 密度(g·cm-3) 熔点℃ 沸点℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 1.879 28.40 678.4
密度:从上到下,逐渐增大(K特殊)
熔沸点:从上到下,逐渐降低
递变性
相似性
略带金色光泽
0.86
0.86
除铯外,都呈银白色,都较柔软,密度、熔点都较小
保存在石蜡油中
任务 5
初步认识“位—构—性”的内在联系
性 质
位置
结构
原子结构
(质子数、
最外层电子数)
化合价
得失电子能力
原子序数
周期与族
1.铯是一种碱金属元素,下列关于铯的叙述中正确的是( )
A. 氢氧化铯是一种可溶于水的强碱
B. 铯在空气中燃烧生成氧化铯一种氧化物
C. 铯与水反应,能发生爆炸,并放出氧气
D. 加热碳酸铯可生成氧化铯和二氧化碳
2.下列关于碱金属铷的叙述中,不正确的是( )
A. 碳酸铷易溶于水、易电离
B. 在钠、钾、铷三种单质中,铷的熔点最低
C. 铷比钠活泼,铷可以从氯化钠溶液中置换出钠
D. 氢氧化铷与盐酸反应的离子方程式是H++OH- === H2O
A
C
3.已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )
A. 钡可从氯化钠溶液中置换出金属钠
B. 钡可从冷水中置换出氢气
C. 钡可从硫酸铜溶液中置换出铜
D. 在溶液中钡离子可氧化金属锌,生成锌离子
B
第一节:原子结构与元素周期律
任务 1
了解元素周期表的发展过程
门捷列夫
1869年第1张
Ti = 50 Zr= 90 = 100
V = 51 Nb=94 Ta= 182
Cr = 52 Mo=96 W= 186
Mn= 55 Rh=104.4 Pt= 197.4
Fe = 56 Ru=104.4 Ir= 198
Ni=Co = 59 Pd=106.6 Os= 199
H=1 Cu= 63.4 Ag=108 Hg= 200
Be= 9.4 Mg= 24 Zn= 65.2 Cd=112
B= 11 Al= 27.4 = 68 U=116 Au= 197
C= 12 Si= 28 = 70 Sn=118
N= 14 P= 31 As= 75 Sb=122 Bi= 210
O= 16 S= 32 Se= 79.4 Te= 128
F= 19 Cl= 35.5 Br = 80 I= 127
Li= Na= 23 K= 39 Rb= 85.4 Cs= 133 Tl= 204
Ca= 40 Sr= 87.6 Ba= 137 Pb= 207
= 45 Ce= 92
Er= 56 La= 94
Yt= 60 Di= 95
In= 75.6 Th=118
相对原子质量
门捷列夫
1869年第1张
1871年第2张
门捷列夫
1955年,美国的乔索、哈维、肖邦等人,获得了一种新的元素,以门捷列夫的名字命名为钔,以纪念这位伟大的科学家。
任务 2
认识元素周期表的编排原则及结构
按____________________递增的顺序从左到右排列
将___________________的元素排成一个横行——周期
把________________________的元素排成一个纵列 ——族
原子的核电荷数
电子层数相同
最外层电子数相同
短周期
长周期
三短三长一不全
镧系锕系躲一格
2
8
8
18
18
32
各周期元素种数=本周期0族元素与上周期0族元素原子序数差
VIII族
A:主族
B:副族
0 族
七 A 七 B和 0族
3个纵行第VIII族
42、53、115号元素在什么位置?如何快速确定?
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2He
10Ne
18Ar
36kr
54Xe
86Rn
118Og
2
8
8
18
18
32
32
稀有气体定位法
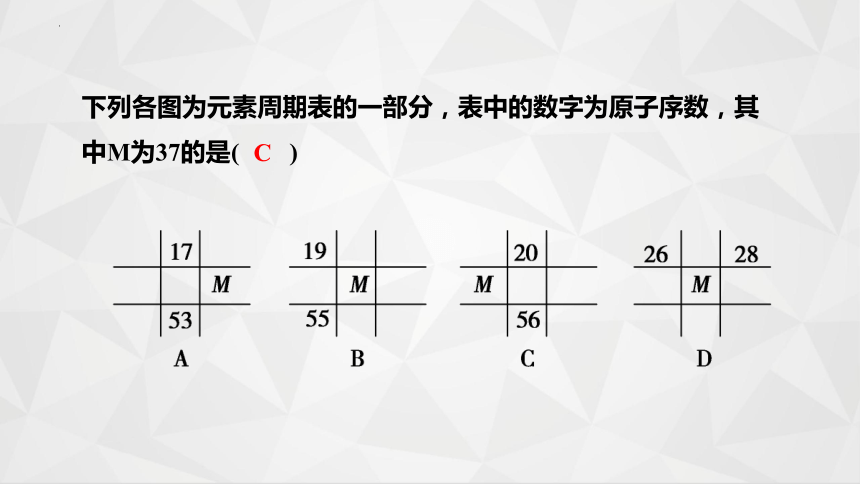
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
C
第3周期第ⅣA族的元素是________;Na元素的原子序数为11,其相邻的同族元素的原子序数是________;短周期元素中,族序数等于周期序数的元素有______________,族序数等于周期序数2倍的元素有________,周期序数等于族序数2倍的元素有______。
Li
Si
3、19
H、Be、Al
C、S
螺旋时钟式元素周期表
塔式元素周期表
棱台型元素周期表
层式元素周期表
螺旋式元素周期表
透视式元素周期表
螺旋式元素周期表
多用途元素周期表
任务 3
初步认识碱金属元素原子的结构与性质
碱金属
元素名称 元素符号 核电荷数 原子结构 示意图 最外层电子数 最高价 电子 层数 原子半径
( nm)
锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
结构
决定
性质
相似性
递变性
化学性
质相似
(1) 易失去电子,表现出强还原性
(2)化合物中显+1价
最外层电子数相同
核电荷数增大
电子层数增大
原子半径增大
原子核对最外层电子的吸引力减小
失电子能力增强
还原性增强
任务 3
结合钠的化学性质,预测碱金属元素
化学性质的相似性与递变性
元素名称 与水反应 现象 化学方程式
锂
钠
钾
铷
铯
浮、熔、游、响、红
2Na+2H2O === 2NaOH+H2↑
2K+2H2O === 2KOH+H2↑
熔成小球,浮在水面上,四处游动,有轻微的爆鸣声,溶液变红(比钠和水反应剧烈)
不如钠剧烈
比钾剧烈
比铷剧烈
2Li+2H2O === 2LiOH+H2↑
2Rb+2H2O === 2RbOH+H2↑
2Cs+2H2O === 2CsOH+H2↑
相似性
递变性
均能与水反应
均作还原剂
产物中均生成碱和氢气
与水反应越来越剧烈
生成的碱,碱性逐渐增强
还原性逐渐增强
生成氢气的难易程度
越来越容易
元素名称 与O2反应 现象 化学方程式
锂
钠 剧烈燃烧,产生黄色 火焰,生成淡黄色固体
钾 剧烈燃烧(比钠剧烈),产生 紫色火焰,生成黄色固体(超氧化钾)
铷
铯
2Na+O2 === Na2O2
4Li+O2 === 2Li2O
K+O2 === KO2
不如钠剧烈
比钾剧烈
比铷剧烈
产物更加复杂
相似性
递变性
均能与氧气反应
均作还原剂
产物中均生成氧化物
与氧气反应越来越剧烈
生成的氧化物越来越复杂
还原性逐渐增强
单质 与氧气反应 与水反应 反应程度 氢氧化物的碱性 结论
Li
Na
K
Rb
Cs
反应越来越剧烈,产物越来越复杂
遇水燃烧,甚至爆炸
2Na+O2 === Na2O2
4Li+O2 === 2Li2O
2Na+2H2O === 2NaOH+H2↑
2K+2H2O ===2KOH+H2↑
2Li+2H2O === 2LiOH+H2↑
反应剧烈程度依次增强
氢氧化物的碱性依次增强
单质的还原性依次增强
均具有还原性
生成的氧化物越来越复杂
K+O2 === KO2
任务 4
了解碱金属元素物理性质的相似性与递变性
碱金属元素 颜色、状态 密度(g·cm-3) 熔点℃ 沸点℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 1.879 28.40 678.4
密度:从上到下,逐渐增大(K特殊)
熔沸点:从上到下,逐渐降低
递变性
相似性
略带金色光泽
0.86
0.86
除铯外,都呈银白色,都较柔软,密度、熔点都较小
保存在石蜡油中
任务 5
初步认识“位—构—性”的内在联系
性 质
位置
结构
原子结构
(质子数、
最外层电子数)
化合价
得失电子能力
原子序数
周期与族
1.铯是一种碱金属元素,下列关于铯的叙述中正确的是( )
A. 氢氧化铯是一种可溶于水的强碱
B. 铯在空气中燃烧生成氧化铯一种氧化物
C. 铯与水反应,能发生爆炸,并放出氧气
D. 加热碳酸铯可生成氧化铯和二氧化碳
2.下列关于碱金属铷的叙述中,不正确的是( )
A. 碳酸铷易溶于水、易电离
B. 在钠、钾、铷三种单质中,铷的熔点最低
C. 铷比钠活泼,铷可以从氯化钠溶液中置换出钠
D. 氢氧化铷与盐酸反应的离子方程式是H++OH- === H2O
A
C
3.已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )
A. 钡可从氯化钠溶液中置换出金属钠
B. 钡可从冷水中置换出氢气
C. 钡可从硫酸铜溶液中置换出铜
D. 在溶液中钡离子可氧化金属锌,生成锌离子
B
