4.1元素周期表(第三课时)课件(共18张)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1元素周期表(第三课时)课件(共18张)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 835.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 08:20:42 | ||
图片预览





文档简介
(共18张PPT)
第一节:原子结构与元素周期律
任务 1
初步认识卤族元素原子的结构与性质
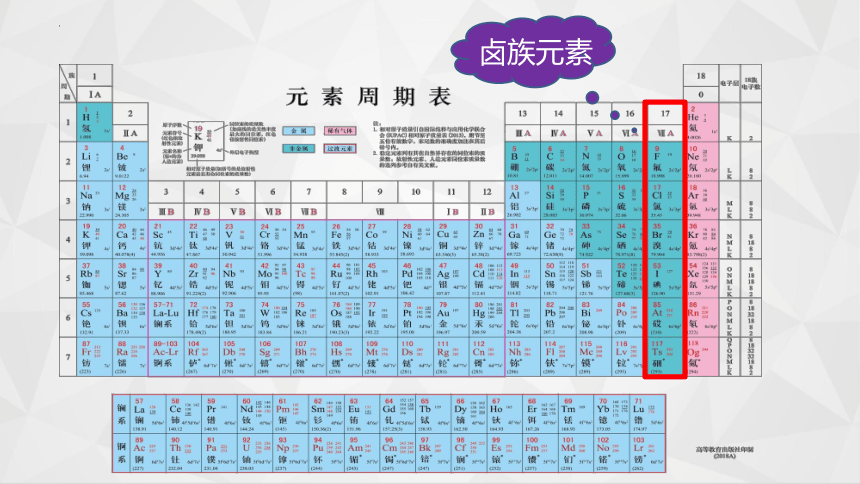
卤族元素
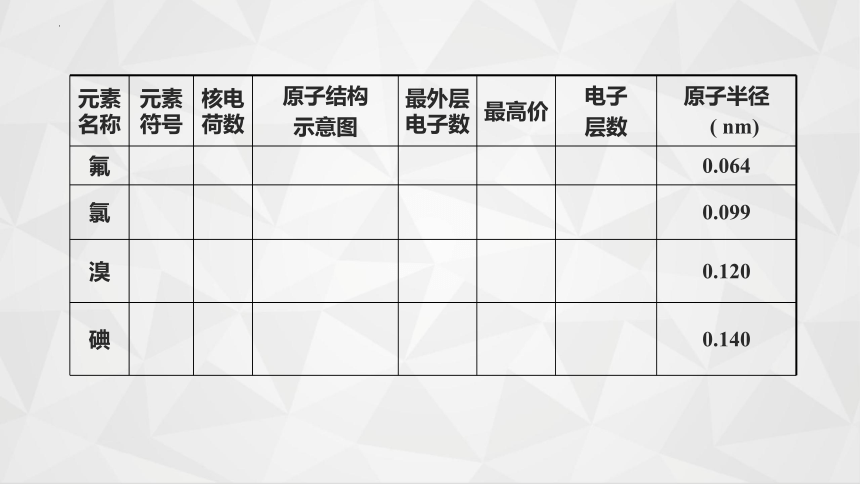
元素名称 元素符号 核电荷数 原子结构 示意图 最外层电子数 最高价 电子 层数 原子半径
( nm)
氟 0.064
氯 0.099
溴 0.120
碘 0.140
结构
决定
性质
相似性
递变性
化学性
质相似
(1) 易得到电子,表现出强氧化性
(2)化合物中通常显-1价
最外层电子数相同
核电荷数增大
电子层数增大
原子半径增大
原子核对最外层电子的吸引力减小
得电子能力减弱
氧化性减弱
任务 3
结合氯的化学性质,预测卤族元素
化学性质的相似性与递变性
元素名称 与水反应 现象 化学方程式
氟
氯
溴
碘
2F2 + 2H2O === 4HF + O2 (爆炸)
反应剧烈,易爆炸,产生无色无味气体
X2 + H2O HX+ HXO
反应逐渐变缓慢
元素名称 与H2反应 现象 反应条件 气态氢化物稳定性 化学方程式
氟
氯
溴
碘
H2+X2 → 2HX
一定条件
元素名称 与碱反应 化学方程式
氟 X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
氯
溴
碘
元素名称 与金属单质反应 化学方程式
氟
氯
溴
碘
3X2 + 2Fe === 2FeX3
△
(X=F、Cl、Br 但≠I 除外)
△
I2 + Fe === FeI2
实验操作 实验现象 离子反应方程式 结论
振荡静置后,溶液由无色变为橙黄色
振荡静置后,溶液由无色变为褐色
振荡静置后,溶液由无色变为褐色
Cl2+ 2I- === 2Cl-+I2
Cl2+2Br- === 2Cl-+Br2
Br2+2I- === 2Br-+I2
Cl2>Br2
Cl2>I2
Br2>I2
结论:氧化性:Cl2>Br2>I2
元素非金属性强弱的探究:
相似性
递变性
均能与水、H2、碱、金属单质反应
均作氧化剂
反应类型相似
反应越来越不剧烈
与氢气化合的难易程度
越来越难
氧化性逐渐减弱
生成的气态氢化物
越来越不稳定
任务 4
了解卤族元素物理性质的相似性与递变性
卤素单质 颜色和状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69 g·L-1(15 ℃) -219.6 -188.1
Cl2 黄绿色气体 3.214 g·L-1(0 ℃) -101 -34.6
Br2 深红棕色液体 3.119 g·cm-3(20 ℃) -7.2 58.78
I2 紫黑色固体 4.93 g·cm-3 113.5 184.4
都是有色单质
熔、沸点较低
相似性
单质密度逐渐增大
从上到下,熔、沸点逐渐升高
单质颜色逐渐加深,状态由气态到液态到固态
递变性
氯易液化、溴易挥发、碘易升华,遇淀粉变蓝。
特殊性:
任务 5
再认识“位—构—性”的内在联系
非金属性
逐渐增强
金属性
逐渐增强
1.单质的氧化性逐渐增强
2.与氢气化合的难易程度越来越容易
3.生成的气态氢化物越来越稳定
1.单质的还原性逐渐增强
2.与水反应的剧烈程度越来越剧烈
3.生成的碱,碱性越来越强
元素周期律
1. 卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增大起主要作用
D
2. 随着卤素原子序数的增加,下列递变规律正确的是( )
A.单质的熔沸点逐渐降低 B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
B
3. 若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子
层,且最外层有7个电子。下列叙述中正确的是( )
A.此X元素的气态氢化物的化学式为HX,在常温下很稳定
B.其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2
C.其单质的分子式为X2,易溶于有机溶剂
D.AgX是一种有色的易溶于水的化合物
C
第一节:原子结构与元素周期律
任务 1
初步认识卤族元素原子的结构与性质
卤族元素
元素名称 元素符号 核电荷数 原子结构 示意图 最外层电子数 最高价 电子 层数 原子半径
( nm)
氟 0.064
氯 0.099
溴 0.120
碘 0.140
结构
决定
性质
相似性
递变性
化学性
质相似
(1) 易得到电子,表现出强氧化性
(2)化合物中通常显-1价
最外层电子数相同
核电荷数增大
电子层数增大
原子半径增大
原子核对最外层电子的吸引力减小
得电子能力减弱
氧化性减弱
任务 3
结合氯的化学性质,预测卤族元素
化学性质的相似性与递变性
元素名称 与水反应 现象 化学方程式
氟
氯
溴
碘
2F2 + 2H2O === 4HF + O2 (爆炸)
反应剧烈,易爆炸,产生无色无味气体
X2 + H2O HX+ HXO
反应逐渐变缓慢
元素名称 与H2反应 现象 反应条件 气态氢化物稳定性 化学方程式
氟
氯
溴
碘
H2+X2 → 2HX
一定条件
元素名称 与碱反应 化学方程式
氟 X2+ 2NaOH === NaX+ NaXO+H2O (F除外)
氯
溴
碘
元素名称 与金属单质反应 化学方程式
氟
氯
溴
碘
3X2 + 2Fe === 2FeX3
△
(X=F、Cl、Br 但≠I 除外)
△
I2 + Fe === FeI2
实验操作 实验现象 离子反应方程式 结论
振荡静置后,溶液由无色变为橙黄色
振荡静置后,溶液由无色变为褐色
振荡静置后,溶液由无色变为褐色
Cl2+ 2I- === 2Cl-+I2
Cl2+2Br- === 2Cl-+Br2
Br2+2I- === 2Br-+I2
Cl2>Br2
Cl2>I2
Br2>I2
结论:氧化性:Cl2>Br2>I2
元素非金属性强弱的探究:
相似性
递变性
均能与水、H2、碱、金属单质反应
均作氧化剂
反应类型相似
反应越来越不剧烈
与氢气化合的难易程度
越来越难
氧化性逐渐减弱
生成的气态氢化物
越来越不稳定
任务 4
了解卤族元素物理性质的相似性与递变性
卤素单质 颜色和状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69 g·L-1(15 ℃) -219.6 -188.1
Cl2 黄绿色气体 3.214 g·L-1(0 ℃) -101 -34.6
Br2 深红棕色液体 3.119 g·cm-3(20 ℃) -7.2 58.78
I2 紫黑色固体 4.93 g·cm-3 113.5 184.4
都是有色单质
熔、沸点较低
相似性
单质密度逐渐增大
从上到下,熔、沸点逐渐升高
单质颜色逐渐加深,状态由气态到液态到固态
递变性
氯易液化、溴易挥发、碘易升华,遇淀粉变蓝。
特殊性:
任务 5
再认识“位—构—性”的内在联系
非金属性
逐渐增强
金属性
逐渐增强
1.单质的氧化性逐渐增强
2.与氢气化合的难易程度越来越容易
3.生成的气态氢化物越来越稳定
1.单质的还原性逐渐增强
2.与水反应的剧烈程度越来越剧烈
3.生成的碱,碱性越来越强
元素周期律
1. 卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增大起主要作用
D
2. 随着卤素原子序数的增加,下列递变规律正确的是( )
A.单质的熔沸点逐渐降低 B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
B
3. 若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子
层,且最外层有7个电子。下列叙述中正确的是( )
A.此X元素的气态氢化物的化学式为HX,在常温下很稳定
B.其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2
C.其单质的分子式为X2,易溶于有机溶剂
D.AgX是一种有色的易溶于水的化合物
C
