5.1.1元素周期律课件(共18张PPT)2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 5.1.1元素周期律课件(共18张PPT)2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 18:49:45 | ||
图片预览




文档简介
(共18张PPT)
第一节 元素周期律和元素周期表
课时1 元素周期律
第五章 微观结构与物质的多样性
学习目标
1.通过分析1~18号元素原子核外电子排布、原子半径、主要化合价的变化,总结出它们的递变规律,并由此认识元素周期律。
2.初步认识元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。
3.形成结构决定性质的观念。
有什么规律?
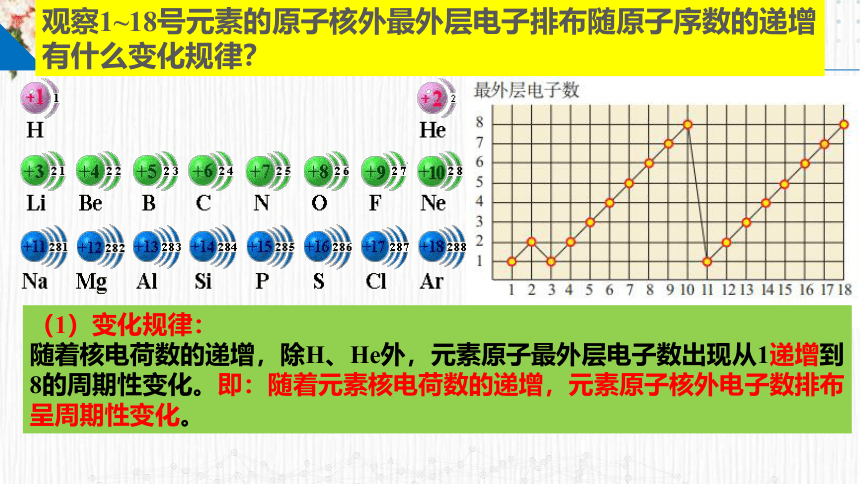
(1)变化规律:
随着核电荷数的递增,除H、He外,元素原子最外层电子数出现从1递增到8的周期性变化。即:随着元素核电荷数的递增,元素原子核外电子数排布呈周期性变化。
观察1~18号元素的原子核外最外层电子排布随原子序数的递增有什么变化规律?
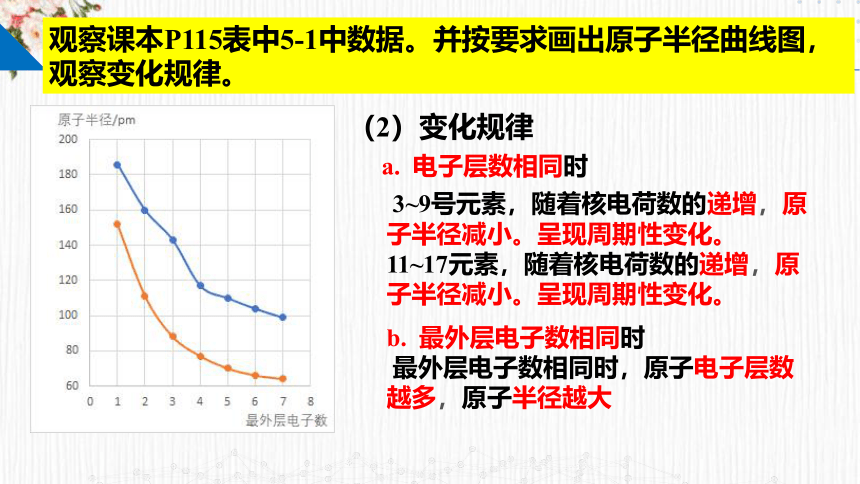
观察课本P115表中5-1中数据。并按要求画出原子半径曲线图,观察变化规律。
(2)变化规律
3~9号元素,随着核电荷数的递增,原子半径减小。呈现周期性变化。
11~17元素,随着核电荷数的递增,原子半径减小。呈现周期性变化。
b. 最外层电子数相同时
最外层电子数相同时,原子电子层数越多,原子半径越大
a. 电子层数相同时
原子半径减小(稀有气体除外)
原子半径增大
总结:微粒半径大小比较规律:(稀有气体除外)
1.先看电子层,层多径大
2.层同看序号,序大径小
3.序同看电子数,数大径大
如:r(S2-)>r(Na+)>r(H+)
如:r(Al3+)<r(Mg2+)<r(Na+)
如:r(Cl-)>r(Cl)
例:下列各组元素中按微粒半径递增顺序排列的是 ( )
A.K Na Li B.N O F
C.Ca2+ K+ Cl- D.Ba2+ Ca2+ Mg2+
C
交流与讨论:以1-18号元素为例,参照下表,以原子序数为横坐标、元素主要化合价(最高正价、最低负价)为纵坐标,绘制折线图。
随着核电荷数的递增,元素的最高正化合价呈现+1到+7(氧、氟除外)、最低负化合价呈现-4到-1的周期性变化。
(3)变化规律(稀有气体元素除外)
O无最高正价,F没有正价
观察思考:主要化合价变化和最外层电子数有何关系?
元素的最高正化合价=最外层电子数(O、F及稀有气体除外)
元素的最低负化合价(非金属具有)=最外层电子数-8
元素的最高正化合价+|元素的最低负化合价|=8
金属性
在化学反应中元素的原子失去电子的能力,与失电子的数目无关。
非金属性
在化学反应中元素的原子得电子的能力,与得电子的数目无关。
推测:元素的金属性、非金属性是否也呈现周期性变化?
1、元素金属性强弱的判断依据:
①元素原子越易失去电子
②与水或酸置换氢气越容易
③最高价氧化物水化物碱性越强
④单质还原性越强、金属阳离子
氧化性越弱
2、元素非金属性强弱的判断依据:
①元素原子越易得到电子
②与氢气反应越容易
③气态氢化物越稳定
④最高价氧化物水化物酸性越强
⑤单质氧化性越强、阴离子还原性越弱
以11-17号元素为例,分析元素金属性与非金属的变化。
基础实验
P117
实验 Na Mg Al
与水反应 与冷水反应
与热水反应 ─
与盐酸反应 ─
钠与水反应剧烈,熔成闪亮的小球,四处游动最终消失,溶液变红
反应缓慢
镁条表面产生气泡,溶液变红
不反应
铝条表面产生气泡,溶液变红
两种金属均与盐酸反应并产生大量气泡;镁与盐酸的反应比铝与盐酸的反应剧烈
分析:钠、镁、铝金属性强弱的顺序是 。
Na>Mg>Al
?
与水或酸反应置换出氢的剧烈程度减弱
最高价氧化物的水化物的碱性:
元素的金属性:Na>Mg>Al
金属失电子的能力:
Na>Mg>Al
NaOH>Mg(OH)2>Al(OH)3
与水或酸反应置换出氢的剧烈程度:
Na>Mg>Al
对应阳离子的氧化性:
Na+单质的还原性:
Na>Mg>Al
交流讨论
P118
与氢气化合条件由难到易
气态氢化物稳定性由弱到强
结论:非金属性Si?
最高价氧化物的水化物的酸性:
非金属得电子的能力:
SiH2SiO3单质与氢气的化合难易程度:
单质的氧化性:
气态氢化物稳定性:
元素的非金属性:Si弱酸
中强酸
强酸
最强酸
SiH4Si对应阴离子的还原性
Si4->P3->S2->Cl-
Si当元素原子的核外电子层数相同时,随着核电荷数的递增,元素的非金属性逐渐增强,元素的金属性逐渐减弱。呈现周期性的变化
Al(OH)3的性质
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,Al(OH)3是两性氢氧化物。
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
归纳总结:
随着原子序数的递增:
①原子核外电子排布呈周期性变化(结构上)
②原子半径呈周期性变化
③元素主要化合价呈周期性变化
④元素的金属性、非金属性呈现周期性的变化
元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周期律。
(性质体现)
第一节 元素周期律和元素周期表
课时1 元素周期律
第五章 微观结构与物质的多样性
学习目标
1.通过分析1~18号元素原子核外电子排布、原子半径、主要化合价的变化,总结出它们的递变规律,并由此认识元素周期律。
2.初步认识元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。
3.形成结构决定性质的观念。
有什么规律?
(1)变化规律:
随着核电荷数的递增,除H、He外,元素原子最外层电子数出现从1递增到8的周期性变化。即:随着元素核电荷数的递增,元素原子核外电子数排布呈周期性变化。
观察1~18号元素的原子核外最外层电子排布随原子序数的递增有什么变化规律?
观察课本P115表中5-1中数据。并按要求画出原子半径曲线图,观察变化规律。
(2)变化规律
3~9号元素,随着核电荷数的递增,原子半径减小。呈现周期性变化。
11~17元素,随着核电荷数的递增,原子半径减小。呈现周期性变化。
b. 最外层电子数相同时
最外层电子数相同时,原子电子层数越多,原子半径越大
a. 电子层数相同时
原子半径减小(稀有气体除外)
原子半径增大
总结:微粒半径大小比较规律:(稀有气体除外)
1.先看电子层,层多径大
2.层同看序号,序大径小
3.序同看电子数,数大径大
如:r(S2-)>r(Na+)>r(H+)
如:r(Al3+)<r(Mg2+)<r(Na+)
如:r(Cl-)>r(Cl)
例:下列各组元素中按微粒半径递增顺序排列的是 ( )
A.K Na Li B.N O F
C.Ca2+ K+ Cl- D.Ba2+ Ca2+ Mg2+
C
交流与讨论:以1-18号元素为例,参照下表,以原子序数为横坐标、元素主要化合价(最高正价、最低负价)为纵坐标,绘制折线图。
随着核电荷数的递增,元素的最高正化合价呈现+1到+7(氧、氟除外)、最低负化合价呈现-4到-1的周期性变化。
(3)变化规律(稀有气体元素除外)
O无最高正价,F没有正价
观察思考:主要化合价变化和最外层电子数有何关系?
元素的最高正化合价=最外层电子数(O、F及稀有气体除外)
元素的最低负化合价(非金属具有)=最外层电子数-8
元素的最高正化合价+|元素的最低负化合价|=8
金属性
在化学反应中元素的原子失去电子的能力,与失电子的数目无关。
非金属性
在化学反应中元素的原子得电子的能力,与得电子的数目无关。
推测:元素的金属性、非金属性是否也呈现周期性变化?
1、元素金属性强弱的判断依据:
①元素原子越易失去电子
②与水或酸置换氢气越容易
③最高价氧化物水化物碱性越强
④单质还原性越强、金属阳离子
氧化性越弱
2、元素非金属性强弱的判断依据:
①元素原子越易得到电子
②与氢气反应越容易
③气态氢化物越稳定
④最高价氧化物水化物酸性越强
⑤单质氧化性越强、阴离子还原性越弱
以11-17号元素为例,分析元素金属性与非金属的变化。
基础实验
P117
实验 Na Mg Al
与水反应 与冷水反应
与热水反应 ─
与盐酸反应 ─
钠与水反应剧烈,熔成闪亮的小球,四处游动最终消失,溶液变红
反应缓慢
镁条表面产生气泡,溶液变红
不反应
铝条表面产生气泡,溶液变红
两种金属均与盐酸反应并产生大量气泡;镁与盐酸的反应比铝与盐酸的反应剧烈
分析:钠、镁、铝金属性强弱的顺序是 。
Na>Mg>Al
?
与水或酸反应置换出氢的剧烈程度减弱
最高价氧化物的水化物的碱性:
元素的金属性:Na>Mg>Al
金属失电子的能力:
Na>Mg>Al
NaOH>Mg(OH)2>Al(OH)3
与水或酸反应置换出氢的剧烈程度:
Na>Mg>Al
对应阳离子的氧化性:
Na+
Na>Mg>Al
交流讨论
P118
与氢气化合条件由难到易
气态氢化物稳定性由弱到强
结论:非金属性Si
最高价氧化物的水化物的酸性:
非金属得电子的能力:
Si
单质的氧化性:
气态氢化物稳定性:
元素的非金属性:Si
中强酸
强酸
最强酸
SiH4
Si4->P3->S2->Cl-
Si
Al(OH)3的性质
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,Al(OH)3是两性氢氧化物。
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
归纳总结:
随着原子序数的递增:
①原子核外电子排布呈周期性变化(结构上)
②原子半径呈周期性变化
③元素主要化合价呈周期性变化
④元素的金属性、非金属性呈现周期性的变化
元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周期律。
(性质体现)
