化学人教版(2019)必修第一册4.3.1离子键(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.1离子键(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 19:16:49 | ||
图片预览





文档简介
(共21张PPT)
第1课时 离子键
第四章 第三节 化学键
1.通过氯化钠的形成过程,认识离子键的形成,了解离子键和离子化
合物的概念,会判断离子化合物(重点)。
2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微
观探析”化学核心素养的发展(难点)。
核心素养学习目标
创设情境
118种元素组成的物质千万种,什么作用使这些元素的原子结合在一起的呢?
任务一:离子键与离子化合物
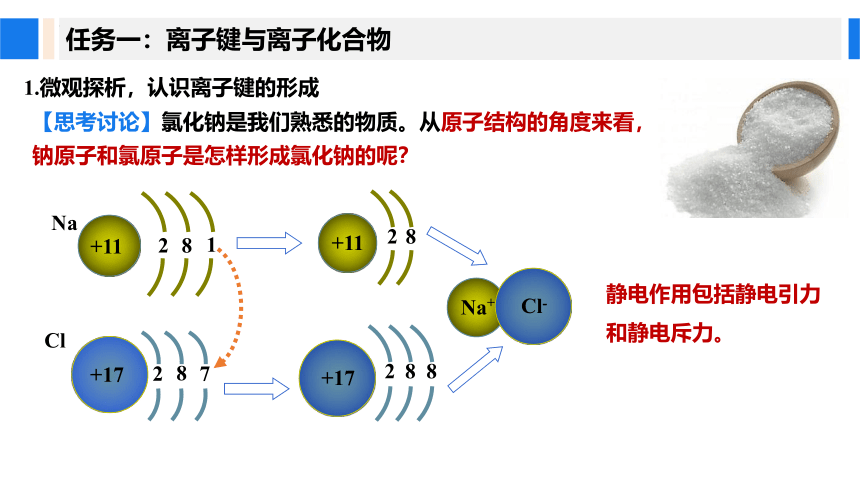
1.微观探析,认识离子键的形成
【思考讨论】氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
静电作用包括静电引力和静电斥力。
任务一:离子键与离子化合物
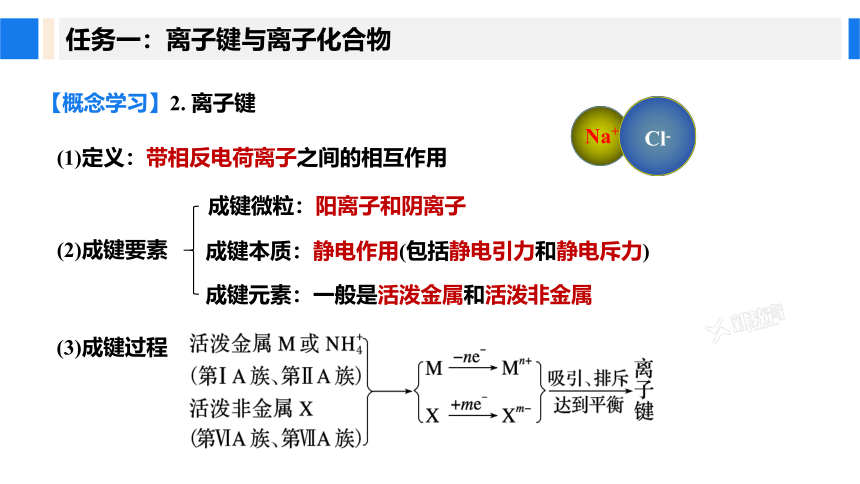
(1)定义:带相反电荷离子之间的相互作用
Na+
Cl-
【概念学习】2. 离子键
(2)成键要素
成键微粒:阳离子和阴离子
成键本质:静电作用(包括静电引力和静电斥力)
成键元素:一般是活泼金属和活泼非金属
(3)成键过程
任务一:离子键与离子化合物
【概念学习】3.离子化合物
(1)定义:由离子键构成的化合物。
【思考讨论】判断下列哪些物质是离子化合物?(填“是”或“不是”)
①KBr______;②HCl______;③NH4Cl ______;
④NaOH______;⑤KNO3______;⑥Na2O______。
是
不是
是
是
是
是
(2)与物质类别的关系
强碱:NaOH、KOH等
大多数盐:NaCl、K2SO4、NH4Cl等
活泼金属氧化物:Na2O、CaO等
任务一:离子键与离子化合物
【归纳总结】
(1)并不是所有的金属与非金属化合都能形成离子键。
如AlCl3中不存在离子键。
(2)非金属元素间也可形成离子键。
如NH4Cl中与Cl-间的就是离子键。
(3)离子化合物中一定含有离子键,含离子键的化合物一定是离子化合物。
【评价训练】
任务一:离子键与离子化合物
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键。
(2)金属元素与非金属元素形成的化合物一定为离子化合物。
(3)离子化合物中一定含有金属元素。
(4)所有氧化物均为离子化合物。
(5)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物。
(6)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电。
×
×
×
×
×
×
任务一:离子键与离子化合物
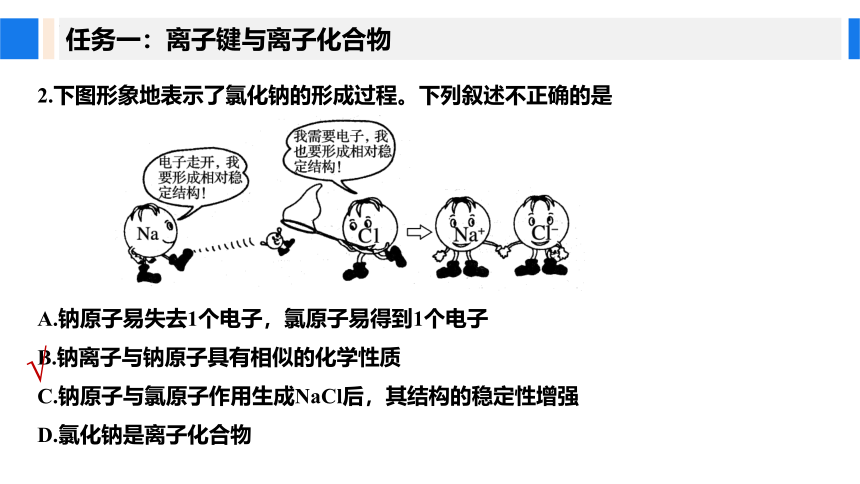
2.下图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子具有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
任务一:离子键与离子化合物
3.含离子键的氧化物是
A.MgO B.HClO C.NO D.KOH
√
4.下列哪一组元素的原子间容易形成离子键
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c B.a和f C.d和g D.c和g
√
任务二:电子式
Gilbert Newton Lewis
(吉尔伯特·牛顿·路易斯)
吉尔伯特·牛顿·路易斯(Gilbert Newton Lewis,1875-1946年),美国化学家,美国加利福尼亚大学伯克利分校教授、前伯克利化学院院长,曾41次获得诺贝尔化学奖提名,而他从未获奖也成为诺贝尔奖历史上的巨大争议之一。 路易斯是化学热力学创始人之一,提出了电子对共价键理论、酸碱电子理论等,化学中的"路易斯结构式"即是以其名字命名,他还在同位素分离、光化学领域做出了贡献,并于1926年命名了"光子"
【资料卡片】
(1)定义:在元素符号周围用“·”或“×”来表示原子的__________________的式子叫做电子式。
任务二:电子式
【微观表征】1.电子式
最外层电子(价电子)
(2)书写
a.原子的电子式(以第三周期部分元素为例)
Na
·Na
Mg
·Mg·
Mg
·
·
Al
Al
·
·
·
Al
·
·
·
每个方向最多一对电子(两个电子)
美国化学家托马斯·米奇利
制冷剂——氟利昂
上世纪80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害到人类的健康。在元素周期表和元素周期律的指导下,人们踏上了寻找新一代制冷剂的征程,氟利昂将逐步被新的制冷剂所替代。
任务二:电子式
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示。
b.简单阳离子的电子式
画出最外层电子数,用“[ ]”括起来,并在右上角标出“ n-”以表示其所带的电荷。
例如:Na+、Li+、Mg2+、Al3+等。
c.简单阴离子的电子式
d.离子化合物的电子式
例如:氯离子__________________、硫离子__________________。
氧化钙_________________、硫化钾_________________。
相同离子不合并,分列在另一离子的周围
【对比归纳】
任务二:电子式
原子
阳离子
阴离子
化合物
【归纳总结】常见粒子的电子式
Na
Mg
N
O
F
Al
C
Na+
Mg2+
Ca2+
H+
[ Cl ]-
[ S ]2-
[ Br ]-
[ O ]2-
[H N H]+
H
H
[ O H]-
[ O
O ]2-
Na+
[ Cl ]-
[ Cl ]-
Mg2+
[ Cl ]-
Mg2+
[ O ]2-
Na+
[ O H]-
注意电子平均分布
简单阳离子即离子符号
注意离子不可合并
任务二:电子式
【思考讨论】有的同学将MgO的电子式写为 ,这样书写是否正确并说明原因?
不正确。MgO为离子化合物,应写为 ,阴离子的电子式必须加[ ],并指明电荷数。
任务二:电子式
2.用电子式表示离子化合物的形成过程
【思考讨论】有的同学用电子式表示化合物Na2S的形成过程为
2Na+S == ,这样书写是否正确并说明原因?
不正确。应书写为 ,且形成过程不用“===”,应用“ ”。
【归纳总结】
任务二:电子式
书写电子式的注意事项
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”或“×”的个数即表示原子的
最外层电子数。
(2)化合物形成之前同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaCl2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能用“===”,应用“ ”。“ ”前是原子的电子式,“ ”后是化合物的电子式。
【评价训练】
任务二:电子式
1.判断正误
(1)O:
(2)Al3+:
(3)Na2O:
(4)KCl的形成过程:
(5)Mg3N2的形成过程:3Mg×+
×
×
×
×
×
任务二:电子式
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
任务二:电子式
3.用电子式表示下列离子化合物的形成过程:
BaCl2:________________________________________;
MgS:________________________;
K2O:__________________________。
本课结束
今日作业
第四章 第三节 第1课时 离子键
第1课时 离子键
第四章 第三节 化学键
1.通过氯化钠的形成过程,认识离子键的形成,了解离子键和离子化
合物的概念,会判断离子化合物(重点)。
2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微
观探析”化学核心素养的发展(难点)。
核心素养学习目标
创设情境
118种元素组成的物质千万种,什么作用使这些元素的原子结合在一起的呢?
任务一:离子键与离子化合物
1.微观探析,认识离子键的形成
【思考讨论】氯化钠是我们熟悉的物质。从原子结构的角度来看,钠原子和氯原子是怎样形成氯化钠的呢?
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
静电作用包括静电引力和静电斥力。
任务一:离子键与离子化合物
(1)定义:带相反电荷离子之间的相互作用
Na+
Cl-
【概念学习】2. 离子键
(2)成键要素
成键微粒:阳离子和阴离子
成键本质:静电作用(包括静电引力和静电斥力)
成键元素:一般是活泼金属和活泼非金属
(3)成键过程
任务一:离子键与离子化合物
【概念学习】3.离子化合物
(1)定义:由离子键构成的化合物。
【思考讨论】判断下列哪些物质是离子化合物?(填“是”或“不是”)
①KBr______;②HCl______;③NH4Cl ______;
④NaOH______;⑤KNO3______;⑥Na2O______。
是
不是
是
是
是
是
(2)与物质类别的关系
强碱:NaOH、KOH等
大多数盐:NaCl、K2SO4、NH4Cl等
活泼金属氧化物:Na2O、CaO等
任务一:离子键与离子化合物
【归纳总结】
(1)并不是所有的金属与非金属化合都能形成离子键。
如AlCl3中不存在离子键。
(2)非金属元素间也可形成离子键。
如NH4Cl中与Cl-间的就是离子键。
(3)离子化合物中一定含有离子键,含离子键的化合物一定是离子化合物。
【评价训练】
任务一:离子键与离子化合物
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键。
(2)金属元素与非金属元素形成的化合物一定为离子化合物。
(3)离子化合物中一定含有金属元素。
(4)所有氧化物均为离子化合物。
(5)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物。
(6)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电。
×
×
×
×
×
×
任务一:离子键与离子化合物
2.下图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子具有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
任务一:离子键与离子化合物
3.含离子键的氧化物是
A.MgO B.HClO C.NO D.KOH
√
4.下列哪一组元素的原子间容易形成离子键
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c B.a和f C.d和g D.c和g
√
任务二:电子式
Gilbert Newton Lewis
(吉尔伯特·牛顿·路易斯)
吉尔伯特·牛顿·路易斯(Gilbert Newton Lewis,1875-1946年),美国化学家,美国加利福尼亚大学伯克利分校教授、前伯克利化学院院长,曾41次获得诺贝尔化学奖提名,而他从未获奖也成为诺贝尔奖历史上的巨大争议之一。 路易斯是化学热力学创始人之一,提出了电子对共价键理论、酸碱电子理论等,化学中的"路易斯结构式"即是以其名字命名,他还在同位素分离、光化学领域做出了贡献,并于1926年命名了"光子"
【资料卡片】
(1)定义:在元素符号周围用“·”或“×”来表示原子的__________________的式子叫做电子式。
任务二:电子式
【微观表征】1.电子式
最外层电子(价电子)
(2)书写
a.原子的电子式(以第三周期部分元素为例)
Na
·Na
Mg
·Mg·
Mg
·
·
Al
Al
·
·
·
Al
·
·
·
每个方向最多一对电子(两个电子)
美国化学家托马斯·米奇利
制冷剂——氟利昂
上世纪80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害到人类的健康。在元素周期表和元素周期律的指导下,人们踏上了寻找新一代制冷剂的征程,氟利昂将逐步被新的制冷剂所替代。
任务二:电子式
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示。
b.简单阳离子的电子式
画出最外层电子数,用“[ ]”括起来,并在右上角标出“ n-”以表示其所带的电荷。
例如:Na+、Li+、Mg2+、Al3+等。
c.简单阴离子的电子式
d.离子化合物的电子式
例如:氯离子__________________、硫离子__________________。
氧化钙_________________、硫化钾_________________。
相同离子不合并,分列在另一离子的周围
【对比归纳】
任务二:电子式
原子
阳离子
阴离子
化合物
【归纳总结】常见粒子的电子式
Na
Mg
N
O
F
Al
C
Na+
Mg2+
Ca2+
H+
[ Cl ]-
[ S ]2-
[ Br ]-
[ O ]2-
[H N H]+
H
H
[ O H]-
[ O
O ]2-
Na+
[ Cl ]-
[ Cl ]-
Mg2+
[ Cl ]-
Mg2+
[ O ]2-
Na+
[ O H]-
注意电子平均分布
简单阳离子即离子符号
注意离子不可合并
任务二:电子式
【思考讨论】有的同学将MgO的电子式写为 ,这样书写是否正确并说明原因?
不正确。MgO为离子化合物,应写为 ,阴离子的电子式必须加[ ],并指明电荷数。
任务二:电子式
2.用电子式表示离子化合物的形成过程
【思考讨论】有的同学用电子式表示化合物Na2S的形成过程为
2Na+S == ,这样书写是否正确并说明原因?
不正确。应书写为 ,且形成过程不用“===”,应用“ ”。
【归纳总结】
任务二:电子式
书写电子式的注意事项
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”或“×”的个数即表示原子的
最外层电子数。
(2)化合物形成之前同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaCl2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能用“===”,应用“ ”。“ ”前是原子的电子式,“ ”后是化合物的电子式。
【评价训练】
任务二:电子式
1.判断正误
(1)O:
(2)Al3+:
(3)Na2O:
(4)KCl的形成过程:
(5)Mg3N2的形成过程:3Mg×+
×
×
×
×
×
任务二:电子式
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
任务二:电子式
3.用电子式表示下列离子化合物的形成过程:
BaCl2:________________________________________;
MgS:________________________;
K2O:__________________________。
本课结束
今日作业
第四章 第三节 第1课时 离子键
