第1章 化学反应与能量转化 同步练习题(含解析) 高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 化学反应与能量转化 同步练习题(含解析) 高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 19:20:17 | ||
图片预览


文档简介
第一章:化学反应与能量转化 同步练习题
一、单选题
1.如图是铅酸蓄电池的构造示意图,下列说法错误的是
A.铅酸蓄电池是二次电池,充电时电能转化为化学能
B.该电池工作时,电子由板通过外电路流向板
C.该电池工作时,负极的电极反应式为
D.该电池工作时,移向板
2.某同学利用如图所示装置探究原电池原理。下列说法正确的是
A.Zn电极是该电池的正极
B.Cu电极表面产生的气体是H2
C.电子经导线由Cu电极流入Zn电极
D.该装置可将电能转化为化学能
3.中和热测定实验中,下列操作一定会降低实验准确性的是
A.用滴定管取所用药品
B.NaOH溶液在倒入小烧杯时速度过慢
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后,用来测NaOH溶液的温度
4.关于化学反应热效应的叙述中,正确的是
A.放热反应在常温下就一定很容易发生 B.放热反应中反应物的总能量大于生成物的总能量
C.化学反应过程中,化学能一定转化成热能 D.凡是需加热才能进行的反应—定是吸热反应
5.“暖宝宝”的主要原料有:铁粉、活性炭、水、食盐等。其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液。下列有关“暖宝宝”的说法中错误的是
A.活性炭作用是作原电池的正极,加速铁粉的氧化
B.“暖宝宝”放出的热量是铁氧化时产生的
C.“暖宝宝”使用前要密封保存,使之与空气隔绝
D.活性炭最终将转化为二氧化碳
6.2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法错误的是
A.催化剂可促进反应中电子的转移
B.b电极上的电极反应为O2+H2O+2e-=HO+OH-
C.每生成1molH2O2电极上流过2mole-
D.Y膜为选择性阳离子交换膜
7.已知:。以太阳能为热源分解,经热化学铁氧化合物循环分解水制的过程如图所示:
过程Ⅰ:
过程Ⅱ:……
下列说法不正确的是
A.过程Ⅰ中每消耗,转移电子
B.过程Ⅱ中反应的热化学方程式为
C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能
D.铁氧化合物循环制具有成本低、产物易分离等优点
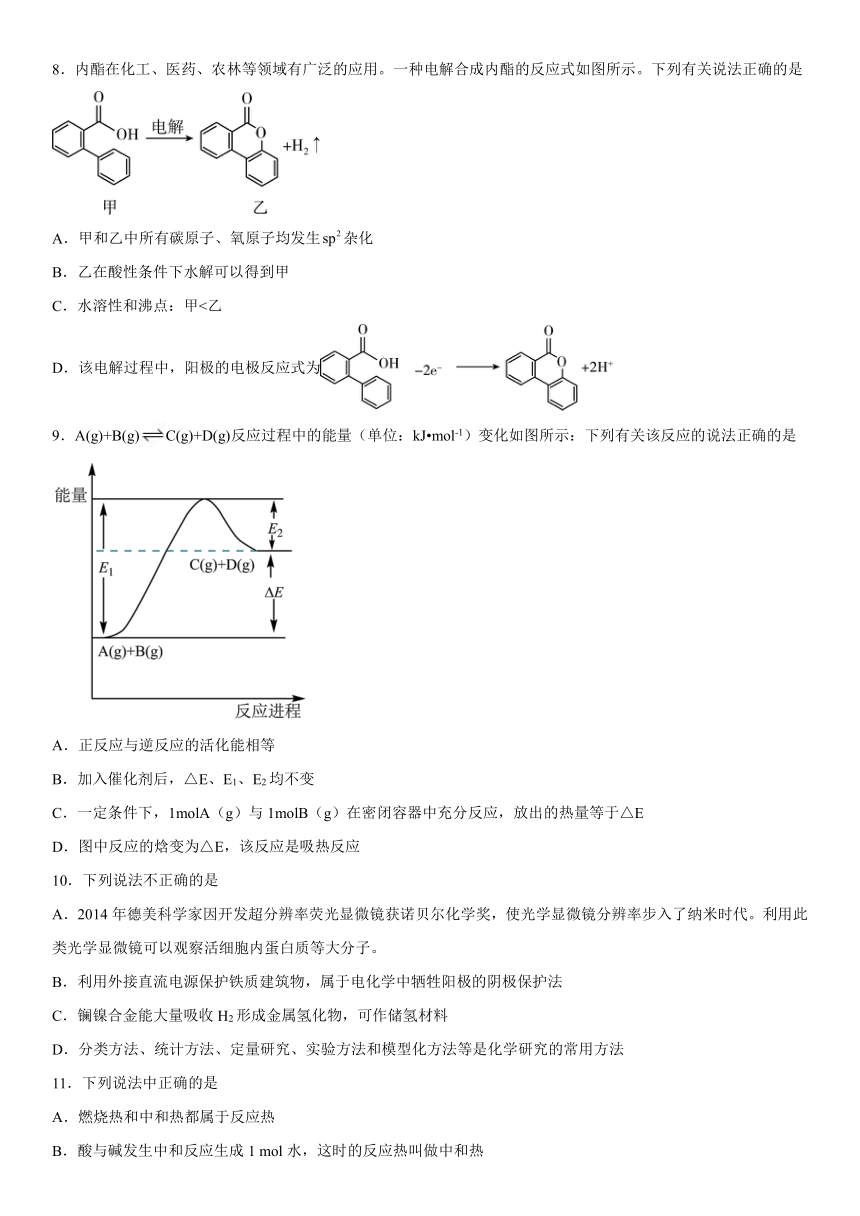
8.内酯在化工、医药、农林等领域有广泛的应用。一种电解合成内酯的反应式如图所示。下列有关说法正确的是
A.甲和乙中所有碳原子、氧原子均发生杂化
B.乙在酸性条件下水解可以得到甲
C.水溶性和沸点:甲<乙
D.该电解过程中,阳极的电极反应式为
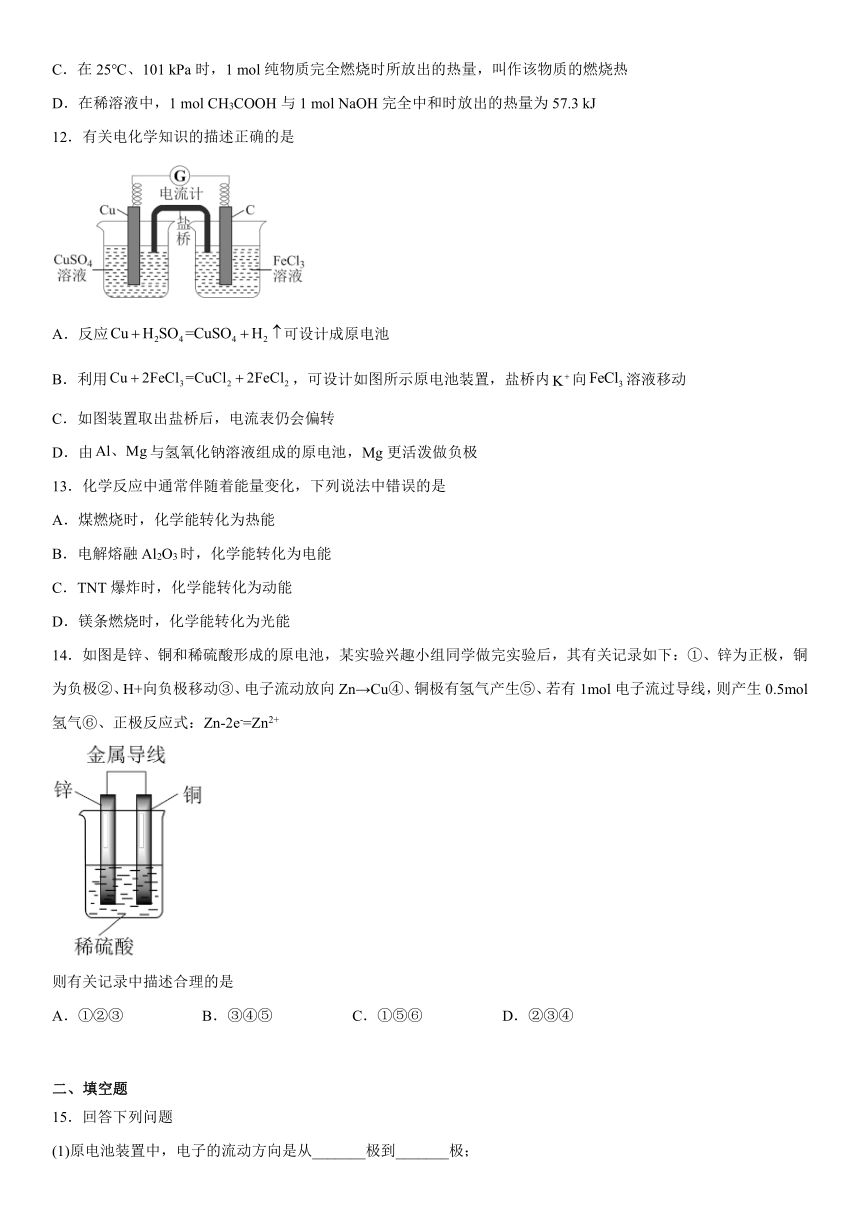
9.A(g)+B(g)C(g)+D(g)反应过程中的能量(单位:kJ mol-1)变化如图所示:下列有关该反应的说法正确的是
A.正反应与逆反应的活化能相等
B.加入催化剂后,△E、E1、E2均不变
C.一定条件下,1molA(g)与1molB(g)在密闭容器中充分反应,放出的热量等于△E
D.图中反应的焓变为△E,该反应是吸热反应
10.下列说法不正确的是
A.2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代。利用此类光学显微镜可以观察活细胞内蛋白质等大分子。
B.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法
C.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法
11.下列说法中正确的是
A.燃烧热和中和热都属于反应热
B.酸与碱发生中和反应生成1 mol水,这时的反应热叫做中和热
C.在25℃、101 kPa时,1 mol纯物质完全燃烧时所放出的热量,叫作该物质的燃烧热
D.在稀溶液中,1 mol CH3COOH与1 mol NaOH完全中和时放出的热量为57.3 kJ
12.有关电化学知识的描述正确的是
A.反应可设计成原电池
B.利用,可设计如图所示原电池装置,盐桥内向溶液移动
C.如图装置取出盐桥后,电流表仍会偏转
D.由与氢氧化钠溶液组成的原电池,Mg更活泼做负极
13.化学反应中通常伴随着能量变化,下列说法中错误的是
A.煤燃烧时,化学能转化为热能
B.电解熔融Al2O3时,化学能转化为电能
C.TNT爆炸时,化学能转化为动能
D.镁条燃烧时,化学能转化为光能
14.如图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,其有关记录如下:①、锌为正极,铜为负极②、H+向负极移动③、电子流动放向Zn→Cu④、铜极有氢气产生⑤、若有1mol电子流过导线,则产生0.5mol氢气⑥、正极反应式:Zn-2e-=Zn2+
则有关记录中描述合理的是
A.①②③ B.③④⑤ C.①⑤⑥ D.②③④
二、填空题
15.回答下列问题
(1)原电池装置中,电子的流动方向是从_______极到_______极;
(2)由铜、锌和稀硫酸组成的原电池中,正极是_______,发生_______反应,电极反应是_______;
(3)负极是_______,发生_______反应,电极反应是_______。
16.利用键能数据计算反应的ΔH:N2(g)+3H2(g)=2NH3(g)。___
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 393 946
17.下图是一个电化学过程的示意图。请回答下列问题:
(1)图中甲池中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:__________________________________
(3)A电极的名称是_____ , 乙池中反应的化学方程式为_____________。若要使溶液恢复电解前的状态,应向乙池中加入________(写化学式)。
(4)当乙池中B(Ag)极质量增加10.8g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是____________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
18.(1)甲醇(CH3OH,常温下为液态)是一种常用的能源物质。
①甲醇的热值为23 kJ · g-1。写出甲醇燃烧热的热化学方程式:_________________________。
②以甲醇为原料设计成燃料电池:若以熔融Na2CO3作为电解质,一极充入甲醇,另一极充入空气和CO2气体。回答下列问题:
充入空气和CO2气体的电极为__________极,该电池的总反应式:_____________________,充入甲醇电极的反应式:______________________________________。
③若用该燃料电池为电源,用石墨电极电解250 mL CuSO4溶液。则与充入空气和CO2气体的电极相连的是电解池的_______极;与甲醇电极相连的电极反应式为______________________;若燃料电池中消耗0.05 mol甲醇,电解池中共产生标准状况下气体2.24 L, 则原 CuSO4溶液浓度为________mol·L-1(假设电解前后溶液体积不变)。
(2)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。写出该电解的总反应_________________________________。
19.根据下列装置图,回答问题。
(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液(写电极反应式,下同)。
阳极:___;
阴极:___;
总反应式:___。
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液。
阳极:__;
阴极:__。
(3)若A为碳棒,B为铁,电解质为熔融NaCl。
阳极:___;
阴极:___;
总反应式___。
20.水是生命之源。请结合如图所示的空间站水、气整合循环系统,回答下列问题:
(1)“萨巴蒂尔反应器”内发生反应的化学方程式为_________________________________________。
(2)通过“萨巴蒂尔反应器”生成的水可以电解,实现氧气的再生,电解水的化学方程式为__________________________________________。
21.按要求回答下列问题:
(1)已知:I.H2O(g)=H2(g)+O2(g)ΔH=+241.8kJ/mol
II.C(s)+O2(g)=CO(g)ΔH=-110.5kJ/mol
III.C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol
①上述反应中,属于吸热反应的是___________(填序号)。
②表示C的燃烧热的热化学方程式为___________(填序号)。
③计算1molCO燃烧的放热___________kJ。
(2)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式为
2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol
该过程可分为以下两步反应完成:
i甲醇合成反应:___________。
ii甲醇脱水反应:2CH3OH(g)CH3OCH3(g)+H2O(g)ΔH=-24.0kJ/mol
请写出i甲醇合成反应的热化学方程式:___________。
(3)依据(2)的总反应的热化学方程式,起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________。
22.用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。回答下列问题:
(1)电源的 F端为_______(填“正”或“负”)极。
(2)A中发生反应的总化学方程式为_______。
(3)B中石墨电极上的电极反应式为_______;Cu电极观察到的现象是_______;一段时间后,B中溶液pH_______(填“升高”、“降低”或“不变”)
(4)电池工作t min后,B装置中共收集到16.8 L(折算为标准状况下)气体,此时A中溶液的质量减轻了_______g。
(5)去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,可将_______(填“A”或“B”)中的溶液换成_______(填“稀硫酸”或“浓硝酸”)。
参考答案:
1.D
【详解】A. 铅酸蓄电池是可充电电池,是二次电池,充电时电能转化为化学能,A项正确;
B. 在该电池中板为负极,则电池工作时,电子由板通过外电路流向板,B项正确;
C. 该电池工作时,负极的电极反应式为,C项正确;
D. 在原电池工作时,阳离子向正极移动,则该电池工作时移向板,D项错误;
故选D。
2.B
【分析】,锌与硫酸自发发生氧化还原反应,故Zn为负极,Cu为正极,硫酸为电解质溶液;
【详解】A.根据分析,锌失电子为负极,A错误;
B.电解质溶液中的氢离子移动到铜电极表面,生成氢气,B正确;
C.负极失去电子,正极得电子,则Zn失电子,Cu得电子,C错误;
D.该装置为原电池,由化学能转化为电能,D错误;
故答案为:B。
3.B
【详解】A.用滴定管取所用药品,比用量筒更加精确,可以减少误差,A不符合题意;
B.NaOH溶液在倒入小烧杯时速度过慢,测得的温度差减少,会产生误差,B符合题意;
C.大小烧杯体积相差较大,夹层间放的碎泡沫塑料较多可以减少热量损失,C不符合题意;
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度可以减少氢氧化钠的损耗,实验更加准确,D不符合题意;
答案选B。
4.B
【详解】A. 有的放热反应需要点燃或加热,如可燃物的燃烧,甚至有的放热反应需要高温条件,如铝热反应,故A不选;
B. 反应物总能量高于生成物总能量,则反应放热,故B选;
C. 化学反应过程中,化学能可能转化为热能,也可以转化为光能或电能,故C不选;
D. 有的吸热反应可以在常温下发生,如Ba(OH)2·8H2O和NH4Cl的反应,故D不选;
故选B。
5.D
【分析】该原电池中,铁粉易失电子作负极,电极反应式为Fe-2e-=Fe2+,活性炭为原电池中的正极,不发生变化,据此分析判断。
【详解】A.构成原电池,加快反应速率。活性炭是原电池正极,能够加速铁粉的氧化,故A正确;
B.“暖宝宝”放出的热量是铁作负极发生氧化反应产生的,故B正确;
C.“暖宝宝”使用前要密封保存,使之与空气隔绝,防止铁粉被氧化,故C正确;
D.活性炭为原电池中的正极,不发生变化,故D错误。
故选D。
6.D
【分析】氢气和氧气反应生成H2O2,氢气失去电子,作负极,氧气得到电子,作正极。
【详解】A.催化剂可促进反应中电子的转移,加快反应速率,故A正确;
B.b为正极,氧气得电子,b极上的电极反应为O2+H2O+2e-=HO+OH-,故B正确;
C.氧元素由0价变成-1价,每生成1mo1H2O2电极上流过2mole-,故C正确;
D.b极发生O2+H2O+2e-=HO+OH-,Y膜为选择性阴离子交换膜,让HO和OH-进入中间,故D错误;
故选:D。
7.C
【详解】A.过程Ⅰ:,当有分解时,生成,而的物质的量为,故生成,氧元素由价变为0价,故每消耗转移电子,选项A正确;
B.已知反应①和反应②,根据盖斯定律,由可得过程Ⅱ中反应的热化学方程式,选项B正确;
C.过程Ⅰ和过程Ⅱ中的反应均为吸热反应,故不存在将化学能转化为热能的过程,选项C错误;
D.反应中,为气体,而为固体,故铁氧化合物循环制的产物易分离,且由于利用太阳能,故成本低,选项D正确;
答案选C。
8.D
【详解】A.苯环上的碳原子为杂化,羧基和酯基上的碳原子均形成1个双键和2个单键,为杂化,碳氧双键中的氧原子为杂化,形成2个单键的氧原子为杂化,A错误;
B.酸性条件下,乙发生水解反应的产物为 ,B错误;
C.由于甲分子间能形成氢键,故其沸点较高,又甲分子与水分子间能形成氢键,故其水溶性较好,C错误;
D. 转化为 ,发生去氢的氧化反应,为阳极反应,D正确;
故答案为:D。
9.D
【详解】A. 反应物总能量低于生成物总能量,因此是吸热反应,所以正反应活化能大于逆反应的活化能,A错误;
B. 加入催化剂后可改变活化能,E1、E2均变化,但反应热△E不变,B错误;
C. 一定条件下,1molA(g)与1molB(g)在密闭容器中充分反应,由于是可逆反应,所以放出的热量小于△E,C错误;
D. 反应物总能量低于生成物总能量,图中反应的焓变为△E,该反应是吸热反应,D正确;答案选D。
10.B
【详解】A.由于超分辨荧光显微镜步入了纳米时代,因此利用此类光学显微镜可以观察活细胞内蛋白质等大分子,A正确;
B.外接直流电源,则形成电解池装置,该方法保护铁质建筑物属于外加电源的阴极保护法,B错误;
C.镧镍合金能大量吸收H2形成金属氢化物,可吸收或释放氢气,所以可作储氢材料,C正确;
D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法,有利于学生对化学的学习,D正确;
答案选B。
11.A
【详解】A. 燃烧热和中和热均属于反应热,属于反应热的一种,A正确;
B. 在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热,选项中未说明是稀溶液,B错误;
C. 在101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物放出的热量为燃烧热,选项未说明产物一定为稳定氧化物,故C错误;
D.乙酸为弱酸,电离吸热,则在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为小于57.3 kJ,D错误;
故答案选A。
12.B
【详解】A.不是自发的氧化还原反应,故不能设计成原电池,故A错误;
B.中Cu发生氧化反应做负极,原电池中阳离子向正极移动,故向溶液移动,故B正确;
C.取出盐桥后不是闭合回路,无电流,故电流表不会偏转,故C错误;
D.由与氢氧化钠溶液组成的原电池,Al和氢氧化钠发生反应,Al发生氧化反应,故Al做负极,故D错误;
故选B。
13.B
【详解】A.煤燃烧时,发生化学变化并放出大量热,实现了化学能转化为热能,A正确;
B.电解熔融Al2O3是将电能转化为化学能,B错误;
C.TNT爆炸时,化学能转化为热能、光能、动能等,C正确;
D.镁条燃烧发出刺眼的白光,实现了化学能转化为光能,D正确;
答案选B。
14.B
【分析】分析装置图可知是原电池反应,依据原电池原理可知,活泼金属做负极,锌做负极,铜做正极;电极名称为正极和负极,锌失电子发生氧化反应,溶液中阳离子移向正极,电子从负极沿外导线流向正极;溶液中氢离子在铜电极得到电子生成氢气,据此解题。
【详解】由分析可知:装置图为原电池反应,依据原电池原理可知,活泼金属做负极,锌做负极,铜做正极;
①原电池中电极名称为正负极,Zn为负极,Cu为正极,①错误;
②电解质溶液中阳离子移向正极,H+向正极移动,②错误;
③电子从负极沿外导线流向正极,Zn→Cu,③正确;
④溶液中氢离子在铜电极得到电子生成氢气,Cu极有H2产生,④正确;
⑤若有1mol电子流过导线,依据电解反应2H++2e-=H2↑,则产生H2为0.5mol,⑤正确;
⑥负极电极反应式:Zn-2e-=Zn2+,正极电极反应 2H++2e-=H2↑,⑥错误;
综上所述③④⑤正确;
答案选B。
15.(1) 负 正
(2) Cu 还原 2H++2e-=H2↑
(3) Zn 氧化 Zn-2e-=Zn2+
【分析】由铜、锌和稀硫酸组成的原电池中,锌的活泼性大于铜,则Zn作负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,Cu为正极,发生还原反应,电极反应式为2H++2e-=H2↑。
【详解】(1)原电池中,电子由负极经导线流向正极,故答案为:负;正;
(2)由上述分析可知,由铜、锌和稀硫酸组成的原电池中,正极是Cu,发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:Cu;还原;2H++2e-=H2↑;
(3)由上述分析可知,由铜、锌和稀硫酸组成的原电池中,负极是Zn,负极发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:Zn;氧化;Zn-2e-=Zn2+。
16.-104kJ·mol-1
【详解】根据ΔH=反应物断键吸收的热量-生成物成键所放出的热量可知,N2(g)+3H2(g)=2NH3(g)的ΔH=946 kJ·mol-1+3436 kJ·mol-1-6393 kJ·mol-1=-104 kJ·mol-1,故答案为:-104kJ·mol-1。
17. CH3OH CH3OH-6e﹣+8OH﹣ = CO32﹣+6H2O 阳极 4AgNO3 + 2H2O 4HNO3 + 4Ag + O2↑ Ag2O或Ag2CO3 0.56L BD
【分析】(1)甲池:燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)与电源正极相连的叫阳极,乙池:有外接电源是电解池,阳极上氢氧根离子放电,阴极上银离子放电,要使溶液恢复原状需加入氧化银或碳酸银;
(4)根据串联电池中转移电子数相等列关系式计算,丙为电解池,析出金属元素,则金属活泼性排在氢后,据此确定含有的金属元素。
【详解】(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动;
答案:CH3OH
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
答案:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上氢氧根离子放电,B电极银离子放电,电极反应式 4AgNO3 + 2H2O 4HNO3 + 4Ag + O2↑,因此要想恢复原状加入适量氧化银或者碳酸银;
答案:4AgNO3 + 2H2O 4HNO3 + 4Ag + O2↑ Ag2O或Ag2CO3
(4)根据串联电路转移电子数相等列关系式
4e- ~4Ag ~ O2
4×108g 22.4L
10.8g V(O2)
计算得V(O2)=L=0.56L;
阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后面
A.硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故A错误;
B.电解硫酸铜溶液时,阴极上析出铜,故B正确;
C.氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故C错误;
D.电解硝酸银溶液时,阴极上析出银,故D正确;
答案: 0.56L BD
【点睛】串联电路中解题的关键是转移电子数相等,注意守恒法的灵活应用。
18. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l),ΔH1=-736 kJ·mol-1 正 2CH3OH+3O2=2CO2+4H2O CH3OH-6e-+3CO32-=4CO2+2H2O 阳 Cu2++2e-=Cu 0.5 2(CH3)4NCl+2H2O2(CH3)4NOH+H2 ↑+Cl2 ↑
【分析】(1)①101kPa下,1mol纯物质完全燃烧生成稳定的氧化物时所释放的热量称为该物质的燃烧热,据此写出甲醇燃烧热的热化学方程式;
②以熔融Na2CO3作为电解质的甲醇燃料电池的总反应:CH3OH+O2=CO2+2H2O,从分析化合价入手确定电池的正、负极及电极反应式;
③以甲醇燃料电池为电源电解CuSO4溶液时,在电解池中与电源正极相连的为阳极,与电源负极相连的为阴极,阴极发生还原反应,据此写出阴极反应式。甲醇燃料电池与电解池是串联的,根据电路中转移的电子守恒,利用讨论法分析电解产生的2.24L气体是纯O2还是H2和O2的混合气体,来确定CuSO4被电解完后是否有水被电解,再根据反应式的计量关系进行相关计算;
(2) 分析四甲基氯化铵[(CH3)4NCl]和四甲基氢氧化铵[(CH3)4NOH]的化学式可知,由四甲基氯化铵转化为四甲基氢氧化铵即将-Cl替换为-OH(羟基),再结合电解池中阳极发生氧化反应,阴极发生还原反应确定电解过程中还会产生Cl2和H2,据此写出总反应的化学方程式。
【详解】(1) ①甲醇的摩尔质量为32g/mol,1mol甲醇完全燃烧生成CO2(g)和H2O(l)时释放出的热量=32g/mol×1mol×23 kJ · g-1=736kJ,甲醇燃烧热的热化学方程式为CH3OH(l)+O2(g)=CO2(g)+2H2O(l),△H=-736kJ/mol;
② 以熔融Na2CO3作为电解质的甲醇燃料电池的总反应:2CH3OH+3O2=2CO2+4H2O,其中氧元素化合价由0价降低到-2价,故O2得电子发生还原反应,所以充入空气和CO2的一极是正极;甲醇中碳元素化合价由-2价升高到+4价,每个碳原子得6个电子,充入甲醇的一极为负极,其电极反应为:CH3OH-6e-+3CO=4CO2+2H2O;
③由上面分析可知,甲醇燃料电池中充入空气和CO2气体的一极为正极;充入甲醇的一极为负极。在以甲醇燃料电池为电源的电解池中与电源正极相连的为阳极,即与充入空气和CO2气体的一极相连的为电解池的阳极。与甲醇电极相连的为电解池的阴极,电解池的阴极发生还原反应,其电极反应式为Cu2++2e-=Cu;用石墨电极电解CuSO4溶液总反应式为2CuSO4+2H2O2Cu+O2↑+2H2SO4,转移电子4e-,由燃料电池负极反应式CH3OH-6e-+3CO=4CO2+2H2O可知,每消耗0.05 mol甲醇时电路中转移电子物质的量=0.05mol×6=0.3mol,再由电解CuSO4的阳极反应式2H2O-4e-=O2↑+4H+可知,产生的2.24 L气体若是纯O2,则此时转移电子物质的量=4×=0.4mol>0.3mol,说明电解产生的2.24L气体是H2和O2的混合气体,即CuSO4电解结束后又继续电解水:2H2O2H2↑+O2↑,转移电子4e-;设原CuSO4溶液中含CuSO4物质的量为x,电解CuSO4转移的电子物质的量为2x,则电解水转移电子物质的量=0.3mol-2x,电解池共产生气体物质的量=×2x+×(0.3mol-2x)= ,解得x=0.125mol,所以原CuSO4溶液浓度==0.5mol/L;
(2)根据四甲基氯化铵[(CH3)4NCl]和四甲基氢氧化铵[(CH3)4NOH]的化学式可知,由四甲基氯化铵转化为四甲基氢氧化铵即将-Cl替换为-OH(羟基),氯原子可在阳极放电生成Cl2,-OH可有阴极H2O的H+放电产生的OH-转化而来:2H2O+4e-=2H2↑+4OH-,所以电解产物还应有Cl2和H2,总反应方程式为2(CH3)4NCl+2H2O2(CH3)4NOH+H2 ↑+Cl2 ↑;
19. 2Cl--2e-=Cl2↑ 2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑ Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+ Cl2↑ Cu-2e-=Cu2+ Cu2++2e-= Cu 2Cl--2e-=Cl2↑ Na++e-=Na 2NaCl Cl2↑+ 2Na
【详解】(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液,阴极生成氢气和氢氧化镁沉淀,阳极:2Cl--2e-=Cl2↑;阴极:2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑;总反应式:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+ Cl2↑。
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液,为电镀铜装置,阳极:Cu-2e-=Cu2+;阴极:Cu2++2e-= Cu。
(3)若A为碳棒,B为铁,电解质为熔融NaCl,阳极生成氯气,阴极生成钠,阳极:2Cl--2e-=Cl2↑;阴极:Na++e-=Na;总反应式:2NaCl Cl2↑+ 2Na。
20.
【详解】(1)“萨巴蒂尔反应器”内发生反应为氢气和二氧化碳在催化剂的作用下生成甲烷和水,化学方程式为:,故答案为:;
(2)电解水的化学方程式为:,故答案为:。
21.(1) I III -283.0kJ
(2)2CO(g)+4H2(g)2CH3OH(g)△H=-182.0kJ/mol(或CO(g)+2H2(g)CH3OH(g)△H=-91.0kJ/mol)
(3)25%
【解析】(1)
①吸热反应的ΔH>0,属于吸热反应的为I。
②C的燃烧热是指1molC完全燃烧生成二氧化碳放出的热量,故为II。
③根据盖斯定律,反应III-反应II,可得CO(g)+O2(g)=CO2(g),ΔH=-393.5kJ/mol-(-110.5kJ/mol)=-283.0kJ。
(2)
已知①2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol,②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=-24.0kJ/mol,根据盖斯定律,由×(①-②)得甲醇合成反应的热化学方程式CO(g)+2H2(g)CH3OH(g)△H=-91.0kJ/mol。
(3)
起始时向容器中投入2molCO和4molH,测得某时刻上述总反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol中放出的热量为51.5kJ,此时消耗CO为0.5mol,转化率为×100%=25%。
22. 负 Fe+2H2OFe(OH)2+H2 2H2O-4e-=O2+4H+ 有气泡产生 不变 18 A 稀硫酸
【分析】通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色,说明D端碘离子被氧化生成碘单质,所以D为阳极,E为电源正极,F为电源负极,Pt电极、Cu电极均为电解池的阴极,Fe电极、石墨电极均为电解池的阳极。
【详解】(1)根据分析可知电源的F端为负极;
(2)A中Fe电极为阳极,则Fe失电子生成Fe2+,Pt电极上水放电产生氢气和氢氧根,生成的氢氧根与Fe2+结合生成Fe(OH)2沉淀,由于有植物油覆盖隔绝氧气,所以生成的Fe(OH)2沉淀不会被氧化,总反应为Fe+2H2OFe(OH)2+H2;
(3)B中石墨电极为阳极,水电离出的氢氧根放电生成氧气,电极反应式为2H2O-4e-=O2+4H+;Cu电极为阴极,水电离出的氢离子放电生成氢气,所以可以观察到的现象是有气泡产生;B中实际上就是在电解水,而硫酸钠溶液为中性溶液,水少了依然为中性,所以pH不变;
(4)B中实际上电解水,所以生成的O2和H2的物质的量之比为1:2,共收集到16.8 L(折算为标准状况下)气体,则收集到5.6L O2,转移的电子为=1mol,A中总反应为Fe+2H2OFe(OH)2+H2,溶液减轻的质量即水的质量,转移1mol电子消耗1molH2O,质量减轻18g;
(5)去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,则需要A或B成为原电池,且Pt电极或Cu电极为正极,发生还原反应,若将A中换成稀硫酸,则A中总反应为Fe与稀硫酸的反应,Fe被氧化为负极,Pt为正极,符合条件;常温下Fe在浓硝酸中钝化,若换成浓硝酸则无法形成原电池,不符合条件;若将B中溶液换成稀硫酸,Cu与稀硫酸不反应,无法形成原电池,不符合条件,若换成浓硝酸,Cu被氧化,作负极,也不符合条件,综上所述应将A中的溶液换成稀硫酸。
一、单选题
1.如图是铅酸蓄电池的构造示意图,下列说法错误的是
A.铅酸蓄电池是二次电池,充电时电能转化为化学能
B.该电池工作时,电子由板通过外电路流向板
C.该电池工作时,负极的电极反应式为
D.该电池工作时,移向板
2.某同学利用如图所示装置探究原电池原理。下列说法正确的是
A.Zn电极是该电池的正极
B.Cu电极表面产生的气体是H2
C.电子经导线由Cu电极流入Zn电极
D.该装置可将电能转化为化学能
3.中和热测定实验中,下列操作一定会降低实验准确性的是
A.用滴定管取所用药品
B.NaOH溶液在倒入小烧杯时速度过慢
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后,用来测NaOH溶液的温度
4.关于化学反应热效应的叙述中,正确的是
A.放热反应在常温下就一定很容易发生 B.放热反应中反应物的总能量大于生成物的总能量
C.化学反应过程中,化学能一定转化成热能 D.凡是需加热才能进行的反应—定是吸热反应
5.“暖宝宝”的主要原料有:铁粉、活性炭、水、食盐等。其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液。下列有关“暖宝宝”的说法中错误的是
A.活性炭作用是作原电池的正极,加速铁粉的氧化
B.“暖宝宝”放出的热量是铁氧化时产生的
C.“暖宝宝”使用前要密封保存,使之与空气隔绝
D.活性炭最终将转化为二氧化碳
6.2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法错误的是
A.催化剂可促进反应中电子的转移
B.b电极上的电极反应为O2+H2O+2e-=HO+OH-
C.每生成1molH2O2电极上流过2mole-
D.Y膜为选择性阳离子交换膜
7.已知:。以太阳能为热源分解,经热化学铁氧化合物循环分解水制的过程如图所示:
过程Ⅰ:
过程Ⅱ:……
下列说法不正确的是
A.过程Ⅰ中每消耗,转移电子
B.过程Ⅱ中反应的热化学方程式为
C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能
D.铁氧化合物循环制具有成本低、产物易分离等优点
8.内酯在化工、医药、农林等领域有广泛的应用。一种电解合成内酯的反应式如图所示。下列有关说法正确的是
A.甲和乙中所有碳原子、氧原子均发生杂化
B.乙在酸性条件下水解可以得到甲
C.水溶性和沸点:甲<乙
D.该电解过程中,阳极的电极反应式为
9.A(g)+B(g)C(g)+D(g)反应过程中的能量(单位:kJ mol-1)变化如图所示:下列有关该反应的说法正确的是
A.正反应与逆反应的活化能相等
B.加入催化剂后,△E、E1、E2均不变
C.一定条件下,1molA(g)与1molB(g)在密闭容器中充分反应,放出的热量等于△E
D.图中反应的焓变为△E,该反应是吸热反应
10.下列说法不正确的是
A.2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代。利用此类光学显微镜可以观察活细胞内蛋白质等大分子。
B.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法
C.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法
11.下列说法中正确的是
A.燃烧热和中和热都属于反应热
B.酸与碱发生中和反应生成1 mol水,这时的反应热叫做中和热
C.在25℃、101 kPa时,1 mol纯物质完全燃烧时所放出的热量,叫作该物质的燃烧热
D.在稀溶液中,1 mol CH3COOH与1 mol NaOH完全中和时放出的热量为57.3 kJ
12.有关电化学知识的描述正确的是
A.反应可设计成原电池
B.利用,可设计如图所示原电池装置,盐桥内向溶液移动
C.如图装置取出盐桥后,电流表仍会偏转
D.由与氢氧化钠溶液组成的原电池,Mg更活泼做负极
13.化学反应中通常伴随着能量变化,下列说法中错误的是
A.煤燃烧时,化学能转化为热能
B.电解熔融Al2O3时,化学能转化为电能
C.TNT爆炸时,化学能转化为动能
D.镁条燃烧时,化学能转化为光能
14.如图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,其有关记录如下:①、锌为正极,铜为负极②、H+向负极移动③、电子流动放向Zn→Cu④、铜极有氢气产生⑤、若有1mol电子流过导线,则产生0.5mol氢气⑥、正极反应式:Zn-2e-=Zn2+
则有关记录中描述合理的是
A.①②③ B.③④⑤ C.①⑤⑥ D.②③④
二、填空题
15.回答下列问题
(1)原电池装置中,电子的流动方向是从_______极到_______极;
(2)由铜、锌和稀硫酸组成的原电池中,正极是_______,发生_______反应,电极反应是_______;
(3)负极是_______,发生_______反应,电极反应是_______。
16.利用键能数据计算反应的ΔH:N2(g)+3H2(g)=2NH3(g)。___
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 393 946
17.下图是一个电化学过程的示意图。请回答下列问题:
(1)图中甲池中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:__________________________________
(3)A电极的名称是_____ , 乙池中反应的化学方程式为_____________。若要使溶液恢复电解前的状态,应向乙池中加入________(写化学式)。
(4)当乙池中B(Ag)极质量增加10.8g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是____________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
18.(1)甲醇(CH3OH,常温下为液态)是一种常用的能源物质。
①甲醇的热值为23 kJ · g-1。写出甲醇燃烧热的热化学方程式:_________________________。
②以甲醇为原料设计成燃料电池:若以熔融Na2CO3作为电解质,一极充入甲醇,另一极充入空气和CO2气体。回答下列问题:
充入空气和CO2气体的电极为__________极,该电池的总反应式:_____________________,充入甲醇电极的反应式:______________________________________。
③若用该燃料电池为电源,用石墨电极电解250 mL CuSO4溶液。则与充入空气和CO2气体的电极相连的是电解池的_______极;与甲醇电极相连的电极反应式为______________________;若燃料电池中消耗0.05 mol甲醇,电解池中共产生标准状况下气体2.24 L, 则原 CuSO4溶液浓度为________mol·L-1(假设电解前后溶液体积不变)。
(2)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。写出该电解的总反应_________________________________。
19.根据下列装置图,回答问题。
(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液(写电极反应式,下同)。
阳极:___;
阴极:___;
总反应式:___。
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液。
阳极:__;
阴极:__。
(3)若A为碳棒,B为铁,电解质为熔融NaCl。
阳极:___;
阴极:___;
总反应式___。
20.水是生命之源。请结合如图所示的空间站水、气整合循环系统,回答下列问题:
(1)“萨巴蒂尔反应器”内发生反应的化学方程式为_________________________________________。
(2)通过“萨巴蒂尔反应器”生成的水可以电解,实现氧气的再生,电解水的化学方程式为__________________________________________。
21.按要求回答下列问题:
(1)已知:I.H2O(g)=H2(g)+O2(g)ΔH=+241.8kJ/mol
II.C(s)+O2(g)=CO(g)ΔH=-110.5kJ/mol
III.C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol
①上述反应中,属于吸热反应的是___________(填序号)。
②表示C的燃烧热的热化学方程式为___________(填序号)。
③计算1molCO燃烧的放热___________kJ。
(2)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式为
2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol
该过程可分为以下两步反应完成:
i甲醇合成反应:___________。
ii甲醇脱水反应:2CH3OH(g)CH3OCH3(g)+H2O(g)ΔH=-24.0kJ/mol
请写出i甲醇合成反应的热化学方程式:___________。
(3)依据(2)的总反应的热化学方程式,起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________。
22.用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。回答下列问题:
(1)电源的 F端为_______(填“正”或“负”)极。
(2)A中发生反应的总化学方程式为_______。
(3)B中石墨电极上的电极反应式为_______;Cu电极观察到的现象是_______;一段时间后,B中溶液pH_______(填“升高”、“降低”或“不变”)
(4)电池工作t min后,B装置中共收集到16.8 L(折算为标准状况下)气体,此时A中溶液的质量减轻了_______g。
(5)去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,可将_______(填“A”或“B”)中的溶液换成_______(填“稀硫酸”或“浓硝酸”)。
参考答案:
1.D
【详解】A. 铅酸蓄电池是可充电电池,是二次电池,充电时电能转化为化学能,A项正确;
B. 在该电池中板为负极,则电池工作时,电子由板通过外电路流向板,B项正确;
C. 该电池工作时,负极的电极反应式为,C项正确;
D. 在原电池工作时,阳离子向正极移动,则该电池工作时移向板,D项错误;
故选D。
2.B
【分析】,锌与硫酸自发发生氧化还原反应,故Zn为负极,Cu为正极,硫酸为电解质溶液;
【详解】A.根据分析,锌失电子为负极,A错误;
B.电解质溶液中的氢离子移动到铜电极表面,生成氢气,B正确;
C.负极失去电子,正极得电子,则Zn失电子,Cu得电子,C错误;
D.该装置为原电池,由化学能转化为电能,D错误;
故答案为:B。
3.B
【详解】A.用滴定管取所用药品,比用量筒更加精确,可以减少误差,A不符合题意;
B.NaOH溶液在倒入小烧杯时速度过慢,测得的温度差减少,会产生误差,B符合题意;
C.大小烧杯体积相差较大,夹层间放的碎泡沫塑料较多可以减少热量损失,C不符合题意;
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度可以减少氢氧化钠的损耗,实验更加准确,D不符合题意;
答案选B。
4.B
【详解】A. 有的放热反应需要点燃或加热,如可燃物的燃烧,甚至有的放热反应需要高温条件,如铝热反应,故A不选;
B. 反应物总能量高于生成物总能量,则反应放热,故B选;
C. 化学反应过程中,化学能可能转化为热能,也可以转化为光能或电能,故C不选;
D. 有的吸热反应可以在常温下发生,如Ba(OH)2·8H2O和NH4Cl的反应,故D不选;
故选B。
5.D
【分析】该原电池中,铁粉易失电子作负极,电极反应式为Fe-2e-=Fe2+,活性炭为原电池中的正极,不发生变化,据此分析判断。
【详解】A.构成原电池,加快反应速率。活性炭是原电池正极,能够加速铁粉的氧化,故A正确;
B.“暖宝宝”放出的热量是铁作负极发生氧化反应产生的,故B正确;
C.“暖宝宝”使用前要密封保存,使之与空气隔绝,防止铁粉被氧化,故C正确;
D.活性炭为原电池中的正极,不发生变化,故D错误。
故选D。
6.D
【分析】氢气和氧气反应生成H2O2,氢气失去电子,作负极,氧气得到电子,作正极。
【详解】A.催化剂可促进反应中电子的转移,加快反应速率,故A正确;
B.b为正极,氧气得电子,b极上的电极反应为O2+H2O+2e-=HO+OH-,故B正确;
C.氧元素由0价变成-1价,每生成1mo1H2O2电极上流过2mole-,故C正确;
D.b极发生O2+H2O+2e-=HO+OH-,Y膜为选择性阴离子交换膜,让HO和OH-进入中间,故D错误;
故选:D。
7.C
【详解】A.过程Ⅰ:,当有分解时,生成,而的物质的量为,故生成,氧元素由价变为0价,故每消耗转移电子,选项A正确;
B.已知反应①和反应②,根据盖斯定律,由可得过程Ⅱ中反应的热化学方程式,选项B正确;
C.过程Ⅰ和过程Ⅱ中的反应均为吸热反应,故不存在将化学能转化为热能的过程,选项C错误;
D.反应中,为气体,而为固体,故铁氧化合物循环制的产物易分离,且由于利用太阳能,故成本低,选项D正确;
答案选C。
8.D
【详解】A.苯环上的碳原子为杂化,羧基和酯基上的碳原子均形成1个双键和2个单键,为杂化,碳氧双键中的氧原子为杂化,形成2个单键的氧原子为杂化,A错误;
B.酸性条件下,乙发生水解反应的产物为 ,B错误;
C.由于甲分子间能形成氢键,故其沸点较高,又甲分子与水分子间能形成氢键,故其水溶性较好,C错误;
D. 转化为 ,发生去氢的氧化反应,为阳极反应,D正确;
故答案为:D。
9.D
【详解】A. 反应物总能量低于生成物总能量,因此是吸热反应,所以正反应活化能大于逆反应的活化能,A错误;
B. 加入催化剂后可改变活化能,E1、E2均变化,但反应热△E不变,B错误;
C. 一定条件下,1molA(g)与1molB(g)在密闭容器中充分反应,由于是可逆反应,所以放出的热量小于△E,C错误;
D. 反应物总能量低于生成物总能量,图中反应的焓变为△E,该反应是吸热反应,D正确;答案选D。
10.B
【详解】A.由于超分辨荧光显微镜步入了纳米时代,因此利用此类光学显微镜可以观察活细胞内蛋白质等大分子,A正确;
B.外接直流电源,则形成电解池装置,该方法保护铁质建筑物属于外加电源的阴极保护法,B错误;
C.镧镍合金能大量吸收H2形成金属氢化物,可吸收或释放氢气,所以可作储氢材料,C正确;
D.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法,有利于学生对化学的学习,D正确;
答案选B。
11.A
【详解】A. 燃烧热和中和热均属于反应热,属于反应热的一种,A正确;
B. 在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热,选项中未说明是稀溶液,B错误;
C. 在101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物放出的热量为燃烧热,选项未说明产物一定为稳定氧化物,故C错误;
D.乙酸为弱酸,电离吸热,则在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为小于57.3 kJ,D错误;
故答案选A。
12.B
【详解】A.不是自发的氧化还原反应,故不能设计成原电池,故A错误;
B.中Cu发生氧化反应做负极,原电池中阳离子向正极移动,故向溶液移动,故B正确;
C.取出盐桥后不是闭合回路,无电流,故电流表不会偏转,故C错误;
D.由与氢氧化钠溶液组成的原电池,Al和氢氧化钠发生反应,Al发生氧化反应,故Al做负极,故D错误;
故选B。
13.B
【详解】A.煤燃烧时,发生化学变化并放出大量热,实现了化学能转化为热能,A正确;
B.电解熔融Al2O3是将电能转化为化学能,B错误;
C.TNT爆炸时,化学能转化为热能、光能、动能等,C正确;
D.镁条燃烧发出刺眼的白光,实现了化学能转化为光能,D正确;
答案选B。
14.B
【分析】分析装置图可知是原电池反应,依据原电池原理可知,活泼金属做负极,锌做负极,铜做正极;电极名称为正极和负极,锌失电子发生氧化反应,溶液中阳离子移向正极,电子从负极沿外导线流向正极;溶液中氢离子在铜电极得到电子生成氢气,据此解题。
【详解】由分析可知:装置图为原电池反应,依据原电池原理可知,活泼金属做负极,锌做负极,铜做正极;
①原电池中电极名称为正负极,Zn为负极,Cu为正极,①错误;
②电解质溶液中阳离子移向正极,H+向正极移动,②错误;
③电子从负极沿外导线流向正极,Zn→Cu,③正确;
④溶液中氢离子在铜电极得到电子生成氢气,Cu极有H2产生,④正确;
⑤若有1mol电子流过导线,依据电解反应2H++2e-=H2↑,则产生H2为0.5mol,⑤正确;
⑥负极电极反应式:Zn-2e-=Zn2+,正极电极反应 2H++2e-=H2↑,⑥错误;
综上所述③④⑤正确;
答案选B。
15.(1) 负 正
(2) Cu 还原 2H++2e-=H2↑
(3) Zn 氧化 Zn-2e-=Zn2+
【分析】由铜、锌和稀硫酸组成的原电池中,锌的活泼性大于铜,则Zn作负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,Cu为正极,发生还原反应,电极反应式为2H++2e-=H2↑。
【详解】(1)原电池中,电子由负极经导线流向正极,故答案为:负;正;
(2)由上述分析可知,由铜、锌和稀硫酸组成的原电池中,正极是Cu,发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:Cu;还原;2H++2e-=H2↑;
(3)由上述分析可知,由铜、锌和稀硫酸组成的原电池中,负极是Zn,负极发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:Zn;氧化;Zn-2e-=Zn2+。
16.-104kJ·mol-1
【详解】根据ΔH=反应物断键吸收的热量-生成物成键所放出的热量可知,N2(g)+3H2(g)=2NH3(g)的ΔH=946 kJ·mol-1+3436 kJ·mol-1-6393 kJ·mol-1=-104 kJ·mol-1,故答案为:-104kJ·mol-1。
17. CH3OH CH3OH-6e﹣+8OH﹣ = CO32﹣+6H2O 阳极 4AgNO3 + 2H2O 4HNO3 + 4Ag + O2↑ Ag2O或Ag2CO3 0.56L BD
【分析】(1)甲池:燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)与电源正极相连的叫阳极,乙池:有外接电源是电解池,阳极上氢氧根离子放电,阴极上银离子放电,要使溶液恢复原状需加入氧化银或碳酸银;
(4)根据串联电池中转移电子数相等列关系式计算,丙为电解池,析出金属元素,则金属活泼性排在氢后,据此确定含有的金属元素。
【详解】(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动;
答案:CH3OH
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
答案:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上氢氧根离子放电,B电极银离子放电,电极反应式 4AgNO3 + 2H2O 4HNO3 + 4Ag + O2↑,因此要想恢复原状加入适量氧化银或者碳酸银;
答案:4AgNO3 + 2H2O 4HNO3 + 4Ag + O2↑ Ag2O或Ag2CO3
(4)根据串联电路转移电子数相等列关系式
4e- ~4Ag ~ O2
4×108g 22.4L
10.8g V(O2)
计算得V(O2)=L=0.56L;
阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后面
A.硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故A错误;
B.电解硫酸铜溶液时,阴极上析出铜,故B正确;
C.氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故C错误;
D.电解硝酸银溶液时,阴极上析出银,故D正确;
答案: 0.56L BD
【点睛】串联电路中解题的关键是转移电子数相等,注意守恒法的灵活应用。
18. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l),ΔH1=-736 kJ·mol-1 正 2CH3OH+3O2=2CO2+4H2O CH3OH-6e-+3CO32-=4CO2+2H2O 阳 Cu2++2e-=Cu 0.5 2(CH3)4NCl+2H2O2(CH3)4NOH+H2 ↑+Cl2 ↑
【分析】(1)①101kPa下,1mol纯物质完全燃烧生成稳定的氧化物时所释放的热量称为该物质的燃烧热,据此写出甲醇燃烧热的热化学方程式;
②以熔融Na2CO3作为电解质的甲醇燃料电池的总反应:CH3OH+O2=CO2+2H2O,从分析化合价入手确定电池的正、负极及电极反应式;
③以甲醇燃料电池为电源电解CuSO4溶液时,在电解池中与电源正极相连的为阳极,与电源负极相连的为阴极,阴极发生还原反应,据此写出阴极反应式。甲醇燃料电池与电解池是串联的,根据电路中转移的电子守恒,利用讨论法分析电解产生的2.24L气体是纯O2还是H2和O2的混合气体,来确定CuSO4被电解完后是否有水被电解,再根据反应式的计量关系进行相关计算;
(2) 分析四甲基氯化铵[(CH3)4NCl]和四甲基氢氧化铵[(CH3)4NOH]的化学式可知,由四甲基氯化铵转化为四甲基氢氧化铵即将-Cl替换为-OH(羟基),再结合电解池中阳极发生氧化反应,阴极发生还原反应确定电解过程中还会产生Cl2和H2,据此写出总反应的化学方程式。
【详解】(1) ①甲醇的摩尔质量为32g/mol,1mol甲醇完全燃烧生成CO2(g)和H2O(l)时释放出的热量=32g/mol×1mol×23 kJ · g-1=736kJ,甲醇燃烧热的热化学方程式为CH3OH(l)+O2(g)=CO2(g)+2H2O(l),△H=-736kJ/mol;
② 以熔融Na2CO3作为电解质的甲醇燃料电池的总反应:2CH3OH+3O2=2CO2+4H2O,其中氧元素化合价由0价降低到-2价,故O2得电子发生还原反应,所以充入空气和CO2的一极是正极;甲醇中碳元素化合价由-2价升高到+4价,每个碳原子得6个电子,充入甲醇的一极为负极,其电极反应为:CH3OH-6e-+3CO=4CO2+2H2O;
③由上面分析可知,甲醇燃料电池中充入空气和CO2气体的一极为正极;充入甲醇的一极为负极。在以甲醇燃料电池为电源的电解池中与电源正极相连的为阳极,即与充入空气和CO2气体的一极相连的为电解池的阳极。与甲醇电极相连的为电解池的阴极,电解池的阴极发生还原反应,其电极反应式为Cu2++2e-=Cu;用石墨电极电解CuSO4溶液总反应式为2CuSO4+2H2O2Cu+O2↑+2H2SO4,转移电子4e-,由燃料电池负极反应式CH3OH-6e-+3CO=4CO2+2H2O可知,每消耗0.05 mol甲醇时电路中转移电子物质的量=0.05mol×6=0.3mol,再由电解CuSO4的阳极反应式2H2O-4e-=O2↑+4H+可知,产生的2.24 L气体若是纯O2,则此时转移电子物质的量=4×=0.4mol>0.3mol,说明电解产生的2.24L气体是H2和O2的混合气体,即CuSO4电解结束后又继续电解水:2H2O2H2↑+O2↑,转移电子4e-;设原CuSO4溶液中含CuSO4物质的量为x,电解CuSO4转移的电子物质的量为2x,则电解水转移电子物质的量=0.3mol-2x,电解池共产生气体物质的量=×2x+×(0.3mol-2x)= ,解得x=0.125mol,所以原CuSO4溶液浓度==0.5mol/L;
(2)根据四甲基氯化铵[(CH3)4NCl]和四甲基氢氧化铵[(CH3)4NOH]的化学式可知,由四甲基氯化铵转化为四甲基氢氧化铵即将-Cl替换为-OH(羟基),氯原子可在阳极放电生成Cl2,-OH可有阴极H2O的H+放电产生的OH-转化而来:2H2O+4e-=2H2↑+4OH-,所以电解产物还应有Cl2和H2,总反应方程式为2(CH3)4NCl+2H2O2(CH3)4NOH+H2 ↑+Cl2 ↑;
19. 2Cl--2e-=Cl2↑ 2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑ Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+ Cl2↑ Cu-2e-=Cu2+ Cu2++2e-= Cu 2Cl--2e-=Cl2↑ Na++e-=Na 2NaCl Cl2↑+ 2Na
【详解】(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液,阴极生成氢气和氢氧化镁沉淀,阳极:2Cl--2e-=Cl2↑;阴极:2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑;总反应式:Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+ Cl2↑。
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液,为电镀铜装置,阳极:Cu-2e-=Cu2+;阴极:Cu2++2e-= Cu。
(3)若A为碳棒,B为铁,电解质为熔融NaCl,阳极生成氯气,阴极生成钠,阳极:2Cl--2e-=Cl2↑;阴极:Na++e-=Na;总反应式:2NaCl Cl2↑+ 2Na。
20.
【详解】(1)“萨巴蒂尔反应器”内发生反应为氢气和二氧化碳在催化剂的作用下生成甲烷和水,化学方程式为:,故答案为:;
(2)电解水的化学方程式为:,故答案为:。
21.(1) I III -283.0kJ
(2)2CO(g)+4H2(g)2CH3OH(g)△H=-182.0kJ/mol(或CO(g)+2H2(g)CH3OH(g)△H=-91.0kJ/mol)
(3)25%
【解析】(1)
①吸热反应的ΔH>0,属于吸热反应的为I。
②C的燃烧热是指1molC完全燃烧生成二氧化碳放出的热量,故为II。
③根据盖斯定律,反应III-反应II,可得CO(g)+O2(g)=CO2(g),ΔH=-393.5kJ/mol-(-110.5kJ/mol)=-283.0kJ。
(2)
已知①2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol,②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=-24.0kJ/mol,根据盖斯定律,由×(①-②)得甲醇合成反应的热化学方程式CO(g)+2H2(g)CH3OH(g)△H=-91.0kJ/mol。
(3)
起始时向容器中投入2molCO和4molH,测得某时刻上述总反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)ΔH=-206.0kJ/mol中放出的热量为51.5kJ,此时消耗CO为0.5mol,转化率为×100%=25%。
22. 负 Fe+2H2OFe(OH)2+H2 2H2O-4e-=O2+4H+ 有气泡产生 不变 18 A 稀硫酸
【分析】通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色,说明D端碘离子被氧化生成碘单质,所以D为阳极,E为电源正极,F为电源负极,Pt电极、Cu电极均为电解池的阴极,Fe电极、石墨电极均为电解池的阳极。
【详解】(1)根据分析可知电源的F端为负极;
(2)A中Fe电极为阳极,则Fe失电子生成Fe2+,Pt电极上水放电产生氢气和氢氧根,生成的氢氧根与Fe2+结合生成Fe(OH)2沉淀,由于有植物油覆盖隔绝氧气,所以生成的Fe(OH)2沉淀不会被氧化,总反应为Fe+2H2OFe(OH)2+H2;
(3)B中石墨电极为阳极,水电离出的氢氧根放电生成氧气,电极反应式为2H2O-4e-=O2+4H+;Cu电极为阴极,水电离出的氢离子放电生成氢气,所以可以观察到的现象是有气泡产生;B中实际上就是在电解水,而硫酸钠溶液为中性溶液,水少了依然为中性,所以pH不变;
(4)B中实际上电解水,所以生成的O2和H2的物质的量之比为1:2,共收集到16.8 L(折算为标准状况下)气体,则收集到5.6L O2,转移的电子为=1mol,A中总反应为Fe+2H2OFe(OH)2+H2,溶液减轻的质量即水的质量,转移1mol电子消耗1molH2O,质量减轻18g;
(5)去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,则需要A或B成为原电池,且Pt电极或Cu电极为正极,发生还原反应,若将A中换成稀硫酸,则A中总反应为Fe与稀硫酸的反应,Fe被氧化为负极,Pt为正极,符合条件;常温下Fe在浓硝酸中钝化,若换成浓硝酸则无法形成原电池,不符合条件;若将B中溶液换成稀硫酸,Cu与稀硫酸不反应,无法形成原电池,不符合条件,若换成浓硝酸,Cu被氧化,作负极,也不符合条件,综上所述应将A中的溶液换成稀硫酸。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
