专题4 硫与环境保护 单元测试卷(含解析) 高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题4 硫与环境保护 单元测试卷(含解析) 高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 918.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 19:23:30 | ||
图片预览



文档简介
专题4《硫与环境保护》单元测试卷
一、单选题
1.下列离子的检验方法正确的是( )
A.某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中有SO42
B.某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl
C.某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有CO32
D.某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2
2.下列叙述不涉及氧化还原反应的是
A.用漂白纸浆 B.由二氧化硅制晶体硅
C.含氯消毒剂用于环境消毒 D.大气中的参与酸雨的形成
3.火法炼铜要焙烧黄铜矿,其反应为:2CuFeS2+O2 Cu2S+2FeS+SO2,下列说法正确的是
A.铜的冶炼可采用热还原法、电解法和热分解法
B.仅为氧化产物
C.每转移电子,有硫被氧化
D. CuFeS2仅作还原剂,硫元素被氧化
4.对于反应14CuSO4 +5FeS2 +12H2O=7Cu2S +5FeSO4+12H2SO4,下列结论正确的是
A.FeS2既不是氧化剂,又不是还原剂
B.Cu2S 既是氧化产物,又是还原产物
C.被氧化的硫和被还原的硫质量比是7∶3
D.被CuSO4氧化的硫占全部被氧化的硫的
5.二氧化氯(ClO2)是世界卫生组织(WHO)公认的新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。经大量实验研究表明,ClO2对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用,研究表明,ClO2在浓度低于100mg·L 1时不会对人体产生任何的影响。在“新冠”疫情防控中ClO2也被广泛的用于公共场所的消杀。下列关于ClO2的说法正确的是
A.ClO2能用于消毒是因为它是氯的最高价氧化物
B.在进行消毒作业时使用的ClO2溶液浓度越大越好
C.ClO2杀菌力强,是一种比“84”性能更优越的消毒剂
D.ClO2可与NaOH在一条件下发生反应,产物只有NaClO3和H2O
6.在太空舱里,常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2,NiFe2O4中Fe的化合价为+3.则Ni的化合价为
A.+4 B.+3 C.+2 D.+1
7.某化学兴趣小组设计了如图所示的浓硝酸与铜反应的微型实验。下列说法中错误的是
A.挤压塑料瓶使浓硝酸进入干燥管就可引发反应
B.将装置口向上竖起就可停止反应
C.蘸碱液的棉花可起到吸收的作用
D.该装置适用于木炭与浓硫酸的反应实验
8.下列有关物质应用的说法正确的是
A.生石灰用作食品抗氧剂
B.氯气有毒,不可作自来水消毒剂
C.铝罐可久盛食醋
D.氯和氧的化合物可作自来水消毒剂
9.在氧气中灼烧有硫元素和铁元素组成的化合物,使其中的硫全部转化为二氧化硫,并将二氧化硫,全部氧化成硫酸,这些硫酸与氢氧化钠溶液恰好完全中和,则原化合物中硫的质量分别约为( )
A. B. C. D.
10.含有氧化剂X2的溶液与亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,已知X2、Na2SO3的个数比为1∶2,则还原产物中元素X的价态是
A.-1 B.-2 C.+1 D.0
11.下列实验能达到目的的是
A.用溴水鉴别正己烷和甲苯 B.用BaCl2溶液鉴别SO和SO
C.用饱和NaHCO3中除去Cl2中的HCl D.用浓HNO3与Cu反应制备NO2
12.将32gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被700 mL 1mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
13.下列不能使KI-淀粉溶液变蓝的是
A.SO2 B.H2O2 C.ClO2 D.碘酒
14.已知反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O,下列说法正确的是 ( )
A.氧化产物与还原产物的物质的量之比为2:5
B.每生成1molCl2时转移2mol e-
C.KMnO4的还原性强于Cl2的还原性
D.参与反应的氧化剂与还原剂的物质的量之比为1:8
15.高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示。下列叙述正确的是
A.K2FeO4用作水处理剂的作用与明矾净水完全相同
B.过量的铁屑与Cl2反应生成FeCl2
C.反应Ⅱ中每生成1molNa2FeO4转移6mol电子
D.K2FeO4晶体析出的原因与侯氏制碱法析出NaHCO3的原因相同
二、填空题
16.氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O。
①其中还原剂为____,还原产物为____。
②若有0.8mol还原剂被氧化,则转移电子的物质的量是____。
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为_____,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_______。
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为______。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为___。
17.(1)0.1mol/L AlCl3溶液20mL和0.1mol/LNaOH 70mL溶液混合充分反应,试书写反应离子方程式:___________。
(2)已知:SO+I2+H2O=SO+2I-+2H+。某无色溶液中可能含有NH、Cu2+、I-、SO中的几种离子,向该溶液中滴加少量溴水后,溶液仍呈无色。(已知,溴水为Br2的水溶液,为橙黄色,且氧化性:Br2>I2)则该溶液中一定含有的离子是___________;一定没有的离子是___________。
(3)工业废水中含有的重铬酸根离子(Cr2O)有毒,对土壤和水资源会造成污染,须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O+14H+=6Fe3++2Cr3++7H2O。该反应中,还原产物是___________;若该反应中氧化反应的过程可以表示为Fe2+-e-=Fe3+,则还原反应的过程可以表示为___________。
(4)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:
①该反应的氧化剂为___________,发生氧化反应的物质为___________。
②当烟气中NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生了反应。该反应的化学方程式为___________。
三、实验题
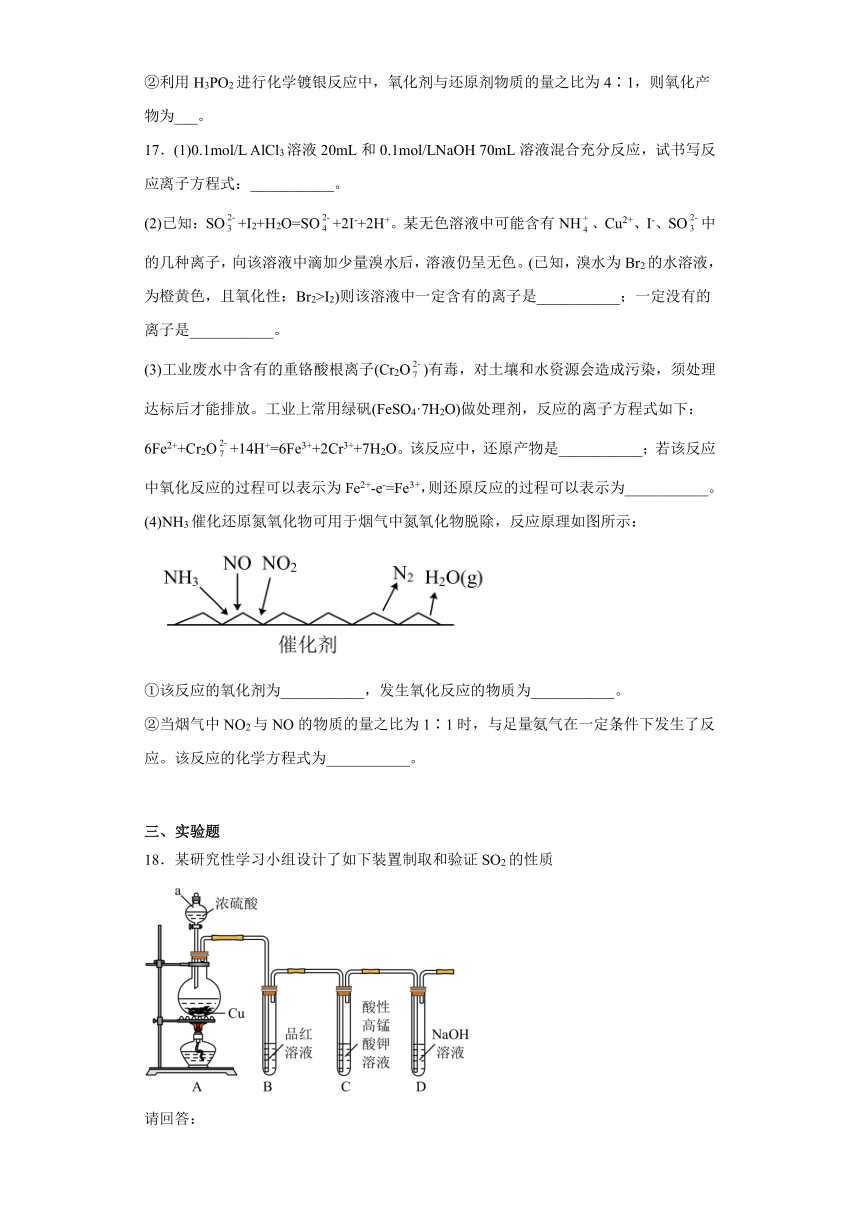
18.某研究性学习小组设计了如下装置制取和验证SO2的性质
请回答:
(1)图中仪器a的名称为_____________。
(2)A中发生反应的化学方程式是_____________________________________。
(3)若C中溶液褪色,体现SO2具有_________________性。
(4)过量NaOH溶液与SO2反应的离子方程式是__________________________________。
(5)向两支装有品红溶液的试管中,分别通入Cl2和SO2,发现两支试管中品红溶液均褪色,请你设计实验证明哪支试管中通入的是SO2:_________________。
(6)该小组继续设计实验,相同条件下将Cl2和SO2两种气体按体积1:1混合,再通入品红溶液中,观察溶液几乎不褪色。查阅资料知:两种气体按体积1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是________________________。
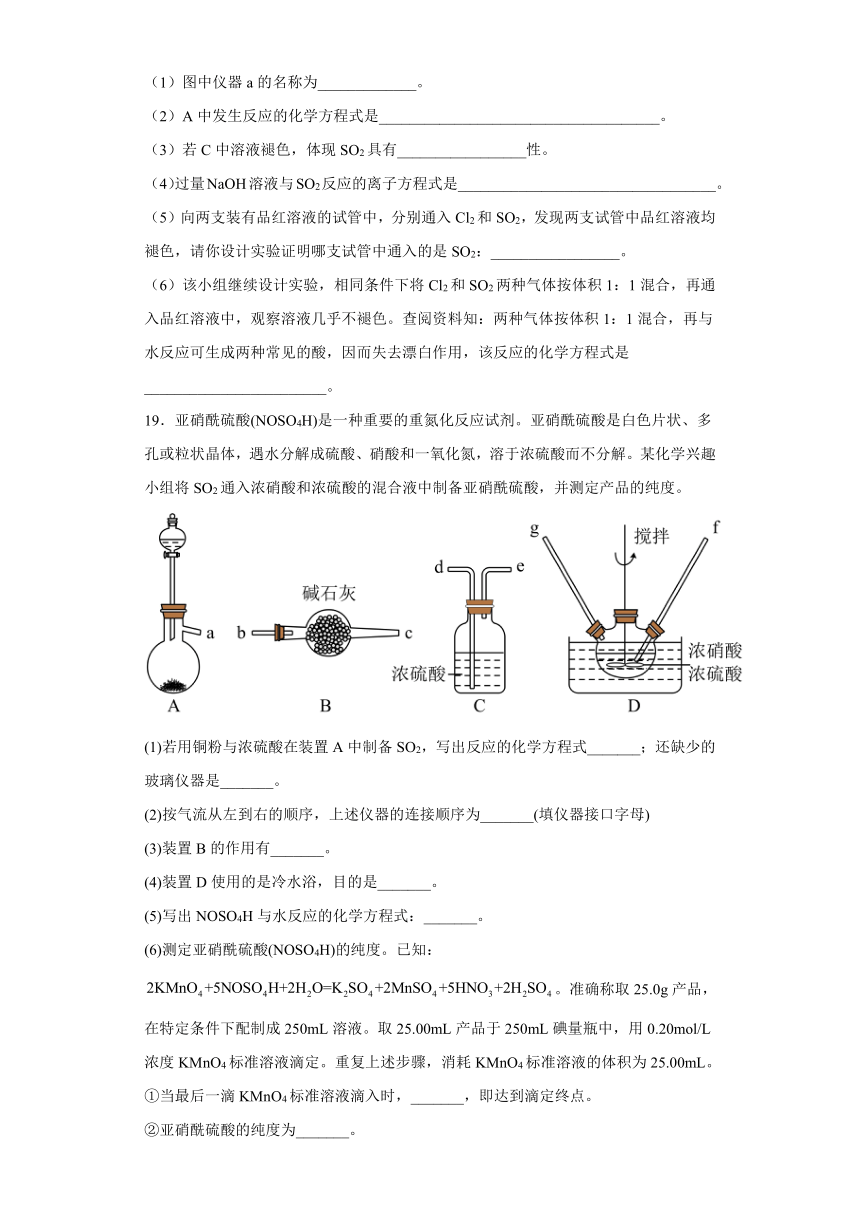
19.亚硝酰硫酸(NOSO4H)是一种重要的重氮化反应试剂。亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解成硫酸、硝酸和一氧化氮,溶于浓硫酸而不分解。某化学兴趣小组将SO2通入浓硝酸和浓硫酸的混合液中制备亚硝酰硫酸,并测定产品的纯度。
(1)若用铜粉与浓硫酸在装置A中制备SO2,写出反应的化学方程式_______;还缺少的玻璃仪器是_______。
(2)按气流从左到右的顺序,上述仪器的连接顺序为_______(填仪器接口字母)
(3)装置B的作用有_______。
(4)装置D使用的是冷水浴,目的是_______。
(5)写出NOSO4H与水反应的化学方程式:_______。
(6)测定亚硝酰硫酸(NOSO4H)的纯度。已知:。准确称取25.0g产品,在特定条件下配制成250mL溶液。取25.00mL产品于250mL碘量瓶中,用0.20mol/L浓度KMnO4标准溶液滴定。重复上述步骤,消耗KMnO4标准溶液的体积为25.00mL。
①当最后一滴KMnO4标准溶液滴入时,_______,即达到滴定终点。
②亚硝酰硫酸的纯度为_______。
四、计算题
20.取 100mL18.3 mol/L 的 H2SO4 与 Zn 反应,当 Zn 完全溶解时,生成气体为22.4L(标准状况),将所得溶液稀释成 1L,测得溶液中H+浓度为 1 mol/L。
①反应转移的电子数目为_________。
②消耗硫酸的物质的量为__________。
③则所得气体中SO2 和 H2 的体积比约为___________。
21.一定量氢气在氯气中燃烧,所得混合物用溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)所得混合物与NaOH溶液反应的离子方程式______
(2)所得溶液中NaCl的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比________。
参考答案:
1.D
【详解】A.某溶液中滴入氯化钡溶液,生成白色沉淀,该白色沉淀可能为AgCl,原溶液中可能含有氯离子,不一定有SO42 ,故A错误;
B.某溶液中滴入硝酸银溶液,生成白色沉淀,由于碳酸银等沉淀也是白色沉淀,所以原溶液中不一定有Cl ,故B错误;
C.某溶液中滴入稀盐酸,生成无色气体,原溶液中可能含有HCO3 ,不一定有CO32 ,故C错误;
D.某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,该蓝色沉淀为氢氧化铜,则说明原溶液中一定有Cu2+,故D正确;
答案选D。
2.A
【详解】A.用漂白纸浆利用的是SO2的漂白性,而与氧化还原反应无关,A符合题意;
B.由二氧化硅制晶体硅,发生的反应为,属于氧化还原反应,B不符合题意;
C.含氯消毒剂用于环境消毒利用了其强氧化性的性质,涉及到氧化还原反应,C不符合题意;
D.大气中的参与酸雨的形成,发生反应3NO2+H2O=2HNO3+NO,N元素化合价发生改变,属于氧化还原反应,D不符合题意;
答案选A。
3.C
【详解】A.工业上用热还原法冶炼铜,故A错误;
B.由方程式可知,反应中氧元素的化合价降低被还原、硫元素的化合价部分升高被氧化,二氧化硫即是反应的氧化产物也是反应的还原产物,故B错误;
C.由方程式可知,反应生成1mol二氧化硫,反应转移6mol电子,故C正确;
D.由方程式可知,CuFeS2中铜元素的化合价降低被还原,硫元素的化合价升高被氧化,CuFeS2即是反应的氧化剂又是反应的还原剂,故D错误;
故选C。
4.D
【详解】A.该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,Cu元素被还原、S元素既被氧化,又被还原,则FeS2既是氧化剂,又是还原剂,A错误;
B.根据元素化合价知,Cu2S只是还原产物,B错误;
C.FeS2中化合价升高的硫被氧化生成硫酸根离子,化合价降低的硫被还原生成Cu2S,则被氧化的S和被还原的S质量比为3:7,C错误;
D.1mol硫酸铜失去1mol电子,被硫酸铜氧化的S是mol,而1mol硫酸铜参加反应被氧化的硫是,所以被CuSO4氧化的硫占全部被氧化的硫的,D正确;
答案选D。
【点睛】本题考查了氧化还原反应的有关判断与计算,根据元素化合价变化来分析解答即可,注意FeS2中S元素化合价,明确FeS2的作用。选项D为易错点,主要是没有考虑到硫元素还发生自身的氧化还原反应,答题的关键是利用好电子得失守恒。
5.C
【详解】A.氯元素的最高价态为+7价,ClO2中氯元素的化合价为+4价,故ClO2不是氯的最高价氧化物,A项错误;
B.由题中叙述可知,ClO2的浓度不宜高于100mg·L 1,故在进行消毒作业时使用的ClO2溶液浓度不是越大越好,B项错误;
C.ClO2得电子能力强,且无三致、有三效,则ClO2杀菌力强,是一种比“84”性能更优越的消毒剂,C项正确;
D.分析题中所给信息,氧化还原反应中有元素的化合价升高和降低,Cl元素的化合价由+4价升高为+5价,则与NaOH反应还应生成NaCl,D项错误;
答案选C。
6.C
【详解】NiFe2O4中Fe的化合价为+3,O为-2价 ,根据化合物中元素化合价代数和为零的原则,设Ni的化合价为x,则可得等式x+(+3)2+(-2)=0,x=+2,则Ni的化合价为+2,故答案为C。
7.D
【详解】A.挤压塑料瓶能使浓硝酸进入干燥管与铜接触,引发反应,故A正确;
B.只需将装置口向上竖起,浓硝酸回流到锥形瓶,而铜片不能进入锥形瓶,可以停止反应,故B正确;
C.二氧化氮与碱反应生成亚硝酸盐和硝酸盐,所以蘸碱液的棉花可起到吸收NO2的作用,故C正确;
D.该装置适用于块状固体和液体反应,且不需要加热的气体的制备,而木炭与浓硫酸和浓硝酸都要加热才反应,故D错误;
故选D。
8.D
【详解】氧化钙不具有还原性,则生石灰不能用作食品抗氧剂,故A错误;
B.氯气与水反应生成具有强氧化性的次氯酸能起到杀菌消毒的作用,在国标范围内,氯气是可以用作自来水消毒剂,故B错误;
C.铝是活泼金属,能与醋酸反应而被腐蚀,所以不能用铝罐存储食醋,故C错误;
D.二氧化氯具有强的氧化性,能够起到杀菌消毒的作用,常作自来水消毒剂,故D正确;
故选
9.D
【分析】根据计算NaOH的物质的量,关系式为,据此计算S元素物质的量,再计算S元素质量,进而可计算质量分数。
【详解】,由反应的关系式可知,,则硫和铁组成的化合物中,则,故答案选D。
【点睛】当一种物质经过多个化学反应的变化时,按照化学方程式一步步的计算是非常繁琐的,甚至无法计算,这时要注意用守恒的思想进行解题。
10.B
【详解】S元素由Na2SO3中的+4价升高到Na2SO4中的+6价,X2的化合价只能降低,假设每个X2分子降低的价态是a,根据得失电子守恒,有a=2 × 2=4,所以每个X原子降低的价态数是2,X原来是0价,降低2个价态后是-2价,B项正确。
11.D
【详解】A.两者密度都比水小,均发生萃取,溴水层褪色,不能鉴别,故A错误;
B.两者都有沉淀生成,不能鉴别,故B错误;
C.两者均能与NaHCO3溶液反应,而且引入CO2,故C错误;
D.浓硝酸具有强氧化性,可与Cu反应生成NO2,故D正确;
故答案选C。
12.B
【分析】用终态分析法:只有两种元素的价态变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,根据电子转移守恒得,32gCu失去的电子等于HNO3到NaNO2得到的电子,计算产物中NaNO2的物质的量,由Na守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),得n(NaNO3)。
【详解】n(Cu)==0.5mol,根据电子守恒生成n(NaNO2)==0.5mol,由钠原子守恒可知n(NaNO3)=0.7L×1mol·L-1-0.5mol=0.2mol,故选B。
13.A
【分析】KI-淀粉溶液变蓝,说明有I2存在,说明该物质中含有I2,或具有氧化性可以氧化KI得到I2。
【详解】A.SO2不能氧化KI,不能使淀粉KI试纸变蓝,故A选;
B.H2O2将KI氧化为I2,淀粉遇碘变蓝色,故B不选;
C.ClO2可将KI氧化为I2,淀粉遇碘变蓝色,故C不选;
D.碘酒中含有I2,淀粉遇碘变蓝色,故D不选;
故选A。
14.B
【详解】A.由反应方程式可知,氧化产物为Cl2,还原产物为MnCl2,氧化产物与还原产物的物质的量之比为5:2,故A错误;
B.每生成1molCl2时,反应中转移的电子为1mol×2×[0-(-1)]=2mol,故B正确;
C.元素的化合价降低,作氧化剂,高锰酸钾是氧化剂,氯气是氧化产物,所以KMnO4的氧化性强于Cl2的氧化性,故C错误;
D.由方程式可知,每消耗16molHCl,只有10mol失去电子,则其中作还原剂的HCl是10mol,高锰酸钾作氧化剂,氧化剂与还原剂的物质的量之比为2mol:10mol=1:5,故D错误;
故选B。
【点睛】在氧化还原反应中,作还原剂的物质并非只体现还原性,比如此题中HCl,既体现了还原性又体现了酸性。
15.D
【详解】A.K2FeO4具有强氧化性,可用于杀菌消毒,被还原为铁离子,水解生成氢氧化铁胶体,具有吸附性,可用于吸附水中的悬浮杂质,而明矾水解生成氢氧化铝胶体,只用于净水,不能杀菌消毒,则两者用作水处理剂的作用与明矾净水不完全相同,故A错误;
B.过量的铁屑与Cl2反应生成FeCl3 ,故B错误;
C.反应Ⅱ中铁元素化合价由+3价升高到+6价,则每生成1molNa2FeO4转移3mol电子,故C错误;
D.最后一步制取高铁酸钾的原因实际是利用了盐析的原理,相同温度下高铁酸钾的溶解度小于高铁酸钠的溶解度,侯氏制碱法中碳酸氢钠的溶解度小于碳酸钠,则两者析出原因相同,故D正确;
故选:D。
16. HBr MnBr2 0.8mol Fe+2H+=Fe2++H2↑ 4Fe2++O2+4H+=4Fe3++2H2O +1 H3PO4
【分析】(1)根据氧化还原反应的规律分析;
(2)铁粉在人体胃酸的作用下转化成亚铁盐,则铁与盐酸反应生成亚铁离子和氢气;Fe2+与氢离子和氧气反应生成铁离子和水;
(3)①H3PO2中元素化合价的代数和为零,进行求解;
②根据化合价升降总数相等进行判断。
【详解】(1)①高锰酸钾和氢溴酸反应,Mn的化合价降低,KMnO4作氧化剂,对应的产物为还原产物,为MnBr2;Br的化合价升高,HBr作还原剂;
②有0.8mol还原剂被氧化,化合价由-1变为0价,失去0.8mol电子;
(2)铁粉在人体胃酸的作用下转化成亚铁盐,则铁与盐酸反应生成亚铁离子和氢气,离子方程式为Fe+2H+=Fe2++H2↑;Fe2+与氢离子和氧气反应生成铁离子和水,则离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(3)①H3PO2中元素化合价的代数和为零,H为+1价,O为-2价,则P为+1价;
②H3PO2化合价升高,Ag+还原为Ag,化合价降低,作氧化剂,其物质的量为4,得4个电子,则H3PO2的计量数为1,失去4个电子,化合价变为+5价,产物为H3PO4。
【点睛】还原剂化合价升高,失去电子;氧化剂得电子,化合价降低,且得失电子总数相等。
17. 2Al3++7OH-= Al(OH)3↓+AlO+2H2O SO、NH Cu2+ Cr3+ Cr2O+6e-+14H+=2Cr3++ 7H2O NO2,NO NH3 NO+NO2+2NH3=2N2+3H2O
【详解】(1)0.1mol/L AlCl3溶液20mL含有0.002mol AlCl3,0.1mol/LNaOH 70mL溶液含有0.007molNaOH,0.002mol氯化铝先和0.006molNaOH反应生成0.002molAl(OH)3沉淀,之后剩余0.001molNaOH和Al(OH)3反应生成0.001mol偏铝酸钠,所以离子反应方程式为2Al3++7OH-= Al(OH)3↓+AlO+2H2O;
(2)根据方程式SO+I2+H2O=SO+2I-+2H+可知SO的还原性强于I-,滴加少量溴水后,溶液仍呈无色,说明有物质将Br2还原,但如果是I-,I-被氧化后会生成I2,溶液会先黄色,所以将Br2还原的是SO,即溶液中一定有SO,溶液无色则一定不含Cu2+,根据电中性原则可知一定还含有NH,综上所述一定有的是SO、NH,一定没有的是Cu2+;
(3)该反应中Cr元素由+6价变为+3价,所以还原产物为Cr3+,还原反应的过程为Cr2O得电子后结合氢离子生成Cr3+和H2O,根据电子守恒和元素守恒可得方程式为Cr2O+6e-+14H+=2Cr3++ 7H2O;
(4)该反应中NO2、NO与NH3反应生成N2,NO2、NO中N元素化合价降低被还原,所以氧化剂为NO2,NO;NH3中N元素化合价升高,发生氧化反应;
(5)NO2与NO的物质的量之比为1:1,则NO2与NO共降低6价,NH3升高3价,所以(NO2+NO)与NH3的系数比为1:2,再结合元素守恒可得化学方程式为NO+NO2+2NH3=2N2+3H2O。
18. 分液漏斗 Cu + 2H2SO4 (浓) CuSO4 + SO2↑+2H2O 还原 SO2+2OH = SO32 + H2O 将两支试管中的液体加热,恢复红色的通入的为SO2 Cl2+SO2+2H2O=H2SO4+2HCl
【分析】A中浓硫酸与铜在加热条件下反应生成二氧化硫和水、硫酸铜,二氧化硫具有漂白性,能够使B中品红溶液褪色,二氧化硫具有还原性,能够与C中高锰酸钾溶液褪色,二氧化硫有毒,多余的二氧化硫可以用D中氢氧化钠吸收,以此解答该题。
【详解】(1)由装置图可知仪器a为分液漏斗,故答案为:分液漏斗;
(2)浓硫酸具有强氧化性,加热条件下可与铜发生氧化还原反应,方程式为 ,
(3)高锰酸钾具有强氧化性,C中高锰酸钾褪色,说明二氧化硫具有还原性,故答案为:还原;
(4)过量NaOH溶液与SO2反应生成亚硫酸钠,离子方程式是SO2+2OH-=SO32-+H2O;
(5)二氧化硫的漂白效果具有不稳定性,加热可恢复到原来的颜色,则鉴别两种气体,可将两支试管中的液体加热,恢复红色的通入的为SO2,故答案为:将两支试管中的液体加热,恢复红色的通入的为SO2;
(6)氯气与二氧化硫发生氧化还原反应生成硫酸和盐酸,反应的方程式为Cl2+SO2+2H2O=H2SO4+2HCl。
19.(1) Cu+2H2SO4CuSO4+SO2↑+2H2O 酒精灯
(2)adefgb
(3)吸收SO2防止空气污染;防止空气中的水蒸气进入D中干扰实验
(4)防止浓硝酸分解(或挥发)而减少产率
(5)3NOSO4H+2H2O=3H2SO4+HNO3+NO↑
(6) 溶液由无色变为浅红色(或紫色),且半分钟不褪色 63.5%
【分析】在装置A中用Na2SO3与浓H2SO4发生复分解反应制取SO2,由于亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解,因此制取的SO2气体需经装置C中浓硫酸的干燥作用,将气体通入D中,与浓硝酸在浓硫酸催化下反应产生NOSO4H,由于SO2是大气污染物,同时硝酸有挥发性,挥发的硝酸蒸气及未反应的SO2气体可以使用B中碱石灰进行吸收,防止大气污染。
(1)
铜粉与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式为Cu+2H2SO4CuSO4+SO2↑+2H2O,还缺少酒精灯。
(2)
在装置A中制取SO2气体,在装置C中干燥SO2,导气管连接应该是长进短出,然后使SO2气体由f通入D装置中,在装置D中发生反应制取NOSO4H,为防止NOSO4H水解变质,再连接B装置,挥发的硝酸蒸气及未反应的SO2气体用B装置的碱石灰进行吸收,故按气流从左到右的顺序,上述仪器接口的连接顺序为adefgb。
(3)
装置B的作用吸收SO2防止空气污染;防止空气中的水蒸气进入D中干扰实验。
(4)
为防止浓硝酸分解(或挥发)而减少产率,D使用的是冷水浴。
(5)
NOSO4H与水遇水分解成硫酸、硝酸和一氧化氮,故反应的化学方程式为3NOSO4H+2H2O=3H2SO4+HNO3+NO↑。
(6)
①当最后一滴KMnO4标准溶液滴入时,溶液由无色变为浅红色(或紫色),且半分钟不褪色,即达到滴定终点。
②消耗KMnO4标准溶液的物质的量n=cV=0.20mol/L×0.025L=0.005mol,根据反应可得NOSO4H的物质的量为0.0125mol,故纯度为×100%=63.5%。
20. 2×6.02×1023或2mol 1.33mol 1:2
【详解】①根据反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O和Zn+H 2SO4=ZnSO4+H2↑可知,不管生成1molSO2还是生成1molH2均需转移2mol电子,故有:n(e-)=2n(气体)=2×=2mol,故转移电子数为2×6.02×1023或2mol,故答案为:2×6.02×1023或2mol;
②18.3mol/L的H2SO4 中含有硫酸的物质的量为:n(H2SO4)浓=0.1L×18.3mol/L=1.83mol;剩余硫酸的物质的量为:n(H2SO4)剩 =n(H+)=×1L×1.0mol/L=0.5mol;消耗硫酸的物质的量为:n(H2SO4)消耗 =1.83mol-0.5mol=1.33mol, 故答案为:1.33mol;
③锌与浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H 2SO4=ZnSO4+H2↑, 生成气体为SO2和H2的混合物,物质的量为 22.4L÷22.4L/mol=1mol ,设混合物气体中含有xmolSO2 ,ymolH2 ,则发生反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O消耗硫酸物质的量为2xmol,发生反应Zn+H 2SO4=ZnSO4+H2↑消耗硫酸物质的量为ymol,则有x+y=1、2x+y=1.33,解得:x=0.33 、y=0.67 ,所以V(SO2):V(H2)=x:y=0.33:67=1:2,故答案为:1:2。
21. 、 0.250
【分析】由溶液中含有0.0500 mol次氯酸钠可知,氢气在氯气中燃烧时,氯气过量,反应得到氯化氢和氯气的混合气体。
【详解】(1)氯化氢和氯气的混合气体被氢氧化钠溶液吸收时,氯化氢与氢氧化钠溶液发生中和反应生成氯化钠和水,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为OH—+H+= H2O,Cl2+2OH—=Cl—+ClO—+H2O,故答案为OH—+H+= H2O,Cl2+2OH—=Cl—+ClO—+H2O;
(2)根据溶液电中性原则可知:n(Na+)=n(Cl-)+n(ClO-),n(Cl-)=n(Na+)-n(ClO-)=0.1L×3.00mol/L-0.0500mol=0.250mol,则所得溶液中NaCl的物质的量为0.250mol,故答案为0.250;
(3)根据Cl原子守恒可知,n(Cl2)=×n(NaOH)=0.15mol,由氯气与氢氧化钠溶液反应的化学方程式可知,生成0.0500 mol次氯酸钠消耗过量氯气0.0500 mol,则与氢气反应的氯气为0.15mol-0.05mol=0.1mol,氢气在氯气中燃烧的化学方程式为H2+Cl22HCl,由化学方程式可知氢气的物质的量为0.1mol,故氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2,故答案为3:2。
【点睛】所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,根据钠元素及氯元素守恒可知2n(Cl2)=n(Na+)=n(Cl-)+n(ClO-);根据电子转移守恒,计算氯气发生氧化还原反应生成的氯离子的物质的量,溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,计算反应后混合气体中氯化氢的物质的量,根据氢元素守恒计算氢气的物质的量是解答关键。
一、单选题
1.下列离子的检验方法正确的是( )
A.某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中有SO42
B.某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl
C.某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有CO32
D.某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2
2.下列叙述不涉及氧化还原反应的是
A.用漂白纸浆 B.由二氧化硅制晶体硅
C.含氯消毒剂用于环境消毒 D.大气中的参与酸雨的形成
3.火法炼铜要焙烧黄铜矿,其反应为:2CuFeS2+O2 Cu2S+2FeS+SO2,下列说法正确的是
A.铜的冶炼可采用热还原法、电解法和热分解法
B.仅为氧化产物
C.每转移电子,有硫被氧化
D. CuFeS2仅作还原剂,硫元素被氧化
4.对于反应14CuSO4 +5FeS2 +12H2O=7Cu2S +5FeSO4+12H2SO4,下列结论正确的是
A.FeS2既不是氧化剂,又不是还原剂
B.Cu2S 既是氧化产物,又是还原产物
C.被氧化的硫和被还原的硫质量比是7∶3
D.被CuSO4氧化的硫占全部被氧化的硫的
5.二氧化氯(ClO2)是世界卫生组织(WHO)公认的新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。经大量实验研究表明,ClO2对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用,研究表明,ClO2在浓度低于100mg·L 1时不会对人体产生任何的影响。在“新冠”疫情防控中ClO2也被广泛的用于公共场所的消杀。下列关于ClO2的说法正确的是
A.ClO2能用于消毒是因为它是氯的最高价氧化物
B.在进行消毒作业时使用的ClO2溶液浓度越大越好
C.ClO2杀菌力强,是一种比“84”性能更优越的消毒剂
D.ClO2可与NaOH在一条件下发生反应,产物只有NaClO3和H2O
6.在太空舱里,常用NiFe2O4作催化剂将宇航员呼出的CO2转化为O2,NiFe2O4中Fe的化合价为+3.则Ni的化合价为
A.+4 B.+3 C.+2 D.+1
7.某化学兴趣小组设计了如图所示的浓硝酸与铜反应的微型实验。下列说法中错误的是
A.挤压塑料瓶使浓硝酸进入干燥管就可引发反应
B.将装置口向上竖起就可停止反应
C.蘸碱液的棉花可起到吸收的作用
D.该装置适用于木炭与浓硫酸的反应实验
8.下列有关物质应用的说法正确的是
A.生石灰用作食品抗氧剂
B.氯气有毒,不可作自来水消毒剂
C.铝罐可久盛食醋
D.氯和氧的化合物可作自来水消毒剂
9.在氧气中灼烧有硫元素和铁元素组成的化合物,使其中的硫全部转化为二氧化硫,并将二氧化硫,全部氧化成硫酸,这些硫酸与氢氧化钠溶液恰好完全中和,则原化合物中硫的质量分别约为( )
A. B. C. D.
10.含有氧化剂X2的溶液与亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,已知X2、Na2SO3的个数比为1∶2,则还原产物中元素X的价态是
A.-1 B.-2 C.+1 D.0
11.下列实验能达到目的的是
A.用溴水鉴别正己烷和甲苯 B.用BaCl2溶液鉴别SO和SO
C.用饱和NaHCO3中除去Cl2中的HCl D.用浓HNO3与Cu反应制备NO2
12.将32gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物,这些气体恰好能被700 mL 1mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
13.下列不能使KI-淀粉溶液变蓝的是
A.SO2 B.H2O2 C.ClO2 D.碘酒
14.已知反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O,下列说法正确的是 ( )
A.氧化产物与还原产物的物质的量之比为2:5
B.每生成1molCl2时转移2mol e-
C.KMnO4的还原性强于Cl2的还原性
D.参与反应的氧化剂与还原剂的物质的量之比为1:8
15.高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示。下列叙述正确的是
A.K2FeO4用作水处理剂的作用与明矾净水完全相同
B.过量的铁屑与Cl2反应生成FeCl2
C.反应Ⅱ中每生成1molNa2FeO4转移6mol电子
D.K2FeO4晶体析出的原因与侯氏制碱法析出NaHCO3的原因相同
二、填空题
16.氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O。
①其中还原剂为____,还原产物为____。
②若有0.8mol还原剂被氧化,则转移电子的物质的量是____。
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为_____,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_______。
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为______。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为___。
17.(1)0.1mol/L AlCl3溶液20mL和0.1mol/LNaOH 70mL溶液混合充分反应,试书写反应离子方程式:___________。
(2)已知:SO+I2+H2O=SO+2I-+2H+。某无色溶液中可能含有NH、Cu2+、I-、SO中的几种离子,向该溶液中滴加少量溴水后,溶液仍呈无色。(已知,溴水为Br2的水溶液,为橙黄色,且氧化性:Br2>I2)则该溶液中一定含有的离子是___________;一定没有的离子是___________。
(3)工业废水中含有的重铬酸根离子(Cr2O)有毒,对土壤和水资源会造成污染,须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O+14H+=6Fe3++2Cr3++7H2O。该反应中,还原产物是___________;若该反应中氧化反应的过程可以表示为Fe2+-e-=Fe3+,则还原反应的过程可以表示为___________。
(4)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:
①该反应的氧化剂为___________,发生氧化反应的物质为___________。
②当烟气中NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生了反应。该反应的化学方程式为___________。
三、实验题
18.某研究性学习小组设计了如下装置制取和验证SO2的性质
请回答:
(1)图中仪器a的名称为_____________。
(2)A中发生反应的化学方程式是_____________________________________。
(3)若C中溶液褪色,体现SO2具有_________________性。
(4)过量NaOH溶液与SO2反应的离子方程式是__________________________________。
(5)向两支装有品红溶液的试管中,分别通入Cl2和SO2,发现两支试管中品红溶液均褪色,请你设计实验证明哪支试管中通入的是SO2:_________________。
(6)该小组继续设计实验,相同条件下将Cl2和SO2两种气体按体积1:1混合,再通入品红溶液中,观察溶液几乎不褪色。查阅资料知:两种气体按体积1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是________________________。
19.亚硝酰硫酸(NOSO4H)是一种重要的重氮化反应试剂。亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解成硫酸、硝酸和一氧化氮,溶于浓硫酸而不分解。某化学兴趣小组将SO2通入浓硝酸和浓硫酸的混合液中制备亚硝酰硫酸,并测定产品的纯度。
(1)若用铜粉与浓硫酸在装置A中制备SO2,写出反应的化学方程式_______;还缺少的玻璃仪器是_______。
(2)按气流从左到右的顺序,上述仪器的连接顺序为_______(填仪器接口字母)
(3)装置B的作用有_______。
(4)装置D使用的是冷水浴,目的是_______。
(5)写出NOSO4H与水反应的化学方程式:_______。
(6)测定亚硝酰硫酸(NOSO4H)的纯度。已知:。准确称取25.0g产品,在特定条件下配制成250mL溶液。取25.00mL产品于250mL碘量瓶中,用0.20mol/L浓度KMnO4标准溶液滴定。重复上述步骤,消耗KMnO4标准溶液的体积为25.00mL。
①当最后一滴KMnO4标准溶液滴入时,_______,即达到滴定终点。
②亚硝酰硫酸的纯度为_______。
四、计算题
20.取 100mL18.3 mol/L 的 H2SO4 与 Zn 反应,当 Zn 完全溶解时,生成气体为22.4L(标准状况),将所得溶液稀释成 1L,测得溶液中H+浓度为 1 mol/L。
①反应转移的电子数目为_________。
②消耗硫酸的物质的量为__________。
③则所得气体中SO2 和 H2 的体积比约为___________。
21.一定量氢气在氯气中燃烧,所得混合物用溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)所得混合物与NaOH溶液反应的离子方程式______
(2)所得溶液中NaCl的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比________。
参考答案:
1.D
【详解】A.某溶液中滴入氯化钡溶液,生成白色沉淀,该白色沉淀可能为AgCl,原溶液中可能含有氯离子,不一定有SO42 ,故A错误;
B.某溶液中滴入硝酸银溶液,生成白色沉淀,由于碳酸银等沉淀也是白色沉淀,所以原溶液中不一定有Cl ,故B错误;
C.某溶液中滴入稀盐酸,生成无色气体,原溶液中可能含有HCO3 ,不一定有CO32 ,故C错误;
D.某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,该蓝色沉淀为氢氧化铜,则说明原溶液中一定有Cu2+,故D正确;
答案选D。
2.A
【详解】A.用漂白纸浆利用的是SO2的漂白性,而与氧化还原反应无关,A符合题意;
B.由二氧化硅制晶体硅,发生的反应为,属于氧化还原反应,B不符合题意;
C.含氯消毒剂用于环境消毒利用了其强氧化性的性质,涉及到氧化还原反应,C不符合题意;
D.大气中的参与酸雨的形成,发生反应3NO2+H2O=2HNO3+NO,N元素化合价发生改变,属于氧化还原反应,D不符合题意;
答案选A。
3.C
【详解】A.工业上用热还原法冶炼铜,故A错误;
B.由方程式可知,反应中氧元素的化合价降低被还原、硫元素的化合价部分升高被氧化,二氧化硫即是反应的氧化产物也是反应的还原产物,故B错误;
C.由方程式可知,反应生成1mol二氧化硫,反应转移6mol电子,故C正确;
D.由方程式可知,CuFeS2中铜元素的化合价降低被还原,硫元素的化合价升高被氧化,CuFeS2即是反应的氧化剂又是反应的还原剂,故D错误;
故选C。
4.D
【详解】A.该反应中Cu元素化合价由+2价变为+1价、S元素化合价由-1价变为+6价、-2价,Cu元素被还原、S元素既被氧化,又被还原,则FeS2既是氧化剂,又是还原剂,A错误;
B.根据元素化合价知,Cu2S只是还原产物,B错误;
C.FeS2中化合价升高的硫被氧化生成硫酸根离子,化合价降低的硫被还原生成Cu2S,则被氧化的S和被还原的S质量比为3:7,C错误;
D.1mol硫酸铜失去1mol电子,被硫酸铜氧化的S是mol,而1mol硫酸铜参加反应被氧化的硫是,所以被CuSO4氧化的硫占全部被氧化的硫的,D正确;
答案选D。
【点睛】本题考查了氧化还原反应的有关判断与计算,根据元素化合价变化来分析解答即可,注意FeS2中S元素化合价,明确FeS2的作用。选项D为易错点,主要是没有考虑到硫元素还发生自身的氧化还原反应,答题的关键是利用好电子得失守恒。
5.C
【详解】A.氯元素的最高价态为+7价,ClO2中氯元素的化合价为+4价,故ClO2不是氯的最高价氧化物,A项错误;
B.由题中叙述可知,ClO2的浓度不宜高于100mg·L 1,故在进行消毒作业时使用的ClO2溶液浓度不是越大越好,B项错误;
C.ClO2得电子能力强,且无三致、有三效,则ClO2杀菌力强,是一种比“84”性能更优越的消毒剂,C项正确;
D.分析题中所给信息,氧化还原反应中有元素的化合价升高和降低,Cl元素的化合价由+4价升高为+5价,则与NaOH反应还应生成NaCl,D项错误;
答案选C。
6.C
【详解】NiFe2O4中Fe的化合价为+3,O为-2价 ,根据化合物中元素化合价代数和为零的原则,设Ni的化合价为x,则可得等式x+(+3)2+(-2)=0,x=+2,则Ni的化合价为+2,故答案为C。
7.D
【详解】A.挤压塑料瓶能使浓硝酸进入干燥管与铜接触,引发反应,故A正确;
B.只需将装置口向上竖起,浓硝酸回流到锥形瓶,而铜片不能进入锥形瓶,可以停止反应,故B正确;
C.二氧化氮与碱反应生成亚硝酸盐和硝酸盐,所以蘸碱液的棉花可起到吸收NO2的作用,故C正确;
D.该装置适用于块状固体和液体反应,且不需要加热的气体的制备,而木炭与浓硫酸和浓硝酸都要加热才反应,故D错误;
故选D。
8.D
【详解】氧化钙不具有还原性,则生石灰不能用作食品抗氧剂,故A错误;
B.氯气与水反应生成具有强氧化性的次氯酸能起到杀菌消毒的作用,在国标范围内,氯气是可以用作自来水消毒剂,故B错误;
C.铝是活泼金属,能与醋酸反应而被腐蚀,所以不能用铝罐存储食醋,故C错误;
D.二氧化氯具有强的氧化性,能够起到杀菌消毒的作用,常作自来水消毒剂,故D正确;
故选
9.D
【分析】根据计算NaOH的物质的量,关系式为,据此计算S元素物质的量,再计算S元素质量,进而可计算质量分数。
【详解】,由反应的关系式可知,,则硫和铁组成的化合物中,则,故答案选D。
【点睛】当一种物质经过多个化学反应的变化时,按照化学方程式一步步的计算是非常繁琐的,甚至无法计算,这时要注意用守恒的思想进行解题。
10.B
【详解】S元素由Na2SO3中的+4价升高到Na2SO4中的+6价,X2的化合价只能降低,假设每个X2分子降低的价态是a,根据得失电子守恒,有a=2 × 2=4,所以每个X原子降低的价态数是2,X原来是0价,降低2个价态后是-2价,B项正确。
11.D
【详解】A.两者密度都比水小,均发生萃取,溴水层褪色,不能鉴别,故A错误;
B.两者都有沉淀生成,不能鉴别,故B错误;
C.两者均能与NaHCO3溶液反应,而且引入CO2,故C错误;
D.浓硝酸具有强氧化性,可与Cu反应生成NO2,故D正确;
故答案选C。
12.B
【分析】用终态分析法:只有两种元素的价态变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,根据电子转移守恒得,32gCu失去的电子等于HNO3到NaNO2得到的电子,计算产物中NaNO2的物质的量,由Na守恒可知n(NaOH)=n(NaNO2)+n(NaNO3),得n(NaNO3)。
【详解】n(Cu)==0.5mol,根据电子守恒生成n(NaNO2)==0.5mol,由钠原子守恒可知n(NaNO3)=0.7L×1mol·L-1-0.5mol=0.2mol,故选B。
13.A
【分析】KI-淀粉溶液变蓝,说明有I2存在,说明该物质中含有I2,或具有氧化性可以氧化KI得到I2。
【详解】A.SO2不能氧化KI,不能使淀粉KI试纸变蓝,故A选;
B.H2O2将KI氧化为I2,淀粉遇碘变蓝色,故B不选;
C.ClO2可将KI氧化为I2,淀粉遇碘变蓝色,故C不选;
D.碘酒中含有I2,淀粉遇碘变蓝色,故D不选;
故选A。
14.B
【详解】A.由反应方程式可知,氧化产物为Cl2,还原产物为MnCl2,氧化产物与还原产物的物质的量之比为5:2,故A错误;
B.每生成1molCl2时,反应中转移的电子为1mol×2×[0-(-1)]=2mol,故B正确;
C.元素的化合价降低,作氧化剂,高锰酸钾是氧化剂,氯气是氧化产物,所以KMnO4的氧化性强于Cl2的氧化性,故C错误;
D.由方程式可知,每消耗16molHCl,只有10mol失去电子,则其中作还原剂的HCl是10mol,高锰酸钾作氧化剂,氧化剂与还原剂的物质的量之比为2mol:10mol=1:5,故D错误;
故选B。
【点睛】在氧化还原反应中,作还原剂的物质并非只体现还原性,比如此题中HCl,既体现了还原性又体现了酸性。
15.D
【详解】A.K2FeO4具有强氧化性,可用于杀菌消毒,被还原为铁离子,水解生成氢氧化铁胶体,具有吸附性,可用于吸附水中的悬浮杂质,而明矾水解生成氢氧化铝胶体,只用于净水,不能杀菌消毒,则两者用作水处理剂的作用与明矾净水不完全相同,故A错误;
B.过量的铁屑与Cl2反应生成FeCl3 ,故B错误;
C.反应Ⅱ中铁元素化合价由+3价升高到+6价,则每生成1molNa2FeO4转移3mol电子,故C错误;
D.最后一步制取高铁酸钾的原因实际是利用了盐析的原理,相同温度下高铁酸钾的溶解度小于高铁酸钠的溶解度,侯氏制碱法中碳酸氢钠的溶解度小于碳酸钠,则两者析出原因相同,故D正确;
故选:D。
16. HBr MnBr2 0.8mol Fe+2H+=Fe2++H2↑ 4Fe2++O2+4H+=4Fe3++2H2O +1 H3PO4
【分析】(1)根据氧化还原反应的规律分析;
(2)铁粉在人体胃酸的作用下转化成亚铁盐,则铁与盐酸反应生成亚铁离子和氢气;Fe2+与氢离子和氧气反应生成铁离子和水;
(3)①H3PO2中元素化合价的代数和为零,进行求解;
②根据化合价升降总数相等进行判断。
【详解】(1)①高锰酸钾和氢溴酸反应,Mn的化合价降低,KMnO4作氧化剂,对应的产物为还原产物,为MnBr2;Br的化合价升高,HBr作还原剂;
②有0.8mol还原剂被氧化,化合价由-1变为0价,失去0.8mol电子;
(2)铁粉在人体胃酸的作用下转化成亚铁盐,则铁与盐酸反应生成亚铁离子和氢气,离子方程式为Fe+2H+=Fe2++H2↑;Fe2+与氢离子和氧气反应生成铁离子和水,则离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(3)①H3PO2中元素化合价的代数和为零,H为+1价,O为-2价,则P为+1价;
②H3PO2化合价升高,Ag+还原为Ag,化合价降低,作氧化剂,其物质的量为4,得4个电子,则H3PO2的计量数为1,失去4个电子,化合价变为+5价,产物为H3PO4。
【点睛】还原剂化合价升高,失去电子;氧化剂得电子,化合价降低,且得失电子总数相等。
17. 2Al3++7OH-= Al(OH)3↓+AlO+2H2O SO、NH Cu2+ Cr3+ Cr2O+6e-+14H+=2Cr3++ 7H2O NO2,NO NH3 NO+NO2+2NH3=2N2+3H2O
【详解】(1)0.1mol/L AlCl3溶液20mL含有0.002mol AlCl3,0.1mol/LNaOH 70mL溶液含有0.007molNaOH,0.002mol氯化铝先和0.006molNaOH反应生成0.002molAl(OH)3沉淀,之后剩余0.001molNaOH和Al(OH)3反应生成0.001mol偏铝酸钠,所以离子反应方程式为2Al3++7OH-= Al(OH)3↓+AlO+2H2O;
(2)根据方程式SO+I2+H2O=SO+2I-+2H+可知SO的还原性强于I-,滴加少量溴水后,溶液仍呈无色,说明有物质将Br2还原,但如果是I-,I-被氧化后会生成I2,溶液会先黄色,所以将Br2还原的是SO,即溶液中一定有SO,溶液无色则一定不含Cu2+,根据电中性原则可知一定还含有NH,综上所述一定有的是SO、NH,一定没有的是Cu2+;
(3)该反应中Cr元素由+6价变为+3价,所以还原产物为Cr3+,还原反应的过程为Cr2O得电子后结合氢离子生成Cr3+和H2O,根据电子守恒和元素守恒可得方程式为Cr2O+6e-+14H+=2Cr3++ 7H2O;
(4)该反应中NO2、NO与NH3反应生成N2,NO2、NO中N元素化合价降低被还原,所以氧化剂为NO2,NO;NH3中N元素化合价升高,发生氧化反应;
(5)NO2与NO的物质的量之比为1:1,则NO2与NO共降低6价,NH3升高3价,所以(NO2+NO)与NH3的系数比为1:2,再结合元素守恒可得化学方程式为NO+NO2+2NH3=2N2+3H2O。
18. 分液漏斗 Cu + 2H2SO4 (浓) CuSO4 + SO2↑+2H2O 还原 SO2+2OH = SO32 + H2O 将两支试管中的液体加热,恢复红色的通入的为SO2 Cl2+SO2+2H2O=H2SO4+2HCl
【分析】A中浓硫酸与铜在加热条件下反应生成二氧化硫和水、硫酸铜,二氧化硫具有漂白性,能够使B中品红溶液褪色,二氧化硫具有还原性,能够与C中高锰酸钾溶液褪色,二氧化硫有毒,多余的二氧化硫可以用D中氢氧化钠吸收,以此解答该题。
【详解】(1)由装置图可知仪器a为分液漏斗,故答案为:分液漏斗;
(2)浓硫酸具有强氧化性,加热条件下可与铜发生氧化还原反应,方程式为 ,
(3)高锰酸钾具有强氧化性,C中高锰酸钾褪色,说明二氧化硫具有还原性,故答案为:还原;
(4)过量NaOH溶液与SO2反应生成亚硫酸钠,离子方程式是SO2+2OH-=SO32-+H2O;
(5)二氧化硫的漂白效果具有不稳定性,加热可恢复到原来的颜色,则鉴别两种气体,可将两支试管中的液体加热,恢复红色的通入的为SO2,故答案为:将两支试管中的液体加热,恢复红色的通入的为SO2;
(6)氯气与二氧化硫发生氧化还原反应生成硫酸和盐酸,反应的方程式为Cl2+SO2+2H2O=H2SO4+2HCl。
19.(1) Cu+2H2SO4CuSO4+SO2↑+2H2O 酒精灯
(2)adefgb
(3)吸收SO2防止空气污染;防止空气中的水蒸气进入D中干扰实验
(4)防止浓硝酸分解(或挥发)而减少产率
(5)3NOSO4H+2H2O=3H2SO4+HNO3+NO↑
(6) 溶液由无色变为浅红色(或紫色),且半分钟不褪色 63.5%
【分析】在装置A中用Na2SO3与浓H2SO4发生复分解反应制取SO2,由于亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解,因此制取的SO2气体需经装置C中浓硫酸的干燥作用,将气体通入D中,与浓硝酸在浓硫酸催化下反应产生NOSO4H,由于SO2是大气污染物,同时硝酸有挥发性,挥发的硝酸蒸气及未反应的SO2气体可以使用B中碱石灰进行吸收,防止大气污染。
(1)
铜粉与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式为Cu+2H2SO4CuSO4+SO2↑+2H2O,还缺少酒精灯。
(2)
在装置A中制取SO2气体,在装置C中干燥SO2,导气管连接应该是长进短出,然后使SO2气体由f通入D装置中,在装置D中发生反应制取NOSO4H,为防止NOSO4H水解变质,再连接B装置,挥发的硝酸蒸气及未反应的SO2气体用B装置的碱石灰进行吸收,故按气流从左到右的顺序,上述仪器接口的连接顺序为adefgb。
(3)
装置B的作用吸收SO2防止空气污染;防止空气中的水蒸气进入D中干扰实验。
(4)
为防止浓硝酸分解(或挥发)而减少产率,D使用的是冷水浴。
(5)
NOSO4H与水遇水分解成硫酸、硝酸和一氧化氮,故反应的化学方程式为3NOSO4H+2H2O=3H2SO4+HNO3+NO↑。
(6)
①当最后一滴KMnO4标准溶液滴入时,溶液由无色变为浅红色(或紫色),且半分钟不褪色,即达到滴定终点。
②消耗KMnO4标准溶液的物质的量n=cV=0.20mol/L×0.025L=0.005mol,根据反应可得NOSO4H的物质的量为0.0125mol,故纯度为×100%=63.5%。
20. 2×6.02×1023或2mol 1.33mol 1:2
【详解】①根据反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O和Zn+H 2SO4=ZnSO4+H2↑可知,不管生成1molSO2还是生成1molH2均需转移2mol电子,故有:n(e-)=2n(气体)=2×=2mol,故转移电子数为2×6.02×1023或2mol,故答案为:2×6.02×1023或2mol;
②18.3mol/L的H2SO4 中含有硫酸的物质的量为:n(H2SO4)浓=0.1L×18.3mol/L=1.83mol;剩余硫酸的物质的量为:n(H2SO4)剩 =n(H+)=×1L×1.0mol/L=0.5mol;消耗硫酸的物质的量为:n(H2SO4)消耗 =1.83mol-0.5mol=1.33mol, 故答案为:1.33mol;
③锌与浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H 2SO4=ZnSO4+H2↑, 生成气体为SO2和H2的混合物,物质的量为 22.4L÷22.4L/mol=1mol ,设混合物气体中含有xmolSO2 ,ymolH2 ,则发生反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O消耗硫酸物质的量为2xmol,发生反应Zn+H 2SO4=ZnSO4+H2↑消耗硫酸物质的量为ymol,则有x+y=1、2x+y=1.33,解得:x=0.33 、y=0.67 ,所以V(SO2):V(H2)=x:y=0.33:67=1:2,故答案为:1:2。
21. 、 0.250
【分析】由溶液中含有0.0500 mol次氯酸钠可知,氢气在氯气中燃烧时,氯气过量,反应得到氯化氢和氯气的混合气体。
【详解】(1)氯化氢和氯气的混合气体被氢氧化钠溶液吸收时,氯化氢与氢氧化钠溶液发生中和反应生成氯化钠和水,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为OH—+H+= H2O,Cl2+2OH—=Cl—+ClO—+H2O,故答案为OH—+H+= H2O,Cl2+2OH—=Cl—+ClO—+H2O;
(2)根据溶液电中性原则可知:n(Na+)=n(Cl-)+n(ClO-),n(Cl-)=n(Na+)-n(ClO-)=0.1L×3.00mol/L-0.0500mol=0.250mol,则所得溶液中NaCl的物质的量为0.250mol,故答案为0.250;
(3)根据Cl原子守恒可知,n(Cl2)=×n(NaOH)=0.15mol,由氯气与氢氧化钠溶液反应的化学方程式可知,生成0.0500 mol次氯酸钠消耗过量氯气0.0500 mol,则与氢气反应的氯气为0.15mol-0.05mol=0.1mol,氢气在氯气中燃烧的化学方程式为H2+Cl22HCl,由化学方程式可知氢气的物质的量为0.1mol,故氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2,故答案为3:2。
【点睛】所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,根据钠元素及氯元素守恒可知2n(Cl2)=n(Na+)=n(Cl-)+n(ClO-);根据电子转移守恒,计算氯气发生氧化还原反应生成的氯离子的物质的量,溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,计算反应后混合气体中氯化氢的物质的量,根据氢元素守恒计算氢气的物质的量是解答关键。
