第2章 化学反应的方向、限度与速率 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 684.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 20:19:59 | ||
图片预览



文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题
1.一定条件下,反应2SO2+O22SO3在密闭容器中进行。下列有关说法错误的是( )
A.使用催化剂能增大反应速率
B.达到反应限度后,各物质的浓度不再变化
C.该条件下,SO2能全部转化为SO3
D.增大O2的浓度可加快SO2的反应速率
2.在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:NO2+SO2NO+SO3,达到平衡时,下列叙述正确的是
A.SO2、NO2、NO、SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.平衡体系中总物质的量一定等于反应开始时总物质的量
D.NO和SO3的物质的量一定不相等
3.蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1,标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法不正确的是
A.该反应的ΔS>0
B.ΔH2<-41.8kJ·mol-1
C.SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态
D.标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×1023
4.下列说法正确的是
A.C(石墨,s)=C(金刚石,s) H>0,说明反应物总键能大于生成物总键能
B.H2(g)的燃烧热 H=-285.8kJ/mol,则2H2O(g)=2H2(g)+O2(g) H=+571.6kJ/mol
C.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) H=-57.3kJ/mol,则稀硫酸与氢氧化钡稀溶液反应生成1mol水时放出57.3kJ的热量
D.增大压强,加快反应速率,是因为提高了活化分子百分比
5.用如图所示实验装置进行相应实验,不能达到实验目的的是
A B C D
探究温度对反应平衡的影响 测定酸碱中和反应的反应热 验证FeCl3对H2O2分解反应有催化作用 除去CO2气体中混有的HCl
A.A B.B C.C D.D
6.以下说法中正确的是
A.冰在室温下自动熔化成水,是熵增的过程
B.高锰酸钾加热分解是一个熵减小的过程
C.放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的
D.自发进行的反应一定能迅速进行
7.一定温度下H2(g)与I2(g)反应,生成HI(g),反应的能量变化如图所示。对下对该反应体系的描述中,正确的是
A.该反应正反应的活化能大于逆反应的活化能
B.反应物的总能量比生成物的总能量低13 kJ
C.反应物化学键中储存的总能量比生成物化学键中储存的总能量低
D.从图中可知氢气的燃烧热为13 kJ/mol
8.下列实验过程可以达到实验目的的是
编号 实验目的 实验过程
A 探究浓度对反应速率的影响 分别向2支盛有等体积、等浓度的FeCl3和CuCl2溶液的试管中同时加入2 mL5%H2O2溶液
B 制备无水Fe(OH)3 胶体 加热饱和FeCl3溶液至出现红褐色沉淀
C 探究温度对化学反应速率的影响 将等浓度的Na2S2O3和H2SO4等体积混合,平均分成两份,一份置于热水中,一份置于冷水中,记录出现浑浊的时间
D 比较金属的活泼性 向两只盛有稀硫酸的烧杯中分别投入铜丝和银丝
A.A B.B C.C D.D
9.与在催化剂(简写为)表面催化生成和的历程示意图如下。下列说法正确的是
A.该反应的
B.正反应的活化能大于逆反应的活化能
C.羟基磷灰石(HAP)的作用是降低反应的活化能
D.反应过程中有极性共价键和非极性共价键的断裂和形成
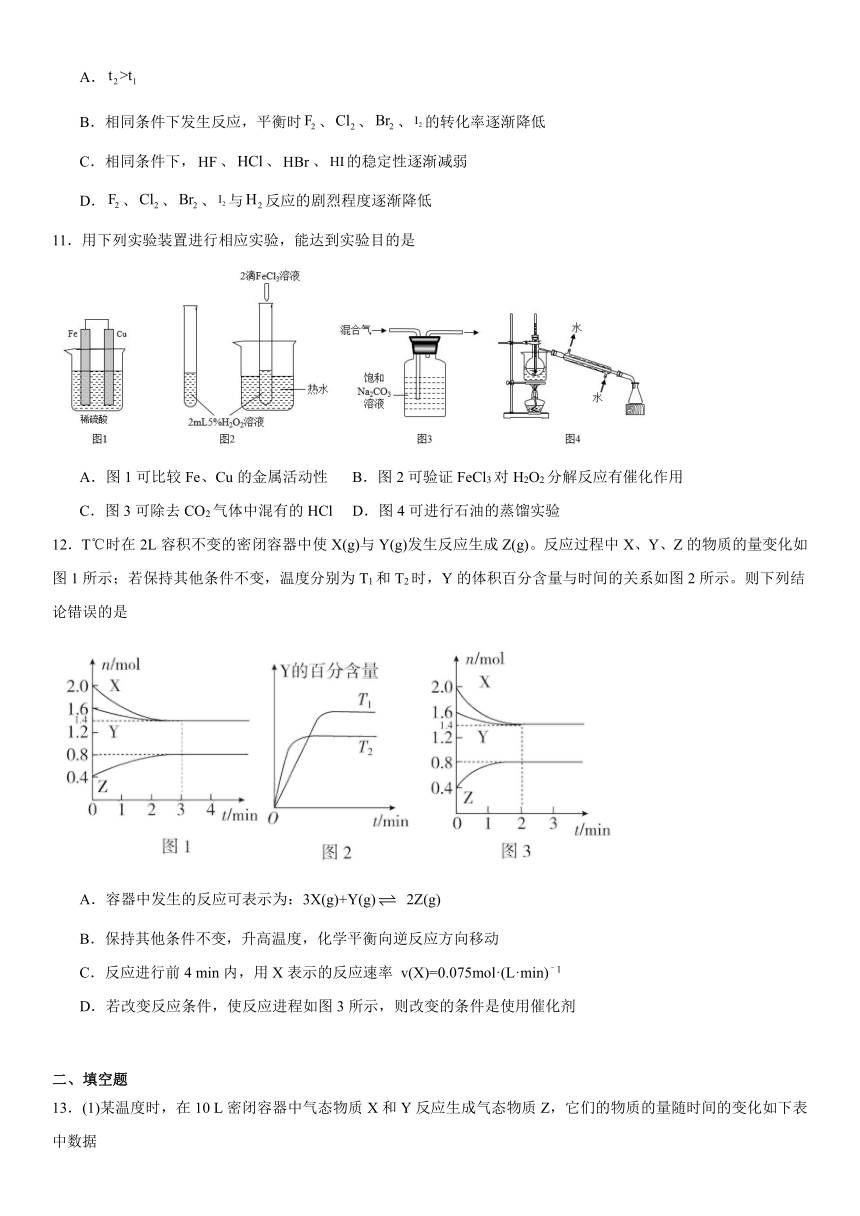
10.在温度t1和t2下,发生反应:。仅依据平衡常数(K)的变化,不能解释下列事实的是(代表卤族元素单质)
化学方程式
43 34
A.
B.相同条件下发生反应,平衡时、、、的转化率逐渐降低
C.相同条件下,、、、的稳定性逐渐减弱
D.、、、与反应的剧烈程度逐渐降低
11.用下列实验装置进行相应实验,能达到实验目的是
A.图1可比较Fe、Cu的金属活动性 B.图2可验证FeCl3对H2O2分解反应有催化作用
C.图3可除去CO2气体中混有的HCl D.图4可进行石油的蒸馏实验
12.T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
B.保持其他条件不变,升高温度,化学平衡向逆反应方向移动
C.反应进行前4 min内,用X表示的反应速率 v(X)=0.075mol·(L·min)﹣1
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
二、填空题
13.(1)某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表中数据
t/min X/mol Y/mol Z/mol
0 1.00 2.00 0.00
1 0.90 1.80 0.20
3 0.75 1.50 0.50
5 0.65 1.30 0.70
9 0.55 1.10 0.90
10 0.55 1.10 0.90
14 0.55 1.10 0.90
①体系中发生反应的化学方程式是
②该反应在0~5 min时间内产物Z的平均反应速率: ;
③该反应达到平衡时反应物X的转化率α等于 。
(2)在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度 ;
②加入催化剂 ;
③充入更多的H2 ;
④保持容器中压强不变,充入氖气 ;
⑤保持容器容积不变,通入氖气 ;
⑥保持压强不变,充入2x mol H2(g)和2y mol I2(g) 。
14.根据氨的合成反应的特点,应分别采取什么措施提高该反应的平衡转化率和反应速率?将有关建议填入表格中。
提高反应的转化率 提高反应速率
性质 措施 性质 措施
放热 活化能高
分子数减小 低温时反应速率低
反应可逆 原料气浓度增大能提高反应速率
氨气浓度增加能降低反应速率
15.工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
0.1个大气压 0.5个大气压 1个大气压 10个大气压
400 99.2 99.6 99.7 99.9
500 93.5 96.9 97.8 99.3
600 73.7 85.8 89.5 96.4
(1)SO2的氧化反应是 反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是 。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度 。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量 。(填“增大”或“减小”)
16.研究CO2与CH4反应使之转化为CO 和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知该转化反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH,为加快该反应的化学反应速率,应采用的有效措施有 (填写两种)。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。
①由图可知,该反应的ΔH 0 (填写“大于”或者“小于”),P1、P2、P3、P4由大到小的顺序为 。
②工业生产时一般会选用P4和1250℃进行合成,请解释其原因 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 mol·L-1·min-1。
④1100℃的条件下,反应的平衡常数K的表达式为K= ,经计算K的数值为K= (保留3位有效数字),若要使K减小可采取的措施是 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是
A.H2、CO和H2O的物质的量之比为1:1:1 B.体系压强不再变化
C. 气体平均相对分子质量不变 D.混合气体的密度保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2mol H2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为 。
17.已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化和化学平衡的移动方向。
t1时刻,增大反应物浓度,使v′正增大,而v′逆不变,则v′正>v′逆,平衡向正反应方向移动。请参照上图,画出t1时刻,减小反应物浓度,其反应速率的变化,并分析化学平衡的移动方向。
18.B卷题.汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是 (填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体的总压强不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图(t—时间、T—温度)中变化趋势正确的是 (填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数 (填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应 (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是 。(写出必要的计算过程)
19.汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2 L密闭容器中充入N2和O2各1 mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应 (填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是 。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大”、“变小”或“不变”)。
判断正误
20.ΔH<0,ΔS>0的反应在温度低时不能自发进行。(_______)
21.一定温度下,反应MgCl2(l)Mg(l)+Cl2(g)的ΔH>0、ΔS>0。(_______)
22.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0。(_______)
23.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0。(_______)
24.SO2(g)=S(g)+O2(g) ΔH>0,ΔS>0,该反应不能自发进行。(_______)
25.SO2(g)+2H2S(g)=3S(s)+2H2O(l) ΔH<0,低温下能自发进行。(_______)
26.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0。(_______)
27.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向。(_______)
28.放热过程有自发进行的倾向性,但并不一定能自发进行,吸热过程没有自发进行的倾向性,但在一定条件下也可自发进行。(_______)
29.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向。(_______)
30.在T℃时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始的关系如图所示:(分压=总压×物质的量分数)
(1)起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)= mol/(L·min)。
(2)b点时反应的平衡常数Kp= (kPa)-1(以分压表示)。
(3)c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率 (填“增大”“不变”或减小”)。
试卷第1页,共3页
参考答案:
1.C
【详解】A.使用催化剂能增大反应速率,缩短反应时间,提高反应速率,故A正确;
B.达到反应限度后,即化学平衡状态,各物质的浓度不再变化,故B正确;
C.因为该反应是可逆反应,存在反应限度,SO2不可能全部转化为SO3,故C错误;
D.增大O2的浓度,平衡正向移动,可加快SO2的反应速率,故D正确;
答案选:C。
2.C
【详解】A.平衡时,O2、NO2、NO、SO3的物质的量不变,但不一定相等,故A错误;
B.NO2和SO2是按1:1关系反应的,若反应开始时加入的二者的物质的量不等,则平衡时NO2和SO2的物质的量不等,与起始投料量有关,若加入的二者的物质的量相等,则平衡时二者的物质的量相等,故B错误;
C.两边气体的计量数相等,所以体系中的总物质的量一定等于反应开始时总物质的量,故C正确;
D.根据方程式,因为NO和SO3 的物质的量之比为1:1,反应从正反应方向开始,所以平衡NO和SO3的物质的量一定相等,故D错误;
答案选C。
3.A
【详解】A.由反应可知,标准状况下,反应生成固体,气体分子数减少,ΔS<0,故A错误;
B.同种物质的气态能量高于固体,则在标准状况下该反应放热更多,则ΔH2<ΔH1,故B正确;
C.SO2的生成速率是逆反应速率,NO2的消耗速率是正反应速率,速率之比等于化学计量数之比,说明反应达到正反应速率等于逆反应速率,反应达到平衡,故C正确;
D.由反应可知每生成1molNO转移2mol电子,标况下22.4LNO为1mol,转移电子数目为2NA,故D正确;
故选:A。
4.A
【详解】A.断键需要吸收热量,成键需要释放热量,反应为吸热反应,说明反应物总键能大于生成物总键能,A正确;
B.燃烧热为1mol可燃物完全燃烧生成指定物质所放出的热量,正反应为放热反应,则逆反应为吸热反应,则2H2O(l)=2H2(g)+O2(g) H=+571.6kJ/mol,B错误;
C.稀硫酸与氢氧化钡反应生成水和硫酸钡沉淀,反应实质不相符,C错误;
D.增大压强,导致单位体积内活化分子个数增多,活化分子百分比没有增大,D错误;
答案选A。
5.B
【详解】A.将NO2气体的平衡球一个放在热水中,一个放入冷水中,通过观察NO2气体颜色深浅变化判断温度对平衡的影响,A能达到实验目,A不符合题意;
B.为了使反应液充分混合,要使用玻璃搅拌器进行搅拌,图示的测定中和反应的反应热的装置中缺少玻璃搅拌器,不能达到实验目的,B符合题意;
C.采用对照方法进行实验,可以探究FeCl3对H2O2分解反应有催化作用,能达到实验目的,C不符合题意;
D.HCl能够与NaHCO3反应产生CO2气体,而CO2难溶于饱和NaHCO3溶液,也不能发生反应,因此可以达到除杂净化的目的,D不符合题意;
故合理选项是B。
6.A
【详解】A.冰自动熔化成水,同一物质的相同质量的固态转化为液态,是熵增的过程,A正确;
B.高锰酸钾加热分解生成三种物质,是固体反应生成气体,属于熵增大的过程,B错误;
C.放热过程或熵增过程可能需要达到某一条件才能自发进行,C错误;
D.自发进行的反应可能是很慢的,比如食物的腐败,D错误;
故选A。
7.C
【详解】A. 该反应正反应的活化能小于逆反应的活化能,A错误;
B. 该反应为放热反应,反应物的总能量比生成物的总能量高,B错误;
C. 该反应为放热反应,反应物化学键中储存的总能量比生成物化学键中储存的总能量低,C正确;
D. 氢气的燃烧热为1mol氢气和氧气反应充分燃烧生成液态水时放出的热量,D错误;
答案选C。
8.C
【详解】A.只有催化剂不同,可探究催化剂对反应速率的影响,故A错误;
B.制备Fe(OH)3 胶体的方法是向沸水中加入饱和FeCl3溶液并煮沸至有红褐色胶状物出现为止,故B错误;
C.只有温度不同,可探究温度对反应速率的影响,故C正确;
D.Cu、Ag与稀硫酸均不反应,不能比较二者金属的活泼性,故D错误;
答案选C。
9.C
【详解】A.反应物能量大于生成物的能量,反应为放热反应,A错误;
B.由图可知正反应的活化能小于逆反应的活化能,B错误;
C.催化剂可以改变反应历程,降低反应的活化能,加快反应速率,C正确;
D.反应中存在碳氢极性键、氧氧非极性键的断裂;存在氢氧极性键、碳氧极性键的生成,不存在非极性键的生成,D错误;
故选C。
10.D
【详解】A.正反应方向为放热反应,则升高温度平衡逆向移动,平衡常数K减小,对比同一反应K数据可知,K(t1)>K(t2),则t2>t1,A正确;
B.K值越大,反应正向进行的程度越大,转化率越高,则相同条件下发生反应,平衡时 F2 、 Cl2 、 Br2 、 I2 的转化率逐渐降低,B正确;
C.K值越小,反应的正向程度越小,说明生成物越不稳定,越易分解,随着核电荷数增大,K值减小,则相同条件下, HF 、 HCl 、 HBr 、 HI 的稳定性逐渐减弱,C正确;
D.反应的剧烈程度与K值大小无关,D错误;
故选D。
11.A
【详解】A.图1为原电池装置,原电池中负极金属比正极金属活泼,因此可用来比较Fe、Cu的金属活动性,故A正确;
B.验证催化剂对反应的影响应控制温度相同,而图2中两试管的温度不同,故B错误;
C.饱和碳酸钠溶液能与二氧化碳反应,不能用饱和碳酸钠液除去二氧化碳中的HCl,因选用饱和碳酸氢钠溶液,故C错误;
D.蒸馏时温度计的水银球应处于支管口处,故D错误;
故选:A。
12.B
【详解】A.由图1可知,X、Y的物质的量减小,为反应物,△n(X)=2.0mol﹣1.4mol=0.6mol,△n(Y)=1.6mol﹣1.4mol=0.2mol,Z的物质的量增大,为生成物,△n(Z)=0.8mol﹣0.4mol=0.4mol,故X、Y、Z的化学计量数之比为0.6mol:0.2mol:0.4mol=3:1:2,反应最后各物质的物质的量不变,为可逆反应,故该反应为3X(g)+Y(g)2Z(g),故A正确;
B.由图2可知,温度T2到达平衡需要的时间较短,故T2>T1,温度越高Y的含量降低,升高温度平衡向正反应方向移动,说明正反应是吸热反应,故B错误;
C.由图1可知,3min时反应达平衡,X的物质的量变化量为2.0mol﹣1.4mol=0.6mol,故v(X)==0.075mol·(L·min)﹣1,故C正确;
D.图3与图1相比,平衡时各组分的物质的量不变,到达平衡时间缩短,说明改变条件,增大反应速率,平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是增大压强,故改变条件是使用催化剂,故D正确;
故选B。
13. X(g)+2Y(g) 2Z(g) 0.014 mol/(L·min) 45% 增大 增大 增大 减小 不变 不变
【分析】(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,物质的量变化量之比等于化学计量数之比,故反应方程式为X+2Y 2Z.
①根据物质的量的变化与化学计量数呈正比书写化学方程式;
②依据化学反应速率= c÷ t,结合图表数据计算;
③依据图表数据分析当反应进行到9min时反应已达到平衡,转化率等于消耗量除以原来起始量;
(2)根据增大浓度、增大压强、使用催化剂,反应速率加快,反之反应速率减慢来解答,注意反应体系中各物质的浓度不变,则反应速率不变。
【详解】(1)①由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反应方程式为X+2Y 2Z,
故答案为X+2Y 2Z;
②0-5min内Z的反应速率= c÷ t=0.7mol÷10L÷5min=0.014mol L-1 min-1,故答案为0.014mol L-1 min-1;
③由图表数据可知反应到9min,反应达到平衡,反应达到平衡时反应物X的转化率α=(1.0mol-0.55mol)÷1.0mol×100%=45%,故答案为45%;
(2)①升高温度,反应速率增大,故答案为增大;
②加入催化剂,反应速率增大,故答案为增大;
③再充入H2,反应物浓度增大,化学反应速率增大,故答案为增大;
④容器中压强不变,充入氖气,则容器容积扩大,相当于减小压强,则反应速率减小,故答案为减小;
⑤容器容积不变,通入氖气,反应体系中各物质的浓度不变,则反应速率不变,故答案为不变;
⑥保持压强不变,充入2xmolH2(g)和2ymolI2(g),各物质的浓度保持不变,所以速率不变,故答案为不变。
14. 低温 使用合适催化剂 高压 高温 原料循环利用 增大原料气浓度 分离出氨气
【解析】略
15. 放热 1个大气压、400-500℃(或400℃) 否 减小 减小
【分析】本题结合了硫酸的工业制取和化学平衡的相关知识,须注意工业流程除了要考虑转化率以外,成本和反应速率也是重要的考量因素,据此来逐项分析即可。
【详解】(1)绝大多数的化合反应都是放热的,绝大多数的分解反应都是吸热的,因此二氧化硫的氧化反应是放热的;
(2)先来看温度,400℃到500℃的转化率都比较高,适当提高温度虽然会牺牲一些转化率,但是可以显著提高反应速率;再来看压强,压强越大固然转化率越高,但是10个大气压对设备的要求较高,生产成本也会提升,产生的额外收益却不显著,因此选1个大气压即可;
(3)催化剂不改变平衡常数,因此不提高转化率;
(4)通入氧气相当于提高反应物的浓度,平衡会正向移动,因此二氧化硫的浓度减小;
(5)保持压强不变充入氦气,容器的体积增大,各气体的浓度降低,平衡要向气体分子数增大的方向移动,即逆向移动,因此三氧化硫的含量减小。
【点睛】针对与有气体参与的可逆反应,如果反应达到平衡后,在等温等容条件下,再充入和反应无关的气体,各物质浓度不变,速率不变,平衡不移动;在等温等压条件下,充入和反应无关的气体,等效于减压过程,各物质浓度减小,速率减慢,平衡向着气体体积增大的方向移动。
16. 使用催化剂;升温;增大反应物浓度;增大压强 大于 P4>P3>P2>P1 较大的压强和温度能加快合成速率,提高生产效率 0.032 1.64 降温 BCD 逆 12g/mol
【详解】(1)加快反应的化学反应速率,可以采用的有效措施有使用催化剂;升温;增大反应物浓度;增大压强等,故答案为使用催化剂;升温;增大反应物浓度;增大压强;
(2)①由图可知,升高温度,CH4的平衡转化率增大,平衡正向移动,正反应为吸热反应,ΔH大于0;温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故答案为大于;P4>P3>P2>P1;
②较大的压强和温度能加快合成速率,提高生产效率,工业生产时一般会选用P4和1250℃进行合成,故答案为较大的压强和温度能加快合成速率,提高生产效率;
③由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,故v(CH4)= =0.016mol/(L min),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH4)=2×0.16mol/(L min)=0.032mol/(L min),故答案为0.032;
④ CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k===1.64,若要使K减小,需要平衡逆向移动,由于K只与温度应该,可以采取的措施是降温,故答案为;1.64;降温;
(3)①A、H2、CO和H2O的物质的量之比为1:1:1,CO与H2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故A错误;B、正反应方向是个气体体积增大的方向,故随着反应的进行,平衡之前,体系压强会增大,故一旦当体系压强不变,说明反应达平衡,故B正确;C、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,故C正确;D、混合气体的密度ρ=,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故D正确;故选BCD;
②根据勒沙特列原理可知,增大压强,平衡向着气体体积减小的方向移动,此反应的逆反应方向是个气体体积减小的方向,故增大压强,向逆反应方向移动;在第2min时,混合气体的平均相对分子质量即平均摩尔质量===12g/mol,故答案为逆;12g/mol。
17.
t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动。
【详解】t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动,图像为。
18. 0.05 mol·(L·min)-1 A、D A、C 不变 向正反应方向进行 根据计算得浓度商Qc<K
【分析】(1)、5分钟内,△n (O2) =1mol-0.5mol=0.5mol,由N2(g)+O2(g) 2NO(g) ΔH>0,可知△n (N2) =0. 5mol,带入计算;
(2)、可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)、根据温度、催化剂对反应速率和平衡移动的影响判断;
(4)、根据化学方程式的特点结合压强对平衡的影响分析;
(5)、计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论。
【详解】(1)、5分钟内,△n (O2) =1mol-0.5mol=0.5mol,由N2(g)+O2(g) 2NO(g) ΔH>0,可知△n (N2) =0. 5mol,,
故答案为0.05 mol·(L·min)-1;
(2)A、消耗1 mol N2同时生成1 mol O2, A达到平衡;
B、混合气体密度一直不变,故不能衡量是否达到平衡;
C、混合气体平均相对分子质量不变,总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故不能衡量是否达到平衡;
D、2v正(N2)=v逆(NO), 正逆反应速率相等,达到平衡;
故选AD;
(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为AC;
(4)、该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数;
故答案为不变;
(5)、该温度下, 某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:,则反应应向正反应方向进行,
故答案为向正反应方向进行; 根据计算得浓度商Qc<K。
19. 4 向正方向进行 此时的浓度商小于K 不变
【详解】(1)对应反应:N2(g)+O2(g) 2NO(g),按定义,该反应的平衡常数表达式为。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,,平衡时,,a=0.04mol,N2的转化率是;故答案为:4。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10 1 mol L 1、4.0×10 2 mol L 1和3.0×10 3 mol L 1,,因此反应向正方向进行。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态,可以理解为先向另外一个容器中充入一定量NO,达到平衡,两者NO的体积分数相等,将另外一个容器压入到开始容器中,故等效于加压,由于反应前后气体体积不变,加压平衡不移动,因此平衡混合气中NO的体积分数不变。
20.错误 21.正确 22.正确 23.错误 24.错误 25.正确 26.正确 27.错误 28.正确 29.正确
【解析】20.ΔH<0,ΔS>0的反应,所有温度下△H-T△S<0,反应自发进行,故错误;
21.一定温度下,反应MgCl2(l)Mg(l)+Cl2(g)是吸热反应ΔH>0,气体分子数增大的反应ΔS>0,故正确;
22.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行△H-T△S<0,,又△S<0,则该反应的ΔH<0,故正确;
23.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行△H-T△S<0,,又△S<0,则该反应的ΔH<0,故错误;
24.SO2(g)=S(g)+O2(g) ΔH>0,ΔS>0,该反应在高温下能自发进行,故错误;
25.SO2(g)+2H2S(g)=3S(s)+2H2O(l) ΔH<0,又△S<0,低温下能自发进行,故正确;
26.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,△H-T△S>0,ΔS>0,则该反应的ΔH>0,故正确;
27.在其他外界条件不变的情况下,使用催化剂只改变反应速率,不影响平衡的移动,使用催化剂不可以改变化学反应进行的方向,故错误;
28.放热过程有自发进行的倾向性,但并不一定能自发进行,吸热过程没有自发进行的倾向性,但在一定条件下也可自发进行,还要看△H-T△S的值,故正确;
29.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=185.57 kJ·mol-1,该反应为吸热反应,不能自发进行;而最终该反应能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故正确;
30.(1)0.1
(2)
(3)不变
【详解】(1)起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,c点HCHO的物质的量为x,=,x=0.5mol,则反应消耗氢气的物质的量为1mol,v(H2)==0.1mol/(L·min);
故答案为:0.1。
(2)
C点时,甲醛的压强为0.2pkPa,则二氧化碳的压强为0.2pkPa、氢气的压强为0.4pkPa、水蒸气的压强为0.2pkPa,b点和c点温度相同,平衡常数相同,反应的平衡常数Kp===kPa-1;
故答案为:。
(3)c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,Q==kPa-1=Kp,平衡不移动,则H2的转化率不变;
故答案为:不变
一、单选题
1.一定条件下,反应2SO2+O22SO3在密闭容器中进行。下列有关说法错误的是( )
A.使用催化剂能增大反应速率
B.达到反应限度后,各物质的浓度不再变化
C.该条件下,SO2能全部转化为SO3
D.增大O2的浓度可加快SO2的反应速率
2.在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:NO2+SO2NO+SO3,达到平衡时,下列叙述正确的是
A.SO2、NO2、NO、SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.平衡体系中总物质的量一定等于反应开始时总物质的量
D.NO和SO3的物质的量一定不相等
3.蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1,标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法不正确的是
A.该反应的ΔS>0
B.ΔH2<-41.8kJ·mol-1
C.SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态
D.标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×1023
4.下列说法正确的是
A.C(石墨,s)=C(金刚石,s) H>0,说明反应物总键能大于生成物总键能
B.H2(g)的燃烧热 H=-285.8kJ/mol,则2H2O(g)=2H2(g)+O2(g) H=+571.6kJ/mol
C.已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) H=-57.3kJ/mol,则稀硫酸与氢氧化钡稀溶液反应生成1mol水时放出57.3kJ的热量
D.增大压强,加快反应速率,是因为提高了活化分子百分比
5.用如图所示实验装置进行相应实验,不能达到实验目的的是
A B C D
探究温度对反应平衡的影响 测定酸碱中和反应的反应热 验证FeCl3对H2O2分解反应有催化作用 除去CO2气体中混有的HCl
A.A B.B C.C D.D
6.以下说法中正确的是
A.冰在室温下自动熔化成水,是熵增的过程
B.高锰酸钾加热分解是一个熵减小的过程
C.放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的
D.自发进行的反应一定能迅速进行
7.一定温度下H2(g)与I2(g)反应,生成HI(g),反应的能量变化如图所示。对下对该反应体系的描述中,正确的是
A.该反应正反应的活化能大于逆反应的活化能
B.反应物的总能量比生成物的总能量低13 kJ
C.反应物化学键中储存的总能量比生成物化学键中储存的总能量低
D.从图中可知氢气的燃烧热为13 kJ/mol
8.下列实验过程可以达到实验目的的是
编号 实验目的 实验过程
A 探究浓度对反应速率的影响 分别向2支盛有等体积、等浓度的FeCl3和CuCl2溶液的试管中同时加入2 mL5%H2O2溶液
B 制备无水Fe(OH)3 胶体 加热饱和FeCl3溶液至出现红褐色沉淀
C 探究温度对化学反应速率的影响 将等浓度的Na2S2O3和H2SO4等体积混合,平均分成两份,一份置于热水中,一份置于冷水中,记录出现浑浊的时间
D 比较金属的活泼性 向两只盛有稀硫酸的烧杯中分别投入铜丝和银丝
A.A B.B C.C D.D
9.与在催化剂(简写为)表面催化生成和的历程示意图如下。下列说法正确的是
A.该反应的
B.正反应的活化能大于逆反应的活化能
C.羟基磷灰石(HAP)的作用是降低反应的活化能
D.反应过程中有极性共价键和非极性共价键的断裂和形成
10.在温度t1和t2下,发生反应:。仅依据平衡常数(K)的变化,不能解释下列事实的是(代表卤族元素单质)
化学方程式
43 34
A.
B.相同条件下发生反应,平衡时、、、的转化率逐渐降低
C.相同条件下,、、、的稳定性逐渐减弱
D.、、、与反应的剧烈程度逐渐降低
11.用下列实验装置进行相应实验,能达到实验目的是
A.图1可比较Fe、Cu的金属活动性 B.图2可验证FeCl3对H2O2分解反应有催化作用
C.图3可除去CO2气体中混有的HCl D.图4可进行石油的蒸馏实验
12.T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
B.保持其他条件不变,升高温度,化学平衡向逆反应方向移动
C.反应进行前4 min内,用X表示的反应速率 v(X)=0.075mol·(L·min)﹣1
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
二、填空题
13.(1)某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表中数据
t/min X/mol Y/mol Z/mol
0 1.00 2.00 0.00
1 0.90 1.80 0.20
3 0.75 1.50 0.50
5 0.65 1.30 0.70
9 0.55 1.10 0.90
10 0.55 1.10 0.90
14 0.55 1.10 0.90
①体系中发生反应的化学方程式是
②该反应在0~5 min时间内产物Z的平均反应速率: ;
③该反应达到平衡时反应物X的转化率α等于 。
(2)在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度 ;
②加入催化剂 ;
③充入更多的H2 ;
④保持容器中压强不变,充入氖气 ;
⑤保持容器容积不变,通入氖气 ;
⑥保持压强不变,充入2x mol H2(g)和2y mol I2(g) 。
14.根据氨的合成反应的特点,应分别采取什么措施提高该反应的平衡转化率和反应速率?将有关建议填入表格中。
提高反应的转化率 提高反应速率
性质 措施 性质 措施
放热 活化能高
分子数减小 低温时反应速率低
反应可逆 原料气浓度增大能提高反应速率
氨气浓度增加能降低反应速率
15.工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
0.1个大气压 0.5个大气压 1个大气压 10个大气压
400 99.2 99.6 99.7 99.9
500 93.5 96.9 97.8 99.3
600 73.7 85.8 89.5 96.4
(1)SO2的氧化反应是 反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是 。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度 。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量 。(填“增大”或“减小”)
16.研究CO2与CH4反应使之转化为CO 和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知该转化反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH,为加快该反应的化学反应速率,应采用的有效措施有 (填写两种)。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。
①由图可知,该反应的ΔH 0 (填写“大于”或者“小于”),P1、P2、P3、P4由大到小的顺序为 。
②工业生产时一般会选用P4和1250℃进行合成,请解释其原因 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 mol·L-1·min-1。
④1100℃的条件下,反应的平衡常数K的表达式为K= ,经计算K的数值为K= (保留3位有效数字),若要使K减小可采取的措施是 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是
A.H2、CO和H2O的物质的量之比为1:1:1 B.体系压强不再变化
C. 气体平均相对分子质量不变 D.混合气体的密度保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2mol H2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为 。
17.已知反应:mA(g)+nB(g)pC(g),当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化和化学平衡的移动方向。
t1时刻,增大反应物浓度,使v′正增大,而v′逆不变,则v′正>v′逆,平衡向正反应方向移动。请参照上图,画出t1时刻,减小反应物浓度,其反应速率的变化,并分析化学平衡的移动方向。
18.B卷题.汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为 。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是 (填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体的总压强不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图(t—时间、T—温度)中变化趋势正确的是 (填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数 (填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应 (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是 。(写出必要的计算过程)
19.汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2 L密闭容器中充入N2和O2各1 mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应 (填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是 。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大”、“变小”或“不变”)。
判断正误
20.ΔH<0,ΔS>0的反应在温度低时不能自发进行。(_______)
21.一定温度下,反应MgCl2(l)Mg(l)+Cl2(g)的ΔH>0、ΔS>0。(_______)
22.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0。(_______)
23.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0。(_______)
24.SO2(g)=S(g)+O2(g) ΔH>0,ΔS>0,该反应不能自发进行。(_______)
25.SO2(g)+2H2S(g)=3S(s)+2H2O(l) ΔH<0,低温下能自发进行。(_______)
26.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0。(_______)
27.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向。(_______)
28.放热过程有自发进行的倾向性,但并不一定能自发进行,吸热过程没有自发进行的倾向性,但在一定条件下也可自发进行。(_______)
29.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向。(_______)
30.在T℃时,向容积为2L的恒容密闭容器中充入1molCO2和一定量的H2发生反应:CO2(g)+2H2(g)HCHO(g)+H2O(g)。达到平衡时,HCHO的分压与起始的关系如图所示:(分压=总压×物质的量分数)
(1)起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,v(H2)= mol/(L·min)。
(2)b点时反应的平衡常数Kp= (kPa)-1(以分压表示)。
(3)c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,则H2的转化率 (填“增大”“不变”或减小”)。
试卷第1页,共3页
参考答案:
1.C
【详解】A.使用催化剂能增大反应速率,缩短反应时间,提高反应速率,故A正确;
B.达到反应限度后,即化学平衡状态,各物质的浓度不再变化,故B正确;
C.因为该反应是可逆反应,存在反应限度,SO2不可能全部转化为SO3,故C错误;
D.增大O2的浓度,平衡正向移动,可加快SO2的反应速率,故D正确;
答案选:C。
2.C
【详解】A.平衡时,O2、NO2、NO、SO3的物质的量不变,但不一定相等,故A错误;
B.NO2和SO2是按1:1关系反应的,若反应开始时加入的二者的物质的量不等,则平衡时NO2和SO2的物质的量不等,与起始投料量有关,若加入的二者的物质的量相等,则平衡时二者的物质的量相等,故B错误;
C.两边气体的计量数相等,所以体系中的总物质的量一定等于反应开始时总物质的量,故C正确;
D.根据方程式,因为NO和SO3 的物质的量之比为1:1,反应从正反应方向开始,所以平衡NO和SO3的物质的量一定相等,故D错误;
答案选C。
3.A
【详解】A.由反应可知,标准状况下,反应生成固体,气体分子数减少,ΔS<0,故A错误;
B.同种物质的气态能量高于固体,则在标准状况下该反应放热更多,则ΔH2<ΔH1,故B正确;
C.SO2的生成速率是逆反应速率,NO2的消耗速率是正反应速率,速率之比等于化学计量数之比,说明反应达到正反应速率等于逆反应速率,反应达到平衡,故C正确;
D.由反应可知每生成1molNO转移2mol电子,标况下22.4LNO为1mol,转移电子数目为2NA,故D正确;
故选:A。
4.A
【详解】A.断键需要吸收热量,成键需要释放热量,反应为吸热反应,说明反应物总键能大于生成物总键能,A正确;
B.燃烧热为1mol可燃物完全燃烧生成指定物质所放出的热量,正反应为放热反应,则逆反应为吸热反应,则2H2O(l)=2H2(g)+O2(g) H=+571.6kJ/mol,B错误;
C.稀硫酸与氢氧化钡反应生成水和硫酸钡沉淀,反应实质不相符,C错误;
D.增大压强,导致单位体积内活化分子个数增多,活化分子百分比没有增大,D错误;
答案选A。
5.B
【详解】A.将NO2气体的平衡球一个放在热水中,一个放入冷水中,通过观察NO2气体颜色深浅变化判断温度对平衡的影响,A能达到实验目,A不符合题意;
B.为了使反应液充分混合,要使用玻璃搅拌器进行搅拌,图示的测定中和反应的反应热的装置中缺少玻璃搅拌器,不能达到实验目的,B符合题意;
C.采用对照方法进行实验,可以探究FeCl3对H2O2分解反应有催化作用,能达到实验目的,C不符合题意;
D.HCl能够与NaHCO3反应产生CO2气体,而CO2难溶于饱和NaHCO3溶液,也不能发生反应,因此可以达到除杂净化的目的,D不符合题意;
故合理选项是B。
6.A
【详解】A.冰自动熔化成水,同一物质的相同质量的固态转化为液态,是熵增的过程,A正确;
B.高锰酸钾加热分解生成三种物质,是固体反应生成气体,属于熵增大的过程,B错误;
C.放热过程或熵增过程可能需要达到某一条件才能自发进行,C错误;
D.自发进行的反应可能是很慢的,比如食物的腐败,D错误;
故选A。
7.C
【详解】A. 该反应正反应的活化能小于逆反应的活化能,A错误;
B. 该反应为放热反应,反应物的总能量比生成物的总能量高,B错误;
C. 该反应为放热反应,反应物化学键中储存的总能量比生成物化学键中储存的总能量低,C正确;
D. 氢气的燃烧热为1mol氢气和氧气反应充分燃烧生成液态水时放出的热量,D错误;
答案选C。
8.C
【详解】A.只有催化剂不同,可探究催化剂对反应速率的影响,故A错误;
B.制备Fe(OH)3 胶体的方法是向沸水中加入饱和FeCl3溶液并煮沸至有红褐色胶状物出现为止,故B错误;
C.只有温度不同,可探究温度对反应速率的影响,故C正确;
D.Cu、Ag与稀硫酸均不反应,不能比较二者金属的活泼性,故D错误;
答案选C。
9.C
【详解】A.反应物能量大于生成物的能量,反应为放热反应,A错误;
B.由图可知正反应的活化能小于逆反应的活化能,B错误;
C.催化剂可以改变反应历程,降低反应的活化能,加快反应速率,C正确;
D.反应中存在碳氢极性键、氧氧非极性键的断裂;存在氢氧极性键、碳氧极性键的生成,不存在非极性键的生成,D错误;
故选C。
10.D
【详解】A.正反应方向为放热反应,则升高温度平衡逆向移动,平衡常数K减小,对比同一反应K数据可知,K(t1)>K(t2),则t2>t1,A正确;
B.K值越大,反应正向进行的程度越大,转化率越高,则相同条件下发生反应,平衡时 F2 、 Cl2 、 Br2 、 I2 的转化率逐渐降低,B正确;
C.K值越小,反应的正向程度越小,说明生成物越不稳定,越易分解,随着核电荷数增大,K值减小,则相同条件下, HF 、 HCl 、 HBr 、 HI 的稳定性逐渐减弱,C正确;
D.反应的剧烈程度与K值大小无关,D错误;
故选D。
11.A
【详解】A.图1为原电池装置,原电池中负极金属比正极金属活泼,因此可用来比较Fe、Cu的金属活动性,故A正确;
B.验证催化剂对反应的影响应控制温度相同,而图2中两试管的温度不同,故B错误;
C.饱和碳酸钠溶液能与二氧化碳反应,不能用饱和碳酸钠液除去二氧化碳中的HCl,因选用饱和碳酸氢钠溶液,故C错误;
D.蒸馏时温度计的水银球应处于支管口处,故D错误;
故选:A。
12.B
【详解】A.由图1可知,X、Y的物质的量减小,为反应物,△n(X)=2.0mol﹣1.4mol=0.6mol,△n(Y)=1.6mol﹣1.4mol=0.2mol,Z的物质的量增大,为生成物,△n(Z)=0.8mol﹣0.4mol=0.4mol,故X、Y、Z的化学计量数之比为0.6mol:0.2mol:0.4mol=3:1:2,反应最后各物质的物质的量不变,为可逆反应,故该反应为3X(g)+Y(g)2Z(g),故A正确;
B.由图2可知,温度T2到达平衡需要的时间较短,故T2>T1,温度越高Y的含量降低,升高温度平衡向正反应方向移动,说明正反应是吸热反应,故B错误;
C.由图1可知,3min时反应达平衡,X的物质的量变化量为2.0mol﹣1.4mol=0.6mol,故v(X)==0.075mol·(L·min)﹣1,故C正确;
D.图3与图1相比,平衡时各组分的物质的量不变,到达平衡时间缩短,说明改变条件,增大反应速率,平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是增大压强,故改变条件是使用催化剂,故D正确;
故选B。
13. X(g)+2Y(g) 2Z(g) 0.014 mol/(L·min) 45% 增大 增大 增大 减小 不变 不变
【分析】(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,物质的量变化量之比等于化学计量数之比,故反应方程式为X+2Y 2Z.
①根据物质的量的变化与化学计量数呈正比书写化学方程式;
②依据化学反应速率= c÷ t,结合图表数据计算;
③依据图表数据分析当反应进行到9min时反应已达到平衡,转化率等于消耗量除以原来起始量;
(2)根据增大浓度、增大压强、使用催化剂,反应速率加快,反之反应速率减慢来解答,注意反应体系中各物质的浓度不变,则反应速率不变。
【详解】(1)①由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反应方程式为X+2Y 2Z,
故答案为X+2Y 2Z;
②0-5min内Z的反应速率= c÷ t=0.7mol÷10L÷5min=0.014mol L-1 min-1,故答案为0.014mol L-1 min-1;
③由图表数据可知反应到9min,反应达到平衡,反应达到平衡时反应物X的转化率α=(1.0mol-0.55mol)÷1.0mol×100%=45%,故答案为45%;
(2)①升高温度,反应速率增大,故答案为增大;
②加入催化剂,反应速率增大,故答案为增大;
③再充入H2,反应物浓度增大,化学反应速率增大,故答案为增大;
④容器中压强不变,充入氖气,则容器容积扩大,相当于减小压强,则反应速率减小,故答案为减小;
⑤容器容积不变,通入氖气,反应体系中各物质的浓度不变,则反应速率不变,故答案为不变;
⑥保持压强不变,充入2xmolH2(g)和2ymolI2(g),各物质的浓度保持不变,所以速率不变,故答案为不变。
14. 低温 使用合适催化剂 高压 高温 原料循环利用 增大原料气浓度 分离出氨气
【解析】略
15. 放热 1个大气压、400-500℃(或400℃) 否 减小 减小
【分析】本题结合了硫酸的工业制取和化学平衡的相关知识,须注意工业流程除了要考虑转化率以外,成本和反应速率也是重要的考量因素,据此来逐项分析即可。
【详解】(1)绝大多数的化合反应都是放热的,绝大多数的分解反应都是吸热的,因此二氧化硫的氧化反应是放热的;
(2)先来看温度,400℃到500℃的转化率都比较高,适当提高温度虽然会牺牲一些转化率,但是可以显著提高反应速率;再来看压强,压强越大固然转化率越高,但是10个大气压对设备的要求较高,生产成本也会提升,产生的额外收益却不显著,因此选1个大气压即可;
(3)催化剂不改变平衡常数,因此不提高转化率;
(4)通入氧气相当于提高反应物的浓度,平衡会正向移动,因此二氧化硫的浓度减小;
(5)保持压强不变充入氦气,容器的体积增大,各气体的浓度降低,平衡要向气体分子数增大的方向移动,即逆向移动,因此三氧化硫的含量减小。
【点睛】针对与有气体参与的可逆反应,如果反应达到平衡后,在等温等容条件下,再充入和反应无关的气体,各物质浓度不变,速率不变,平衡不移动;在等温等压条件下,充入和反应无关的气体,等效于减压过程,各物质浓度减小,速率减慢,平衡向着气体体积增大的方向移动。
16. 使用催化剂;升温;增大反应物浓度;增大压强 大于 P4>P3>P2>P1 较大的压强和温度能加快合成速率,提高生产效率 0.032 1.64 降温 BCD 逆 12g/mol
【详解】(1)加快反应的化学反应速率,可以采用的有效措施有使用催化剂;升温;增大反应物浓度;增大压强等,故答案为使用催化剂;升温;增大反应物浓度;增大压强;
(2)①由图可知,升高温度,CH4的平衡转化率增大,平衡正向移动,正反应为吸热反应,ΔH大于0;温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故答案为大于;P4>P3>P2>P1;
②较大的压强和温度能加快合成速率,提高生产效率,工业生产时一般会选用P4和1250℃进行合成,故答案为较大的压强和温度能加快合成速率,提高生产效率;
③由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,故v(CH4)= =0.016mol/(L min),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH4)=2×0.16mol/(L min)=0.032mol/(L min),故答案为0.032;
④ CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k===1.64,若要使K减小,需要平衡逆向移动,由于K只与温度应该,可以采取的措施是降温,故答案为;1.64;降温;
(3)①A、H2、CO和H2O的物质的量之比为1:1:1,CO与H2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故A错误;B、正反应方向是个气体体积增大的方向,故随着反应的进行,平衡之前,体系压强会增大,故一旦当体系压强不变,说明反应达平衡,故B正确;C、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,故C正确;D、混合气体的密度ρ=,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故D正确;故选BCD;
②根据勒沙特列原理可知,增大压强,平衡向着气体体积减小的方向移动,此反应的逆反应方向是个气体体积减小的方向,故增大压强,向逆反应方向移动;在第2min时,混合气体的平均相对分子质量即平均摩尔质量===12g/mol,故答案为逆;12g/mol。
17.
t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动。
【详解】t1时刻,减小反应物浓度,使v′正减小,而v′逆不变,则v′逆>v′正,平衡向逆反应方向移动,图像为。
18. 0.05 mol·(L·min)-1 A、D A、C 不变 向正反应方向进行 根据计算得浓度商Qc<K
【分析】(1)、5分钟内,△n (O2) =1mol-0.5mol=0.5mol,由N2(g)+O2(g) 2NO(g) ΔH>0,可知△n (N2) =0. 5mol,带入计算;
(2)、可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)、根据温度、催化剂对反应速率和平衡移动的影响判断;
(4)、根据化学方程式的特点结合压强对平衡的影响分析;
(5)、计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论。
【详解】(1)、5分钟内,△n (O2) =1mol-0.5mol=0.5mol,由N2(g)+O2(g) 2NO(g) ΔH>0,可知△n (N2) =0. 5mol,,
故答案为0.05 mol·(L·min)-1;
(2)A、消耗1 mol N2同时生成1 mol O2, A达到平衡;
B、混合气体密度一直不变,故不能衡量是否达到平衡;
C、混合气体平均相对分子质量不变,总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故不能衡量是否达到平衡;
D、2v正(N2)=v逆(NO), 正逆反应速率相等,达到平衡;
故选AD;
(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为AC;
(4)、该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数;
故答案为不变;
(5)、该温度下, 某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:,则反应应向正反应方向进行,
故答案为向正反应方向进行; 根据计算得浓度商Qc<K。
19. 4 向正方向进行 此时的浓度商小于K 不变
【详解】(1)对应反应:N2(g)+O2(g) 2NO(g),按定义,该反应的平衡常数表达式为。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,,平衡时,,a=0.04mol,N2的转化率是;故答案为:4。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10 1 mol L 1、4.0×10 2 mol L 1和3.0×10 3 mol L 1,,因此反应向正方向进行。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态,可以理解为先向另外一个容器中充入一定量NO,达到平衡,两者NO的体积分数相等,将另外一个容器压入到开始容器中,故等效于加压,由于反应前后气体体积不变,加压平衡不移动,因此平衡混合气中NO的体积分数不变。
20.错误 21.正确 22.正确 23.错误 24.错误 25.正确 26.正确 27.错误 28.正确 29.正确
【解析】20.ΔH<0,ΔS>0的反应,所有温度下△H-T△S<0,反应自发进行,故错误;
21.一定温度下,反应MgCl2(l)Mg(l)+Cl2(g)是吸热反应ΔH>0,气体分子数增大的反应ΔS>0,故正确;
22.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行△H-T△S<0,,又△S<0,则该反应的ΔH<0,故正确;
23.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行△H-T△S<0,,又△S<0,则该反应的ΔH<0,故错误;
24.SO2(g)=S(g)+O2(g) ΔH>0,ΔS>0,该反应在高温下能自发进行,故错误;
25.SO2(g)+2H2S(g)=3S(s)+2H2O(l) ΔH<0,又△S<0,低温下能自发进行,故正确;
26.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,△H-T△S>0,ΔS>0,则该反应的ΔH>0,故正确;
27.在其他外界条件不变的情况下,使用催化剂只改变反应速率,不影响平衡的移动,使用催化剂不可以改变化学反应进行的方向,故错误;
28.放热过程有自发进行的倾向性,但并不一定能自发进行,吸热过程没有自发进行的倾向性,但在一定条件下也可自发进行,还要看△H-T△S的值,故正确;
29.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=185.57 kJ·mol-1,该反应为吸热反应,不能自发进行;而最终该反应能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故正确;
30.(1)0.1
(2)
(3)不变
【详解】(1)起始时容器内气体的总压强为1.2pkPa,若5min时反应到达c点,c点HCHO的物质的量为x,=,x=0.5mol,则反应消耗氢气的物质的量为1mol,v(H2)==0.1mol/(L·min);
故答案为:0.1。
(2)
C点时,甲醛的压强为0.2pkPa,则二氧化碳的压强为0.2pkPa、氢气的压强为0.4pkPa、水蒸气的压强为0.2pkPa,b点和c点温度相同,平衡常数相同,反应的平衡常数Kp===kPa-1;
故答案为:。
(3)c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05pkPa,Q==kPa-1=Kp,平衡不移动,则H2的转化率不变;
故答案为:不变
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
