第1章 化学反应与能量转化 章末题 (含答案)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 化学反应与能量转化 章末题 (含答案)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 445.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 20:38:31 | ||
图片预览


文档简介
第1章 化学反应与能量转化 章末题2023—2024学年上学期高二化学鲁科版(2019)选择性必修一
一、选择题。(18题)
1、(双选)一种分解海水制氢气的方法为2H2O(l)2H2(g)+O2(g)。如图为此反应的能量变化示意图,则下列说法不正确的是( )
A.反应物H2O(l)的总能量高于反应产物H2(g)和O2(g)的总能量
B.TiO2可以提高H2O的分解速率
C.催化剂对该反应的反应热无影响
D.由于该反应使用了激光,故该反应不遵循能量守恒定律
2、下列反应吸收热量的是( )
A.铁与稀盐酸反应 B.铁丝在氧气中燃烧
C.铝还原氧化铁 D.碳与二氧化碳反应
3、下列说法正确的是( )
A.蛋白质溶液中加入饱和溶液可发生盐析
B.由反应可知,甲烷的燃烧热为
C.铅蓄电池放电时的正极反应式为
D.,,结论:相同条件下金刚石比石墨稳定
4、2019年诺贝尔化学奖由三位科学家共同获得,他们获奖的研究领域是( )
A.铅蓄电池 B.燃料电池 C.镍镉电池 D.锂离子电池
5、下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e-,阳极就会溶解64 g铜
B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液需要不断更换
6、有关下列四个常用电化学装置的叙述中,正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ铅 硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,正极质量不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
7、下到过程需要通电才可进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.①②③ B.②③④ C.①②④ D.②③
8、下列关于原电池和电解池的说法,不正确的是( )
A.燃料电池的优点是能量转化率很高,反应物不必全部储藏在电池内
B.电解质为KOH,氢气和氧气构成的燃料电池在放电过程中KOH溶液的浓度不变
C.电池充电时,原电池的正极变成了电解池的阳极
D.钢铁发生吸氧腐蚀时,正极反应为O2+4e-+2H2O===4OH-
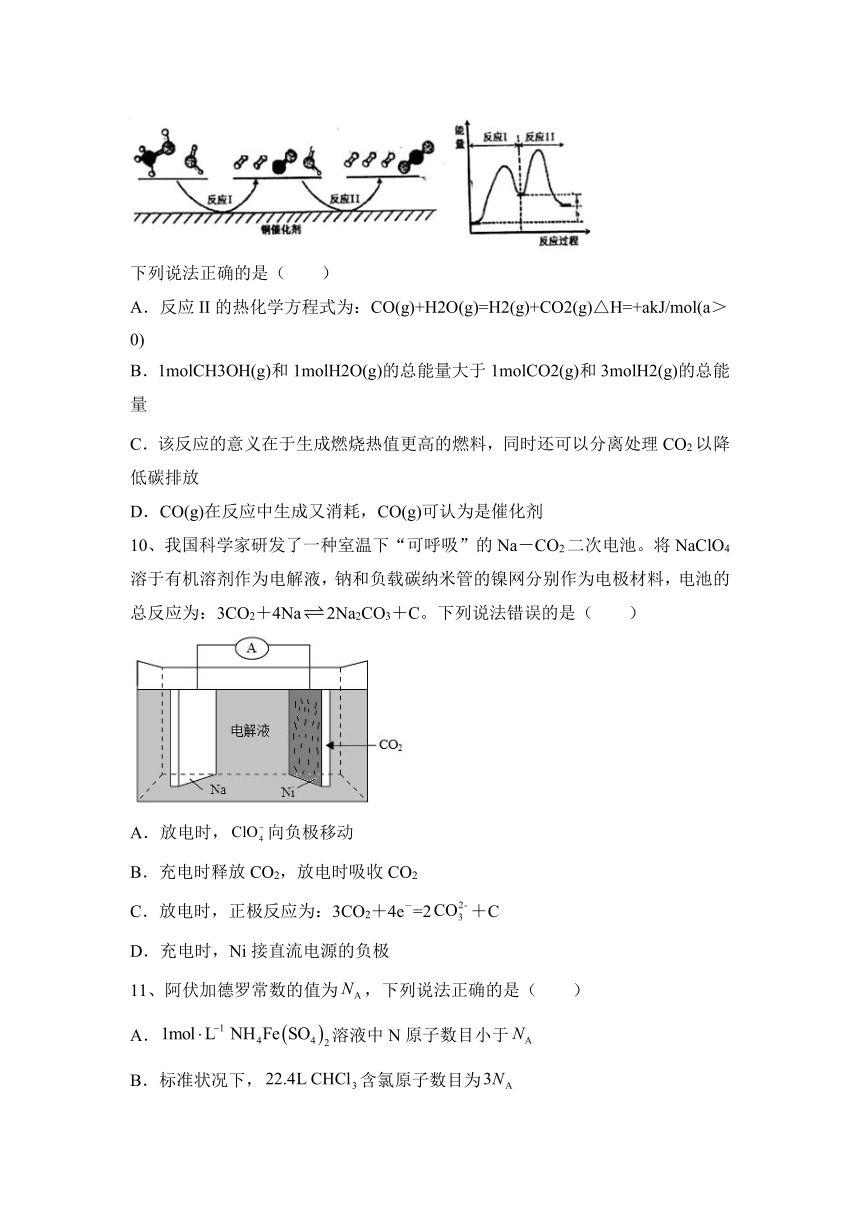
9、多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
下列说法正确的是( )
A.反应II的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.该反应的意义在于生成燃烧热值更高的燃料,同时还可以分离处理CO2以降低碳排放
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
10、我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2+C
D.充电时,Ni接直流电源的负极
11、阿伏加德罗常数的值为,下列说法正确的是( )
A.溶液中N原子数目小于
B.标准状况下,含氯原子数目为
C.含键数目一定为
D.电解法精炼铜时,阴极质量增加,转移电子数一定为
12、如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH-―4e-=O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况)
13、下列说法正确的是( )
A.化学反应的热效应的大小与参加反应的物质的多少无关
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.反应物的总能量大于生成物的总能量的反应一定是放热反应
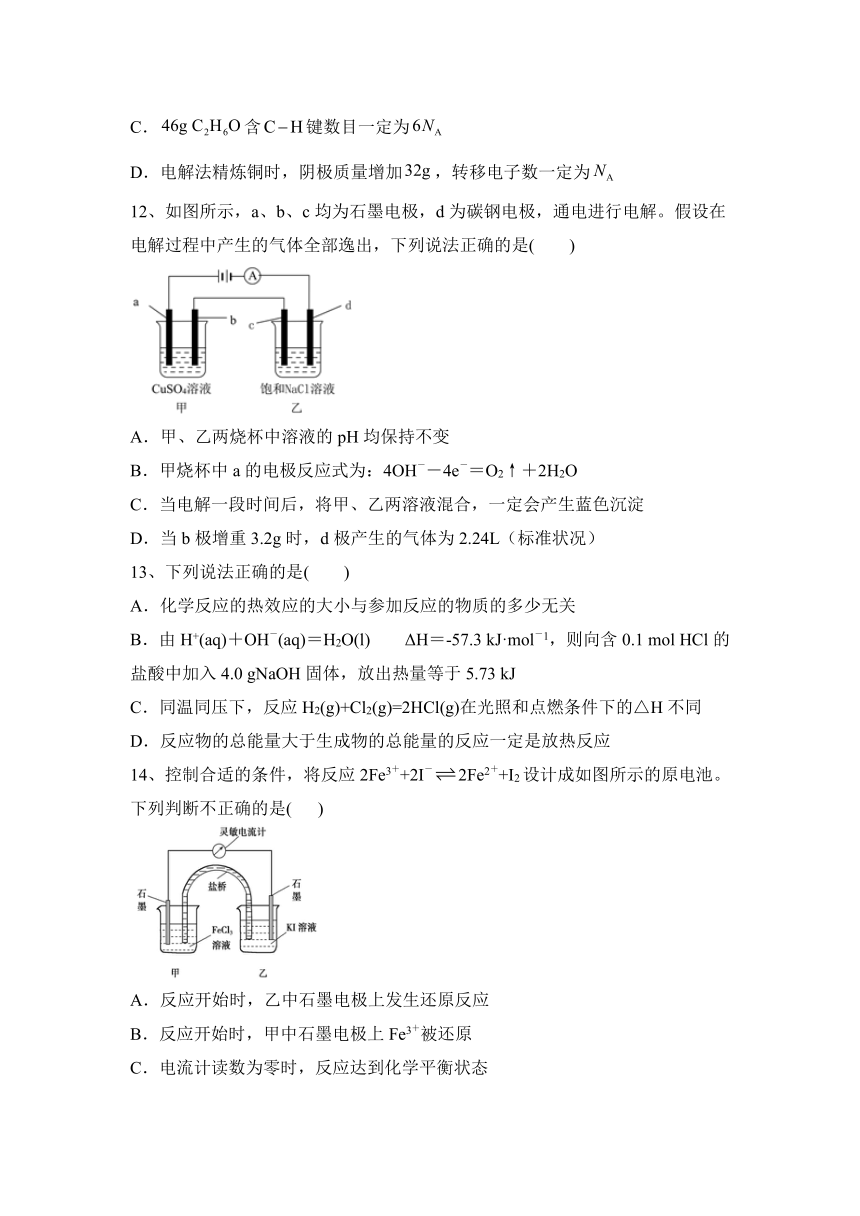
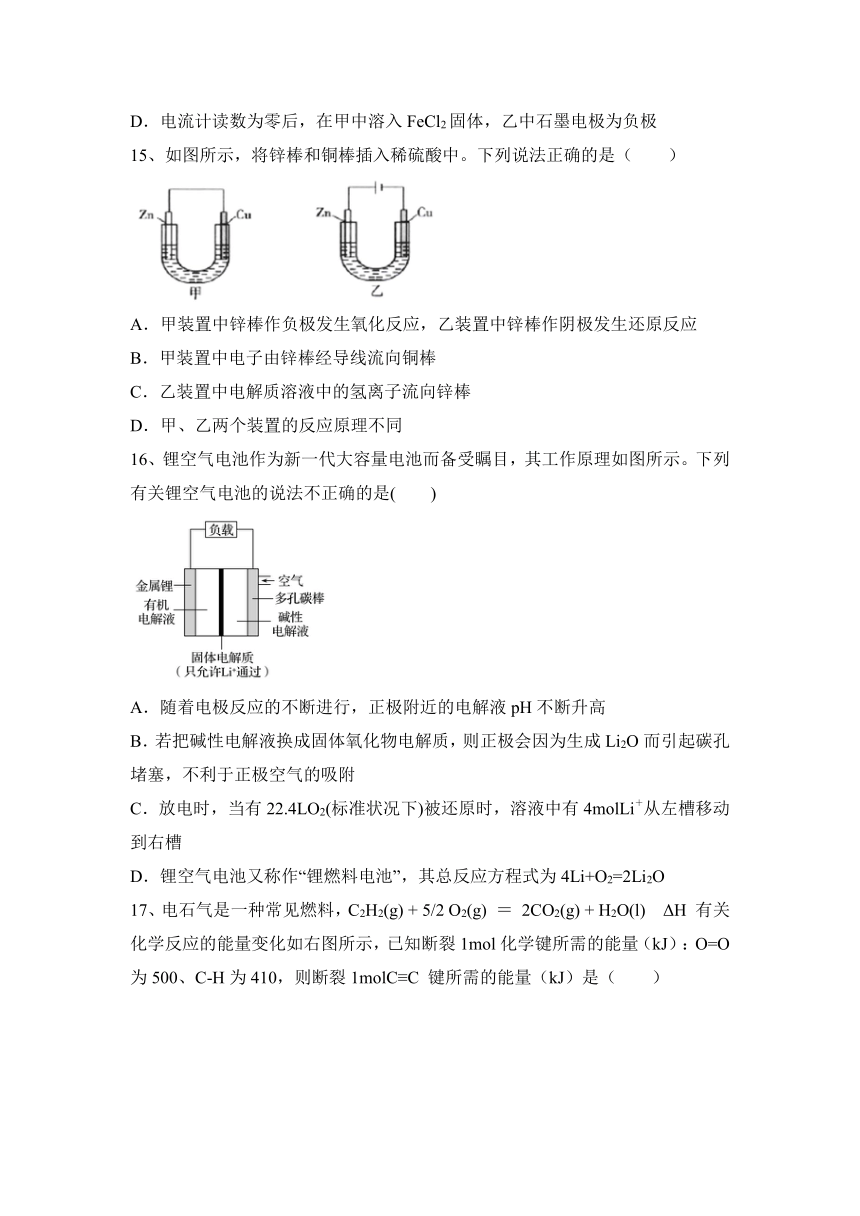
14、控制合适的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生还原反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
15、如图所示,将锌棒和铜棒插入稀硫酸中。下列说法正确的是( )
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应
B.甲装置中电子由锌棒经导线流向铜棒
C.乙装置中电解质溶液中的氢离子流向锌棒
D.甲、乙两个装置的反应原理不同
16、锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示。下列有关锂空气电池的说法不正确的是( )
A.随着电极反应的不断进行,正极附近的电解液pH不断升高
B.若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附
C.放电时,当有22.4LO2(标准状况下)被还原时,溶液中有4molLi+从左槽移动到右槽
D.锂空气电池又称作“锂燃料电池”,其总反应方程式为4Li+O2=2Li2O
17、电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是( )
A.840 B.1590 C.900 D.1250
18、一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是 ( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤ C.③④⑤ D.①③
二、填空题。(4题)
19、合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q________184.4 kJ(填“>”“<”或“=”)。
(2)已知
1 mol N—H键断裂吸收的能量等于________kJ。
20、燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_____________ 。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①a极电极反应式为______________ ;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。
21、如图所示,A为直流电源,B为浸润饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现滤纸B上的c附近显红色。请回答:
(1)电源A中a为______极。
(2)滤纸B上发生的总反应方程式为__________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通开关K,使c、d短路,则电极e上发生的反应为__________________________________________________________,
电极f上发生的反应为________________________________________________,
槽中盛放的电镀液可以是________或________(要求填两种电解质溶液)。
四、原理综合题。
22、如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2H2+2NiO(OH)。
(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
第1章 化学反应与能量转化 章末题2023—2024学年上学期高二化学鲁科版(2019)选择性必修一
一、选择题。(18题)
1、(双选)一种分解海水制氢气的方法为2H2O(l)2H2(g)+O2(g)。如图为此反应的能量变化示意图,则下列说法不正确的是( )
A.反应物H2O(l)的总能量高于反应产物H2(g)和O2(g)的总能量
B.TiO2可以提高H2O的分解速率
C.催化剂对该反应的反应热无影响
D.由于该反应使用了激光,故该反应不遵循能量守恒定律
【答案】AD
2、下列反应吸收热量的是( )
A.铁与稀盐酸反应 B.铁丝在氧气中燃烧
C.铝还原氧化铁 D.碳与二氧化碳反应
【答案】D
3、下列说法正确的是( )
A.蛋白质溶液中加入饱和溶液可发生盐析
B.由反应可知,甲烷的燃烧热为
C.铅蓄电池放电时的正极反应式为
D.,,结论:相同条件下金刚石比石墨稳定
【答案】C
4、2019年诺贝尔化学奖由三位科学家共同获得,他们获奖的研究领域是( )
A.铅蓄电池 B.燃料电池 C.镍镉电池 D.锂离子电池
【答案】D
5、下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e-,阳极就会溶解64 g铜
B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液需要不断更换
【答案】C
6、有关下列四个常用电化学装置的叙述中,正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ铅 硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,正极质量不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
【答案】B
7、下到过程需要通电才可进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.①②③ B.②③④ C.①②④ D.②③
【答案】D
8、下列关于原电池和电解池的说法,不正确的是( )
A.燃料电池的优点是能量转化率很高,反应物不必全部储藏在电池内
B.电解质为KOH,氢气和氧气构成的燃料电池在放电过程中KOH溶液的浓度不变
C.电池充电时,原电池的正极变成了电解池的阳极
D.钢铁发生吸氧腐蚀时,正极反应为O2+4e-+2H2O===4OH-
【答案】B
9、多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
下列说法正确的是( )
A.反应II的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.该反应的意义在于生成燃烧热值更高的燃料,同时还可以分离处理CO2以降低碳排放
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
【答案】C
10、我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2+C
D.充电时,Ni接直流电源的负极
【答案】D
11、阿伏加德罗常数的值为,下列说法正确的是( )
A.溶液中N原子数目小于
B.标准状况下,含氯原子数目为
C.含键数目一定为
D.电解法精炼铜时,阴极质量增加,转移电子数一定为
【答案】D
12、如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH-―4e-=O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况)
【答案】B
13、下列说法正确的是( )
A.化学反应的热效应的大小与参加反应的物质的多少无关
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.反应物的总能量大于生成物的总能量的反应一定是放热反应
【答案】D
14、控制合适的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生还原反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
【答案】AD
15、如图所示,将锌棒和铜棒插入稀硫酸中。下列说法正确的是( )
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应
B.甲装置中电子由锌棒经导线流向铜棒
C.乙装置中电解质溶液中的氢离子流向锌棒
D.甲、乙两个装置的反应原理不同
【答案】B
16、锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示。下列有关锂空气电池的说法不正确的是( )
A.随着电极反应的不断进行,正极附近的电解液pH不断升高
B.若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附
C.放电时,当有22.4LO2(标准状况下)被还原时,溶液中有4molLi+从左槽移动到右槽
D.锂空气电池又称作“锂燃料电池”,其总反应方程式为4Li+O2=2Li2O
【答案】D
17、电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是( )
A.840 B.1590 C.900 D.1250
【答案】A
18、一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是 ( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤ C.③④⑤ D.①③
【答案】B
二、填空题。(4题)
19、合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q________184.4 kJ(填“>”“<”或“=”)。
(2)已知
1 mol N—H键断裂吸收的能量等于________kJ。
【答案】(1)< (2)391
20、燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_____________ 。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①a极电极反应式为______________ ;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。
【答案】(1)正 O2+4H++4e-=2H2O 负 正 22.4 L
(2)CO+O2--2e-=CO2 b a a b
21、如图所示,A为直流电源,B为浸润饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现滤纸B上的c附近显红色。请回答:
(1)电源A中a为______极。
(2)滤纸B上发生的总反应方程式为__________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通开关K,使c、d短路,则电极e上发生的反应为__________________________________________________________,
电极f上发生的反应为________________________________________________,
槽中盛放的电镀液可以是________或________(要求填两种电解质溶液)。
【答案】(1)正 (2)2NaCl+2H2OH2↑+Cl2↑+2NaOH
(3)Zn-2e-===Zn2+ Zn2++2e-===Zn ZnSO4溶液 ZnCl2溶液
四、原理综合题。
22、如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2H2+2NiO(OH)。
(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
【答案】O2+2H2O+4e-=4OH- 2Cu+2H2SO4+O2=2CuSO4+2H2O
a Cu+2H+Cu2++H2↑ OH-+Ni(OH)2-e-=NiO(OH)+H2O
变小 1.2 mol
一、选择题。(18题)
1、(双选)一种分解海水制氢气的方法为2H2O(l)2H2(g)+O2(g)。如图为此反应的能量变化示意图,则下列说法不正确的是( )
A.反应物H2O(l)的总能量高于反应产物H2(g)和O2(g)的总能量
B.TiO2可以提高H2O的分解速率
C.催化剂对该反应的反应热无影响
D.由于该反应使用了激光,故该反应不遵循能量守恒定律
2、下列反应吸收热量的是( )
A.铁与稀盐酸反应 B.铁丝在氧气中燃烧
C.铝还原氧化铁 D.碳与二氧化碳反应
3、下列说法正确的是( )
A.蛋白质溶液中加入饱和溶液可发生盐析
B.由反应可知,甲烷的燃烧热为
C.铅蓄电池放电时的正极反应式为
D.,,结论:相同条件下金刚石比石墨稳定
4、2019年诺贝尔化学奖由三位科学家共同获得,他们获奖的研究领域是( )
A.铅蓄电池 B.燃料电池 C.镍镉电池 D.锂离子电池
5、下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e-,阳极就会溶解64 g铜
B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液需要不断更换
6、有关下列四个常用电化学装置的叙述中,正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ铅 硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,正极质量不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
7、下到过程需要通电才可进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.①②③ B.②③④ C.①②④ D.②③
8、下列关于原电池和电解池的说法,不正确的是( )
A.燃料电池的优点是能量转化率很高,反应物不必全部储藏在电池内
B.电解质为KOH,氢气和氧气构成的燃料电池在放电过程中KOH溶液的浓度不变
C.电池充电时,原电池的正极变成了电解池的阳极
D.钢铁发生吸氧腐蚀时,正极反应为O2+4e-+2H2O===4OH-
9、多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
下列说法正确的是( )
A.反应II的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.该反应的意义在于生成燃烧热值更高的燃料,同时还可以分离处理CO2以降低碳排放
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
10、我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2+C
D.充电时,Ni接直流电源的负极
11、阿伏加德罗常数的值为,下列说法正确的是( )
A.溶液中N原子数目小于
B.标准状况下,含氯原子数目为
C.含键数目一定为
D.电解法精炼铜时,阴极质量增加,转移电子数一定为
12、如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH-―4e-=O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况)
13、下列说法正确的是( )
A.化学反应的热效应的大小与参加反应的物质的多少无关
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.反应物的总能量大于生成物的总能量的反应一定是放热反应
14、控制合适的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生还原反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
15、如图所示,将锌棒和铜棒插入稀硫酸中。下列说法正确的是( )
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应
B.甲装置中电子由锌棒经导线流向铜棒
C.乙装置中电解质溶液中的氢离子流向锌棒
D.甲、乙两个装置的反应原理不同
16、锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示。下列有关锂空气电池的说法不正确的是( )
A.随着电极反应的不断进行,正极附近的电解液pH不断升高
B.若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附
C.放电时,当有22.4LO2(标准状况下)被还原时,溶液中有4molLi+从左槽移动到右槽
D.锂空气电池又称作“锂燃料电池”,其总反应方程式为4Li+O2=2Li2O
17、电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是( )
A.840 B.1590 C.900 D.1250
18、一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是 ( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤ C.③④⑤ D.①③
二、填空题。(4题)
19、合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q________184.4 kJ(填“>”“<”或“=”)。
(2)已知
1 mol N—H键断裂吸收的能量等于________kJ。
20、燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_____________ 。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①a极电极反应式为______________ ;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。
21、如图所示,A为直流电源,B为浸润饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现滤纸B上的c附近显红色。请回答:
(1)电源A中a为______极。
(2)滤纸B上发生的总反应方程式为__________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通开关K,使c、d短路,则电极e上发生的反应为__________________________________________________________,
电极f上发生的反应为________________________________________________,
槽中盛放的电镀液可以是________或________(要求填两种电解质溶液)。
四、原理综合题。
22、如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2H2+2NiO(OH)。
(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
第1章 化学反应与能量转化 章末题2023—2024学年上学期高二化学鲁科版(2019)选择性必修一
一、选择题。(18题)
1、(双选)一种分解海水制氢气的方法为2H2O(l)2H2(g)+O2(g)。如图为此反应的能量变化示意图,则下列说法不正确的是( )
A.反应物H2O(l)的总能量高于反应产物H2(g)和O2(g)的总能量
B.TiO2可以提高H2O的分解速率
C.催化剂对该反应的反应热无影响
D.由于该反应使用了激光,故该反应不遵循能量守恒定律
【答案】AD
2、下列反应吸收热量的是( )
A.铁与稀盐酸反应 B.铁丝在氧气中燃烧
C.铝还原氧化铁 D.碳与二氧化碳反应
【答案】D
3、下列说法正确的是( )
A.蛋白质溶液中加入饱和溶液可发生盐析
B.由反应可知,甲烷的燃烧热为
C.铅蓄电池放电时的正极反应式为
D.,,结论:相同条件下金刚石比石墨稳定
【答案】C
4、2019年诺贝尔化学奖由三位科学家共同获得,他们获奖的研究领域是( )
A.铅蓄电池 B.燃料电池 C.镍镉电池 D.锂离子电池
【答案】D
5、下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e-,阳极就会溶解64 g铜
B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液不需要更换
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液需要不断更换
【答案】C
6、有关下列四个常用电化学装置的叙述中,正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ铅 硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,正极质量不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,放电时,负极附近溶液的pH不变
【答案】B
7、下到过程需要通电才可进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.①②③ B.②③④ C.①②④ D.②③
【答案】D
8、下列关于原电池和电解池的说法,不正确的是( )
A.燃料电池的优点是能量转化率很高,反应物不必全部储藏在电池内
B.电解质为KOH,氢气和氧气构成的燃料电池在放电过程中KOH溶液的浓度不变
C.电池充电时,原电池的正极变成了电解池的阳极
D.钢铁发生吸氧腐蚀时,正极反应为O2+4e-+2H2O===4OH-
【答案】B
9、多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
下列说法正确的是( )
A.反应II的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.该反应的意义在于生成燃烧热值更高的燃料,同时还可以分离处理CO2以降低碳排放
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
【答案】C
10、我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2+C
D.充电时,Ni接直流电源的负极
【答案】D
11、阿伏加德罗常数的值为,下列说法正确的是( )
A.溶液中N原子数目小于
B.标准状况下,含氯原子数目为
C.含键数目一定为
D.电解法精炼铜时,阴极质量增加,转移电子数一定为
【答案】D
12、如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
A.甲、乙两烧杯中溶液的pH均保持不变
B.甲烧杯中a的电极反应式为:4OH-―4e-=O2↑+2H2O
C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况)
【答案】B
13、下列说法正确的是( )
A.化学反应的热效应的大小与参加反应的物质的多少无关
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.反应物的总能量大于生成物的总能量的反应一定是放热反应
【答案】D
14、控制合适的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生还原反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
【答案】AD
15、如图所示,将锌棒和铜棒插入稀硫酸中。下列说法正确的是( )
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应
B.甲装置中电子由锌棒经导线流向铜棒
C.乙装置中电解质溶液中的氢离子流向锌棒
D.甲、乙两个装置的反应原理不同
【答案】B
16、锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示。下列有关锂空气电池的说法不正确的是( )
A.随着电极反应的不断进行,正极附近的电解液pH不断升高
B.若把碱性电解液换成固体氧化物电解质,则正极会因为生成Li2O而引起碳孔堵塞,不利于正极空气的吸附
C.放电时,当有22.4LO2(标准状况下)被还原时,溶液中有4molLi+从左槽移动到右槽
D.锂空气电池又称作“锂燃料电池”,其总反应方程式为4Li+O2=2Li2O
【答案】D
17、电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是( )
A.840 B.1590 C.900 D.1250
【答案】A
18、一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是 ( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤ C.③④⑤ D.①③
【答案】B
二、填空题。(4题)
19、合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q________184.4 kJ(填“>”“<”或“=”)。
(2)已知
1 mol N—H键断裂吸收的能量等于________kJ。
【答案】(1)< (2)391
20、燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_____________ 。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①a极电极反应式为______________ ;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。
【答案】(1)正 O2+4H++4e-=2H2O 负 正 22.4 L
(2)CO+O2--2e-=CO2 b a a b
21、如图所示,A为直流电源,B为浸润饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现滤纸B上的c附近显红色。请回答:
(1)电源A中a为______极。
(2)滤纸B上发生的总反应方程式为__________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通开关K,使c、d短路,则电极e上发生的反应为__________________________________________________________,
电极f上发生的反应为________________________________________________,
槽中盛放的电镀液可以是________或________(要求填两种电解质溶液)。
【答案】(1)正 (2)2NaCl+2H2OH2↑+Cl2↑+2NaOH
(3)Zn-2e-===Zn2+ Zn2++2e-===Zn ZnSO4溶液 ZnCl2溶液
四、原理综合题。
22、如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2H2+2NiO(OH)。
(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
【答案】O2+2H2O+4e-=4OH- 2Cu+2H2SO4+O2=2CuSO4+2H2O
a Cu+2H+Cu2++H2↑ OH-+Ni(OH)2-e-=NiO(OH)+H2O
变小 1.2 mol
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
