4.2 电解池 课件(共26张PPT含视频) 高中化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 电解池 课件(共26张PPT含视频) 高中化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 52.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 21:26:47 | ||
图片预览








文档简介
(共26张PPT)
第二节:电解池
1799年意大利物理学家伏打发明了伏打电池。次年,英国化学家用伏打电池进行电解水的试验。经检验,水在通电的情况下生成了氢气和氧气。
2H2O==O2↑+2H2↑
电解
任务1
电解氯化铜(CuCl2)溶液
阴极:石墨棒上覆盖一层红色固体;
阳极:①有气泡冒出并闻到刺激性气味;
②湿润的碘化钾淀粉试纸变为蓝色。
阳极材料
石墨
阴极材料
石墨
阳极反应物
Cl-
阴极反应物
Cu2+
Cu
Cl2
实验现象
电极反应能写出来吗?
2Cl--2e-=Cl2↑
Cu2++2e-=Cu
还原反应
氧化反应
阳极
阴极
总反应
离子导体
Cu2+
H+
Cl-
OH-
+ -
直流电源
C
C
e-
e-
阴极
阳极
阴极
阳极
电子导体
电极材料
电极反应
2Cl--2e-=Cl2↑
Cu2++2e-=Cu
Cu2++2Cl-==Cu+Cl2↑
电解
CuCl2==Cu+Cl2↑
电解
离子导体的移动方向?
放电过程
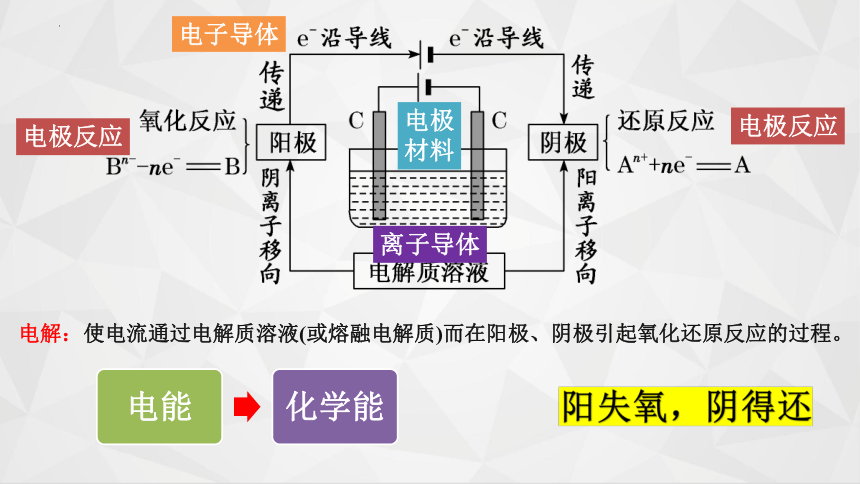
电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
电子导体
电极
材料
离子导体
电极反应
电极反应
阳失氧,阴得还
通电前,氯化铜溶液中有哪些离子?
Cu2+、Cl-、H+、OH-
向阴极移动的离子有?
Cu2+、H+
但只有铜离子参与反应,原因是什么?
向阳极移动的离子有?
但只有氯离子参与反应,原因是什么?
Cl-、OH-
任务2
认识电解质溶液中的放电顺序
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
还原性
氧化性
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
参与电极反应的物质及生成物会受离子浓度、溶液酸碱性等多因素的影响。
一般规律
具体情况具体分析
HCl
评价
通电前,HCl溶液中有哪些离子?
Cl-、H+、OH-
2Cl--2e-=Cl2↑
阳极
阴极
2H++2e-=H2↑
你觉得电解氯化铜溶液与电解盐酸的共性是什么?
电解本身型
Cu2++2Cl-==Cu+Cl2↑
电解
2H++2Cl-==H2↑+Cl2↑
电解
任务3
演绎推理H2SO4、NaOH、Na2SO4溶液的电解产物
H2SO4
阳极材料
石墨
阴极材料
石墨
阳极反应物
OH-
阴极反应物
H+
2H++2e-=H2↑
2H2O-4e-=O2↑+4H+
还原反应
氧化反应
阳极
阴极
为什么阳极不写OH-失电子?
总反应
2H2O==2H2↑+O2↑
电解
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
NaOH
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
4H2O+4e-=2H2↑+4OH-
4OH--4e-=O2↑+2H2O
还原反应
氧化反应
阳极
阴极
总反应
2H2O==2H2↑+O2↑
电解
Na2SO4
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
4H2O+4e-=2H2↑+4OH-
2H2O-4e-=O2↑+4H+
还原反应
氧化反应
阳极
阴极
总反应
2H2O==2H2↑+O2↑
电解
你觉得电解硫酸、氢氧化钠、硫酸钠溶液的共性是什么?
电解水型
任务4
演绎推理CuSO4溶液的电解产物
CuSO4
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
Cu2++2e-=Cu
2H2O-4e-=O2↑+4H+
还原反应
氧化反应
阳极
阴极
2CuSO4+2H2O === 2Cu+O2↑+2H2SO4
电解
放氧生酸
总反应
任务5
演绎推理NaCl溶液的电解产物
NaCl
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
2H2O+2e-=H2↑+2OH-
2Cl--2e-=Cl2↑
还原反应
氧化反应
阳极
阴极
放氢生碱
总反应
2NaCl+2H2O === 2NaOH+H2↑+Cl2↑
电解
类型 电极反应特点 实例 电解质溶液浓度变化 pH 电解质溶液
复原
电解 水型 阴极:4H++4e-===2H2↑ 阳极:4OH--4e-=== 2H2O+O2↑ NaOH
H2SO4
Na2SO4
电解本身型 电解质电离出的阴、阳离子分别在两极放电 HCl
CuCl2
放氢生 碱型 阴极:H2O放出H2生成OH- 阳极:电解质阴离子放电 KCl
放氧生 酸型 阴极:电解质阳离子放电 阳极:H2O放出O2生成H+ CuSO4
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
生成新
电解质
生成新
电解质
不变
加水
加水
加水
通HCl
通HCl
加CuCl2
加CuO或
CuCO3
之前的电解用的都是惰性电极,如果更换成活泼电极呢?
NaCl
Fe
C
2H2O+2e-=H2↑+2OH-
Fe-2e-=Fe2+
还原反应
氧化反应
阳极
阴极
2Cl--2e-=Cl2↑
活泼电极会参与反应
任务6
建构电解池放电顺序的认识模型
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
阴极
阳极
溶液中的微粒得电子
惰性
电极
活泼
电极
溶液中的微粒失电子
活泼电极自身失电子
放电
顺序
第二节:电解池
1799年意大利物理学家伏打发明了伏打电池。次年,英国化学家用伏打电池进行电解水的试验。经检验,水在通电的情况下生成了氢气和氧气。
2H2O==O2↑+2H2↑
电解
任务1
电解氯化铜(CuCl2)溶液
阴极:石墨棒上覆盖一层红色固体;
阳极:①有气泡冒出并闻到刺激性气味;
②湿润的碘化钾淀粉试纸变为蓝色。
阳极材料
石墨
阴极材料
石墨
阳极反应物
Cl-
阴极反应物
Cu2+
Cu
Cl2
实验现象
电极反应能写出来吗?
2Cl--2e-=Cl2↑
Cu2++2e-=Cu
还原反应
氧化反应
阳极
阴极
总反应
离子导体
Cu2+
H+
Cl-
OH-
+ -
直流电源
C
C
e-
e-
阴极
阳极
阴极
阳极
电子导体
电极材料
电极反应
2Cl--2e-=Cl2↑
Cu2++2e-=Cu
Cu2++2Cl-==Cu+Cl2↑
电解
CuCl2==Cu+Cl2↑
电解
离子导体的移动方向?
放电过程
电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
电子导体
电极
材料
离子导体
电极反应
电极反应
阳失氧,阴得还
通电前,氯化铜溶液中有哪些离子?
Cu2+、Cl-、H+、OH-
向阴极移动的离子有?
Cu2+、H+
但只有铜离子参与反应,原因是什么?
向阳极移动的离子有?
但只有氯离子参与反应,原因是什么?
Cl-、OH-
任务2
认识电解质溶液中的放电顺序
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
还原性
氧化性
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
参与电极反应的物质及生成物会受离子浓度、溶液酸碱性等多因素的影响。
一般规律
具体情况具体分析
HCl
评价
通电前,HCl溶液中有哪些离子?
Cl-、H+、OH-
2Cl--2e-=Cl2↑
阳极
阴极
2H++2e-=H2↑
你觉得电解氯化铜溶液与电解盐酸的共性是什么?
电解本身型
Cu2++2Cl-==Cu+Cl2↑
电解
2H++2Cl-==H2↑+Cl2↑
电解
任务3
演绎推理H2SO4、NaOH、Na2SO4溶液的电解产物
H2SO4
阳极材料
石墨
阴极材料
石墨
阳极反应物
OH-
阴极反应物
H+
2H++2e-=H2↑
2H2O-4e-=O2↑+4H+
还原反应
氧化反应
阳极
阴极
为什么阳极不写OH-失电子?
总反应
2H2O==2H2↑+O2↑
电解
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
NaOH
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
4H2O+4e-=2H2↑+4OH-
4OH--4e-=O2↑+2H2O
还原反应
氧化反应
阳极
阴极
总反应
2H2O==2H2↑+O2↑
电解
Na2SO4
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
4H2O+4e-=2H2↑+4OH-
2H2O-4e-=O2↑+4H+
还原反应
氧化反应
阳极
阴极
总反应
2H2O==2H2↑+O2↑
电解
你觉得电解硫酸、氢氧化钠、硫酸钠溶液的共性是什么?
电解水型
任务4
演绎推理CuSO4溶液的电解产物
CuSO4
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
Cu2++2e-=Cu
2H2O-4e-=O2↑+4H+
还原反应
氧化反应
阳极
阴极
2CuSO4+2H2O === 2Cu+O2↑+2H2SO4
电解
放氧生酸
总反应
任务5
演绎推理NaCl溶液的电解产物
NaCl
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
2H2O+2e-=H2↑+2OH-
2Cl--2e-=Cl2↑
还原反应
氧化反应
阳极
阴极
放氢生碱
总反应
2NaCl+2H2O === 2NaOH+H2↑+Cl2↑
电解
类型 电极反应特点 实例 电解质溶液浓度变化 pH 电解质溶液
复原
电解 水型 阴极:4H++4e-===2H2↑ 阳极:4OH--4e-=== 2H2O+O2↑ NaOH
H2SO4
Na2SO4
电解本身型 电解质电离出的阴、阳离子分别在两极放电 HCl
CuCl2
放氢生 碱型 阴极:H2O放出H2生成OH- 阳极:电解质阴离子放电 KCl
放氧生 酸型 阴极:电解质阳离子放电 阳极:H2O放出O2生成H+ CuSO4
增大
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
生成新
电解质
生成新
电解质
不变
加水
加水
加水
通HCl
通HCl
加CuCl2
加CuO或
CuCO3
之前的电解用的都是惰性电极,如果更换成活泼电极呢?
NaCl
Fe
C
2H2O+2e-=H2↑+2OH-
Fe-2e-=Fe2+
还原反应
氧化反应
阳极
阴极
2Cl--2e-=Cl2↑
活泼电极会参与反应
任务6
建构电解池放电顺序的认识模型
S2﹣>I﹣>Br﹣>Cl﹣>OH﹣>含氧酸根离子>F﹣
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+
>Zn2+>H+(水) >Al3+>Mg2+>Na+>Ca2+>K+
阴极
阳极
溶液中的微粒得电子
惰性
电极
活泼
电极
溶液中的微粒失电子
活泼电极自身失电子
放电
顺序
