4.2元素周期律 课件(共33张PPT) 人教版(2019)必修第一册
文档属性
| 名称 | 4.2元素周期律 课件(共33张PPT) 人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-22 22:30:57 | ||
图片预览








文档简介
(共33张PPT)
元素周期律
金属性
非金属性
元素
1.单质与水/酸反应的难易程度
2.最高价碱的碱性强弱
3.单质置换另一单质
1.单质与H2化合的难易程度
2.最高价含氧酸的酸性强弱
3.单质置换另一单质
4.气态氢化物的稳定性强弱
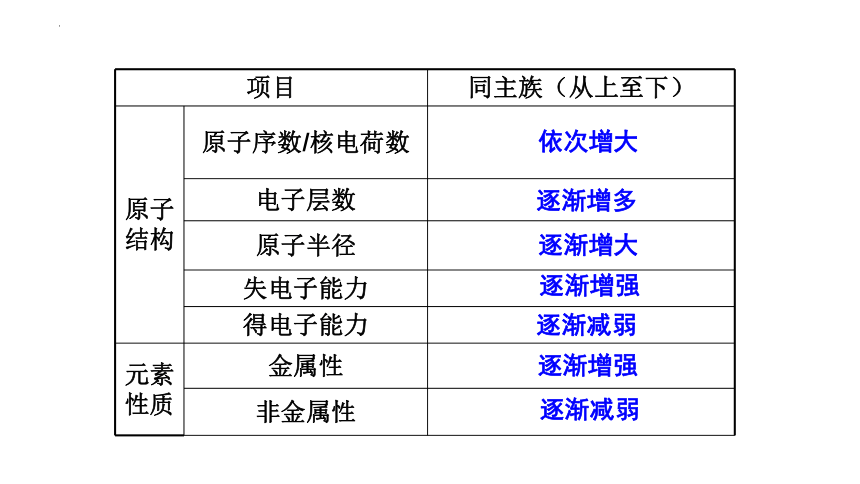
项目 同主族(从上至下)
原子结构 原子序数/核电荷数
电子层数
原子半径
失电子能力
得电子能力
元素性质 金属性
非金属性
逐渐增多
逐渐增大
逐渐增强
逐渐减弱
依次增大
逐渐增强
逐渐减弱
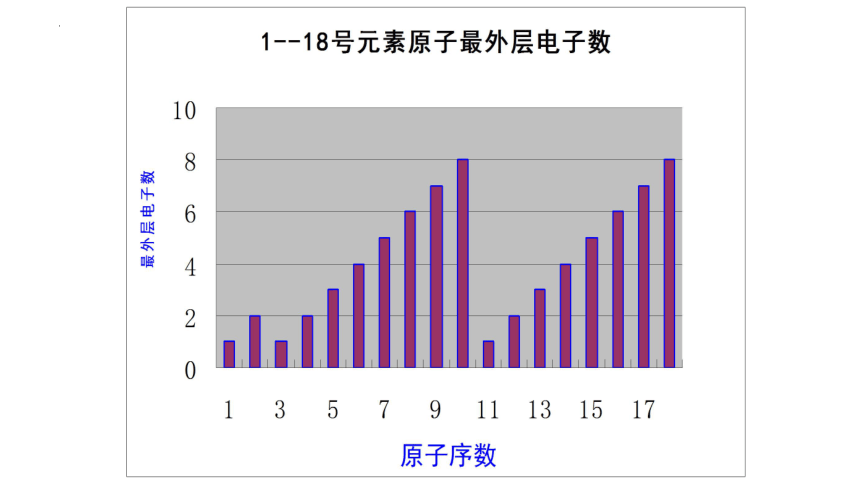
【问题1】1-18号元素,随着原子序数的递增,元素原子最外层电子排布呈现出怎样的变化规律?
学习新知
1—18元素原子的核外电子排布
学习新知
【结论1】随原子序数的递增,元素原子最外层电子排布呈1——8的周期性变化(除第一周期1——2)。
结论
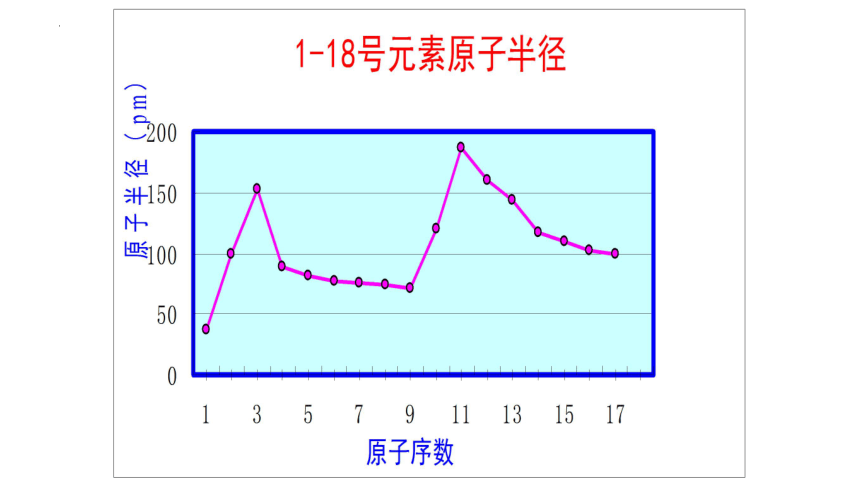
【问题2】1-18号元素(除稀有气体元素外)随着原子序数的递增,元素原子半径呈现出怎样的规律?
学习新知
【结论2】随着原子序数的递增,元素原子半径呈现周期性变化,原子半径重复出现从大到小的变化(稀有气体原子半径暂不研究)。
结论
深度思考
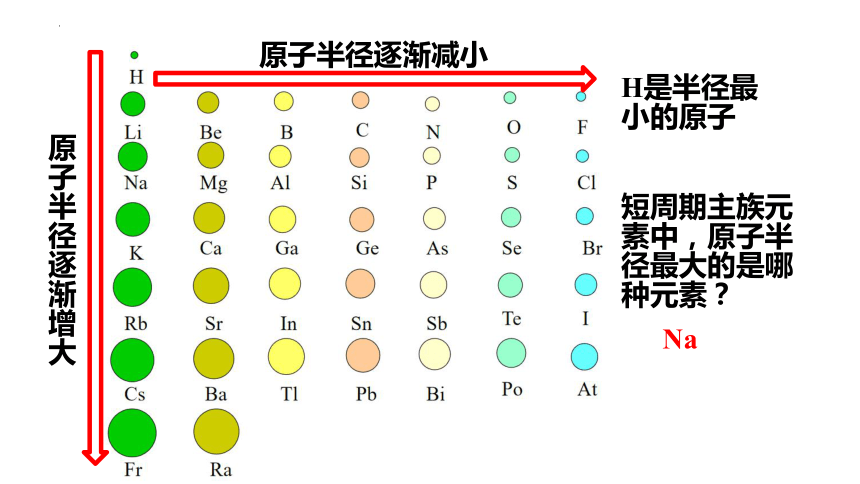
结合同主族元素的原子半径递变规律,整个元素周期表的原子半径呈现什么规律?
原子半径逐渐增大
原子半径逐渐减小
H是半径最小的原子
短周期主族元素中,原子半径最大的是哪种元素?
Na
如何比较P和O的原子半径?
穿插练习
第一步:比较电子层数,电子层数越多,半径越大;
第二步:比较核电荷数,核电荷数越多,半径越小;
第三步:比较电子总数:电子总数越多,半径越大。
拓展
粒子半径比较“三步曲”
(1)如何比较Na和Na+半径大小?
(2)如何比较Na+和Mg2+半径大小?
(3)如何比较Cl和Cl-半径大小?
穿插练习
【问题3】1-18号元素,随着原子序数的递增,元素的主要化合价(最低和最高)呈现出怎样的规律
学习新知
元素的主要化合价
基本规律:
(1)最高正价 = 最外层电子数(O、F除外)
(2)最高正价+|最低负价| = 8
【结论3】随着原子序数的递增,元素的主要化合价呈现出+1——+7、-4——-1周期性变化。
结论
穿插练习
1.判断题
(1)从Na到Cl,元素的最高化合价呈现+1到+7的变化规律( )
(2)从Na到Cl,元素的最低负化合价呈现-7到-1的变化规律( )
(3)从Li到F,元素的最高正化合价呈现+1到+7的变化规律( )
2.填空题
某元素X的最高价氧化物对应水化物的分子式为H2XO4,则其氢化物的分子式为_______。
√
×
×
H2X
【问题4】1-18号元素(稀有气体除外),随着原子序数的递增,元素的金属性和非金属性呈现出怎样的规律?
学习新知
金属性和非金属性的判断依据:
复习回顾
1.单质与水/酸反应的难易程度
2.最高价碱的碱性强弱
3.单质置换另一单质
1.单质与H2化合的难易程度
2.最高价含氧酸的酸性强弱
3.单质置换另一单质
4.气态氢化物的稳定性强弱
请设计实验方案,验证Na、Mg、Al的金属性强弱
穿插练习
金属元素性质 Na Mg Al
单质和水(或酸) 的反应情况
最高价氧化物对应水化物碱性
与冷水剧烈反应
NaOH强碱
与沸水反应
Mg(OH)2沉淀,中强碱
不能与水直接反应
Al(OH)3沉淀,两性氢氧化物
结论:
金属性 Na>Mg>Al
请设计实验方案,验证Si、P、S、Cl的非金属性强弱
穿插练习
Si、P、S、Cl的非金属性强弱比较
原子序数 14 15 16 17
元素符号 Si P S Cl
单质与H2化合的难易
气态氢化物的稳定性
最高价氧化物对应水化物的酸性
H4SiO4极弱酸
H3PO4 中强酸
H2SO4强酸
HClO4最强酸
高温
光照或点燃爆炸化合
磷蒸气
加热
非金属性
Si < P < S < Cl
很不稳定
SiH4
不稳定
PH3
不很稳定
H2S
稳定
HCl
难
易
稳定
不稳定
强
弱
11~17号元素随着核电荷数的递增金
属性和非金属性变化规律:
11Na 12Mg 13Al 14Si 15P 16S 17Cl
金属性逐渐减弱,非金属性逐渐增强
结论
【结论4】随着原子序数的递增,元素的金属性、非金属性呈现周期性变化,重复出现金属性逐渐减弱,非金属性逐渐增强的变化。
结论
深度思考
结合同主族元素的金属性、非金属性,整个元素周期表的金属性、非金属性呈现什么规律?
金属性逐渐增大
非金属性逐渐增大
F是非金属性最强的原子
短周期主族元素中,金属性最强的是哪种元素?
Na
元素周期律
随着原子序数的递增,元素的性质(核外电子排布、原子半径、主要化合价、金属性和非金属性)呈现周期性变化的规律。
课堂小结
主要化合价
决定
结构
核外电子排布呈周期性变化
(最外层电子数)
元素性质呈周期性变化
原子半径
金属性、非金属性
性质
实质
小结提升
元素周期律
金属性
非金属性
元素
1.单质与水/酸反应的难易程度
2.最高价碱的碱性强弱
3.单质置换另一单质
1.单质与H2化合的难易程度
2.最高价含氧酸的酸性强弱
3.单质置换另一单质
4.气态氢化物的稳定性强弱
项目 同主族(从上至下)
原子结构 原子序数/核电荷数
电子层数
原子半径
失电子能力
得电子能力
元素性质 金属性
非金属性
逐渐增多
逐渐增大
逐渐增强
逐渐减弱
依次增大
逐渐增强
逐渐减弱
【问题1】1-18号元素,随着原子序数的递增,元素原子最外层电子排布呈现出怎样的变化规律?
学习新知
1—18元素原子的核外电子排布
学习新知
【结论1】随原子序数的递增,元素原子最外层电子排布呈1——8的周期性变化(除第一周期1——2)。
结论
【问题2】1-18号元素(除稀有气体元素外)随着原子序数的递增,元素原子半径呈现出怎样的规律?
学习新知
【结论2】随着原子序数的递增,元素原子半径呈现周期性变化,原子半径重复出现从大到小的变化(稀有气体原子半径暂不研究)。
结论
深度思考
结合同主族元素的原子半径递变规律,整个元素周期表的原子半径呈现什么规律?
原子半径逐渐增大
原子半径逐渐减小
H是半径最小的原子
短周期主族元素中,原子半径最大的是哪种元素?
Na
如何比较P和O的原子半径?
穿插练习
第一步:比较电子层数,电子层数越多,半径越大;
第二步:比较核电荷数,核电荷数越多,半径越小;
第三步:比较电子总数:电子总数越多,半径越大。
拓展
粒子半径比较“三步曲”
(1)如何比较Na和Na+半径大小?
(2)如何比较Na+和Mg2+半径大小?
(3)如何比较Cl和Cl-半径大小?
穿插练习
【问题3】1-18号元素,随着原子序数的递增,元素的主要化合价(最低和最高)呈现出怎样的规律
学习新知
元素的主要化合价
基本规律:
(1)最高正价 = 最外层电子数(O、F除外)
(2)最高正价+|最低负价| = 8
【结论3】随着原子序数的递增,元素的主要化合价呈现出+1——+7、-4——-1周期性变化。
结论
穿插练习
1.判断题
(1)从Na到Cl,元素的最高化合价呈现+1到+7的变化规律( )
(2)从Na到Cl,元素的最低负化合价呈现-7到-1的变化规律( )
(3)从Li到F,元素的最高正化合价呈现+1到+7的变化规律( )
2.填空题
某元素X的最高价氧化物对应水化物的分子式为H2XO4,则其氢化物的分子式为_______。
√
×
×
H2X
【问题4】1-18号元素(稀有气体除外),随着原子序数的递增,元素的金属性和非金属性呈现出怎样的规律?
学习新知
金属性和非金属性的判断依据:
复习回顾
1.单质与水/酸反应的难易程度
2.最高价碱的碱性强弱
3.单质置换另一单质
1.单质与H2化合的难易程度
2.最高价含氧酸的酸性强弱
3.单质置换另一单质
4.气态氢化物的稳定性强弱
请设计实验方案,验证Na、Mg、Al的金属性强弱
穿插练习
金属元素性质 Na Mg Al
单质和水(或酸) 的反应情况
最高价氧化物对应水化物碱性
与冷水剧烈反应
NaOH强碱
与沸水反应
Mg(OH)2沉淀,中强碱
不能与水直接反应
Al(OH)3沉淀,两性氢氧化物
结论:
金属性 Na>Mg>Al
请设计实验方案,验证Si、P、S、Cl的非金属性强弱
穿插练习
Si、P、S、Cl的非金属性强弱比较
原子序数 14 15 16 17
元素符号 Si P S Cl
单质与H2化合的难易
气态氢化物的稳定性
最高价氧化物对应水化物的酸性
H4SiO4极弱酸
H3PO4 中强酸
H2SO4强酸
HClO4最强酸
高温
光照或点燃爆炸化合
磷蒸气
加热
非金属性
Si < P < S < Cl
很不稳定
SiH4
不稳定
PH3
不很稳定
H2S
稳定
HCl
难
易
稳定
不稳定
强
弱
11~17号元素随着核电荷数的递增金
属性和非金属性变化规律:
11Na 12Mg 13Al 14Si 15P 16S 17Cl
金属性逐渐减弱,非金属性逐渐增强
结论
【结论4】随着原子序数的递增,元素的金属性、非金属性呈现周期性变化,重复出现金属性逐渐减弱,非金属性逐渐增强的变化。
结论
深度思考
结合同主族元素的金属性、非金属性,整个元素周期表的金属性、非金属性呈现什么规律?
金属性逐渐增大
非金属性逐渐增大
F是非金属性最强的原子
短周期主族元素中,金属性最强的是哪种元素?
Na
元素周期律
随着原子序数的递增,元素的性质(核外电子排布、原子半径、主要化合价、金属性和非金属性)呈现周期性变化的规律。
课堂小结
主要化合价
决定
结构
核外电子排布呈周期性变化
(最外层电子数)
元素性质呈周期性变化
原子半径
金属性、非金属性
性质
实质
小结提升
