化学人教版(2019)必修第一册4.2.2元素周期表和元素周期律的应用(共44张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.2元素周期表和元素周期律的应用(共44张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 45.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 09:47:02 | ||
图片预览







文档简介
(共44张PPT)
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素性质的周期性变化规律
通过上面的讨论我们知道,随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。
根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
第二节
元素周期律
第四章 物质结构 元素周期表
赵健
第1课时 元素性质的周期性变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
请你思考!
判断元素金属性和非金属性的事实有哪些?
判断依据是什么呢?
金属性:
元素原子失电子的能力(还原能力)
非金属性:
元素原子得电子的能力(氧化能力)
一般情况下,元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来判断。
一般情况下,元素的非金属性强弱可以从其最高价氧化物的水化物的酸性强弱,或与氢气生成气态氢化物的难易程度及氢化物的稳定性来判断。
meiyangyang8602
请你思考!
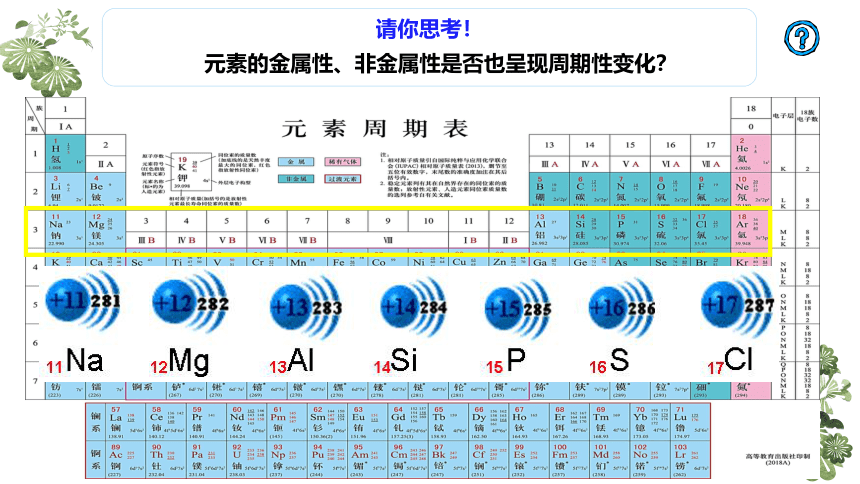
元素的金属性、非金属性是否也呈现周期性变化?
赵健
04
第三周期元素性质的递变
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
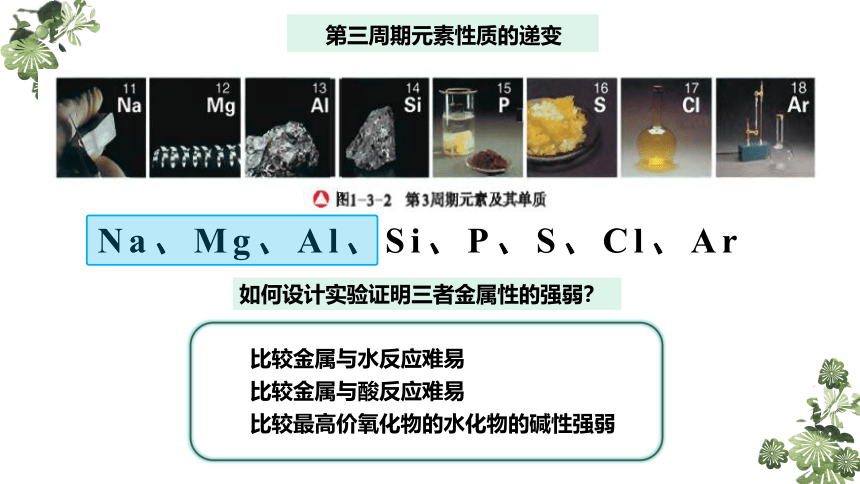
第三周期元素性质的递变
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
如何设计实验证明
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
第三周期元素性质的递变
Na、Mg、Al、Si、P、S、Cl、Ar
如何设计实验证明三者金属性的强弱?
比较金属与水反应难易
比较金属与酸反应难易
比较最高价氧化物的水化物的碱性强弱
meiyangyang8602
meiyangyang8602
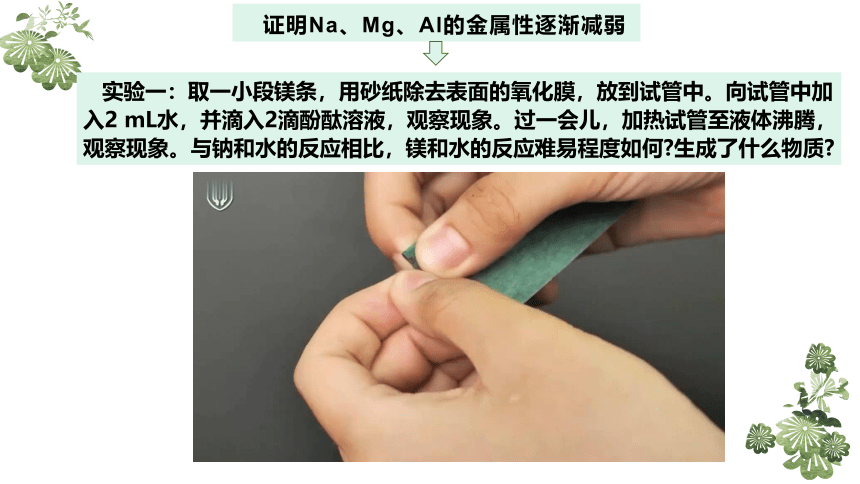
证明Na、Mg、Al的金属性逐渐减弱
实验一:取一小段镁条,用砂纸除去表面的氧化膜,放到试管中。向试管中加入2 mL水,并滴入2滴酚酞溶液,观察现象。过一会儿,加热试管至液体沸腾,观察现象。与钠和水的反应相比,镁和水的反应难易程度如何 生成了什么物质
meiyangyang8602
meiyangyang8602
meiyangyang8602
证明Na、Mg、Al的金属性逐渐减弱
金属与水反应置换出H2的难易。
加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为_____色。
粉红
冷水
>
镁与_______几乎不反应,能与热水反应,
反应的化学方程式为_______________________________________。
结合前面所学钠与水的反应,可得出金属性:Na___Mg。
meiyangyang8602
meiyangyang8602
从实验事实探究同周期元素性质递变规律
meiyangyang8602
实验二:向试管中加入2 mL 1mol/L AlCl3溶液,然后滴加氨水,直到不再产生白色絮状Al(OH)3沉淀为止。将Al(OH)3沉淀分装在两支试管中,向一支试管中滴加2 mol/L盐酸,向另一支试管中滴加2 mol/L NaOH溶液。边滴加边振荡,观察现象。
用2 mL 1mol/L MgCl2溶液代替AlCl3溶液做上述实验,观察现象,并进行比较。
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
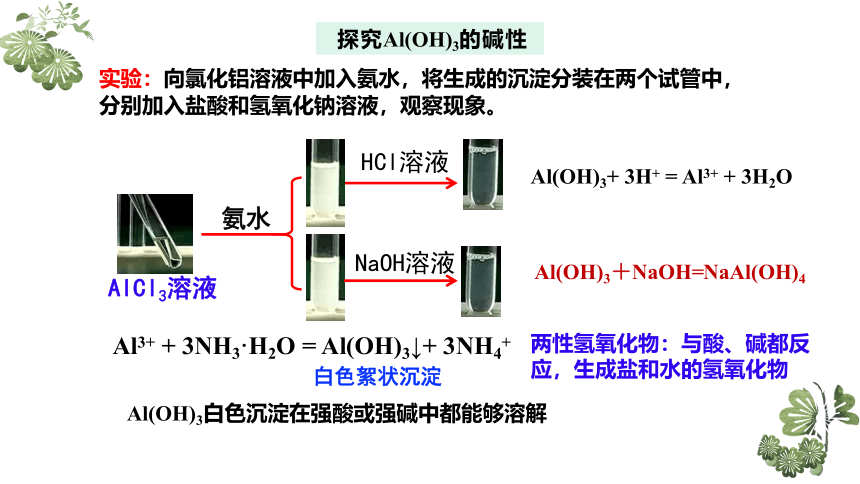
探究Al(OH)3的碱性
实验:向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象。
AlCl3溶液
氨水
HCl溶液
NaOH溶液
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+NaOH=NaAl(OH)4
白色絮状沉淀
两性氢氧化物:与酸、碱都反应,生成盐和水的氢氧化物
Al(OH)3白色沉淀在强酸或强碱中都能够溶解
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
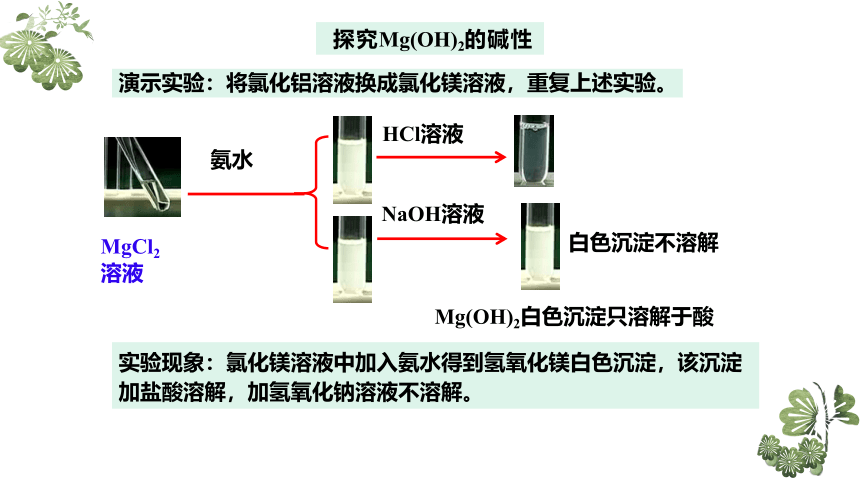
探究Mg(OH)2的碱性
MgCl2
溶液
氨水
HCl溶液
NaOH溶液
白色沉淀不溶解
Mg(OH)2白色沉淀只溶解于酸
演示实验:将氯化铝溶液换成氯化镁溶液,重复上述实验。
实验现象:氯化镁溶液中加入氨水得到氢氧化镁白色沉淀,该沉淀加盐酸溶解,加氢氧化钠溶液不溶解。
meiyangyang8602
meiyangyang8602
meiyangyang8602
证明Na、Mg、Al的金属性逐渐减弱
Na Mg Al
最高价氧化物对应的水化物碱性强弱
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
金属性:钠>镁>铝
根据实验结论以及课本信息,得出结论。
meiyangyang8602
meiyangyang8602
meiyangyang8602
硅、磷、硫、氯元素非金属性的相对强弱
元素 Si P S Cl
最高价氧化物的化学式 SiO2 P2O5 SO3 Cl2O7
最高价氧化物对应水化物的化学式及酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
酸性比
H2SO4强
单质与H2反应的条件 高温 磷蒸气与 H2能反应 加热 光照或点燃时发生爆炸而化合
氢化物的稳定性 不稳定 受热分解 受热分解 稳定
meiyangyang8602
meiyangyang8602
meiyangyang8602
同周期元素金属性和非金属性的递变规律
Na、Mg、Al、Si、P、S、Cl、Ar
金属性逐渐减弱,非金属性逐渐增强
元素周期律
元素的性质随着原子序数的递增而呈周期性的变化的规律。
实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
meiyangyang8602
meiyangyang8602
meiyangyang8602
同周期元素金属性和非金属性的递变规律
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
电子层数相同核电荷数增多
原子半径减小
原子失电子能力逐渐减弱,得电子能力逐渐增强
同周期元素 从左到右
原子核对最外层电子的吸引力增强
元素周期律的应用如何?
第二节
元素周期律
第四章 物质结构 元素周期表
赵健
第2课时 元素周期表和元素周期律的应用
meiyangyang8602
meiyangyang8602
meiyangyang8602
你知道吗?
门捷列夫和金属镓的故事
在门捷列夫编制出元素周期表4年之后,布瓦博德朗(L. de Boisbaudran,1838—1912)首次通过电解获得了约1 g的金属镓,并对其性质作了初步的研究。门捷列夫得知后,大胆提出质疑,认为布瓦博德朗关于镓的一些性质测定并不完全正确,特别是其密度不应是4.7 g·cm-3,而应为5.9~6.0
g·cm-3。布瓦博德朗知悉后十分惊讶,因为当时世界上只有他拥有金属镓。后来,布瓦博德朗将金属镓进一步提纯,重新测得其密度为5.96 g·cm-3,与门捷列夫的预测完全一致。门捷列夫所预言的类铝、类硼和类硅3种元素,在此后的15年内相继被发现。令人惊讶的是,用实验方法测定的元素的一些数据竟和门捷列夫的预言几乎完全吻合。
meiyangyang8602
你知道吗?
门捷列夫作出这些伟大预言的科学依据是什么?
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
meiyangyang8602
学习了元素周期表和元素周期律后,你能否总结出元素在周期表中的位置、
原子结构以及性质(位构性)之间的关系?
推测
决定
位置
决定
性质
结构
赵健
01
金属元素与非金属元素在周期表中的分布及性质规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素周期表与元素周期律的关系
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
增强
减弱
增
强
增强
Al Si
既表现金属元素的性质,又表现非金属元素的性质。
在元素周期表中,主族元素从上到下,从左到右,元素的金属性和非金属性存在着一定的递变规律。
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素周期表与元素周期律的关系
H
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
Fr
思考:
什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置?
meiyangyang8602
请你预测!
硅能与氢氧化钠反应吗?
元素的原子结构决定了元素在周期表中的位置,而元素在周期表中的位置反映了元素的原子结构和元素的性质特点。我们可以根据元素在周期表中的位置,推测元素的原子结构,预测未知元素的主要性质。
赵健
02
元素周期表和周期律的应用
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
预测元素及其化合物的性质
硅能与氢氧化钠反应吗?
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
预测元素及其化合物的性质
硅能与氢氧化钠反应吗?
2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
Si+2NaOH+H2O ═ Na2SiO3+2H2
“在野外的环境里,为了迅速得到氢气,可以用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到氢气。”
meiyangyang8602
练习
【例1】有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
D
【例2】 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( )
A.原子半径: W > Z > Y > X
B. 最高价氧化物对应的水化物的酸性: Z > W > X
C. W单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
X
Y
Z
W
D
meiyangyang8602
meiyangyang8602
meiyangyang8602
指导新元素的发现及预测它们的原子结构和性质
Og——118号元素
Oganesson是一种人工合成的化学元素,原子量为297,半衰期12毫秒(百分之一秒)。属于气体元素,化学性质很不活泼。属于稀有气体一类。 Og具放射性,其原子十分不稳定。
meiyangyang8602
自118号元素发现之后,科学界一直在讨论一个问题,
元素周期表第七周期已经被填满,
是否证明所有化学元素已经被集齐元素周期表到底有没有尽头?
斯维尔德罗夫市的工程师C·霍斯特,声称自己发现了一个新元素。经测验,其元素质量是氢元素的299倍,即原子量为299,很可能就是尚未出现的119号元素,经证实后,俄罗斯科学家宣布,他们已经找到了打开第八元素周期的钥匙——119号元素。
meiyangyang8602
meiyangyang8602
meiyangyang8602
寻找有特殊用途的新物质
预测新元素
在金属和非金属分界线处,寻找半导体材料。
Si、Al既能表现一定金属性又能表现出非金属性
寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等
寻找用于制农药的材料(非金属F、Cl、S、P等)
meiyangyang8602
meiyangyang8602
【例1】元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
A B A B
①制半导体的元素 (a)F、Cl、Br、N、S“三角地带” ①
②制催化剂的元素 (b)金属与非金属元素的分界线附近 ②
③制制冷剂的元素 (c)相对原子质量较小的元素 ③
④地壳中含量较多的元素 (d)过渡元素 ④
(b)
(d)
(a)
(c)
meiyangyang8602
meiyangyang8602
meiyangyang8602
借助元素周期律以及元素周期表能指导我们系统学习化学知识
meiyangyang8602
meiyangyang8602
meiyangyang8602
借助元素周期律以及元素周期表能指导我们系统学习化学知识
酸性减弱?
非金属性减弱?
金属性增强?
H2CO3
H2SiO3
最高价
氧化物的
水化物
∨
∨
……
∨
……
∨
……
meiyangyang8602
例题1.请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se 是无色、有毒、比H2S稳定的气体
C
例题2.砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
C
meiyangyang8602
meiyangyang8602
meiyangyang8602
归纳提升 位、构、性的关系
原子
结构
元素
位置
元素
性质
最外层
电子数
电子
层数
核电
荷数
原子序数
周期
主族
周期序数=电子层数
主族序数=最外层电子数
原子序数=核电荷数
金属性/非金属性
原子半径
化合价
最高正价=最外层电子数
最高正价+|最低负价|=8
+Z K L M
电子层数
核电荷数
核外电子数
元素的原子得失电子的倾向
相似;递变
氧化稳定最高酸 化合非金右上强
还原剧烈最高碱 置换金属左下强
赵健
03
元素综合推断
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素综合推断的一般思路
确定陌生物质的核心元素在周期表中的位置
↓
依据递变规律和同主族元素的相似性进行推测判断
↓
利用学过的元素及其化合物的性质预测其相邻元素的性质
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素综合推断
例1.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
(1)W在周期表中的位置是______________,Q、R、T三种元素原子半径由大到小的顺序是__________ (用元素符号表示),Q的最高价氧化物的化学式为____,R的简单氢化物分子中的电子数为___。
第三周期ⅥA族
Al>C>N
CO2
10
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”)。
弱于
(3)原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为______________________。
meiyangyang8602
meiyangyang8602
meiyangyang8602
练习
1.请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se 是无色、有毒、比H2S稳定的气体
【答案】C
2.砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
【答案】C
meiyangyang8602
练习
3.五种短周期元素的原子半径、最高正化合价及负化合价见下表
B
下列叙述正确的是
A.L的金属性比M的金属性弱
B.Q、T两元素间可形成两性化合物
C.T的单质是黄绿色气体
D.L、R两元素的简单离子的核外电子数可能相等
元素代号 L M Q R T
原子半径/nm 0.160 0.089 0.143 0.102 0.074
化合价 +2 +2 +3 +6,-2 -2
根据元素化合价可以直接得到R为S,T为O;
再根据原子半径和化合价得到L、M、Q分别为Mg、Be、Al
Al2O3
meiyangyang8602
练习
4.我国著名化学家张青莲精确地测定了锗(Ge)、锌等九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗的原子序数为32。
(1)它位于元素周期表中第_____周期______族。
(2)锗类似于铝,能溶于氢氧化钠溶液,其主要原因是_____(填序号)。
①它与硅位于同一主族
②它位于周期表中金属与非金属分界线附近
③它位于边界线附近
④它是两性物质
四
ⅣA
②
(3)材料科学是目前全世界研究的热点,为了寻找半导体材料,科学家应在元素周期表中某区域寻找元素组成材料,该区域是_____(填字母)。
A.左上角 B.右上角 C.过渡元素 D.金属与非金属分界线附近
D
meiyangyang8602
练习
5.门捷列夫在研究周期表时预言了包括“类铝”“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勤发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物对应的水化物为两性氢氧化物。试比较元素的非金属性Si____Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置_______________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是___________。
③硅和锗单质分别与H2反应时,反应较难进行的是___(填“硅”或“锗”)。
>
第四周期ⅣA族
半导体材料
锗
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因________________________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液,__________和______________。
原子最外层电子数都是3个
NaOH溶液
稀硫酸(或盐酸)
赵健
谢谢观看
meiyangyang8602
meiyangyang8602
新人教版 化学 必修第一册
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素性质的周期性变化规律
通过上面的讨论我们知道,随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。
根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
第二节
元素周期律
第四章 物质结构 元素周期表
赵健
第1课时 元素性质的周期性变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
请你思考!
判断元素金属性和非金属性的事实有哪些?
判断依据是什么呢?
金属性:
元素原子失电子的能力(还原能力)
非金属性:
元素原子得电子的能力(氧化能力)
一般情况下,元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来判断。
一般情况下,元素的非金属性强弱可以从其最高价氧化物的水化物的酸性强弱,或与氢气生成气态氢化物的难易程度及氢化物的稳定性来判断。
meiyangyang8602
请你思考!
元素的金属性、非金属性是否也呈现周期性变化?
赵健
04
第三周期元素性质的递变
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
第三周期元素性质的递变
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
如何设计实验证明
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
第三周期元素性质的递变
Na、Mg、Al、Si、P、S、Cl、Ar
如何设计实验证明三者金属性的强弱?
比较金属与水反应难易
比较金属与酸反应难易
比较最高价氧化物的水化物的碱性强弱
meiyangyang8602
meiyangyang8602
证明Na、Mg、Al的金属性逐渐减弱
实验一:取一小段镁条,用砂纸除去表面的氧化膜,放到试管中。向试管中加入2 mL水,并滴入2滴酚酞溶液,观察现象。过一会儿,加热试管至液体沸腾,观察现象。与钠和水的反应相比,镁和水的反应难易程度如何 生成了什么物质
meiyangyang8602
meiyangyang8602
meiyangyang8602
证明Na、Mg、Al的金属性逐渐减弱
金属与水反应置换出H2的难易。
加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为_____色。
粉红
冷水
>
镁与_______几乎不反应,能与热水反应,
反应的化学方程式为_______________________________________。
结合前面所学钠与水的反应,可得出金属性:Na___Mg。
meiyangyang8602
meiyangyang8602
从实验事实探究同周期元素性质递变规律
meiyangyang8602
实验二:向试管中加入2 mL 1mol/L AlCl3溶液,然后滴加氨水,直到不再产生白色絮状Al(OH)3沉淀为止。将Al(OH)3沉淀分装在两支试管中,向一支试管中滴加2 mol/L盐酸,向另一支试管中滴加2 mol/L NaOH溶液。边滴加边振荡,观察现象。
用2 mL 1mol/L MgCl2溶液代替AlCl3溶液做上述实验,观察现象,并进行比较。
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
探究Al(OH)3的碱性
实验:向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象。
AlCl3溶液
氨水
HCl溶液
NaOH溶液
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+NaOH=NaAl(OH)4
白色絮状沉淀
两性氢氧化物:与酸、碱都反应,生成盐和水的氢氧化物
Al(OH)3白色沉淀在强酸或强碱中都能够溶解
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
探究Mg(OH)2的碱性
MgCl2
溶液
氨水
HCl溶液
NaOH溶液
白色沉淀不溶解
Mg(OH)2白色沉淀只溶解于酸
演示实验:将氯化铝溶液换成氯化镁溶液,重复上述实验。
实验现象:氯化镁溶液中加入氨水得到氢氧化镁白色沉淀,该沉淀加盐酸溶解,加氢氧化钠溶液不溶解。
meiyangyang8602
meiyangyang8602
meiyangyang8602
证明Na、Mg、Al的金属性逐渐减弱
Na Mg Al
最高价氧化物对应的水化物碱性强弱
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
金属性:钠>镁>铝
根据实验结论以及课本信息,得出结论。
meiyangyang8602
meiyangyang8602
meiyangyang8602
硅、磷、硫、氯元素非金属性的相对强弱
元素 Si P S Cl
最高价氧化物的化学式 SiO2 P2O5 SO3 Cl2O7
最高价氧化物对应水化物的化学式及酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4
酸性比
H2SO4强
单质与H2反应的条件 高温 磷蒸气与 H2能反应 加热 光照或点燃时发生爆炸而化合
氢化物的稳定性 不稳定 受热分解 受热分解 稳定
meiyangyang8602
meiyangyang8602
meiyangyang8602
同周期元素金属性和非金属性的递变规律
Na、Mg、Al、Si、P、S、Cl、Ar
金属性逐渐减弱,非金属性逐渐增强
元素周期律
元素的性质随着原子序数的递增而呈周期性的变化的规律。
实质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
meiyangyang8602
meiyangyang8602
meiyangyang8602
同周期元素金属性和非金属性的递变规律
根据实验,可得出第三周期元素金属性、非金属性的递变规律:
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
电子层数相同核电荷数增多
原子半径减小
原子失电子能力逐渐减弱,得电子能力逐渐增强
同周期元素 从左到右
原子核对最外层电子的吸引力增强
元素周期律的应用如何?
第二节
元素周期律
第四章 物质结构 元素周期表
赵健
第2课时 元素周期表和元素周期律的应用
meiyangyang8602
meiyangyang8602
meiyangyang8602
你知道吗?
门捷列夫和金属镓的故事
在门捷列夫编制出元素周期表4年之后,布瓦博德朗(L. de Boisbaudran,1838—1912)首次通过电解获得了约1 g的金属镓,并对其性质作了初步的研究。门捷列夫得知后,大胆提出质疑,认为布瓦博德朗关于镓的一些性质测定并不完全正确,特别是其密度不应是4.7 g·cm-3,而应为5.9~6.0
g·cm-3。布瓦博德朗知悉后十分惊讶,因为当时世界上只有他拥有金属镓。后来,布瓦博德朗将金属镓进一步提纯,重新测得其密度为5.96 g·cm-3,与门捷列夫的预测完全一致。门捷列夫所预言的类铝、类硼和类硅3种元素,在此后的15年内相继被发现。令人惊讶的是,用实验方法测定的元素的一些数据竟和门捷列夫的预言几乎完全吻合。
meiyangyang8602
你知道吗?
门捷列夫作出这些伟大预言的科学依据是什么?
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
meiyangyang8602
学习了元素周期表和元素周期律后,你能否总结出元素在周期表中的位置、
原子结构以及性质(位构性)之间的关系?
推测
决定
位置
决定
性质
结构
赵健
01
金属元素与非金属元素在周期表中的分布及性质规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素周期表与元素周期律的关系
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
增强
减弱
增
强
增强
Al Si
既表现金属元素的性质,又表现非金属元素的性质。
在元素周期表中,主族元素从上到下,从左到右,元素的金属性和非金属性存在着一定的递变规律。
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素周期表与元素周期律的关系
H
Li Be B C N O F
Na Mg Al Si P S Cl
K Ca Ga Ge As Se Br
Rb Sr In Sn Sb Te I
Cs Ba Tl Pb Bi Po At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
Fr
思考:
什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置?
meiyangyang8602
请你预测!
硅能与氢氧化钠反应吗?
元素的原子结构决定了元素在周期表中的位置,而元素在周期表中的位置反映了元素的原子结构和元素的性质特点。我们可以根据元素在周期表中的位置,推测元素的原子结构,预测未知元素的主要性质。
赵健
02
元素周期表和周期律的应用
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
预测元素及其化合物的性质
硅能与氢氧化钠反应吗?
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
预测元素及其化合物的性质
硅能与氢氧化钠反应吗?
2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
Si+2NaOH+H2O ═ Na2SiO3+2H2
“在野外的环境里,为了迅速得到氢气,可以用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到氢气。”
meiyangyang8602
练习
【例1】有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
D
【例2】 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( )
A.原子半径: W > Z > Y > X
B. 最高价氧化物对应的水化物的酸性: Z > W > X
C. W单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
X
Y
Z
W
D
meiyangyang8602
meiyangyang8602
meiyangyang8602
指导新元素的发现及预测它们的原子结构和性质
Og——118号元素
Oganesson是一种人工合成的化学元素,原子量为297,半衰期12毫秒(百分之一秒)。属于气体元素,化学性质很不活泼。属于稀有气体一类。 Og具放射性,其原子十分不稳定。
meiyangyang8602
自118号元素发现之后,科学界一直在讨论一个问题,
元素周期表第七周期已经被填满,
是否证明所有化学元素已经被集齐元素周期表到底有没有尽头?
斯维尔德罗夫市的工程师C·霍斯特,声称自己发现了一个新元素。经测验,其元素质量是氢元素的299倍,即原子量为299,很可能就是尚未出现的119号元素,经证实后,俄罗斯科学家宣布,他们已经找到了打开第八元素周期的钥匙——119号元素。
meiyangyang8602
meiyangyang8602
meiyangyang8602
寻找有特殊用途的新物质
预测新元素
在金属和非金属分界线处,寻找半导体材料。
Si、Al既能表现一定金属性又能表现出非金属性
寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等
寻找用于制农药的材料(非金属F、Cl、S、P等)
meiyangyang8602
meiyangyang8602
【例1】元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
A B A B
①制半导体的元素 (a)F、Cl、Br、N、S“三角地带” ①
②制催化剂的元素 (b)金属与非金属元素的分界线附近 ②
③制制冷剂的元素 (c)相对原子质量较小的元素 ③
④地壳中含量较多的元素 (d)过渡元素 ④
(b)
(d)
(a)
(c)
meiyangyang8602
meiyangyang8602
meiyangyang8602
借助元素周期律以及元素周期表能指导我们系统学习化学知识
meiyangyang8602
meiyangyang8602
meiyangyang8602
借助元素周期律以及元素周期表能指导我们系统学习化学知识
酸性减弱?
非金属性减弱?
金属性增强?
H2CO3
H2SiO3
最高价
氧化物的
水化物
∨
∨
……
∨
……
∨
……
meiyangyang8602
例题1.请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se 是无色、有毒、比H2S稳定的气体
C
例题2.砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
C
meiyangyang8602
meiyangyang8602
meiyangyang8602
归纳提升 位、构、性的关系
原子
结构
元素
位置
元素
性质
最外层
电子数
电子
层数
核电
荷数
原子序数
周期
主族
周期序数=电子层数
主族序数=最外层电子数
原子序数=核电荷数
金属性/非金属性
原子半径
化合价
最高正价=最外层电子数
最高正价+|最低负价|=8
+Z K L M
电子层数
核电荷数
核外电子数
元素的原子得失电子的倾向
相似;递变
氧化稳定最高酸 化合非金右上强
还原剧烈最高碱 置换金属左下强
赵健
03
元素综合推断
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素综合推断的一般思路
确定陌生物质的核心元素在周期表中的位置
↓
依据递变规律和同主族元素的相似性进行推测判断
↓
利用学过的元素及其化合物的性质预测其相邻元素的性质
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素综合推断
例1.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
(1)W在周期表中的位置是______________,Q、R、T三种元素原子半径由大到小的顺序是__________ (用元素符号表示),Q的最高价氧化物的化学式为____,R的简单氢化物分子中的电子数为___。
第三周期ⅥA族
Al>C>N
CO2
10
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”)。
弱于
(3)原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为______________________。
meiyangyang8602
meiyangyang8602
meiyangyang8602
练习
1.请运用元素周期表的有关理论分析判断,下面几种元素及其化合物性质的推断中正确的是( )
A.铊(Tl)的氧化物的水化物可能具有两性
B.砹(At)为无色固体,HAt不稳定,AgAt具有感光性,且不溶于水
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.H2Se 是无色、有毒、比H2S稳定的气体
【答案】C
2.砷(As)为第四周期第ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
A.砷有-3、+3、+5等多种化合价
B.原子半径:As>P
C.酸性:H3AsO4>H2SO4
D.热稳定性:HBr>AsH3
【答案】C
meiyangyang8602
练习
3.五种短周期元素的原子半径、最高正化合价及负化合价见下表
B
下列叙述正确的是
A.L的金属性比M的金属性弱
B.Q、T两元素间可形成两性化合物
C.T的单质是黄绿色气体
D.L、R两元素的简单离子的核外电子数可能相等
元素代号 L M Q R T
原子半径/nm 0.160 0.089 0.143 0.102 0.074
化合价 +2 +2 +3 +6,-2 -2
根据元素化合价可以直接得到R为S,T为O;
再根据原子半径和化合价得到L、M、Q分别为Mg、Be、Al
Al2O3
meiyangyang8602
练习
4.我国著名化学家张青莲精确地测定了锗(Ge)、锌等九种元素的相对原子质量,得到的新值被作为国际新标准。已知锗的原子序数为32。
(1)它位于元素周期表中第_____周期______族。
(2)锗类似于铝,能溶于氢氧化钠溶液,其主要原因是_____(填序号)。
①它与硅位于同一主族
②它位于周期表中金属与非金属分界线附近
③它位于边界线附近
④它是两性物质
四
ⅣA
②
(3)材料科学是目前全世界研究的热点,为了寻找半导体材料,科学家应在元素周期表中某区域寻找元素组成材料,该区域是_____(填字母)。
A.左上角 B.右上角 C.过渡元素 D.金属与非金属分界线附近
D
meiyangyang8602
练习
5.门捷列夫在研究周期表时预言了包括“类铝”“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勤发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物对应的水化物为两性氢氧化物。试比较元素的非金属性Si____Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置_______________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是___________。
③硅和锗单质分别与H2反应时,反应较难进行的是___(填“硅”或“锗”)。
>
第四周期ⅣA族
半导体材料
锗
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因________________________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液,__________和______________。
原子最外层电子数都是3个
NaOH溶液
稀硫酸(或盐酸)
赵健
谢谢观看
meiyangyang8602
meiyangyang8602
新人教版 化学 必修第一册
